王宇1,2, 李浩然1,3, 温政1,4, 尚原冰1, 刘婷1,4, 丁铲1, 高崧2, 祁晶晶1

 , 于圣青1
, 于圣青1

1. 中国农业科学院上海兽医研究所, 上海 200241;
2. 扬州大学兽医学院, 江苏 扬州 225009;
3. 安徽农业大学动物科技学院, 安徽 合肥 230036;
4. 山东农业大学动物科技学院, 山东 泰安 271099
收稿日期:2019-05-20;修回日期:2019-09-30;网络出版日期:2019-10-21
基金项目:国家重点研发项目(2017YFD0500705);中央级公益性科研院所基本科研业务费专项资金(2019JB11)
*通信作者:祁晶晶, Tel:+86-21-34293412, E-mail:qijj1011@163.com;
于圣青, Tel:+86-21-34293461, E-mail:yus@shvri.ac.cn.
摘要:[目的] 研究滑液支原体(Mycoplasma synoviae,MS)脂蛋白P80的免疫反应性及其在MS血清抗体ELISA检测中的应用。[方法] 对MS P80的氨基酸序列进行生物信息学分析、原核表达和纯化,并用免疫印迹法分析其与6种不同MS分离株阳性血清的免疫反应性以及与其他禽病原血清的交叉反应性;运用纯化的MS P80表达蛋白作为包被抗原建立了MS血清抗体的间接ELISA检测方法,对其敏感性和重复性进行检测;比较检测了与美国爱德士检测试剂盒对50份临床血清样品的阳性符合率。[结果] 生物信息学分析预测MS P80蛋白为脂蛋白且含有信号肽,其在MS种内同源性高达98%-100%,与其他种属P80蛋白同源性在25%-34%之间,成功表达和纯化了MS P80重组蛋白(rMS P80);Western blotting分析表明纯化的rMS P80具有良好的免疫反应性和特异性;运用rMS P80建立的MS血清ELISA抗体检测方法可对不同株MS阳性血清进行抗体效价检测,而对其他禽病原阳性血清均无交叉反应性;该检测方法的批内变异系数小于5%,批间变异系数小于10%,重复性良好;与美国IDEXX检测试剂盒比较,本文建立的ELISA抗体检测方法敏感性更高,阳性符合率为75%,阴性符合率为89.47%,总样本符合率为86%。[结论] MS P80具有较好的免疫反应性、种内保守性和种间特异,并且可用作MS抗体检测的靶标抗原。
关键词:脂蛋白滑液支原体免疫反应性间接ELISA
Establishment and application of ELISA method for detection of Mycoplasma synoviae antibody based on lipoprotein P80
Yu Wang1,2, Haoran Li1,3, Zheng Wen1,4, Yuanbing Shang1, Ting Liu1,4, Chan Ding1, Song Gao2, Jingjing Qi1

 , Shengqing Yu1
, Shengqing Yu1

1. Shanghai Veterinary Research Institute, the Chinese Academy of Agricultural Sciences(CAAS), Shanghai 200241, China;
2. College of Veterinary, Yangzhou University, Yangzhou 225009, Jiangsu Province, China;
3. College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, Anhui Province, China;
4. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271099, Shandong Province, China
Received: 20 May 2019; Revised: 30 September 2019; Published online: 21 October 2019
*Corresponding author: Jingjing Qi, Tel: +86-21-34293412, E-mail:qijj1011@163.com;
Shengqing Yu, Tel: +86-21-34293461, E-mail: yus@shvri.ac.cn.
Foundation item: Supported by the National Key Research and Development Program of China (2017YFD0500705) and by the Central Public-interest Scientific Institution Basal Research Fund (2019JB11)
Abstract: [Objective] We studied the immunoreactivity of Mycoplasma synoviae lipoprotein P80 (MS P80) and applied it to detect ELISA antibody. [Methods] Firstly, we performed bioinformatics analysis, prokaryotic expression and purification on MS P80, and analyzed its immunoreactivity with 6 positive sera against different MS isolates and other avian pathogens by Western blotting. Then we used the purified rMS P80 as coating antigen to establish an indirect ELISA assay for detection of MS antibodies, and tested its specificity, sensitivity, reproducibility and coincidence rates compared with US IDEXX ELISA kit. [Results] The MS P80 protein was predicted as a lipoprotein that shared 98%-100% homology between different MS strains and 25% to 34% homology with other species. Western blotting analysis proved that rMS P80 protein had good immunoreactivity and specificity. An indirect ELISA assay based on rMS P80 was established and showed no cross-reaction with positive sera against other pathogens. The intra- and inter-assay variation coefficients were less than 5% and 10%, respectively. When compared with the commercial kit, the established ELISA assay was more sensitive, and the total coincidence rate was 86%. [Conclusion] MS P80 has good immunoreactivity, intraspecies conservation and interspecies specificity. Therefore, it can be used as a target antigen for MS antibody detection.
Keywords: lipoproteinMycoplasma synoviaeimmunoreactivityindirect ELISA
滑液支原体(Mycoplasma synoviae,MS)是已知禽致病性支原体之一[1],感染MS能导致鸡和火鸡等关节、足垫、腱鞘及气囊发炎,主要表现为关节及足垫肿大,偶尔可见气囊内存在干酪物[2]。最新研究报道,2010-2015年[3],中国21个省份总体血清阳性率为41.19%,而鸡场阳性率高达80.99%,可见我国鸡群感染MS的范围之广泛,形势之严峻。MS能引起鸡群持续性感染,造成免疫抑制,引发其他重要传染病如禽流感、新城疫、传染性支气管炎等病的混合感染,造成严重经济损失。因此,在防控其他疾病的同时,建立和完善MS感染的监测和防控机制显得尤为重要。
支原体表面的细胞膜不含脂多糖和肽聚糖,有大量与革兰氏阳性菌表面脂多糖结构相似的脂质相关蛋白,而大部分支原体脂蛋白都暴露在外,作为抗原诱导宿主的免疫反应或发挥毒力作用[4-5]。在MS中,脂蛋白MSPB能诱导宿主机体强烈的免疫应答[6],其被证实可以用来作为包被抗原,建立MS血清抗体ELISA检测方法,且特异性和敏感性较好[7-8]。但MSPB具有高频率的抗原变异性[9-10],因此有必要筛选MS特异性高且保守性好的免疫原性蛋白。本研究前期通过MS膜蛋白的免疫蛋白质组学分析筛选到MS的免疫原性膜蛋白MS P80,通过生物信息学分析预测其为可能的脂蛋白,接着对其进行了原核表达,研究了其免疫反应性和与其他禽病原阳性血清的交叉反应性。同时对其在MS血清抗体ELISA检测中的应用进行了初步探索,为国内滑液支原体病的诊断提供了可参考的方法。
1 材料和方法 1.1 菌株、细胞与实验动物 MS WVU1853菌株、衣阿原支原体(MI) 695株均购自中国兽医微生物菌种保藏中心(保藏编号:CVCC385、CVCC364);MS JS1株、SD1株、SH1株和HB1株均由本实验室保藏;原核表达载体pCold Ⅰ购自宝生物工程(大连)有限公司;大肠杆菌E. coli DH5α和E. coli BL21(DE3)感受态细胞购自北京天根生化科技有限公司;SPF鸡购自济南斯派福瑞禽业科技有限公司。
1.2 主要材料 MS标准阳性鸡血清、SPF鸡阴性血清、鸡毒支原体(MG)阳性鸡血清、大肠杆菌(EC) O1/O2/O78鸡阳性血清、鸡白痢鸡伤寒沙门氏菌(SPG)阳性鸡血清、鸡新城疫病毒(NDV)阳性鸡血清、鸡传染性法氏囊炎病毒(IBDV)阳性鸡血清均购自中国兽药监察所;50份临床鸡血清样本来自上海某养禽场;佐剂MONTANIDE ISA 71 VG由法国SEPPIC公司提供;Prime STAR DNA聚合酶及各限制性内切酶购自TaKaRa公司;胶回收试剂盒购自美国Thermo Fisher Scientific公司;BeaverBeadsTM His-Tag蛋白纯化试剂盒为苏州海狸生物医学工程有限公司产品;二喹啉甲酸(Bicinchoninic acid, BCA)蛋白浓度测定试剂盒、TMB显色液购自上海碧云天生物技术有限公司;HRP标记羊抗鸡IgY抗体购自Abcam公司;支原体培养基基础购自青岛海博生物技术有限公司;商品化滑液支原体抗体检测试剂盒购自美国IDEXX公司。
支原体培养基的配制(1 L体系):支原体基础培养基33.0 g,ddH2O补足至895 mL,121 ℃灭菌15 min后,加10 mL 1% NAD,100 mL马血清。LB液体培养基(1 L体系):10.0 g胰蛋白胨,5.0 g酵母提取物,5.0 g NaCl。pH 7.0,121 ℃灭菌15 min (固体培养基加15 g琼脂)。
1.3 主要仪器 PCR仪购自美国ABI公司;DNA电泳仪、化学发光成像系统购自上海天能科技有限公司;高速台式离心机购自德国Eppendorf公司;恒温培养摇床购自北京创新思成公司;蛋白电泳仪、转印槽购自Bio-Rad公司。
1.4 生物信息学分析 从GenBank数据库中获取MS WVU1853株(CP011096.1)的P80蛋白氨基酸序列(WP_020003184.1)。利用在线蛋白质分析工具ProtParam(https://web.expasy.org/protparam/)分析蛋白的氨基酸数、分子质量;使用在线软件Prosite(https://prosite.expasy.org/)对MS P80蛋白功能域进行预测;使用SignalP server 5.0(http://www.cbs.dtu.dk/services/SignalP/)在线预测P80蛋白的信号肽。使用在线软件Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析MS P80氨基酸序列与其他菌种P80氨基酸序列的同源性。
1.5 MS的培养和全基因组的提取 复苏MS WVU1853株,在支原体基础培养基中将其扩大培养至50 mL,培养至对数生长后期,收集细菌,按照细菌基因组的提取试剂盒说明书的操作来提取MS WVU1853的基因组DNA。Nanodrop微量分光光度计测定基因组DNA浓度,于-20 ℃冻存备用。
1.6 MS p80基因的点突变及全长获取 从GenBank数据库中获取MS WVU1853株p80基因(MS p80)的碱基序列(VY93_01820)。SignalP server 5.0软件分析后若有信号肽,设计引物时以去除信号肽的基因序列为模板。由于支原体中编码色氨酸的TGA在大肠杆菌中为终止密码子,为了使目的基因能够在大肠杆菌中顺利表达,通常需要将TGA突变为TGG。利用软件Primer 5.0对MS p80基因序列进行分析,发现有6处碱基位点需要进行突变(分别为第159、258、792、1245、1830、1935位),因此利用该软件在目的片段两端及需突变的位点处设计特异性引物共7对(表 1),接着采用Overlap PCR的方法实现点突变。
表 1. MS p80的Overlap PCR扩增引物 Table 1. The primers of MS p80 for overlapping PCR amplification
| Primers names | Primers sequences (5′ → 3′) | Sequence length/bp |
| MS p80 1F | GGATCCGGAGATAAAACTGATGGTGGATC | 99 |
| MS p80 1R | GTTATTAATTCTTTTCCATTCTTCAGGAG | |
| MS p80 2F | CTCCTGAAGAATGGAAAAGAATTAATAAC | 126 |
| MS p80 2R | TCTCCTTCGCTCCATGGAG | |
| MS p80 3F | CTCCATGGAGCGAAGGAGA | 543 |
| MS p80 3R | ACCCCACAGTTCTTTAACTGCTTC | |
| MS p80 4F | GAAGCAGTTAAAGAACTGTGGGGT | 480 |
| MS p80 4R | CTTCCCCAGTGTGATGTTGAAAC | |
| MS p80 5F | GTTTCAACATCACACTGGGGAAG | 609 |
| MS p80 5R | CATTTTTCCATTTTCCAGGAACA | |
| MS p80 6F | TGTTCCTGGAAAATGGAAAAATG | 136 |
| MS p80 6R | GATAGAAGCCATTTTAGGAATAATCTTGTAG | |
| MS p80 7F | CTACAAGATTATTCCTAAAATGGCTTCTATC | 401 |
| MS p80 7R | CTCGAGTTAGTTGTTAGTAGCTCTAACGGTTGA | |
| The additive restriction endonuclease sites were underlined (GGATCC, BamH I; CTCGAG, Xho I). The mutation sites were bold. | ||
表选项
先用7对引物分别扩增获得MS p80的7个分段片段,PCR体系(40 μL):Prime STAR MAX Premix (2×) 20 μL,上、下游引物各0.2 μmol/L,MS WVU1853基因组DNA模板100 ng,ddH2O补足至40 μL体系。PCR条件为98 ℃ 5 min;98 ℃ 30 s,55 ℃ 5 s,72 ℃ 5 s,35个循环;72 ℃ 10 min。将7个分段产物回收后混合作为模板,进行第二轮PCR,扩增体系和反应条件同上。将获得产物进行1%琼脂糖凝胶电泳后切取与预期大小相符片段回收,即为MS p80基因全长。
1.7 MS p80基因表达载体的构建 将Overlap PCR获得的MS p80基因全长用BamH I和Xho I双酶切后连接表达载体pCold Ⅰ,连接产物转化E. coli DH5α感受态细胞,涂布含50 μg/mL氨苄青霉素的LB琼脂平板,37 ℃培养12-16 h。挑取长出的菌落用MS p80 1F和MS p80 7R引物进行菌落PCR鉴定,扩增体系和反应条件同1.6,同时将鉴定为阳性的菌株扩大培养,抽提质粒,对质粒进行双酶切鉴定。将经PCR及酶切鉴定均正确的质粒送上海睿勉生物科技有限公司测序,将序列完全正确的质粒保存,标记为pCold Ⅰ-MS p80。将pCold Ⅰ-MS p80转化至E. coli BL21(DE3)感受态细胞,PCR鉴定为阳性的菌株即为重组表达菌株E. coli BL21(pColdⅠ-MS p80),添加20%甘油保存于-80 ℃。
1.8 rMS P80蛋白的原核表达及纯化 将重组表达菌株转接到10 mL含50 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、220 r/min振荡培养至OD600值达到0.4-0.6时,加入50 μg/mL IPTG,15 ℃、110 r/min诱导表达24 h,离心收集菌体,PBS洗涤菌体2遍,1 mL PBS重悬菌体,超声裂解(功率30 W,破碎与间歇时间分别为2 s和3 s),10000 r/min、4 ℃离心10 min,获得上清和沉淀,SDS-PAGE检测rMS P80蛋白是否为可溶性表达。按上述方法将200 mL重组菌液进行大量诱导表达,再利用BeaverBeadsTM His-Tag蛋白纯化试剂盒对上清中的rMS P80蛋白进行纯化,用BCA蛋白浓度测定试剂盒测定纯化蛋白浓度,-80 ℃保存备用。
1.9 MS不同分离株(WVU1853、JS1、SD1、SH1和HB1)和MI 695株阳性鸡血清的制备 准备24只10日龄的SPF鸡,分到6个隔离器中培养,每个隔离器4只。用支原体培养基分别培养MS不同分离株和MI 695株,在培养好的MS WVU1853株、JS1株、SD1株、SH1株、HB1株及MI 695株各菌液中分别加入0.4%的福尔马林于37 ℃灭活24 h,离心收集菌体,并用无菌PBS洗涤2遍,将各菌体用PBS重悬,并与佐剂MONTANIDE ISA 71 VG等体积混合,充分乳化后按照1×109 CCU/只的剂量分别对SPF鸡进行颈部皮下免疫,2周后按相同剂量进行二次免疫,二免后2周对免疫鸡只进行翅静脉采血,制备得到血清并用ELISA法检测抗体效价。
1.10 rMS P80蛋白与MS不同分离株及其他禽病原阳性鸡血清的免疫印迹分析 将rMS P80纯化蛋白进行SDS-PAGE,每个泳道1 μg上样量,总共12个泳道,转印NC膜后,分别以MS不同分离株(MS WVU1853、MS JS1、MS SD1、MS SH1和MS HB1)阳性血清、MG阳性血清、MI阳性血清、EC O1/O2/O78混合阳性血清、SPG阳性血清、NDV阳性血清和IBDV阳性鸡血清作为一抗进行孵育,同时设置SPF鸡阴性血清为阴性对照,所有血清按1:500倍稀释,在37 ℃作用1.5 h,PBST洗3次;用HRP标记的羊抗鸡IgY二抗(1:5000)在37 ℃孵育1 h,PBST洗3次,用ECL底物显色液进行显色反应。
1.11 基于rMS P80蛋白的间接ELISA检测方法的初步建立 用碳酸盐缓冲液稀释抗原蛋白,于96孔酶标板中每孔加100 μL,37 ℃温育2 h;PBST (PBS中添加0.5% Tween-20)洗涤3次,拍干;每孔加入200 μL的5%脱脂乳,37 ℃封闭2 h;PBST洗涤3次,拍干;加入经PBST稀释的待检血清100 μL/孔,并加入经PBST同样稀释的MS标准阳性、SPF鸡阴性血清分别用作阳性、阴性对照,37 ℃作用1.5 h;PBST洗涤4次,拍干;每孔加入最适浓度的山羊抗鸡IgG-HRP二抗,37 ℃作用1 h;洗涤4次,拍干;每孔加入100 μL TMB底物显色液,37 ℃避光显色15 min,加入50 μL终止液,10 min内在酶标仪上测OD450值,并计算P/N值。
1.11.1 最适抗原包被浓度和血清最适稀释度的确定: 将rMS P80用碳酸盐缓冲液稀释至5.00、2.50、1.25、0.62、0.31、0.15 μg/mL,每孔100 μL包被96孔酶标板,4 ℃过夜。将MS标准阳性、SPF鸡阴性血清用PBST分别按照1:200、1:500稀释。HRP标记的羊抗鸡IgY二抗按照1:20000稀释,每孔100 μL。选择当阳性血清OD450大于1.0、阴性血清OD450小于0.2时,且P/N值(标准阳性血清OD450/标准阴性血清OD450)最大的组合,即为最适抗原包被浓度和血清稀释度。
1.11.2 酶标二抗稀释度确定: 以最适稀释度的重组抗原包被96孔酶标板,加入最适稀释度的MS标准阳性血清、SPF鸡阴性血清。将酶标二抗稀释成1:20000、1:40000、1:60000。每个稀释度分别作用1 h,每孔100 μL。选择P/N值较大的组别作为酶标二抗稀释度。
1.11.3 阴性血清临界值的确定: 运用本方法检测30份来自临床的阴性血清样品(经IDEXX及平板凝集鉴定均为阴性),每个血清样本设3个重复孔,计算血清样品的S/P值的平均值X和标准差SD。S/P=(待检血清样品OD450平均值-标准阴性血清OD450平均值)/(MS标准阳性血清OD450平均值-MS标准阴性血清OD450平均值)。当待检样品血清S/P值≥X+3×SD,判断为阳性;当待检样品血清S/P值< X+3×SD时,判断为阴性。
1.11.4 特异性检测: 用建立的间接ELISA方法分别对MS JS1阳性血清、MS SD1阳性血清、MG阳性血清、MI阳性血清、EC O1/O2/O78混合阳性血清、SPG阳性血清、NDV阳性血清和IBDV阳性血清,同时设定MS标准阳性、SPF鸡阴性血清对照,每种血清设3个重复,测定OD450平均值,并计算S/P值。商品化滑液支原体抗体检测试剂盒(IDEXX)用作方法对照,参照说明书进行操作,试剂盒判断标准为S/P≥0.5为阳性,小于0.5为阴性。
1.11.5 敏感性试验: 取5份阳性血清样品,分别用PBST按1:50、1:100、1:200…1:102400倍比稀释,利用建立的ELISA检测方法和IDEXX试剂盒进行抗体滴度比较,测定能够检测样品为阳性的最大血清稀释倍数。
1.11.6 重复性试验: 取5份阳性血清和5份阴性血清,用同一批次制备的rMSP80蛋白包被ELISA板,对这10份血清样本进行ELISA检测,每份血清样本设5个重复孔,测定OD450值,计算各血清批次内变异系数。同时,将这10份血清样本用3个不同批次包被的ELISA板进行检测,每份血清设3个重复孔,计算批次间变异系数。
1.11.7 临床样品检测: 分别使用本研究建立的ELISA方法以及IDEXX滑液支原体抗体检测试剂盒,对来自上海某养禽场的50份临床鸡血清样品进行检测,对结果进行统计学分析,并计算两种检测方法的符合率。
2 结果和分析 2.1 生物信息学分析结果 通过ProtParam在线软件分析发现,P80蛋白共有770个氨基酸,分子质量为83.7 kDa。Prosite软件分析得出P80蛋白的1-24个氨基酸序列为原核细胞膜脂蛋白脂类附着位点,SignalP软件分析出该蛋白的前20位氨基酸为信号肽。通过BLASTp将MS WVU1853株的P80蛋白序列比对非冗余蛋白序列(Non-redundant protein sequences,nr)数据库,结果显示,MS P80在不同MS分离株间(MS WVU1853、MS NCTC10121、MS-H及MS 53株)的蛋白序列同源性达到98.31%-100%,Query cover值均为100%,而与其他种属蛋白序列的同源性低于35%,故推断这2个蛋白序列在MS种属内高度保守且特异性高。
2.2 MS p80基因Overlap PCR扩增 将MS P80蛋白序列去掉信号肽后设计特异性引物,以MS WVU1853株的基因组DNA为模板,进行PCR扩增,成功突变6个位点,获得正确大小的7个片段(图 1-A),经Overlap PCR得到完整的MS p80基因片段(2238 bp),见图 1-B。
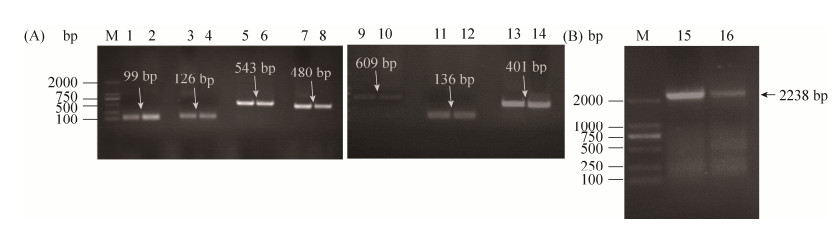 |
| 图 1 MS p80 重叠延伸PCR扩增 Figure 1 Overlap PCR amplification of MS p80 gene. M: 2000 DNA marker; lane 1, 2: amplified with MS p80 1F/1R; lane 3, 4: amplified with MS p80 2F/2R; lane 5, 6: amplified with MS p80 3F/3R; lane 7, 8: amplified with MS p80 4F/4R; lane 9, 10: amplified with MS p80 5F/5R; lane 11, 12: amplified with MS p80 6F/6R; lane 13, 14: amplified with MS p80 7F/7R; lane 15, 16: amplified with MS p80 1F/7R by overlapping PCR. |
| 图选项 |
2.3 重组表达载体的构建和鉴定 将Overlap PCR扩增获得的MS p80全长序列经双酶切后与表达载体pCold Ⅰ连接,再转化至E. coli DH5α感受态细胞中,菌液PCR鉴定见图 2-A,所挑取的4株克隆(泳道2-5)均鉴定为阳性。双酶切鉴定结果见图 2-B,获得与预期大小相符的片段2238 bp和4407 bp的载体片段。重组载体经测序验证后序列全部正确,表明成功获得重组表达载体pColdⅠ-MS p80,且MS p80片段中的6处TGA已成功突变为TGG。
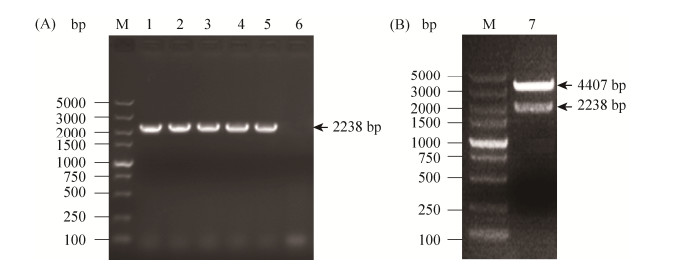 |
| 图 2 重组表达载体的构建和鉴定 Figure 2 Construction and identification of recombinant expression vector. A: identification of E. coli DH5α (pCold Ⅰ-MS p80) by colony PCR amplification; B: double enzyme digestion of pCold Ⅰ-MS p80 vector with BamH I and Xho I. M: 5000 DNA marker; lane 1: positive control (MS WVU1853 genomic DNA); lane 2-5: E. coli DH5α (pCold Ⅰ-MS p80) samples 1-4; lane 6: negative control (PBS); lane 7: product from double enzyme digestion of pCold Ⅰ-MS p80 vector. |
| 图选项 |
2.4 重组蛋白MS P80的表达与纯化 将重组表达载体转化至E. coli BL21(DE3)感受态细胞,经PCR鉴定为阳性的菌株即为重组表达菌株E. coli BL21(pCold Ⅰ-MS p80)。重组表达菌株经IPTG诱导表达,超声裂解后,收集上清,用His-Tag标记的磁珠进行纯化,纯化产物进行SDS-PAGE分析,见图 3。结果显示重组蛋白成功表达并且纯化出约为87 kDa的单一条带,与目的蛋白的预期分子量基本一致,纯化后的rMS P80蛋白条带较纯。
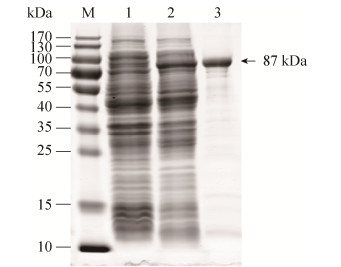 |
| 图 3 rMS P80蛋白的表达和纯化 Figure 3 Expression and purification of rMS P80 protein. M: protein marker; lane 1: total proteins of E. coli BL21(pCold Ⅰ) after induced by IPTG; lane 2: the supernatants of E. coli BL21(pCold Ⅰ-MS p80) after induced by IPTG; lane 3: purified recombinant MS P80 protein. |
| 图选项 |
2.5 rMS P80蛋白与MS不同分离株及其他禽病原阳性鸡血清的免疫印迹分析 制备的不同MS分离株(MS JS1、SD1、SH1、HB1)、MI 695株免疫阳性血清经ELISA效价测定后效价分别为25600、51200、25600、51200、12800。纯化的rMS P80蛋白与不同MS分离株(MS WVU1853、MS JS1、MS SD1、MSSH1、MS HB1)阳性鸡血清的免疫印迹结果显示(图 4,泳道1-5),纯化的rMS P80蛋白与MS不同分离株阳性鸡血清均能发生特异性反应条带,而与SPF鸡阴性血清未见反应条带(泳道12),可见rMS P80蛋白具有良好的免疫反应性且种内保守性较好;而其与MG、MI、EC O1/O2/O78、SPG、NDV、IBDV阳性鸡血清的免疫印迹反应均未见反应条带(图 4,泳道6-11),可见rMS P80蛋白具有较好的种间特异性。
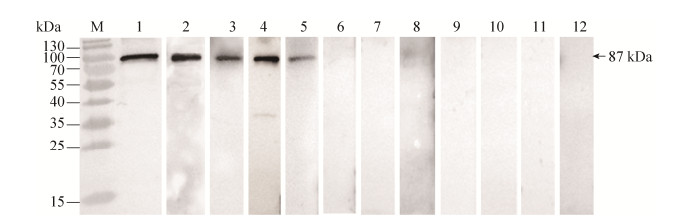 |
| 图 4 纯化rMS P80蛋白与不同禽病原阳性血清的免疫印迹分析 Figure 4 Western bloting analysis of purified rMS P80 with different avian pathogens positive sera. M: protein marker; lane 1: MS WVU1853 positive serum; lane 2: MS JS1 positive serum; lane 3: MS SD1 positive serum; lane 4: MS SH1 positive serum; lane 5: MS HB1 positive serum; lane 6: MG positive serum; lane 7: MI positive serum; lane 8: EC O1/O2/O78 positive serum; lane 9: SPG positive serum; lane 10: NDV positive serum; lane 11: IBDV positive serum; lane 12: negative serum from SPF chicken. |
| 图选项 |
2.6 基于rMS P80蛋白的间接ELISA检测方法的初步建立
2.6.1 最适包被浓度和血清最适稀释度的确定: 当抗原包被浓度为1.25 μg/mL、血清稀释倍数为1:500时,阳性血清OD450值大于1.0,阴性血清OD450值小于0.2,且P/N值相对较大(表 2)。因此,确定最适抗原包被浓度为1.25 μg/mL,MS标准阳性、SPF阴性血清最佳稀释倍数为1:500。
表 2. 抗原最适包被量及血清稀释倍数的ELISA结果(OD450) Table 2. ELISA results of optimal antigen dosage and serum dilution factor (OD450 values)
| Dilutions of serum | Serum | Concentration of coated antigen/(μg/mL) | |||||
| 5.00 | 2.50 | 1.25 | 0.62 | 0.31 | 0.15 | ||
| 1:200 | Positive | 1.483 | 1.379 | 1.234 | 1.006 | 0.842 | 0.597 |
| Negative | 0.644 | 0.376 | 0.239 | 0.158 | 0.113 | 0.098 | |
| P/N | 2.302 | 3.667 | 5.163 | 6.367 | 7.451 | 6.092 | |
| 1:500 | Positive | 1.346 | 1.223 | 1.143 | 0.817 | 0.632 | 0.586 |
| Negative | 0.397 | 0.270 | 0.175 | 0.144 | 0.121 | 0.111 | |
| P/N | 3.390 | 4.530 | 6.531 | 5.674 | 5.223 | 5.279 | |
表选项
2.6.2 酶标二抗工作浓度确定: 试验结果表明,酶标二抗在稀释度为1:20000时P/N值相对较大(表 3),因此确定酶标二抗稀释度为1:20000。
表 3. 酶标二抗最适工作浓度的试验结果 Table 3. ELISA for optimum work concentration of HRP-labeled second antibody
| Serum | Dilutions of antibody | ||
| 1:20000 | 1:40000 | 1:60000 | |
| OD450 value of positive serum | 1.143 | 0.611 | 0.463 |
| OD450 value of negative serum | 0.175 | 0.110 | 0.095 |
| P/N | 6.531 | 5.554 | 4.874 |
表选项
2.6.3 阴性血清临界值的确定: 使用本试剂盒检测30份临床MS阴性鸡血清,根据OD450值计算出S/P值(表 4),求得其S/P值平均值=0.323;标准偏差SD=0.257,由此确定待检血清S/P值≥ 0.323时判断为阳性,小于0.323时判为阴性。
表 4. 测定30份临床MS阴性鸡血清的S/P值 Table 4. Detection of S/P values of 30 clinical MS-negative chicken sera
| Serum number | S/P | Serum number | S/P | Serum number | S/P |
| 1 | 0.263 | 11 | 0.225 | 21 | 0.020 |
| 2 | 0.204 | 12 | 0.155 | 22 | 0.191 |
| 3 | -0.003 | 13 | 0.118 | 23 | 0.196 |
| 4 | 0.130 | 14 | 0.144 | 24 | 0.177 |
| 5 | 0.123 | 15 | 0.045 | 25 | 0.127 |
| 6 | 0.179 | 16 | 0.174 | 26 | 0.117 |
| 7 | 0.154 | 17 | 0.148 | 27 | 0.172 |
| 8 | 0.003 | 18 | 0.120 | 28 | 0.067 |
| 9 | 0.144 | 19 | 0.033 | 29 | 0.116 |
| 10 | 0.095 | 20 | 0.069 | 30 | 0.080 |
表选项
2.6.4 特异性检测: 本研究建立的elisa检测法和idexx试剂盒对其他禽病原阳性血清的检测结果见表 5。基于rms p80蛋白的elisa法检测结果显示ms js1、ms sd1阳性血清结果为阳性,ms临床阴性血清结果为阴性,而mg、mi、ec o1/o2/o78、spg、ndv、ibdv阳性血清均为阴性结果,该结果同idexx试剂盒检测(s/p大于等于0.5阳性,小于0.5阴性)结果一致,故建立的elisa法与idexx试剂盒检测均具有较好特异性。
表 5. 特异性检测结果(与IDEXX试剂盒比较) Table 5. Results of specificity assay (compared to IDEXX kit)
| Serum | ELISA assay based on rMS P80 | IDEXX kit | |||
| S/P average | Judgement | S/P average | Judgement | ||
| MS JS1-positive serum | 1.071 | + | 0.505 | + | |
| MS SD1-positive serum | 0.608 | + | 0.517 | + | |
| MG-positive serum | 0.028 | - | -0.253 | - | |
| MI-positive serum | 0.017 | - | -0.257 | - | |
| EC O1/O2/O78-positive serum | -0.01497 | - | -0.241 | - | |
| SPG-positive serum | -0.032 | - | -0.310 | - | |
| NDV-positive serum | 0.056 | - | -0.200 | - | |
| IBDV-positive serum | 0.141 | - | -0.271 | - | |
表选项
2.6.5 敏感性试验: 利用制备的ELISA检测方法和IDEXX试剂盒分别检测5份MS阳性血清抗体效价(表 6),结果显示,基于rMS P80蛋白的ELISA检测方法的敏感性显著优于IDEXX试剂盒,是IDEXX试剂盒敏感性的4-32倍。
表 6. 敏感性检测结果(与IDEXX试剂盒比较) Table 6. Results of sensitivity assay (compared to IDEXX kit)
| Serum | The ELISA assay based on rMS P80 | IDEXX |
| 1 | 1:3200 | 1:800 |
| 2 | 1:102400 | 1:3200 |
| 3 | 1:1600 | 1:400 |
| 4 | 1:6400 | 1:1600 |
| 5 | 1:6400 | 1:1600 |
表选项
2.6.6 重复性试验: 用建立的ELISA检测方法对5份MS阳性血清和5份MS阴性血清的OD450值进行重复性检测,结果显示(表 7),10份血清的批次内变异系数为均小于5% (0.999%-4.451%),批次间变异系数均小于10% (3.417%-9.092%),因此建立的ELISA方法具有较好的重复性。
表 7. 重复性试验结果 Table 7. Reproducibility of intra- and inter-assays
| Serum number | Intra-assay (OD450) | Inter-assay (OD450) | |||||
| Average | SD | Coefficient of variation (CV%) | Average | SD | Coefficient of variation (CV%) | ||
| 1 | 0.902 | 0.009 | 0.999 | 0.954 | 0.054 | 5.689 | |
| 2 | 1.248 | 0.017 | 1.441 | 1.283 | 0.049 | 3.843 | |
| 3 | 0.812 | 0.014 | 1.817 | 0.835 | 0.034 | 4.056 | |
| 4 | 0.786 | 0.025 | 3.282 | 0.819 | 0.042 | 5.114 | |
| 5 | 1.063 | 0.036 | 3.463 | 1.119 | 0.078 | 7.000 | |
| 6 | 0.123 | 0.005 | 4.451 | 0.114 | 0.007 | 6.477 | |
| 7 | 0.105 | 0.005 | 0.520 | 0.099 | 0.007 | 6.786 | |
| 8 | 0.123 | 0.002 | 1.851 | 0.113 | 0.010 | 9.092 | |
| 9 | 0.134 | 0.003 | 2.000 | 0.129 | 0.004 | 3.494 | |
| 10 | 0.109 | 0.002 | 1.400 | 0.107 | 0.004 | 3.417 | |
表选项
2.6.7 临床样品检测: 采用本研究建立的ELISA检测方法对上海某养殖场50份临床鸡血清样本进行检测,并与IDEXX滑液支原体抗体检测试剂盒检测结果相比较。表 8显示,本ELISA方法检出阳性血清13份、阴性血清37份,IDEXX试剂盒检出阳性血清12份、阴性血清38份,共同检出阳性血清9份、阴性血清34份。以IDEXX试剂盒检测结果为参照,两种方法的阳性样本相符率75%,阴性样本相符率为89.47%,两种方法的总符合率为(9+34)/50=86%。
表 8. 临床样品检测 Table 8. Detection results of two methods on 50 clinical sera (S/P values)
| Serum number | ELISA assay based on rMS P80 | IDEXX kit |
| 1 | 0.263(-) | 0.289(-) |
| 2 | 0.204(-) | 0.058(-) |
| 3 | 0.202(-) | 0.289(-) |
| 4 | 1.076(+) | 0.578(+) |
| 5 | -0.003(-) | 0.085(-) |
| 6 | 0.314(-) | 0.069(-) |
| 7 | 0.223(-) | 0.277(-) |
| 8 | 0.130(-) | 0.123(-) |
| 9 | 0.603(+) | 0.878(+) |
| 10 | 0.228(-) | 0.039(-) |
| 11 | 0.235(-) | 0.486(-) |
| 12 | 0.606(+) | 0.352(-) |
| 13 | 0.473(+) | 0.522(+) |
| 14 | 0.295(-) | 0.405(-) |
| 15 | 0.144(-) | 0.351(-) |
| 16 | 0.045(-) | 0.123(-) |
| 17 | 0.282(-) | 0.143(-) |
| 18 | 0.080(-) | 0.590(+) |
| 19 | 0.174(-) | 0.320(-) |
| 20 | 0.102(-) | 0.285(-) |
| 21 | 0.232(-) | 0.235(-) |
| 22 | 0.148(-) | 0.220(-) |
| 23 | 0.246(-) | 0.150(-) |
| 24 | 0.330(+) | 0.173(-) |
| 25 | 0.120(-) | 0.096(-) |
| 26 | 0.295(-) | 0.046(-) |
| 27 | 0.033(-) | 0.281(-) |
| 28 | 0.603(+) | 0.878(+) |
| 29 | 0.228(-) | 0.039(-) |
| 30 | 0.235(-) | 0.486(-) |
| 31 | 0.606(+) | 0.352(-) |
| 32 | 0.473(+) | 0.522(+) |
| 33 | 0.069(-) | -0.016(-) |
| 34 | 0.020(-) | 0.013(-) |
| 35 | 0.334(+) | 0.672(+) |
| 36 | 0.055(-) | 1.266(+) |
| 37 | 0.254(-) | 0.219(-) |
| 38 | 0.268(-) | 0.016(-) |
| 39 | 0.191(-) | 0.039(-) |
| 40 | 0.288(-) | 0.130(-) |
| 41 | 0.289(-) | 2.655(+) |
| 42 | 0.598(+) | 1.262(+) |
| 43 | 0.276(-) | 0.033(-) |
| 44 | 0.369(+) | 0.529(+) |
| 45 | 0.739(+) | 0.228(-) |
| 46 | 1.039(+) | 0.577(+) |
| 47 | 0.262(-) | 0.039(-) |
| 48 | 0.204(-) | 0.033(-) |
| 49 | 0.181(-) | 0.189(-) |
| 50 | 0.151(-) | 0.123(-) |
表选项
3 讨论和结论 滑液支原体是一种能够引起鸡关节肿大、滑液囊及肌腱发炎和实质器官的肿大的病原体,鸡群感染MS后易发生混合感染,加剧病情,死亡率增高,造成严重的经济损失。目前普遍认为,支原体通过持续感染引发宿主机体免疫应答而导致病变,当支原体黏附并入侵进宿主体内时,可以影响宿主的免疫系统,使病原逃避宿主免疫系统的监视,维持其在宿主细胞中长期生存,促进和辅助其他疾病的并发,造成宿主机体严重损伤[11]。
支原体膜由大约三分之二的蛋白质和三分之一的脂质组成,在多种支原体中,膜表面脂蛋白是其重要的致病相关因子,参与介导支原体与宿主细胞的黏附作用,具有较好的免疫原性,能调节宿主的免疫反应,同时发挥细胞毒性作用,引起宿主细胞的炎症反应或凋亡[12-13]。有研究表明,猪鼻支原体(M. hyorhinis)表面可变脂蛋白VlpB[14]能够黏附宿主细胞;鸡毒支原体(M. gallisepticum)的表面脂蛋白MslA[5]是一种具有免疫原性的脂蛋白,有一定的毒力;人型支原体(M. hominis)中表面脂蛋白OppA[15]除能黏附宿主细胞外,还可以诱导细胞凋亡;从致病性支原体中纯化出炎症诱导因子,鉴定出其为脂蛋白,该脂蛋白能通过Toll样受体2(TLR2)诱导炎症反应[16],其N端结构是诱导免疫和识别Toll样受体的重要因子[17]。肺炎分枝杆菌(M. hyopneumoniae)中表面脂蛋白P46L是膜表面抗原,利用该抗原建立ELISA试剂盒,可用于实验室小鼠和大鼠肺炎支原体感染的血清学检测[18],因此研究支原体膜表面免疫原性脂蛋白是检测该病原和研究其致病机制的基础之一。
本实验室前期通过MS膜蛋白的免疫蛋白质组学结合质谱分析鉴定到MS的免疫原性蛋白MS P80,2008年Ber?i?在当地分离的MS免疫原性蛋白分析实验中同样筛选到MS P80是免疫原性蛋白[19]。从生物信息学分析预测该蛋白是一种脂蛋白,而其他生物学功能研究还是一片空白。因此,本研究成功克隆表达重组蛋白MS P80,并将该蛋白与MS不同分离株阳性血清以及6种其他禽病原阳性血清进行免疫印迹分析,结果表明该蛋白与MS不同分离株阳性血清均具有良好的免疫反应性,而与其他禽病原阳性血清均无交叉反应,证实该蛋白是一个MS特异性的诊断抗原,可作为MS病诊断的候选抗原。接着我们利用该蛋白作为包被抗原,初步建立了MS血清抗体的ELISA检测方法,并评估了其敏感性、重复性及与IDEXX试剂盒的相符率。结果显示,基于rMS P80蛋白的ELISA检测方法具有较好的重复性;与IDEXX试剂盒相比,该方法敏感性更高。对50份临床血清样本检测结果显示,两种方法的阳性样本相符率为75%,总样本符合率为86%,初步证实该蛋白具有一定的应用潜力。
目前国内外尚未见以P80蛋白作为诊断抗原的相关报道。本研究初步建立了以rMS P80作为包被抗原的MS血清抗体间接ELISA检测方法,为我国MS病的诊断、流行病学调查提供了可参考的检测方法。同时,其是否与其他脂蛋白一样,参与MS与宿主细胞的黏附作用、调控宿主免疫系统、诱导机体炎症反应等,还有待进一步研究。
References
| [1] | 陆凤.鸡毒支原体、滑液支原体二联灭活苗的研究.甘肃农业大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10733-1015975481.htm |
| [2] | Zhang JM. Epidemiology, clinical symptoms, changes of autopsy and preventive measures of Mycoplasma synoviae disease in laying hens. Modern Animal Husbandry Science & Technology, 2019(1): 96-97. (in Chinese) 张济明. 蛋鸡滑液囊支原体病的流行病学、临床症状、剖检变化及防治措施. 现代畜牧科技, 2019(1): 96-97. |
| [3] | Xue J, Xu MY, Ma ZJ, Zhao J, Jin N, Zhang GZ. Serological investigation of Mycoplasma synoviae infection in China from 2010 to 2015. Poultry Science, 2017, 96(9): 3109-3112. DOI:10.3382/ps/pex134 |
| [4] | Washburn LR, Bird DW, Dybvig K. Restoration of cytoadherence to an adherence-deficient mutant of Mycoplasma arthritidis by genetic complementation. Infection and Immunity, 2003, 71(2): 671-675. DOI:10.1128/IAI.71.2.671-675.2003 |
| [5] | Szczepanek SM, Frasca S Jr, Schumacher VL, Liao X, Padula M, Djordjevic SP, Geary SJ. Identification of lipoprotein MslA as a neoteric virulence factor of Mycoplasma gallisepticum. Infection and Immunity, 2010, 78(8): 3475-3483. DOI:10.1128/IAI.00154-10 |
| [6] | Noormohammadi AH, Markham PF, Duffy MF, Whithear KG, Browning GF. Multigene families encoding the major hemagglutinins in phylogenetically distinct mycoplasmas. Infection and Immunity, 1998, 66(7): 3470-3475. DOI:10.1128/IAI.66.7.3470-3475.1998 |
| [7] | Noormohammadi AH, Markham PF, Markham JF, Whithear KG, Browning GF. Mycoplasma synoviae surface protein MSPB as a recombinant antigen in an indirect ELISA. Microbiology, 1999, 145(8): 2087-2094. DOI:10.1099/13500872-145-8-2087 |
| [8] | Noormohammadi AH, Browning GF, Jones J, Whithear KG. Improved detection of antibodies to Mycoplasma synoviae vaccine MS-H using an autologous recombinant MSPB enzyme-linked immunosorbent assay. Avian Pathology, 2002, 31(6): 611-617. DOI:10.1080/0307945021000024553 |
| [9] | Noormohammadi AH, Markham PF, Whithear KG, Walker ID, Gurevich VA, Ley DH, Browning GF. Mycoplasma synoviae has two distinct phase-variable major membrane antigens, one of which is a putative hemagglutinin. Infection and Immunity, 1997, 65(7): 2542-2547. DOI:10.1128/IAI.65.7.2542-2547.1997 |
| [10] | Noormohammadi AH, Markham PF, Kanci A, Whithear KG, Browning GF. A novel mechanism for control of antigenic variation in the haemagglutinin gene family of Mycoplasma synoviae. Molecular Microbiology, 2000, 35(4): 911-923. DOI:10.1046/j.1365-2958.2000.01766.x |
| [11] | Hegde S, Rosengarten R, Chopra-Dewasthaly R. Disruption of the pdhB pyruvate dehydrogenase gene affects colony morphology, in vitro growth and cell invasiveness of Mycoplasma agalactiae. PLoS One, 2015, 10(3): e0119706. DOI:10.1371/journal.pone.0119706 |
| [12] | Christodoulides A, Gupta N, Yacoubian V, Maithel N, Parker J, Kelesidis T. The Role of lipoproteins in mycoplasma-mediated immunomodulation. Frontiers in Microbiology, 2018, 9: 1682. DOI:10.3389/fmicb.2018.01682 |
| [13] | Xu CG, Hao YQ, Zhang L, Hao RX, Liu XL, Huang ZY. Molecular cloning and immune response analysis of putative variable lipoproteins from Mycoplasma mycoides subsp. capri. Genetics and Molecular Research, 2014, 13(1): 1527-1539. DOI:10.4238/2014.March.12.5 |
| [14] | Hu YT, Zhang BX, Wang J, Feng ZX, Shao GQ, Xiong QY. The function of the variable lipoprotein B of Mycoplasma hyorhinis in adherence to host cell. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(11): 1049-1054. (in Chinese) 胡永婷, 张必雄, 王佳, 冯志新, 邵国青, 熊祺琰. 猪鼻支原体表面可变脂蛋白VlpB黏附宿主细胞功能研究. 中国预防兽医学报, 2018, 40(11): 1049-1054. |
| [15] | Hopfe M, Henrich B. OppA, the ecto-ATPase of Mycoplasma hominis induces ATP release and cell death in HeLa cells. BMC Microbiology, 2008, 8: 55. DOI:10.1186/1471-2180-8-55 |
| [16] | Shimizu T. Pathogenic factors of mycoplasma. Nippon Saikingaku Zasshi, 2015, 70(4): 369-374. DOI:10.3412/jsb.70.369 |
| [17] | Zuo LL, Wu YM, You XX. Mycoplasma lipoproteins and Toll-like receptors. Journal of Zhejiang University Science B, 2009, 10(1): 67-76. DOI:10.1631/jzus.B0820256 |
| [18] | Asano A, Torigoe D, Sasaki N, Agui T. Development of an ELISA using a recombinant P46-like lipoprotein for diagnosis of Mycoplasma pulmonis infection in rodents. Journal of Veterinary Medical Science, 2014, 76(2): 151-157. DOI:10.1292/jvms.13-0308 |
| [19] | Ber?i? RL, Slavec B, Lavri? M, Narat M, Bidovec A, Dov? P, Ben?ina D. Identification of major immunogenic proteins of Mycoplasma synoviae isolates. Veterinary Microbiology, 2008, 127(1/2): 147-154. |
