刘宇飞, 徐耀波, 袁泽, 翟俊尧, 李瑞, 霍一丹, 张小萍, 魏静


西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室, 水产科学重庆市重点实验室, 重庆 400715
收稿日期:2020-01-03;修回日期:2020-04-15;网络出版日期:2020-05-21
基金项目:西南大学大学生创新创业训练项目(重庆市级)(S201910635050);重庆市高等教育教学改革研究重大项目(171010);重庆市留学人员回国创业创新支持计划(CX2018097);国家自然科学基金(31972776)
作者简介:魏静, 女, 48岁, 教授, 博士生导师, 四川省营山县人。1998年毕业于南京农业大学动物医学院, 获兽医微生物与免疫学专业硕士学位; 2006年毕业于第三军医大学全军免疫学研究所, 获免疫学专业博士学位; 2014-2015年期间在新加坡国立大学进行访学交流及合作研究。教学方面, 主要从事《微生物学》、《免疫学》等课程的本科教学工作, 指导学生成功申报国家级、市级等大学生创新创业训练计划项目多项, 并获得全国大学生生命科学竞赛等奖项, 本人曾获得市级年度优秀指导教师。科研方面, 主要从事分子免疫与干细胞方面研究工作, 主持国家自然科学基金青年基金项目、面上项目等多项, 在国内外核心学术刊物发表学术论文40余篇.
*通信作者:魏静, Tel: +86-23-68252365; E-mail:lalsos@swu.edu.cn.
摘要:[目的] 农用地膜主要成分为聚乙烯(polyethylene,PE),因其难以被降解,其废弃物常造成“白色污染”,本研究从常年覆盖农用地膜的土壤中筛选PE降解菌,并探究其对PE制品的降解效能。[方法] 采集的土壤样品用PE为唯一碳源的无机盐培养基进行富集,筛选、纯化PE降解菌,分离菌通过形态染色、生理生化特征、16S rRNA基因序列分析进行鉴定,检测其在不同PE浓度(0%、0.05%、0.10%、0.25%、0.50%、1.00%、2.00%、3.00%)的无机盐培养基中的生长曲线,最后通过扫描电镜、光镜观察,检测分离菌对农用地膜的降解效能。[结果] 从土壤中筛选获得一株能够降解PE的分离菌株(命名为SW1),初步鉴定其为放线菌的诺卡氏菌属Nocardia sp.。SW1的生长对PE具有明显浓度依赖,在含2% PE的无机盐培养基中生长最快,在培养的第48 h菌液浓度开始明显增加,第60 h达到最大,而在不含PE的无机盐培养基中未见生长。形态生理学观察表明,35℃培养15 d后,扫描电镜观察可见有大量菌嵌入膜内或附于膜表面生长,膜表面粗糙,并开始出现破损;培养60 d后,光镜观察可见膜大面积破损,并出现空洞。[结论] 从土壤中筛选获得了一株能够有效降解PE制品的放线菌菌株Nocardia sp. SW1。该研究丰富了PE制品降解微生物的菌种资源,为PE塑料废弃物的生物降解提供了科学数据与参考。
关键词:聚乙烯塑料农用地膜放线菌诺卡氏菌降解
Isolation of a polyethylene-degrading strain from farm soil
Yufei Liu, Yaobo Xu, Ze Yuan, Junyao Zhai, Rui Li, Yidan Huo, Xiaoping Zhang, Jing Wei


Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education; Laboratory of Aquatic Science of Chongqing, School of Life Sciences, Southwest University, Chongqing 400715, China
Received: 3 January 2020; Revised: 15 April 2020; Published online: 21 May 2020
*Corresponding author: Jing Wei, Tel: +86-23-68252365; E-mail:lalsos@swu.edu.cn.
Foundation item: Supported by Grant Innovation and Entrepreneurship Training Program for College Students of Southwest University (Chongqing Municipal Level) (S201910635050); by the Grant from Chongqing Higher Education Teaching Reform Research Project (171010); by the Innovation Projects of Chongqing Overseas Students' Innovation Support Plan (CX2018097) and by the National Natural Science Foundation of China (31972776)
Abstract: [Objective] The main component of agricultural mulch film is polyethylene. Because it is difficult to be degraded, its waste often causes "white pollution". In this study, polyethylene degrading bacteria were screened from the soil covered with agricultural mulch all the year round, and the degradation efficiency of polyethylene products was also explored. [Methods] Polyethylene-degrading bacteria were enriched, screened and purified using the inorganic salt medium with polyethylene as the sole carbon source. The isolated bacteria were identified by colony, morphological staining, physiological and biochemical characteristics and 16S rRNA gene phylogenetic analysis. The growth curves of isolated strain were detected under different concentrations (0, 0.05%, 0.10% 0.25%, 0.50%, 1%, 2% and 3%) of polyethylene. Finally, the biodegradation of the agricultural mulch film was detected using scanning electron microscopy and light microscopy. [Results] A strain (named as SW1) which could degrade polyethylene was isolated from soil and identified as of Nocardia sp. The growth of SW1 was dependent on the concentration of polyethylene. It grew fastest in the inorganic salt medium containing 2% polyethylene. At 48 h, the concentration of the bacterial solution began to increase; at 60 h, it reached the maximum. Meanwhile, no growth was found in the inorganic salt medium without polyethylene. In the inorganic salt medium containing agricultural mulch film, after culture at 35℃ for 15 d, a large number of bacteria were observed to be embedded in the film or attached to the surface of the film by scanning electron microscopy, the surface of the film was rough, and began to be damaged. After culture for 60 d, the membrane of the inoculated group was damaged in a large area and cavity appeared. [Conclusion] Nocardia sp. SW1 isolated from farm soil can degrade polyethylene products effectively. This study enriches the degradation microbial resources of polyethylene products, and provides scientific data and reference for the biodegradation of polyethylene plastic waste.
Keywords: polyethyleneplasticsfarm filmactinomyceteNocardiadegradation
全球每年生产约3.11亿t塑料制品,其中聚乙烯(polyethylene,PE)塑料制品占比约64%,并产生了大量的环境污染问题[1-2]。据估算,每年约4000万t塑料废弃物被排放到环境中,常被称为“白色污染”[1-4]。塑料废弃物治理是全世界各国政府和学术界面临的共同难题,主要原因是,塑料主要成分是高分子聚合物,如PE是由乙烯单体(CH2=CH2)经加聚反应而成,其具有疏水性高、表面能低等特征,非常难以被生物降解[5-6]。目前,塑料废弃物治理通常采取填埋和焚烧方法[1-4]。前者是目前世界上最常用的垃圾处理技术,其中有约10%的废弃塑料埋入地下,但由于其难以被降解,从而侵占土壤,并降低土壤生产力;后者简便易行,并可回收其产生的热能,但其主要问题是焚烧不彻底,并可产生多种有毒气体如CO、SO2、二噁英,造成严重二次污染[1-4]。
微生物具有繁殖快、代谢类型多等特性。因此,利用微生物降解PE塑料污染被认为是一种生态友好、成本低廉、最具潜力的策略[6-7]。Jen-hou等于1961年最早分离获得PE降解菌[8]。目前已分离获得了多种PE降解微生物,细菌如乳酸链球菌(Streptococcus lactis)、金黄色葡萄球菌(Staphylococcus aureus)、微球菌(Micrococcus sp.)、普通变形杆菌(Proteus vulgaris)、假单胞菌(Pseudomonas sp.)、芽孢杆菌(Bacillus subtilis)、肠杆菌(Enterobacter asburiae)[5-10],其分属于7个不同属;放线菌如东方拟无枝酸菌(Amycolatopsis orientalis)[11];真菌如曲霉(Aspergillus niger)、木霉(Trichoderma sp.)、青霉(Penicillum sp.)[5-6, 12],其分属于3个不同属。本研究从常年覆盖农用地膜的土壤中成功筛选获得了一株新的PE降解菌株SW1, 初步鉴定其属于放线菌的诺卡氏菌属(Nocardia sp.),同时发现该分离菌对农用地膜具有显著降解效能。已有研究发现,诺卡氏菌属具有分解线性和分支烷烃或烯烃、烷基苯、苯酚及其衍生物等脂肪族和芳香族有毒碳氢化合物、有机硫化物、腈类化合物等的强大能力[13],但目前尚未见其降解PE方面的报道。该研究成果可望为PE塑料废弃物处理提供科学数据与参考。
1 材料和方法 1.1 土壤样品、PE和培养基 土壤样品:2018年11月20日采集于重庆马鞍溪湿地公园两侧农用地膜覆盖的农田(106.413E,29.824N)。该农田耕种时间在10年左右,主要农作物为常见的蔬菜,如油菜、菠菜、卷心菜、白菜等,取样时,农田的地膜覆盖率在70%以上。
PE:平均分子量4000的分析纯PE粉末(Sigma公司,美国);农用地膜(一鸣塑业公司,中国四川)。
培养基:(1)无机盐培养基(g/L):K2HPO4 0.7,KH2PO4 0.7,MgSO4·7H2O 0.7,NH4NO3 1.0,NaCl 0.005,FeSO4·7H2O 0.002,ZnSO4·7H2O 0.002,MnSO4·H2O 0.001,pH 7.2;(2) LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10,pH 7.4。
1.2 降解菌的富集及分离纯化 首先将采集的土壤样品1 g加入150 mL无机盐培养基,充分摇匀,制得土壤稀释液;然后将20 μL制备的土壤稀释液接种到100 mL含1% PE的无机盐培养基中,分离以PE为唯一碳源的菌株,同时将20 μL制备的土壤稀释液接种到100 mL的无机盐培养基中作为对照,于35 ℃、150 r/min培养,逐日观察,待培养基出现浑浊,取培养液20 μL到对应的新鲜培养基中继续培养,重复4–5次;最后按照常规方法取培养液采用平板划线法进行分离纯化,以获得纯培养。
1.3 降解菌的鉴定 菌体菌落特征、形态染色及生理生化特征:分离菌菌落特征、形态染色特征、生理生化特征检测参照文献[14-15]进行。
16S rRNA基因序列克隆及系统发育分析:采用16S rRNA基因通用引物[16](27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACGGCTACCTTGTTACGACTT-3′)扩增分离菌16S rRNA基因序列,其序列长度为1466 bp。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 100 s,35个循环;72 ℃ 10 min。扩增产物送华大基因测序,获得的目标基因序列在NCBI(https://www.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对分析,并下载同源性高的菌种序列信息,进一步用MEGA7.0软件进行系统发育分析。
1.4 在不同PE浓度条件下降解菌的生长曲线 在含0.05%、0.10%、0.25%、0.50%、1.00%、2.00%、3.00% PE的100 mL无机盐培养基中接入100 μL分离菌株的菌悬液,同时以不含PE的无机盐培养基为对照,35 ℃、150 r/min条件下培养,每12 h测量OD600,绘制生长曲线。
1.5 降解菌对PE制品的降解效能
1.5.1 扫描电镜观察分离菌在PE制品表面生长情况: 农用地膜用无菌水反复漂洗,在无菌条件下剪成小片,分别适量放于150 mL无机盐培养基中,然后接种分离纯化菌液,对照组不接种,35 ℃、150 r/min条件下培养。在培养第15天,取处理组及对照组样品,按常规方法进行处理[11],具体为:用0.01 mol/L磷酸盐缓冲液(pH 7.2)洗涤样品,以除去表面未粘附菌,重复2次,然后依次用4%多聚甲醛处理8 h,50%乙醇处理2次,每次30 min,70%、80%、90%、95%乙醇各处理60 min,100%乙醇处理120 min,最后样品自然干燥、镀铬,通过扫描电镜(HITACHI S-3400N)观察膜表面细菌定植和侵蚀情况。
1.5.2 光镜观察: 在培养第60天,取处理组及对照组样品,用双蒸水洗涤多次,自然风干,光镜观察PE制品降解情况。
2 结果和分析 2.1 降解菌的筛选、纯化 接种了土壤稀释液的无机盐培养基35 ℃、150 r/min培养7 d,含PE培养液可见明显浑浊,而不含PE的培养液未见浑浊;用培养液重复接种4次以进行富集培养,结果相似;最后用多次富集后的培养液划线、分离,获得纯化菌株,命名为SW1。
2.2 降解菌SW1的鉴定
2.2.1 形态学鉴定: 将分离纯化的SW1菌株接种到LB固体培养基进行培养,其菌落白色、圆形、干燥,表面不平整,菌落边缘不整齐(图 1-A);体式显微镜下可见其菌落表面明显丝绒状,边缘有大量的白色菌丝(图 1-B);插片法进一步观察菌丝形态,可见其呈波曲、分枝状(图 1-C);革兰氏染色阳性,菌体为球杆状或长杆状,长短不一(图 1-D)。根据上述菌落特征、形态染色特征,初步判断SW1为放线菌类微生物。
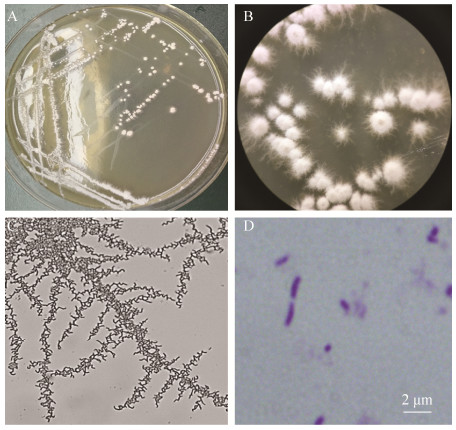 |
| 图 1 降解菌SW1菌落特征及形态染色特征 Figure 1 Colony and morphological staining of degrading strain SW1. A: the colony morphology of SW1 in LB medium; B: the colony morphology under a field vision of stereomicroscope; C: the mycelium morphology of SW1; D: the morphology characteristics after Gram's staining. |
| 图选项 |
2.2.2 生理生化检测: 生理生化试验结果表明,SW1菌株接触酶、丙二酸盐利用、硝酸盐(还原)、淀粉利用、尿素利用均为阳性,与诺卡氏菌属的Nocardia higoensis完全一致[17],与Nocardia thailandica除尿素利用外,其他均相同[18]。提示,分离菌SW1可能属于放线菌的诺卡氏菌属。
2.2.3 16S rRNA基因序列测定及系统发育分析: 将测序获得的SW1菌株16S rRNA基因序列提交至GenBank,获得序列登录号GenBankMN892518,然后与NCBI中序列进行在线比对,其与诺卡氏菌属多种菌株相似度高达95%以上。基于16S rRNA基因的系统发育分析结果显示,SW1与诺卡氏菌属聚为一枝,与Nocardia higoensis及Nocardia thailandica的亲缘关系更近(图 2),进一步证实分离菌SW1为Nocardiasp.,但具体属于哪一种尚需进一步鉴定。
 |
| 图 2 降解菌SW1的16S rRNA基因系统发育树 Figure 2 Phylogenetic tree of degrading strain SW1 based on 16S rRNA gene sequences analysis. The tree was constructed using the neighbor-joining method within the MEGA7.0 program. Node values represent percent bootstrap confidence derived from 2000 replicates. The GenBank accession numbers of the indicated sequences are shown in the parentheses. |
| 图选项 |
2.3 降解菌SW1在不同PE浓度下的生长曲线 降解菌SW1在含2% PE的无机盐培养基中生长最好,在培养的第36 h菌液浓度开始明显增加,第60 h达到最大,第72 h菌液浓度开始下降;其次是在含1% PE的无机盐培养基中生长较好,在培养的第60 h菌液浓度显著增加,第72菌液浓度达到最大,一直维持至第96 h,第108 h后菌液浓度开始下降;在含3% PE的无机盐培养基中,在培养的第36 h菌液浓度开始明显增加,但其最大菌液浓度明显低于在1%、2% PE培养基中的浓度;而在不含PE的无机盐培养基中,SW1菌液浓度几乎无变化(图 3)。上述研究结果表明,分离菌SW1的生长对PE具有明显浓度依赖,并且2% PE为其生长最适浓度。
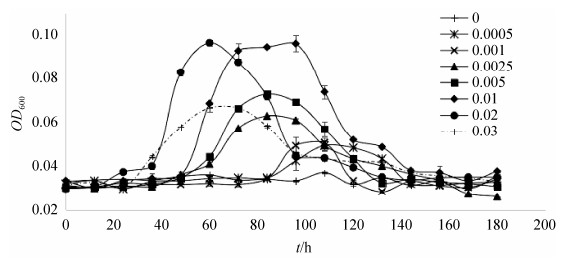 |
| 图 3 降解菌SW1在不同PE浓度下的生长曲线 Figure 3 The growth curve of strain SW1 at different concentrations of PE. The average and standard error were calculated |
| 图选项 |
2.4 降解菌SW1对PE制品的降解效能 降解菌SW1接种于农用地膜为唯一碳源的无机盐培养基中,35 ℃ 150 r/min条件下培养,未接种组为对照组。培养15 d后,扫描电镜观察,对照组膜表面完整(图 4-A),而SW1接种组可见有大量菌嵌入膜内或附于膜表面生长,膜表面粗糙,并开始出现破损(图 4-B,C);培养60 d后,光镜观察未接种组膜完好无损(图 4-D),接种组可见膜表面有大量菌丝聚集生长(图 4-E,F),同时膜表面出现大面积破损及空洞(图 4-F)。上述研究结果表明,降解菌SW1对PE制品农用地膜具有显著降解效能。
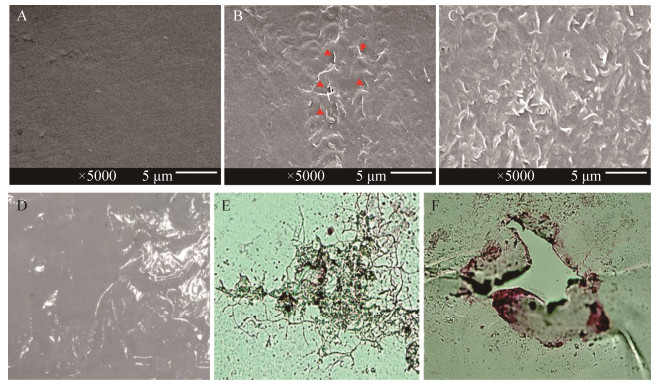 |
| 图 4 农用地膜在未接种及接种降解菌SW1不同时间后的显微观察 Figure 4 The microscope observation of the agricultural film at different time points after incubated without or with strain SW1. A, B, C: the scanning electron microscope observation after incubated for 15 days. Arrows in B indicate microbes inserted in or on the agricultural film. D, E, F: the light microscope observation after incubated for 60 days. |
| 图选项 |
3 讨论 本研究从土壤中成功筛选获得了一株对PE制品具有高效降解效能的菌株SW1,初步鉴定其为放线菌的诺卡氏菌属。就我们所知,目前尚未有诺卡氏菌属对塑料制品具有降解作用的相关报道。因此,该研究丰富了PE制品降解微生物的菌种资源,为进一步开展PE制品生物降解机制研究奠定了重要基础。
诺卡氏菌属不同菌株对脂肪族和芳香族碳氢化合物,如烷基苯、苯酚及其衍生物、多环芳烃、有机硫化合物、各种腈类高分子聚合物等均具有极高的分解代谢能力[13]。分离菌SW1菌落特征、形态染色特征、生理生化特征均与Nocardia higoensis基本一致,其16S rRNA基因序列相似度达97%,但SW1与Nocardia higoensis是否属于同一菌种,尚需分子水平的进一步证实。
PE于1933年首次发现,是由乙烯单体经加聚反应而成的似蜡质高分子聚合物,通常无臭味,耐低温,化学惰性,能耐受常见非氧化性酸碱的腐蚀,塑形方法多样,被广泛用于工业、农业等各种行业中,成为全球五大泛用树脂之首,其中塑料薄膜占比最大[19]。近年来,大量野生动物食用塑料导致的死亡、微塑料带来的安全问题等引起了社会的普遍关注[3],PE等塑料制品的微生物降解相关研究显得尤为迫切。除了从不同条件的土壤等环境中分离,还有研究者报道从蜡虫(Plodia interpunctella)、黄粉虫(Tenebrio molitor Linnaeus)幼虫肠道中分离获得了塑料降解菌[10, 20-21]。2014年Yang等从食用塑料的蜡虫肠道分离获得2株PE降解菌,即肠杆菌(Enterobacter asburiae)YT1和芽孢杆菌(Bacillus sp.)YP1,两分离菌在PE膜上孵育28 d,发现PE膜疏水性降低,扫描电镜和原子力显微镜观察到PE膜表面有明显的损坏,可见有0.3?0.4 μm的凹坑,X射线光电子能谱、傅立叶红外光谱证实PE膜上有羰基形成,在孵育的第60天,PE膜可见有约6.1%±0.3%和10.7%±0.2%的降解,从而表明,在蜡虫的肠道中存在PE降解细菌[10]。同时,2015年Yang等从黄粉虫幼虫肠道分离出能够降解聚苯乙烯薄膜的微小杆菌(Exiguobacterium sp. strain YT2)[20-21]。这些研究为丰富PE降解菌资源库提供了科学数据与新思路。
评价降解菌对PE降解作用的方法目前通常分为三类[5-6, 20-21],一是评价降解菌利用PE的生长情况,如检测在PE为唯一碳源培养基或PE制品表面菌株的生长情况,或者通过检测还原糖或总蛋白含量间接反应菌株生长情况;二是评价PE制品在降解过程中发生的变化,如通过红外光谱、称重等分析膜表面变化情况间接反应膜降解的变化情况;三是通过显微观察膜表面,以评价降解菌对PE制品的降解。在本研究中,一方面,SW1在以PE为唯一碳源的培养基中能够有效生长,在最适浓度2% PE的条件下,培养的第3天即达到稳定生长状态,而在无PE的培养基中无生长,提示其能够高效利用PE。另一方面,在PE膜上孵育15 d,扫描电镜观察即可见大量菌嵌入PE膜内生长,PE膜表面可见有明显破损,在培养的第60天,光镜即可见大面积破损、空洞。此外,SW1接种保鲜膜、一次性塑料手套等其他PE制品,光镜下均观察到大面积破损、空洞。我们的研究结果有力证实,SW1对PE制品具有高效降解作用。然而,SW1对PE降解的关键酶或酶系、编码这些酶的基因及降解机理如何,尚待研究。
References
| [1] | Barnes DKA, Galgani F, Thompson RC, Barlaz M. Accumulation and fragmentation of plastic debris in global environments. Philosophical Transactions of the Royal Society B:Biological Sciences, 2009, 364(1526): 1985-1998. DOI:10.1098/rstb.2008.0205 |
| [2] | Sarker M. Converting waste plastic to hydrocarbon fuel materials. Energy Engineering, 2011, 108(2): 35-43. |
| [3] | Frias JPGL, Sobral P, Ferreira AM. Organic pollutants in microplastics from two beaches of the Portuguese coast. Marine Pollution Bulletin, 2010, 60(11): 1988-1992. DOI:10.1016/j.marpolbul.2010.07.030 |
| [4] | Wei BM. Environmental protection analysis of waste plastics disposal project. Shanxi Chemical Industry, 2016, 36(6): 121-123. (in Chinese) 韦保明. 废弃塑料处理工程中的环境保护分析. 山西化工, 2016, 36(6): 121-123. |
| [5] | Restrepo-Flórez JM, Bassi A, Thompson MR. Microbial degradation and deterioration of polyethylene-a review. International Biodeterioration & Biodegradation, 2014, 88: 83-90. |
| [6] | Priyanka N, Archana T. Biodegradability of polythene and plastic by the help of microorganism:a way for brighter future. Journal of Environmental & Analytical Toxicology, 2011, 1(4): 1000111. |
| [7] | Jen-hou L, Schwartz A. Zum Verhalten von bakterien gemischen gegentiber polyethylen verschiedenen mittleren Molekulargewichts. Kunststoffe, 1961, 51: 317-320. |
| [8] | Lee B, Pometto Ⅲ AL, Fratzke A, Bailey Jr TB. Biodegradation of degradable plastic polyethylene by phanerochaete and Streptomyces species. Applied and Environmental Microbiology, 1991, 57(3): 678-685. DOI:10.1128/AEM.57.3.678-685.1991 |
| [9] | Kathiresan K. Polythene and plastic-degrading microbes in an Indian mangrove soil. Revista de Biologia Tropical, 2003, 51(3/4): 629-633. |
| [10] | Yang J, Yang Y, Wu WM, Zhao J, Jiang L. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [11] | Zhong Y, Li YZ, Zhang RL, Luo BX, Zhang EL, Tao ZY, Zhu WK. Screening a polyethylene degrading strain and study on the degradation characteristics. Ecology and Environmental Sciences, 2017, 26(4): 681-686. (in Chinese) 钟越, 李雨竹, 张榕麟, 罗贝旭, 张尔亮, 陶宗娅, 竹文坤. 一株聚乙烯降解菌的筛选及其降解特性研究. 生态环境学报, 2017, 26(4): 681-686. |
| [12] | Sowmya HV, Ramalingappa, Krishnappa M, Thippeswamy B. Degradation of polyethylene by Trichoderma harzianum-SEM, FTIR, and NMR analyses. Environmental Monitoring and Assessment, 2014, 186(10): 6577-6586. DOI:10.1007/s10661-014-3875-6 |
| [13] | Luo Q, Hiessl S, Steinbüchel A. Functional diversity of N ocardia in metabolism. Environmental Microbiology, 2014, 16(1): 29-48. DOI:10.1111/1462-2920.12221 |
| [14] | 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译.第8版.北京: 科学出版社, 1984. |
| [15] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001. |
| [16] | Lane DJ. 16S/23S rRNA sequencing//Stackebrandt E, Goodfellow M. Nucleic Acid Techniques in Bacterial Systematics. Chichester: John Wiley and Sons, 1991: 115-175. |
| [17] | Kageyama A, Yazawa K, Mukai A, Kinoshita M, Takata N, Nishimura K, Kroppenstedt R M, Mikami Y. Nocardia shimofusensis sp. nov., isolated from soil, and Nocardia higoensis sp. nov., isolated from a patient with lung Nocardiosis in Japan. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(6): 1927-1931. DOI:10.1099/ijs.0.63061-0 |
| [18] | Kageyama A, Poonwan N, Yazawa K, Suzuki SI, Kroppenstedt RM, Mikami Y. Nocardia vermiculata sp. nov. and Nocardia thailandica sp. nov. isolated from clinical specimens. Actinomycetologica, 2004, 18(2): 27-33. DOI:10.3209/saj.18_27 |
| [19] | Liu YH. Status and trends of polyethylene industry. Chemical Industry, 2011, 29(4): 13-16. (in Chinese) 刘雨虹. 聚乙烯产业现状及生产技术进展. 化学工业, 2011, 29(4): 13-16. |
| [20] | Yang Y, Yang J, Wu WM, Zhao J, Song YL, Gao LC, Yang RF, Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms:part 1. Chemical and physical characterization and isotopic tests. Environmental Science & Technology, 2015, 49(20): 12080-12086. |
| [21] | Yang Y, Yang J, Wu WM, Zhao J, Song YL, Gao LC, Yang RF, Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms:part 2. Role of gut microorganisms. Environmental Science & Technolog, 2015, 49(20): 12087-12093. |
