张立伟, 石玉祥, 张永英, 李欣泽, 郝贺, 朱原, 周双, 王芝超, 杜瞳彤, 阿合玛尔列·海依拉提, 时欣欣, 韩旺, 仝星, 朱阵


河北工程大学生命科学与食品工程学院, 河北邯郸 056000
收稿日期:2020-01-18;修回日期:2020-04-06;网络出版日期:2020-04-08
基金项目:兽医公共卫生学(KCJSX2020078);河北省科技厅项目(17226612D-2);奶牛振兴重大技术创新专项(19226607D);河北省自然科学基金(C2019402114);探究鸡源致病性大肠杆菌中blaCTX-M基因的传播机制(CXZZSS2020078)
*通信作者:朱阵, E-mail:zhuzhen234@yeah.net.
摘要:[目的] 本试验旨在阐明鸡源大肠杆菌致病性及分子流行特性,为探索大肠杆菌流行途径制定合理的防控策略提供新思路。[方法] 2018–2019年在河北省采集病死鸡肝脏样品,通过选择培养基筛选、生化鉴定、血清凝集试验对分离菌株进行系统鉴定,应用PCR方法检测分离株中毒力基因流行情况。参考系统发育群分类方法对大肠杆菌进行分群分析,并参照McMLST网站数据库提供的7对管家基因序列进行多位点序列分型(multilocus sequence typing,MLST)分析。[结果] 结果显示,56株分离株符合大肠杆菌生化特征,分为8个生化表型,B4(30.36%)、B5(25%)和B2(23.21%)为主要生化表型。56株分离株大肠杆菌血清凝集试验均呈阳性,分为11种血清型,O78(26.79%)、O2(23.21%)、O157(17.86%)和O1(14.29%)为主要流行血清型。56株大肠杆菌共检测出15种肠外大肠杆菌毒力基因,未检出papC、ibeA和ibeB基因。黏附相关基因fimC和抗血清存活因子相关基因ompA携带率为100%。aatA、yijP、irp2、mat、iss,检出率分别为98.21%、98.21%、98.21%、96.43%、92.86%。同时,大肠杆菌与铁转运相关基因iroN、fyuA、iucD、irp2检出率均在80%以上。56株大肠杆菌中有20株属于肠出血型大肠杆菌(enterohemorrhagic E.coli,EHEC),其次是肠聚集型大肠杆菌(enteroaggregative E.coli,EAEC)(n=4)、肠产毒素型大肠杆菌(Enterotoxigenic E.coli,ETEC)(n=2)。这些菌株D群分离株较多,其次是B2群。通过MLST分型分析,共分为22个ST型,其中ST88(n=7)、ST85(n=6)、ST243(n=6)型为主要流行型。[结论] 结果显示大肠杆菌血清型多样,毒力因子种类繁多,致病性大肠杆菌同时携带多种毒力基因,表明动物源大肠杆菌具有较强的毒力基础。
关键词:大肠杆菌毒力基因MLST系统发育群
Virulence genes and molecular characteristics of chicken-derived Escherichia coli
Liwei Zhang, Yuxiang Shi, Yongying Zhang, Xinze Li, He Hao, Yuan Zhu, Shuang Zhou, Zhichao Wang, Tongtong Du, Ahemaerlie·Haiyilati, Xinxin Shi, Wang Han, Xing Tong, Zhen Zhu


School of Life Sciences and Food Engineering, Hebei University of Engineering, Handan 056000, Hebei Province, China
Received: 18 January 2020; Revised: 6 April 2020; Published online: 8 April 2020
*Corresponding author: Zhen Zhu, E-mail:zhuzhen234@yeah.net.
Foundation item: Supported by the Veterinary Public Health (KCJSX2020078), by the Science and Technology Department of Hebei Province (17226612D-2), by the Cows Revitalize Major Technical Innovation Projects (19226607D), by the Natural Science Foundation of Hebei Province (C2019402114) and by the Exploring the Transmission Mechanism of blaCTX-M Gene in Chicken-borne Pathogenic E. coli (CXZZSS2020078)
Abstract: [Objective] The purpose of this test is to elucidate the pathogenicity and molecular epidemic characteristics of chicken-derived Escherichia coli, and to provide new ideas for exploring reasonable ways to prevent and control E. coli. [Methods] Livers of dead chicken samples were collected in Hebei Province from 2018 to 2019, and the isolated strains were systematically identified through selection of media selection, biochemical identification, and serum agglutination test. Detection of virulence genes in isolates was conducted by PCR. Cluster analysis of E. coli was performed with reference to phylogenetic classification. Multi-sequence typing analysis of housekeeping gene sequences with reference to 7 databases provided on the McMLST website database. [Results] The results show that 56 isolates conformed to the biochemical characteristics of E. coli were divided into 8 biochemical phenotypes. Among them, B4 (30.36%), B5 (25%), and B2 (23.21%) were the main biochemical phenotypes. 56 isolates of E. coli were positive for serum agglutination test, divided into 11 serotypes. O78 (26.79%), O2 (23.21%), O157 (17.86%), and O1 (14.29%) were the main epidemic serotypes. A total of 15 E. coli virulence genes were detected in 56 strains of E. coli, but no papC, ibeA, and ibeB genes were detected. The gene carrying rate of Adhesion-related gene fimC and antiserum survival factor-related gene ompA in all isolates is 100%. The detection rates of the genes of aatA, yijP, irp2, mat, and iss were 98.21%, 98.21%, 98.21%, 96.43% and 92.86%. The detection rates of iroN, fyuA, iucD and irp2 of E. coli and iron transport-related genes were all above 80%. Of the 56 strains of E. coli, 20 are Enterohemorrhagic E. coli (EHEC), followed by Enteroaggregative E. coli (EAEC) (n=4) and enterotoxigenic E. coli (ETEC) (n=2). These strains have more D group isolates, followed by B2 group. According to MLST typing analysis, there are 22 ST types in total, of which ST88, ST85 and ST243 are the main epidemic types. [Conclusion] The serotypes of E. coli were diverse and the virulence factors were various. The pathogenic E. coli also carried multiple virulence genes, indicating that animal-derived E. coli has a strong virulence basis.
Keywords: Escherichia colivirulence geneMLSTphylogenetic group
禽大肠杆菌病是由致病性大肠杆菌引起的一种细菌性传染病,是对我国养禽业危害极大的重要疾病之一[1-3],急性病例能够引起败血症,亚急性病例引起心包炎、肝周炎、腹膜炎、气囊炎、肠炎和输卵管炎。禽大肠杆菌病一般继发于某些病毒病,如新城疫、马立克氏病、传染性支气管炎等,鸡群感染大肠杆菌的发病率一般为11%–69%,死亡率为3.2%–72.9%,各品种及各日龄的鸡均可发病,给养禽业带来巨大经济损失[4]。
致病性大肠杆菌血清型较多,我国报道的血清型主要有O1、O2、O5、O7、O78、O88、O103等70余种[5]。由于不同地区流行的优势血清型不同,即使同一鸡场分离的致病性大肠杆菌也有多种血清型,各血清型之间又缺乏交叉免疫,给疫苗防治带来挑战[5-7]。肠外致病性大肠杆菌(extraintestinal pathogenic E. coli,ExPEC)是近几年提出来的大肠杆菌菌群,主要是指能在肠道内无症状定殖不引起腹泻但能引起肠外组织感染的一类大肠杆菌[8],这类大肠杆菌能随血液循环进入心、肝、脾、肺、肾、脑等肠外组织,并在其中定植引起相应的疾病,可导致人与动物肠道外相关疾病的发生,并可能呈现暴发式流行。对于家禽而言,以禽致病性大肠杆菌(avian pathogenic E. coli,APEC)流行最为广泛[9]。APEC毒力因子众多,主要以外膜蛋白(opmA)、黏附相关基因(Ⅰ型菌毛、P菌毛)、铁摄取系统(气杆菌素、肠杆菌素、耶尔森菌素)、血清抗性蛋白(iss)、溶血素(温度敏感性血凝素和溶血素E)和大肠杆菌素脂多糖为主。这些毒力因子是大肠杆菌引起家禽致病的主要因素[10]。肠道致病性大肠杆菌根据引起的临床症状、病理变化又可分为6类:ETEC、EHEC、EAEC、肠致病性大肠杆菌(enteropathogenic E. coli,EPEC)、肠侵袭性大肠杆菌(enteroinvasive E. coli,EIEC)和弥散粘附性大肠杆菌(diffuselyadherent E. coli,DAEC)[11]。EHEC和EIEC菌株主要定殖于盲肠、结肠和直肠部分,能够导致禽传染性肠炎和出血性肠炎,EAEC在小肠和大肠定植引起禽类严重腹泻。EHEC亦可在人或动物间相互传播,在德国、日本和欧美国家都曾出现过O157:H7和O104:H4菌株严重流行的感染事件,给人和动物机体造成了很大危害[12-13]。分析菌株的毒力因子携带情况,可以评估大肠杆菌的危害性,便于采取相应的控制措施。本研究对2018–2019年河北省分离的大肠杆菌进行了系统鉴定及毒力基因检测、系统发育群鉴定和MLST分型分析,旨在阐明鸡源大肠杆菌致病性及分子流行特征。
1 材料和方法 1.1 材料
1.1.1 样品采集: 试验样品于2018–2019年在河北省采集疑似大肠杆菌病的病鸡肝脏,病鸡肝脏样品共418份:邯郸n=97、邢台n=105、石家庄n=104、秦皇岛n=112。
1.1.2 试验材料: LB、LB琼脂、SS琼脂和麦康凯培养基购自广东环凯微生物科技有限公司;API20E生化鉴定试剂盒购自法国梅里埃;大肠杆菌O抗原血清购自SSI Diagnostica; DNA Maker、琼脂糖凝胶购自宝生物工程大连有限公司;50×TAE Buffer、溴化乙锭(ethidium bromide,EB)购自北京索莱宝科技有限公司。
1.1.3 仪器设备: 生物安全柜,购自力新仪器(上海)有限公司;高压灭菌锅,购自日本松下Panasonic公司;隔水式恒温细菌培养箱、DHG-9240A型电热恒温鼓风干燥箱、DK-8D型电热恒温水槽,购自上海一恒科技有限公司;DYY-8B型电泳槽、DYY-6C型稳压稳流电泳仪,购自北京六一仪器厂;IS-RDV1恒温摇床,购自美国精骐仪器制造有限公司;MINI-4K型为型离心机,购自杭州米欧仪器有限公司;离心机为Centrifuge 5415D,购自Eppendorf公司;T100型梯度PCR仪、Universal Hood Ⅱ型紫外凝胶成像系统,购自美国Bio-Rad公司;ZHSY-50S水浴恒温摇床,购自上海知楚仪器有限公司。
1.2 菌株分离培养 将采集的样品接种于SS培养基上,37 ℃恒温培养18–24 h。挑取粉红色、光滑、湿润、边缘整齐、圆形单菌株,纯化培养后进行生化及血清型鉴定。
1.3 生化鉴定 将纯化好的可疑菌株接种于麦康凯培养基上,37 ℃过夜培养,用吸管挑取单个纯菌落到0.85%的API NaCl培养基中,调整细菌浓度为0.5麦氏单位,加入API20E生化鉴定试剂盒中,37 ℃孵育18–24 h。依据APIweb TMM鉴定软件读取结果。
1.4 血清学鉴定 生化鉴定为大肠杆菌的菌株接种于LB中增菌培养,取大肠杆菌5 mL、4000 r/min离心10 min,弃去上清液,用2 mL 0.5%石炭酸生理盐水稀释均匀,121 ℃高压灭菌2 h,破坏荚膜抗原(K抗原),制成只含有O抗原的待检菌株。同时根据试剂盒说明提取菌株DNA。参照文献[14],应用PCR方法,对分离株大肠杆菌血清型初步鉴定。共检测147种O抗原,反应条件如下:94 ℃ 5 min;4 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共25个循环;72 ℃ 5 min,根据检测结果,采用公认大肠杆菌O抗原的单一抗血清进行验证。通过平板凝集和微量凝集法,分别对分离株进行相应的单价血清玻片凝集试验,同时用待检的菌株与0.5%石炭酸生理盐水做阴性对照,观察有无凝集现象,若1min内出现凝集现象,则判定为阳性反应,否则为阴性反应。
1.5 毒力基因检测
1.5.1 DNA模板制备: 刮取麦康凯培养基上经18–24 h生长的细菌培养物至400 μL TE缓冲液中,100 ℃水浴15 min,然后12000 r/min离心10 min,吸取200 μL上清液至另一无菌EP管,置–20 ℃冰箱备用。
1.5.2 PCR反应及电泳: 采用PCR技术对大肠杆菌分离株的毒力基因进行检测,肠外致病性大肠杆菌毒力基因分别为黏附相关基因、侵袭相关基因、抗血清存活因子相关基因和铁转运相关基因,共18个毒力基因,肠道致病性大肠杆菌毒力基因有7种。
引物均参考已发表文献合成。PCR反应体系、反应条件及电泳,参照文献[10]报道。
1.6 大肠杆菌系统发育群分析 参考文献报道的大肠杆菌系统发育群分类方法[15-18],应用PCR法对分离的大肠杆菌进行系统发育分群鉴定。PCR扩增体系为25 μL:2×Taq PCR Master Mix 12.5 μL,上下游引物各1 μL,DNA模板2 μL,ddH2O 8.5 μL。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。将扩增产物用2%琼脂糖凝胶电泳,120 V电泳30 min,对电泳结果拍照,并根据图 1进行结果判读。
 |
| 图 1 大肠杆菌系统进化群鉴定表 Figure 1 E. coli phylogeny identification table. |
| 图选项 |
1.7 多位点序列分型
1.7.1 实验方法: MLST试验参照McMLST网站数据库提供的7对管家基因序列及实验条件进行(http://www.shigatox.net/ecmlst/cgi-bin/scheme)。PCR产物经纯化后送金唯智科技服务有限公司双向测序。
1.7.2 序列比对及聚类分析: 7对管家基因序列结果分别按照McMLST对各基因规定的长度要求,使用Editseq软件剪切,并分别上传McMLST数据库,得到各基因的等位基因值及菌株的ST型(sequence type)。使用goeBURST软件对分析结果进行聚类分析。
2 结果和分析 2.1 细菌分离鉴定 经SS和MAC平板选择培养,共发现56株具有大肠杆菌生长特征的疑似菌株。经生化鉴定后这些分离株均符合大肠杆菌生化特征,重复鉴定结果一致。经统计,56株大肠杆菌分为8个生化表型,其中以发酵邻硝基苯-半乳糖、葡萄糖、甘露醇、甘露醇、鼠李糖、密二糖和阿拉伯糖同时能够水解赖氨酸和鸟氨酸(n=17)为主要生化表型。其次有14株菌能够发酵邻硝基苯-半乳糖、赖氨酸、鸟氨酸、甘露醇、山梨醇、鼠李糖、蔗糖、密二糖和阿拉伯糖。有13株能够发酵邻硝基苯-半乳糖、赖氨酸、葡萄糖、甘露醇、山梨醇、鼠李糖、蔗糖、密二糖和阿拉伯糖,见表 1和图 2。
表 1. 大肠杆菌生化表型 Table 1. The biochemical characteristics of E. coli isolates
| Biochemical phenotype | Sample number | Ratio/% (n=56) | |
| B1 | ONPG+LDC+GLU+MAN+SOR+RHA+MEL+ARA | 5 | 8.93 |
| B2 | ONPG+LDC+GLU+MAN+SOR+RHA+SAC+MEL+ARA | 13 | 23.21 |
| B3 | ONPG+ODC+GLU+MAN+SOR+RHA+SAC+MEL+ARA | 3 | 5.36 |
| B4 | ONPG+LDC+ODC+ GLU+MAN+SOR+RHA+MEL+ARA | 17 | 30.36 |
| B5 | ONPG+LDC+ODC+GLU+MAN+SOR+RHA+SAC+MEL+ARA | 14 | 25.00 |
| B6 | ONPG+ADH+LDC+GLU+MAN+SOR+RHA+SAC+MEL+ARA | 1 | 3.57 |
| B7 | ONPG+ LDC+ GLU+MAN+INO+SOR+RHA+SAC+MEL+ARA | 1 | 1.79 |
| B8 | ONPG+LDC+ODC+GLU+MAN+SOR+RHA+MEL+AMY+ARA | 2 | 1.79 |
表选项
 |
| 图 2 56株大肠杆菌对各生化试剂反应阳性率 Figure 2 The positive rate of 56 E. coli strains to various biochemical reagents. |
| 图选项 |
对初步分离确定的56株大肠杆菌先通过PCR技术对大肠杆菌O血清型进行初步鉴定,共检测出56株大肠杆菌共分为11种血清型。分别为O1、O2、O5、O6、O9、O18、O45、O65、O78、O91和O157。根据PCR鉴定结果,购买这11种O抗原血清进行血清凝集试验,共鉴定出11种血清型。由图 3可知,15株大肠杆菌菌株血清型为O78,比例为26.79%,O2、O157和O1血清型分离菌株分别是13株、10株和13株,比例分别为23.21%、17.86%和14.29%,为优势血清型。O5、O6、O9、O18、O45、O65和O91血清型大肠杆菌菌株数量较少。血清凝集结果与PCR鉴定结果保持一致。
 |
| 图 3 大肠杆菌血清型鉴定结果 Figure 3 The results of E. coli serotypes. |
| 图选项 |
2.2 毒力基因检测结果
2.2.1 肠外致病性大肠杆菌毒力相关基因分析: 56株大肠杆菌经PCR扩增分别检出aatA、fimC、mat、tsh、vat、yijP、ompA、neuC、cva/cvi、iss、iroN、fyuA、iucD、irp2、ChuA共15种肠外致病性大肠杆菌毒力基因,未检出papC、ibeA和ibeB基因(图 4)。根据大肠杆菌分离株毒力相关基因结果分析,黏附相关基因fimC和抗血清存活因子相关基因ompA基因,携带率为100%,aatA、yijP、irp2、mat、iss检出率分别为98.21%、98.21%、98.21%、96.43%、92.86%。
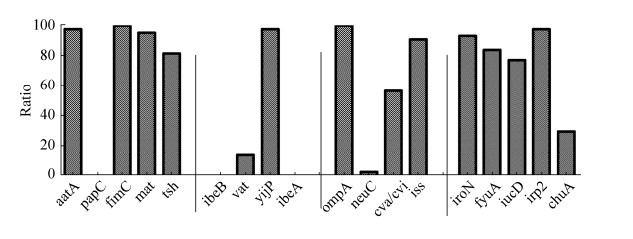 |
| 图 4 ExPEC毒力基因的检出率 Figure 4 Detection of virulence genes in ExPEC. |
| 图选项 |
这些毒力基因与大肠杆菌黏附、侵袭和代谢有密切关系。在大肠杆菌对机体的感染及形成菌血症过程中起重要作用[19-21]。与黏附相关的基因有aatA、papC、fimC、mat和tsh,这类基因以fimC (100%)为主,papC的携带率最低,为3.57%。aatA、mat、tsh基因携带率不低于85%。侵袭相关基因中检测到了vat (32.14%)和yijP (98.21%)基因,抗血清存活因子相关基因opmA、iss、cva/cvi、neuC的携带率分别为100%、92.86%、66.07%、8.93%。大肠杆菌分离株中与铁转运相关基因检出率较高,在80%以上(图 4)。
2.2.2 肠道致病性大肠杆菌毒力基因相关分析: 本试验大肠杆菌分离株共检出stx1、stx2、aggR和stlb四种毒力基因,根据毒力基因的不同,分为以下三类肠道致病性大肠杆菌,分别为EHEC (n=20)、EAEC (n=4)和ETEC (n=2)菌株,未检出EPEC、DAEC与EIEC (图 5-A)。EHEC菌株中stx2 (n=19)为主要毒力基因型,携带率为95%,携带stx1基因的菌株只有一株。EAEC和ETEC菌株携带的毒力基因分别为aggR (n=4)和stlb (n=2)。
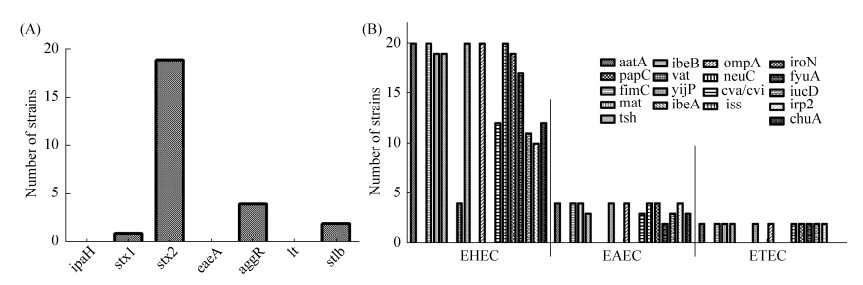 |
| 图 5 肠道致病性大肠杆菌毒力基因 Figure 5 Enteropathogenic E. coli and virulence genes. A: the result of intestinal pathogenic Escherichia coli virulence gene detection; B: the result of intestinal pathogenic Escherichia coli carrying parenteral virulence gene. |
| 图选项 |
EHEC、EAEC和ETEC菌株均不携带neuC基因。EAEC和ETEC也未携带vat基因。EHEC菌株主要携带黏附相关基因aatA (n=20)、fimC (n=20)、mat (n=19)、tsh (n=19),以及侵袭相关基因yijP (n=20)以及抗血清存活因子相关基因ompA (n=20)和iss (n=20)。铁转运相关基因中以iroN (n=19)为主(图 5-B)。
2.3 大肠杆菌系统发育群检测结果 根据不同进化群携带不同的标志基因ChuA、yjaA和TspE4.C2,将大肠杆菌分为4个进化群,分别为A、B1、B2和D群。本试验分离株系统发育群分别为A群、B1群、B2群和D群(图 6)。以D群占比最多,为42.86% (n=24),其次为B2群25% (n=14)、B1群21.43% (n=12)、A群10.71% (n=6)。EHEC菌株中主要以D群菌株数量最多(n=12),其次为B1群(n=5)、A群(n=3)。4株EAEC菌株中有3株为D群,2株ETEC菌株属于B1群。
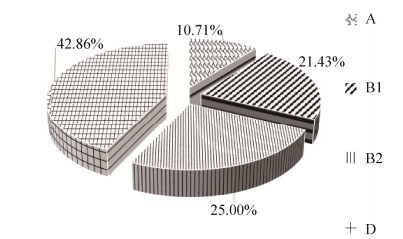 |
| 图 6 大肠杆菌系统发育群 Figure 6 Phylogenetic group of E. coli. Phylogenetic groups are divided into A, B1, B2, D. |
| 图选项 |
2.4 MLST分型结果
2.4.1 大肠杆菌分子分型特征: 依据7个等位基因型差异,56株大肠杆菌共分为22个ST型,其中ST1199、ST1200、ST1201、ST1202、ST1203、STN1、STN2和STN3为本试验发现的新ST型大肠杆菌。大肠杆菌以ST88(n=7)型为主要流行型,其次是ST85(n=6)和ST243(n=6)型大肠杆菌(图 7)。在大肠杆菌的22个ST型中,ST243和ST925型只有aspC一个等位基因的差异。ST88与STN3、ST1201与ST1202、ST1203与ST855、ST1203与STN2差异较小,仅有2个等位基因的差异,分别为fadD和uidA、clpX和lysp、fadD和icdA、clpX和fadD。其余ST型之间等位基因相差较大。ST260与ST243型、ST243与ST1201型、ST243与ST29型、ST243与STN1型大肠杆菌等位基因差异最大,均有7个等位基因的差异(图 8)。
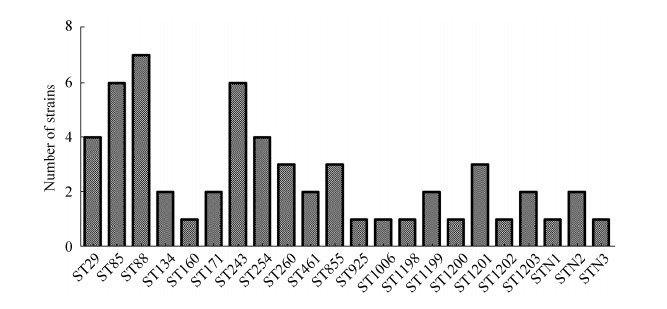 |
| 图 7 大肠杆菌MLST分型结果 Figure 7 MLST typing results of E. coli. |
| 图选项 |
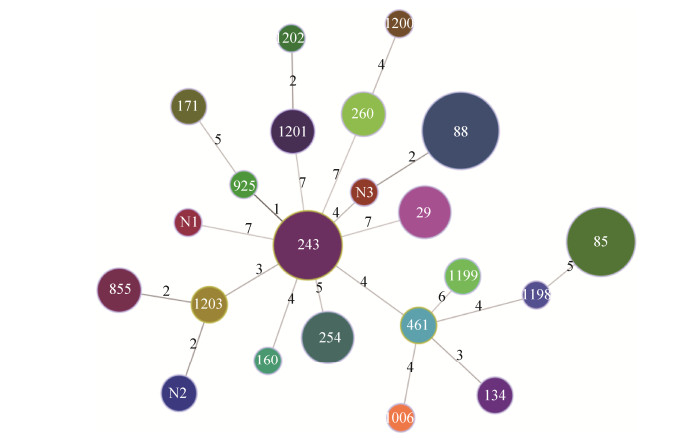 |
| 图 8 大肠杆菌分离株MLST聚类分析图 Figure 8 The clustering tree of E. coli isolates based on STs. |
| 图选项 |
2.4.2 大肠杆菌毒力基因与MLST分型关系: ST88型大肠杆菌主要存在aatA、fimC、mat、tsh、vat、yijP、ompA、cva/cvi、iss、iroN、fyuA、iucD、irp2、ChuA这14个毒力基因。ST85型和ST243型大肠杆菌比ST88型大肠杆菌少vat基因,ST85型大肠杆菌未检测出ChuA基因。
20株EHEC菌株被分为13个不同ST型,分别为ST85、ST1201、ST134、ST243、ST254、ST260、ST1006、ST1199、ST1200、ST171、ST855、ST925和STN2(图 9-A),以ST85型为主要流行型。本试验的EAEC菌株经数据分析均为ST243型。两株ETEC菌株分为ST461和ST855,见图 9-B。
 |
| 图 9 肠致病性大肠杆菌与ST型关系 Figure 9 Relationship between enteropathogenic E. coli and ST type. A: the result of EHEC MLST typing; B: the result of ETEC MLST typing. |
| 图选项 |
3 讨论 大肠杆菌能够引发一系列疾病,禽大肠杆菌病几乎遍布我国各地,已经成为危害我国养禽业的细菌性疾病之一。鉴于大肠杆菌对公共健康的严重威胁,本研究调查分析了大肠杆菌在河北省主要养殖区域流行特性,结果发现从418份肝脏样品中分离56株大肠杆菌对其进行血清型鉴定,结果显示以O78为主要流行血清型,其次是O2、O157、O1。其中血清型O1、O2、O18和O78与禽大肠杆菌病的暴发有密切关系,大约占50%以上,这在经济上对全世界的家禽业造成了破坏[22]。此外,本实验结果与其他地区报道的大肠杆菌主要流行血清型略有不同,如秦皇岛地区鸡源大肠杆菌分离株以O1和O2为主要流行血清型[23],河南省禽源大肠杆菌以O78、O1、O2、O36、O119和O18为主要流行血清型[24],天津地区禽源大肠杆菌优势血清型以O78、O88、O2、O45、O53和O145为主[25],云南地区大肠杆菌优势血清型为O78、O11、O88、O100、O65和O2[26],潍坊地区的优势血清型为O78、O2、O15和O11[27],辽宁地区的优势血清型为O65、O131、O92和O1[28],黑龙江地区的优势血清型为O9、O18、O64和O93[29],吉林的优势血清型为O78、O2、O9和O24[30]。以上结果表明同一地区具有多种大肠杆菌血清型,各地区的优势血型略有不同,不同省份的优势血清型有较大差异,这说明了解各省份的大肠杆菌血清型的重要性,为禽大肠杆菌病的治疗与防控提供理论依据。
大肠杆菌毒力因子多种多样,而且不断发现新毒力因子。本试验发现fimC和ompA基因的检出率为100%,其次是aatA、yijP、irp2、mat、iss。大肠杆菌分离株中与铁转运相关基因iroN、fyuA、iucD、irp2检出率均在80%以上。papC的携带率最低,为3.57%。据国内外报道,Asai等研究表明iutA、hlyF、iss、iroN和ompT这5个毒力基因与禽致病性大肠杆菌中的高致病力密切相关[31]。郑志明和金文杰发现禽致病性大肠杆菌fimC和iucD基因的检出率非常高,表明黏附和摄铁能力对其的生存和繁殖非常重要[32-33]。赵李祥研究发现,在检测的菌株中iroN、iss、iucC、iutA、sitA和traT等6个基因的检出率均超过70%,有40%的菌株发现irp2、fyuA、cvaC、kpsMT(K1)、kpsMTⅡ和papEF基因,而papC和papA检出率相对较低,分别为37%和17%[34]。检测结果表明不同地区的大肠杆菌毒力因子有差异。大肠杆菌的致病性是由多种毒力因子共同作用的结果,这些毒力因子之间相互协调,使细菌逃避或破坏宿主的防御系统,进而引起炎症反应。大肠杆菌的致病力与其自身携带的多种毒力因子密切相关。
iss基因是血清抗体蛋白,检出率为92.86%。有****发现iss基因能显著增强大肠杆菌对1日龄雏鸡的致病力,还能增强转化菌的血清抗性,国外相关研究者大多将iss基因作为大肠杆菌毒力基因的参考指标之一[35-36]。iroN和irp2是大肠杆菌铁吸收和转运相关基因,irp2作为耶尔森氏菌强毒力岛的检测标志(high pathogenictiy island,HPI),本实验的HPI阳性反应率为28.57%。有****在腹泻病死貉脏器和粪便中分离出致病力较强的大肠杆菌,这些菌株均携带irp2[37]。高志刚和沙玉宁报道了呼和浩特地区禽大肠杆菌HPI阳性率为51.4%[38]。河南、河北、辽宁地区分离的256株大肠杆菌HPI阳性率为30.6%[39]。安徽地区的80株大肠杆菌均携带HPI[15]。本研究与其他地区报道的结果有所不同,这可能与采集的样品有关系,报道HPI阳性率高的菌株大多分离于病死动物,阳性率与患病程度及死亡率有密切关系,说明HPI与大肠杆菌的致病性及毒力关系密切相关。而且携带HPI的大肠杆菌能够在细菌种属之间进行水平传播,具有高致病性,能够导致家禽患心包炎、败血症、呼吸道感染、腹膜炎等,严重的能导致家禽突然死亡,使家禽发病风险增加,易导致发生危害程度较重且治愈难度较大的疾病,造成极大的损失[40]。
本研究利用ChuA、YiaA、TspE4.C2三个基因对大肠杆菌进行系统发育群分类,检测出42.86%的菌株属于D群,25%分离菌株为B2群。Maynard等通过对39株动物源性(猪、牛、鸡、宠物等) ExPEC和70株人源ExPEC进行比较,发现67%动物源性ExPEC属于A和B1进化群,77%人源ExPEC属于B2和D进化群[41];Johnson等对分离鉴定的28株ExPEC进行系统发育群分析,结果显示82.1%属于进化群A,其他为B1、B2和D群[8];Tan等对在我国猪场分离鉴定的315株ExPEC进行系统发育群分析,结果表明30.8%属于A群,29.2%属于B1群,17.5%属于B2群,22.5%属于D群[42]。研究发现致病性大肠杆菌主要存在于B2群,其次为D群,A和B1群致病性较弱,一般在机体免疫力低下时能够引发肠道外感染。
伴随着人们对病原菌研究的逐渐深入,传统的血清型分型、生化表型分型等分型方法,已不能满足人们对病原菌分型、变异菌株鉴定以及细菌追踪溯源的要求。MLST分子分型技术逐渐成为菌株遗传多态性研究及揭示菌株之间关系的重要手段。MLST分型技术是基于细菌高度保守的管家基因差异对细菌进行分析,具有较强的通用性,便于不同实验室或不同数据相互比较。本试验检测到的22个ST型中有8个ST型为本次试验发现的新ST型,ST88、ST85、ST243型为主要流行型。而且这些分离株等位基因差异较大。
4 结论 本研究利用系统发育群和MLST分子分型技术对河北省分离到的56株大肠杆菌进行了分子流行病学分析,结合生化鉴定、血清学鉴定、毒力基因等常规检测结果进一步丰富了动物源大肠杆菌流行病学资料。多数菌株携带与黏附相关、侵袭相关、抗血清存活因子相关和铁转运相关基因,表明动物源大肠杆菌具有较强的毒力基础,对公共安全具有潜在的威胁。
References
| [1] | Kabir SML. Avian colibacillosis and salmonellosis:a closer look at epidemiology, pathogenesis, diagnosis, control and public health concerns. International Journal of Environmental Research and Public Health, 2010, 7(1): 89-114. |
| [2] | Wu H, Xia SB, Bu FY, Qi J, Liu YQ, Xu H. Identification of integrons and phylogenetic groups of drug-resistant Escherichia coli from broiler carcasses in China. International Journal of Food Microbiology, 2015, 211: 51-56. DOI:10.1016/j.ijfoodmicro.2015.07.004 |
| [3] | Chen X, Zhang WQ, Yin JJ, Zhang N, Geng SZ, Zhou XH, Wang YH, Gao S, Jia XA. Escherichia coli isolates from sick chickens in China:changes in antimicrobial resistance between 1993 and 2013. The Veterinary Journal, 2014, 202(1): 112-115. DOI:10.1016/j.tvjl.2014.06.016 |
| [4] | Yuan M, Peng LY, Wu SC, Li JH, Song K, Chen S, Huang JN, Yu JL, An Q, Yi PF, Shen HQ, Fu BD. Schizandrin attenuates inflammation induced by avian pathogenic Escherichia coli in chicken type Ⅱ pneumocytes. International Immunopharmacology, 2020, 81: 106313. DOI:10.1016/j.intimp.2020.106313 |
| [5] | Liu CY, Zhang JP, Wang BY. Research progress on identification of Escherichia coli O- antigen serogroups. Chinese Journal of Zoonoses, 2016, 32(10): 928-933. (in Chinese) 刘璨颖, 张济培, 王丙云. 大肠杆菌O-抗原血清型鉴定研究进展. 中国人兽共患病学报, 2016, 32(10): 928-933. |
| [6] | 韩月. O抗原重组减毒沙门菌对O1、O2和O78禽致病性大肠杆菌的免疫保护研究.四川农业大学博士学位论文, 2018. http://d.wanfangdata.com.cn/thesis/Y3494356 |
| [7] | 金杰.禽致病性大肠杆菌O1、O2、O78型多重PCR检测方法的建立及应用.吉林农业大学硕士学位论文, 2018. http://d.wanfangdata.com.cn/thesis/D01653654 |
| [8] | Johnson JR, Russo TA. Molecular epidemiology of extraintestinal pathogenic (uropathogenic) Escherichia coli. International Journal of Medical Microbiology, 2005, 295(6/7): 383-404. |
| [9] | Clermont O, Bonacorsi S, Bingen E. Rapid and simple determination of the Escherichia coli phylogenetic group. Applied and Environmental Microbiology, 2000, 66(10): 4555-4558. DOI:10.1128/AEM.66.10.4555-4558.2000 |
| [10] | 王艳.禽致病性大肠杆菌OmpT质粒编码外膜蛋白的表达、纯化与结构的初步研究.扬州大学硕士学位论文, 2019. |
| [11] | 许腾林.肠外致病性大肠杆菌的分离鉴定及比较基因组学分析.黑龙江八一农垦大学硕士学位论文, 2018. |
| [12] | Balabanova Y, Klar S, Deleré Y, Wilking H, Faber MS, Lassen SG, Gilsdorf A, Dupke S, Nitschke M, Sayk F, Grunow R, Krause G, Cloeckaert A. Serological evidence of asymptomatic infections during Escherichia coli O104:H4 outbreak in Germany in 2011. PLoS One, 2013, 8(9): e73052. DOI:10.1371/journal.pone.0073052 |
| [13] | Rangel JM, Sparling PH, Crowe C, Griffin PM, Swerdlow DL. Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1982-2002. Emerging Infectious Diseases, 2005, 11(4): 603-609. DOI:10.3201/eid1104.040739 |
| [14] | Iguchi A, Iyoda S, Seto K, Morita-Ishihara T, Scheutz F, Ohnishi M. Pathogenic E. coli Working Group in Japan. Escherichia coli O-genotyping PCR:a comprehensive and practical platform for molecular O serogrouping. Journal of Clinical Microbiology, 2015, 53(8): 2427-2432. DOI:10.1128/JCM.00321-15 |
| [15] | Mehdi Y, Létourneau-Montminy MP, Gaucher ML, Chorfi Y, Suresh G, Rouissi T, Brar SK, ?té C, Ramirez AA, Godbout S. Use of antibiotics in broiler production:global impacts and alternatives. Animal Nutrition, 2018, 4(2): 170-178. DOI:10.1016/j.aninu.2018.03.002 |
| [16] | Siqueira AK, Ribeiro MG, da S Leite D, Tiba MR, de Moura C, Lopes MD, Prestes NC, Salerno T, da Silva AV. Virulence factors in Escherichia coli strains isolated from urinary tract infection and pyometra cases and from feces of healthy dogs. Research in Veterinary Science, 2009, 86(2): 206-210. DOI:10.1016/j.rvsc.2008.07.018 |
| [17] | Guo XM, Yang T, He DD, Rao LL, Liu JH, Zeng ZL. Antimicrobial resistance and phylogenetic analysis of E. coli isolated from swine in Guangdong Province. China Animal Husbandry & Veterinary Medicine, 2014, 41(1): 182-186. (in Chinese) 郭潇木, 杨铜, 贺丹丹, 饶丽丽, 刘健华, 曾振灵. 广东地区猪源大肠杆菌耐药性及其系统发育群的研究. 中国畜牧兽医, 2014, 41(1): 182-186. |
| [18] | Zhong YM, Zhang XH, Liu WE, Yang F, Yan Q, Liu QX, Li YM, Li HL, Zou MX. Bloodstream infections with Escherichia coli O16-ST131 and O25b-ST131:molecular epidemiology, phylogenetic analysis and antimicrobial resistance. Journal of Southern Medical University, 2018, 38(12): 1521-1526. (in Chinese) 钟一鸣, 张晓荷, 刘文恩, 杨芳, 晏群, 刘清霞, 李艳明, 李虹玲, 邹明祥. 血流感染O16-ST131和O25b-ST131型大肠埃希菌的流行、系统发育群及耐药性. 南方医科大学学报, 2018, 38(12): 1521-1526. |
| [19] | 陈伟.动物源大肠杆菌耐药基因与HPI毒力基因的检测及相关性分析.安徽农业大学硕士学位论文, 2013. |
| [20] | Zhou LH, Zhang PF, Zhang J, Wu CM, Tang XS, Hao D, Wang X. Virulence genes and antimicrobial resistance of Escherichia coli isolated from slaughtered pigs. Food Science, 2019, 40(2): 264-268. (in Chinese) 周陆红, 张鹏飞, 张杰, 吴聪明, 唐晓双, 郝丹, 王新. 屠宰猪中大肠杆菌毒力基因检测及耐药性分析. 食品科学, 2019, 40(2): 264-268. |
| [21] | Xia QQ, Wen SS, Ma SQ, Wu Q, Zhao LL, Wei CW, Ge JW, Chen HY. Detection and analysis of biofilm formation ability, antimicrobial-resistance and pathogenic island gene of pathogenic Escherichia coli isolated from minks. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(5): 361-365. (in Chinese) 夏琦琦, 温珊珊, 马斯琪, 吴强, 赵丽丽, 魏成威, 葛俊伟, 陈洪岩. 水貂源致病性大肠杆菌生物被膜形成能力、耐药性及毒力岛基因检测与分析. 中国预防兽医学报, 2017, 39(5): 361-365. |
| [22] | Wang SH, Meng QM, Dai JJ, Han XA, Han Y, Ding C, Liu HW. Development of an allele-specific PCR assay for simultaneous sero-typing of avian pathogenic Escherichia coli predominant O1, O2, O18 and O78 strains. PLoS One, 2014, 9(5): e96904. DOI:10.1371/journal.pone.0096904 |
| [23] | Li YY, Ge C, Jiao HJ, Wang SD, Yan YJ, Li PG, Zhang ZX, Zhang XZ. Investigation of serotype and drug resistance of Chicken Escherichia coli in Qinhuangdao area. Chinese Journal of Veterinary Medicine, 2019, 55(8): 71-76. (in Chinese) 李蕴玉, 葛成, 焦贺静, 王盛达, 闫艳娟, 李佩国, 张召兴, 张香斋. 秦皇岛地区育成鸡大肠杆菌血清型鉴定及耐药性分析. 中国兽医杂志, 2019, 55(8): 71-76. |
| [24] | Bai J, Wang Y. Studies on the serotypes and drug-resistance of chicken pathogenic Escherichia. coli in Henan province. Journal of Henan Agricultural Sciences, 2007, 36(10): 105-107. (in Chinese) 白静, 王宇. 河南省鸡致病性大肠杆菌血清型、耐药性的研究. 河南农业科学, 2007, 36(10): 105-107. |
| [25] | Ding BL, Yan MH, Wang YZ, Li XL, Bai PX, Huang JH, Zhao XH, Zhang J. Studies on distribution of serotypes of chicken pathogenic Escherichia coli and outer membrane protein patterns of predominant serogroups in Tianjin regions. Progress in Veterinary Medicine, 2003, 24(2): 94-96. (in Chinese) 丁伯良, 鄢明华, 王英珍, 李秀丽, 白朋勋, 黄金海, 赵相华, 张健. 天津地区鸡致病性大肠杆菌血清型分布及其优势血清型的外膜蛋白型研究. 动物医学进展, 2003, 24(2): 94-96. |
| [26] | Yang B, Wang CY, Yang XD, Chang ZS, Tan H, Liu YL. Serotype identification and drug sensitivity test of chicken pathogenic E. coli in Yunnan Province. Yunnan Animal Husbandry & Veterinary Medicine, 2010(3): 2-4. (in Chinese) 杨斌, 王传禹, 杨向东, 常志顺, 谭红, 刘艳丽. 云南省鸡致病性大肠杆菌的血清型鉴定及药敏试验. 云南畜牧兽医, 2010(3): 2-4. |
| [27] | 董向磊.禽致病性大肠杆菌的分离鉴定和分离株毒力基因与致病性相关性研究.扬州大学硕士学位论文, 2014. |
| [28] | Li HL, Sun YX, Wu HT, Yan MM, Hao Y, Li SB. Pathogenicity test of dominant serotype strains of avian Escherichia coli in Liaoning Province. Modern Journal of Animal Husbandry and Veterinary Medicine, 2012(9): 29-30. (in Chinese) 李惠兰, 孙永祥, 吴洪涛, 闫明媚, 郝禹, 李树博. 辽宁省禽大肠杆菌优势血清型菌株致病性试验研究. 现代畜牧兽医, 2012(9): 29-30. |
| [29] | Zhao Y, Wang YM, Zhang WL, Ma B, Wang JW. Serotype identification and susceptibility testing of geese pathogenic Escherichia coli isolated from some regions in Heilongjiang Province. Chinese Journal of Veterinary Medicine, 2011, 47(11): 20-22. (in Chinese) 赵阳, 王艺萌, 张文龙, 马波, 王君伟. 黑龙江省部分地区鹅致病性大肠杆菌血清型鉴定及药敏试验. 中国兽医杂志, 2011, 47(11): 20-22. |
| [30] | 李沐森.吉林城区鸡致病性大肠杆菌的分离鉴定及灭活疫苗研制.中国农业科学院硕士学位论文, 2007. |
| [31] | Asai T, Masani K, Sato C, Hiki M, Usui M, Baba K, Ozawa M, Harada K, Aoki H, Sawada T. Phylogenetic groups and cephalosporin resistance genes of Escherichia coli from diseased food-producing animals in Japan. Acta Veterinaria Scandinavica, 2011, 53(1): 52. DOI:10.1186/1751-0147-53-52 |
| [32] | 金文杰.禽致病性大肠杆菌耐药基因和毒力因子的分子流行病学及HPI Irp1细胞表位作用的研究.扬州大学博士学位论文, 2006. |
| [33] | 郑志明.禽致病性大肠杆菌流行病学调查及三株大肠杆菌对磷霉素耐药机制的初探.扬州大学硕士学位论文, 2007. |
| [34] | 赵李祥.禽病原性大肠杆菌与尿道致病性大肠杆菌毒力基因相关性与体内外表达差异及其ftsk突变株的研究.扬州大学博士学位论文, 2008. |
| [35] | Tivendale KA, Noormohammadi AH, Allen JL, Browning GF. The conserved portion of the putative virulence region contributes to virulence of avian pathogenic Escherichia coli. Microbiology, 2009, 155(2): 450-460. |
| [36] | Ozawa M, Harada K, Kojima A, Asai T, Sameshima T. Antimicrobial susceptibilities, serogroups, and molecular characterization of avian pathogenic Escherichia coli isolates in Japan. Avian Diseases, 2008, 52(3): 392-397. DOI:10.1637/8193-120907-Reg |
| [37] | Zhang YY, Shi QM, Fang H, Chen CZ, Liu YJ, Yang YL. Detection on pathogenicity islands of Yersinia enterocolitica HPI from Escherichia coli strains in diarrheic young raccoon dogs. Chinese Journal of Zoonoses, 2012, 28(2): 179-182. (in Chinese) 张艳英, 史秋梅, 房海, 陈翠珍, 刘亚君, 杨月琳. 腹泻仔貉检出携带耶尔森菌HPI毒力岛的大肠杆菌. 中国人兽共患病学报, 2012, 28(2): 179-182. |
| [38] | Gao ZG, Sha YN. Screening of avian E. coli virulence island (HPI) and Type Ⅰ integron in Hohhot. Heilongjiang Animal Science and Veterinary Medicine, 2019, 16: 96-99. (in Chinese) 高志刚, 沙玉宁. 呼和浩特地区禽源大肠杆菌毒力岛(HPI)及Ⅰ型整合子筛查. 黑龙江畜牧兽医, 2019, 16(16): 96-99. |
| [39] | Wang YP, Dong L, Guo SJ, Xu QQ, Mo L, Wang JL, Liu JS, Shen ZQ. Establishment and application of PCR detection method for HPI irp2 gene of avian Escherichia coli. Chinese Journal of Veterinary Medicine, 2017, 53(1): 86-89. (in Chinese) 王艳萍, 董林, 郭时金, 徐倩倩, 莫玲, 王金良, 刘吉山, 沈志强. 禽源性大肠杆菌HPI毒力岛irp2基因PCR检测方法的建立与应用. 中国兽医杂志, 2017, 53(1): 86-89. |
| [40] | Lv DH, Wei WK, Huang Z, Wen XH. Virulence genotypes of 105Escherichia coli with high pathogenicity island (HPI) and the HPI sequence analysis. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(1): 71-73. (in Chinese) 吕殿红, 魏文康, 黄忠, 温肖会. 105株携带耶尔森菌强毒力岛大肠杆菌的毒力基因型和部分菌株毒力因子序列研究. 中国预防兽医学报, 2012, 34(1): 71-73. |
| [41] | Maynard C, Bekal S, Sanschagrin F, Levesque RC, Brousseau R, Masson L, Lariviere S, Harel J. Heterogeneity among virulence and antimicrobial resistance gene profiles of extraintestinal Escherichia coli isolates of animal and human origin. Journal of Clinical Microbiology, 2004, 42(12): 5444-5452. DOI:10.1128/JCM.42.12.5444-5452.2004 |
| [42] | Tan C, Tang X, Zhang X, Ding Y, Zhao Z, Wu B, Cai X, Liu Z, He Q, Chen H. Serotypes and virulence genes of extraintestinal pathogenic Escherichia coli isolates from diseased pigs in China. Veterinary Journal, 2012, 192(3): 483-488. DOI:10.1016/j.tvjl.2011.06.038 |
