张朝晖1

 , 彭康1, 卢亚南2, 陆跃乐1
, 彭康1, 卢亚南2, 陆跃乐1 1. 浙江工业大学生物工程学院, 浙江 杭州 310014;
2. 上海艾跃生物科技有限公司, 上海 201100
收稿日期:2020-02-26;修回日期:2020-05-26;网络出版日期:2020-05-26
基金项目:国家自然科学基金(31601390)
*通信作者:张朝晖, Tel:+86-576-88320571;E-mail:zzh@zjut.edu.cn.
摘要:[目的] 将一种可以高选择性水解R-甲霜灵的新脂酶基因,在大肠杆菌中进行克隆和表达,并研究重组脂酶的性质。[方法] 根据已知的目标酯酶N端10个氨基酸序列,在已测序的Albibacters sp. zjut528基因组中找到相匹配的一个酯酶基因,它全长969 bp,编码322个氨基酸,将该基因命名为RMest。通过引物扩增得到该基因的DNA片段,将它与表达载体pET-28a(+)连接后,转化大肠杆菌BL21Gold(DE3),构建重组菌,IPTG诱导表达该酯酶,并用Ni2+亲和层析介质进行纯化。[结果] 在重组菌RMest-pET-28a(+)-E.coli BL21 Gold(DE3)中成功表达了重组酯酶RMesterase,大小约为46 kDa。用胞内重组酶液催化水解R,S-甲霜灵,底物浓度10 g/L,反应6 h,底物转化率为49.8%,产物(甲霜灵酸)的eep为99.3%,对底物的对映体R-构型具有专一(选择)性。该酶最适温度和pH分别为40℃和pH 9.0。该酶的活性受到产物甲醇的抑制。通过Blast+在Uniprot KB数据库中搜寻与酯酶RMest同源的蛋白,采用邻近法构建该酶的蛋白系统发育树,结果显示它与某些Lysophospholipase、AB hydrolase-1 domain-containing protein和Esterase的同源性最高,但是与它们均存在较大的进化距离,表明该酶是一种相对独立进化的新酯酶。[结论] 在大肠杆菌中成功克隆和表达了一种新的脂酶基因RMest,重组酯酶RMesterase可以高手性选择性水解R,S-甲霜灵生成R-甲霜灵酸。
关键词:R, S-甲霜灵对映体选择性水解脂酶基因克隆和表达Albibacters sp.zjut528
Cloning, expression and characterization of a gene encoding the esterase hydrolyzing R, S-metalaxyl high R-enantioselectively
Zhaohui Zhang1

 , Kang Peng1, Yanan Lu2, Yuele Lu1
, Kang Peng1, Yanan Lu2, Yuele Lu1 1. College of Biological Engineering, Zhejiang University of Technology, Hangzhou 310014, Zhejiang Province, China;
2. Active Motif Shanghai Limited, Shanghai 201100, China
Received: 26 February 2020; Revised: 26 May 2020; Published online: 26 May 2020
*Corresponding author: Zhaohui Zhang, Tel: +86-576-88320571; E-mail: zzh@zjut.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31601390)
Abstract: [Objective] A gene encoding the esterase to hydrolyze R, S-metalaxyl high enantioseclectively to R-metalaxyl acid was cloned and expressed in E. coli. The properties of the recombinant esterase were studied. [Methods] Based on known N-terminal 10 amino acid sequence of the target esterase, a candidate esterase gene matching with it was found in the sequenced Albibacters sp. zjut528 genome. It had a length of 969 bp encoding 322 amino acids and was named RMest. The RMest DNA segment was amplified by PCR, ligated with pET-28a(+), transformed into E. coli BL21Gold(DE3) to construct the recombinant strain. The recombinant esterase was expressed by induction with IPTG and purified with Ni2+ resin. [Results] The recombinant RMesterase was expressed successfully in RMest-pET-28a(+)-E. coli BL21 Gold (DE3). Its size was about 46 kDa in SDS-PAGE. Hydrolysis of 10 g/L of R, S-metalaxyl for 6 h catalyzed by intracellular crude enzyme from the recombinant strain, the substrate conversion rate reached 49.8% with product (metalaxyl acid) eep of 99.3%. The main product was R-metalaxyl acid. The optimal temperature and pH of RMestrase was 40℃ and 9.0 respectively. The activity of RMesterase was inhibited by methanol, the other product of metalaxyl hydrolysis. After aligning the amino acid sequence of RMest with other proteins in Uniprot KB database by Blast+, the neighboring-joining phylogenetic tree was constructed. It shows that the esterase RMest had a long evolution distance with homologous Lysophospholipases, AB hydrolase-1 domain-containing proteins and other esterases. That indicates that the esterase RMest was a new one that evolved relative independently. [Conclusion] The esterase gene RMest was successfully cloned and expressed in RMest-pET-28a(+)-E. coli BL21 Gold (DE3). The recombinant RMesterase could hydrolyze R, S-metalaxyl high R-enantioselectively to produce R-metalaxyl acid.
Keywords: R, S-metalaxylenantioselective hydrolysisesterase genecloning and expressionAlbibacters sp. zjut528
甲霜灵[N-(2, 6-二甲基苯基)-N-(2-甲氧基乙酰)丙氨酸甲酯]是一种重要的乙酰苯胺类杀菌剂,它对病原真菌中的卵菌纲(Oomycetes)病菌有特殊的杀灭能力。对由卵菌引起的霜霉病、疫霉病、白锈病等均有很好的防治作用[1]。甲霜灵含有一个手性C原子,有两个对映体,其抗真菌活性主要来源于R-对映体[2]。R-和S-对映体具有相同的作用方式,但它们在达到受体或与受体结合方面表现出相当大的差异。生物体外试验显示R-对映体的活性大约是S-对映体的1000倍,在体内R-对映体仍然是S-对映体的3–10倍[3]。目前市售的甲霜灵产品有普通甲霜灵(外消旋体)和精甲霜灵(R体为主)两种。光学纯产品取代外消旋产品不仅可以提高单位药效,而且减少了非活性异构体对非靶标生物以及土壤的潜在副作用,因此预料未来精甲霜灵将逐渐取代普通甲霜灵成为市场的主流产品。
现阶段精甲霜灵(R-甲霜灵为主)生产方法主要是以手性原料作前体的化学合成法[4]。利用生物催化剂进行生物拆分生产R-甲霜灵已有一些报道,采用的生物催化剂主要是脂肪酶[5-11]或含有脂肪酶的微生物细胞[12],但它们拆分的底物都是生产普通甲霜灵的中间体R, S-N-(2, 6-二甲基苯基)丙氨酸甲酯(R, S-MAP),而R-MAP还需一步反应才能生成R-甲霜灵,这步反应会降低精甲霜灵产品的手性纯度。本文作者近期报道了一株直接水解拆分R, S-甲霜灵生产R-甲霜灵的菌株Albibacters sp. zjut528[13],它的手性选择性极高。利用该菌株细胞作催化剂直接拆分R, S-甲霜灵,可以生产手性纯度极高的精甲霜灵产品。同时,通过盐析、离子交换层析和凝胶过滤层析从Albibacters sp. zjut528菌株的胞内液中得到了纯化的目标酯酶蛋白,并测得N端的10个氨基酸序列为NH2-Ala-Ala -Lys-Ala-Pro-Leu-Arg-Leu-Lys-Glu。
本研究将从菌株Albibacters sp. zjut528的基因组中找出目标酯酶的基因序列,然后将该基因在大肠杆菌中进行克隆表达,研究重组酶的性质和酶基因的蛋白进化关系。
1 材料和方法 1.1 材料
1.1.1 试剂: 普通甲霜灵(R, S-甲霜灵)由某厂赠送,其他化学试剂均为国药分析纯。限制性内切酶Xho Ⅰ、BamH Ⅰ、DNA Marker DL5000、DNA Marker DL10000购于TaKaRa公司;基因组抽提试剂盒、DNA凝胶回收试剂盒、质粒DNA少量抽提试剂盒购于Axyprep公司。
1.1.2 培养基: 种子培养基和发酵摇瓶培养基,参见文献[13]。
1.2 甲霜灵的分析方法 采用高效液相色谱(HPLC)[13]。
1.3 酯酶基因的扩增和重组菌的构建 以Albibacters sp. zjut528的基因组DNA为模板,扩增脂酶基因的引物为:RMest-F (5′-CGGGA TCCACGCCGATAGAGGGTCAAAG-3′,BamH Ⅰ)和RMest-R (5′-CCGCTCGAGCGTTTATAGCCTG CCAC-3′,Xho Ⅰ)。PCR扩增:95 ℃ 5 min;95 ℃ 10 s;65 ℃ 20 s;72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR扩增的条带和pET-28a(+)用限制性内切酶进行酶切,并用T4连接酶连接,转化E. coli BL21Gold(DE3),构建的重组菌命名为RMest- pET-28a(+)-E. coli BL21 Gold(DE3)。挑单菌落,提取质粒,进行质粒PCR验证和DNA序列测序。
1.4 酯酶基因RMest的表达和SDS-PAGE分析 将重组菌在含卡那霉素抗性的LB液体培养基中,37 ℃培养至菌液OD600约为0.5–0.8,分别标记为诱导组和非诱导组。在空载体(宿主菌中)组和诱导组中添加IPTG至终浓度为0.6 mmol/L,25 ℃、180 r/min诱导培养10 h。未诱导组和诱导组菌液,4 ℃、8000 r/min离心10 min后弃上清液,细胞悬浮于100 mmol/L的pH 8.0 Tris-HCl缓冲液中,4 ℃下高压匀浆破碎,12000 r/min离心20 min取上清液(粗酶液),进行SDS-PAGE分析。
1.5 重组蛋白的纯化 使用10倍体积的缓冲液(50 mmol/L磷酸缓冲液,pH 8.0,0.3 mol/L NaCl,10 mmol/L imidazole)与Ni2+亲和层析介质平衡,取适当粗酶液与亲和层析介质结合30 min,用2倍体积的清洗缓冲液(50 mmol/L磷酸缓冲液,pH 8.0,0.3 mol/L NaCl,50 mmol/L imidazole)清洗3次,再用2倍体积的洗脱缓冲液(50 mmol/L磷酸缓冲液,pH 8.0,0.3 mol/L NaCl,200 mmol/L imidazole)洗脱,重复3次。收集洗脱样品,进行SDS-PAGE分析。将含目的蛋白的样品用透析缓冲液(25 mmol/L磷酸缓冲液,pH 8.0,0.5 mmol/L NaCl,10 mmol/L imidazole) 4 ℃过夜透析除去咪唑后,贮存在–20 ℃。
1.6 重组酶RMesterase的酶学性质
1.6.1 酶的立体选择性: 取2 mL重组菌胞内粗酶液,0.2 g R, S-甲霜灵为底物,一定量的磷酸缓冲液(100 mmol/L,pH 8.0),总反应体系为20 mL,37 ℃、180 r/min摇床中反应10、30 min和2、6、12 h,取样分析底物消耗和产物生成。
1.6.2 温度和pH对酶的活性和稳定性的影响: 取适量纯化酶液(pH 8.0)分别在20、30、40、50、60 ℃下测定酶活,测定方法见1.6.1;另将酶液分别放在上述不同温度的水浴中保温4 h,测定残存酶活考察温度稳定性。37 ℃下,将酶液在100 mmol/L不同的pH缓冲液中(pH 4.0、5.0、6.0为柠檬酸钠缓冲液,pH 7.0、8.0、9.0为巴比妥钠- HCl缓冲液,pH 10.0为Na2CO3-NaHCO3缓冲液)测定酶活。另外,将酶液在上述不同pH条件下,4 ℃下保温48 h,测定剩余酶活考察pH稳定性。
1.6.3 酶反应动力学测定: 方法参见文献[13]。
1.6.4 甲醇浓度对酶活的影响: 取适量纯化酶液分别在浓度为0、10、25、50、100 mmol/L甲醇浓度下测定酶活,测定方法见1.6.1。
2 结果和分析 2.1 在Albibacters sp. zjut528菌株基因组中寻找目标酯酶基因 本文作者曾报道[13],通过盐析、离子交换层析和凝胶过滤层析从Albibacters sp. zjut528菌株的胞内液中得到了纯化的目标酯酶蛋白,并测得N端的10个氨基酸序列为NH2-Ala-Ala-Lys-Ala- Pro-Leu-Arg-Leu-Lys-Glu。作者另将菌株的基因组DNA送交某生物公司测序,虽然未得到基因组完成图,但得到基因组框架图(包括198个长度不等的核苷酸序列片段)。从其中一个核苷酸序列片段中找到了和N端10个氨基酸序列完全一致的核苷酸序列(仅此一处),从而找到了相应的酶基因序列。该基因以GCT (氨基酸A)开始,终止于TAG,全长969 bp,编码322个氨基酸,推测该基因即目标酯酶基因,将其命名为RMest,并将该基因在Albibacters sp. zjut528中表达的酶蛋白表示为RMest。
2.2 目标酯酶基因RMest的克隆和表达 以Albibacters sp. zjut528菌株的基因组DNA为模板,根据酯酶基因RMest上下游适当位置的核苷酸序列设计引物,进行PCR扩增,扩增后琼脂糖凝胶电泳检测,如图 1,可以看出,1000–1500 bp有一个明显条带,无非特异性条带,与预期大小相符合。使用胶回收试剂盒回收目的DNA片段,将该片段与pET-28a(+)经双酶切、T4连接酶连接后得到重组质粒,然后转化到E. coli BL21 Gold(DE3),获得重组菌RMest-pET-28a(+)-E. coli BL21 Gold(DE3)。随机挑取平板上的两个单菌落,LB液体培养基(含50 μg/mL卡那霉素)过夜富集培养。提取重组质粒,进行质粒PCR验证(图 2)。将重组质粒送样测序,测序结果表明,重组大肠杆菌构建成功。
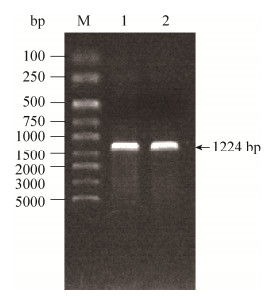 |
| 图 1 PCR扩增的基因RMest的DNA片段琼脂糖电泳图 Figure 1 Agarose electrophoresis of gene RMest's DNA segment amplified by PCR. |
| 图选项 |
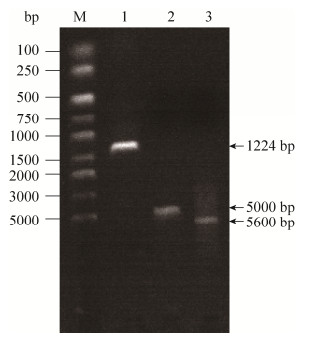 |
| 图 2 重组质粒的PCR验证 Figure 2 PCR verification of recombinant plasmid. M: marker; lane 1: amplified RMest DNA segment; lane 2: pET-28a(+) empty plasmid; lane 3: RMest- pET-28a(+). |
| 图选项 |
分别取宿主菌(含空载体)、未诱导和诱导的重组菌胞内液(发酵液离心获菌体,超声破碎后,离心取上清液)进行SDS-PAGE分析,如图 3可知,经IPTG诱导,重组大肠杆菌有目的蛋白表达,大小约为46 kDa,与预期相符,表明酯酶基因RMest在大肠杆菌RMest-pET-28a(+)-E. coli BL21 Gold(DE3)成功异源表达。
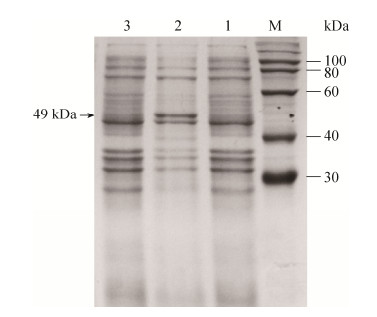 |
| 图 3 重组菌RMest-pET-28a(+)-E. coli BL21 Gold(DE3)表达产物的SDS-PAGE图 Figure 3 SDS-PAGE analysis of expression product of recombinant strain RMest-pET-28a (+)-E. coli BL21 Gold (DE3). M: marker; lane 1: without IPTG induction; lane 2: with IPTG induction; lane 3: host strain with empty plasmid. |
| 图选项 |
2.3 重组蛋白的纯化 用Ni2+亲和层析介质纯化重组蛋白。选用200 mmol/L的咪唑洗脱目的蛋白,从图 4可以看出,纯化后目的蛋白的纯度大幅提高(泳道2)。在第一次洗脱过程中,已经将大部分的目的蛋白洗脱下来(泳道2)。第二次和第三次洗脱下来的蛋白几乎没有了(泳道3和4)。
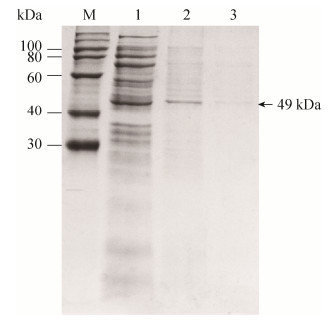 |
| 图 4 用Ni2+亲和层析介质纯化重组蛋白的SDS-PAGE图 Figure 4 SDS-PAGE analysis of recombinant protein's purification by affinity adsorption with Ni2+ resin. M: marker; lane 1: supernatant after adsorption; lane 2: 200 mmol/L imidazole first eluate; lane 3: 200 mmol/L imidazole second eluate; lane 4: 200 mmol/L imidazole third eluate. |
| 图选项 |
2.4 重组酯酶RMesterase的酶学性质
2.4.1 酶的立体选择性: 将重组菌破壁,离心取上清酶液,用获得的粗酶液催化水解R, S-甲霜灵,底物终浓度为10 g/L (35.8 mmol/L)。若甲霜灵水解,产物是甲霜灵酸和甲醇。在反应初始(如图 5-A),S-甲霜灵和R-甲霜灵各占一半,保留时间分别在11 min和35.7 min。反应6 h (如图 5-B),R-甲霜灵的峰完全消失,底物的转化率达到了49.8%;而产物仅为R-甲霜灵酸(16.9 min),产物的eep值为99.3%,表明酶的对映体选择性为严格R型。当反应再进行6 h (总时间到12 h),如图 5-C所示,在10.07 min出现了一个较小的S-甲霜灵酸的产物峰,相应地,S-甲霜灵的峰(11 min)有所下降。这时底物的转化率达到了56.5%,产物的eep值降到82.9%。因此,对该酯酶来说,只有当R型底物降解完之后,才会缓慢降解S型底物。
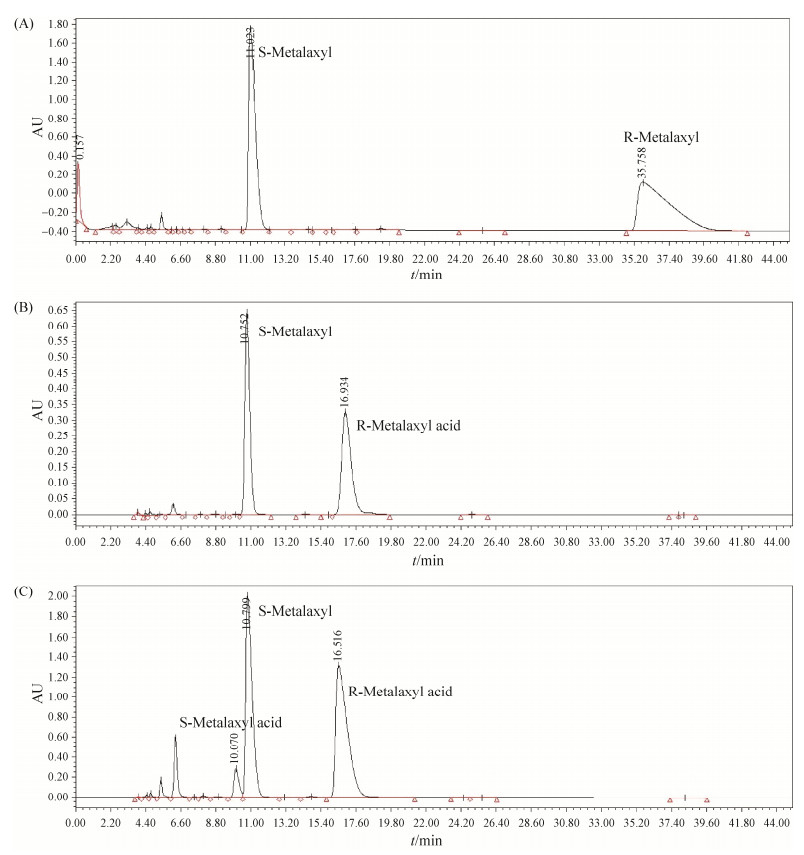 |
| 图 5 HPLC分析重组酯酶粗酶液催化水解R, S-甲霜灵的过程 Figure 5 Process of enantioselective hydrolysis of R, S-metalaxyl catalyzed by crude recombinant RMesterase. A: reaction 0 h; B: reaction 6 h; C: reaction 12 h. |
| 图选项 |
2.4.2 温度和pH对酶活性及稳定性的影响: 取适量纯化重组酶液,分别测定不同温度下的酶活,以最高酶活为100%,结果如图 6。该酯酶在40 ℃时酶活最高,在60 ℃时几乎完全失活。将酶在不同温度下保温4 h后,20–40 ℃下剩余酶活仍保留85%以上(图 6-A、6-B),50 ℃下剩余酶活迅速下降,60 ℃已经很难检测到活性,表明该酶在50 ℃及以上不稳定。
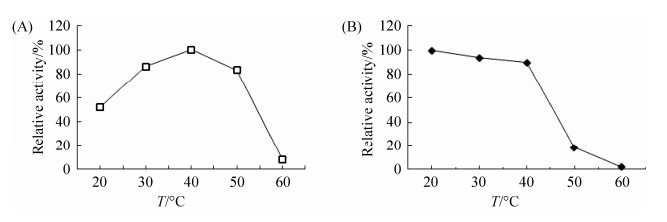 |
| 图 6 温度对重组酯酶活性(A)及稳定性(B)的影响 Figure 6 Effect of temperature on RMesterase activity (A) and stability (B). A: The maximum activity was defined as 100% level. B: The initial activity was defined as 100% level. |
| 图选项 |
分别测定不同pH下的酶活,以最高酶活为100%,如图 7-A所示,酶在pH为9.0时酶活最高,pH为10.0时仍有80%以上的酶活;随着酸性的增加该酶酶活迅速下降,在pH为4.0时,只有最大活性的8%。pH稳定性研究表明,该酶在4 ℃、pH 5.0–10.0下保温48 h,剩余酶活仍保留90%以上(图 7-B),而在pH 4.0下,剩余酶活只为初始的40%,表明该酶在pH 4.0及以下不稳定。
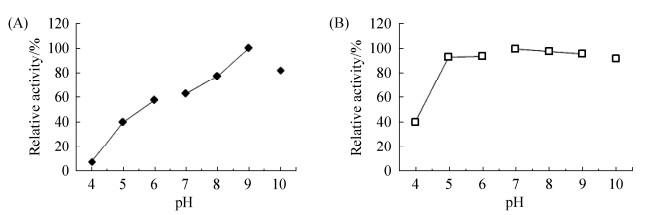 |
| 图 7 pH对重组酯酶活性(A)及稳定性(B)的影响 Figure 7 Effect of pH on RMesterase activity (A) and stability (B). A: The maximum activity was defined as 100% level. B: The initial activity was defined as 100% level. |
| 图选项 |
2.4.3 甲醇浓度对酶活性的影响: 甲醇是甲霜灵水解的产物之一。取适量纯化重组酶液分别在0、10、25、50、100 mmol/L的甲醇浓度下测定酶活,结果如图 8。图中显示甲醇浓度在0–25 mmol/L时,随着甲醇浓度的升高,酶活迅速降低,当甲醇浓度为25 mmol/L时酶活只有无甲醇时的约20%,但高于25 mmol/L时,甲醇对酶活的抑制不再随浓度的升高而增加。上述结果表明,甲霜灵的酶水解存在较严重的产物(甲醇)抑制。该性质将对酶催化水解拆分R, S-甲霜灵生产R-甲霜灵造成不利影响。
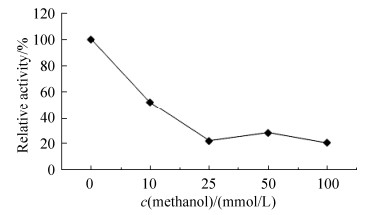 |
| 图 8 甲醇浓度对重组酶催化R, S-甲霜灵的水解活性的影响 Figure 8 Effect of methanol on activity of RMesterase catalyzing hydrolysis of R, S-metalaxyl. |
| 图选项 |
2.4.4 重组酶的酶反应动力学: 用纯化的重组酶测定了不同甲霜灵浓度下的酶反应速度,结果见图 9,反应速率和底物浓度的关系符合米氏方程。再用Lineweaver-Burk双倒数作图(见图 9小图),求得Vmax=0.114 mmol/(L·min),Km=2.04 mmol/L。测定时反应体系中酶(蛋白)浓度[E]=0.156×10–3 mol/L,由kcat=Vm/[E],得kcat=0.73 min–1。
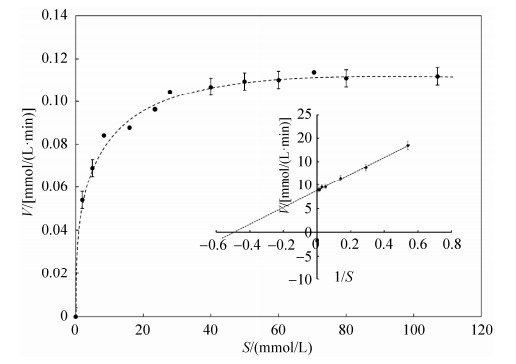 |
| 图 9 不同甲霜灵浓度下的重组酶反应速率及它的Lineweaver-Burk双倒数图 Figure 9 Rates of reaction catalyzed by purified RMesterase at different metalaxyl concentration and its Lineweaver-Burk plot. |
| 图选项 |
2.5 酯酶RMest与其他蛋白的序列比对
2.5.1 酯酶RMest与数据库中其他蛋白的氨基酸序列比对及进化树的构建: 在EBI网站采用Blast+对酯酶RMest进行氨基酸序列比对,选择的数据库是Uniprot KB (include UnitProt KB/Swiss-Prot and uniProt KB/TrEMBL),其他参数为缺省值。在返回的前50个最匹配的条目中,去掉“uncharaterized protein”的条目,剩下23个条目。表 1中列出了这23个条目中的前3个和最后一个。从表中可知,与RMest同源性最高的蛋白是来自Hyphomicrobium sp.的AB hydrolase-1 domain-containing protein (AB指Alpha/Beta),E值为2.4E-69,序列一致性40.2%,相似性57.3%。表中第23个匹配的蛋白是来自Ramlibacter sp. WS9的Lysophospholipase,E值是3.8E-51,序列一致性36.9%,相似性52.7%。而E值< 0.01就能用来可靠地推断同源性。
表 1. 用Blast+在UniProt KB数据库中对酯酶RMest进行氨基酸序列比对的结果* Table 1. Result from Blast+ of esterase RMest against proteins in UniProt KB database*
| No. | DB:ID | Source | Length | Score (Bits) | Identities/% | Positives/% | E |
| 1 | F8J9E5 | AB hydrolase-1 domain-containing protein OS=Hyphomicrobium sp. | 387 | 230.3 | 40.2 | 57.3 | 2.4E-69 |
| 2 | A0A4Q0M384 | Lysophospholipase OS=Hansschlegelia zhihuaiae | 372 | 209.1 | 39.1 | 56.9 | 2.7E-61 |
| 3 | A0A0Q7HBR2 | Lysophospholipase OS=Variovorax sp. Root434 | 343 | 206.8 | 40.9 | 56.1 | 9.5E-61 |
| 23 | A0A4Y7B509 | Lysophospholipase OS=Ramlibacter sp. WS9 | 349 | 182.2 | 36.9 | 52.7 | 3.8E-51 |
| *: Blast+ run retured first 50 matching items. After deleting “uncharaterized protein” items, 23 ones remained among which the first 3 and last ones were showed in the table. | |||||||
表选项
对这23个条目,用MEGA7.0软件构建蛋白系统发育树。先对它们进行Clustal W多重比对,然后采用邻近法建立进化树,得图 10。由图知,树中的祖先蛋白共分出4个蛋白谱系。第一个谱系是上部的Lysophospholipases,共14个成员;第三个谱系是中下部的AB hydrolase-1 domain-containing proteins,共3个成员;第四个是下部的Esterases,共6个成员;而本文的酯酶RMest为第二个谱系,只有自己1个成员。由于这些Lysophospholipases、AB hydrolase-1 domain-containing proteins和Esterases同属Alpha/Beta水解酶家族,所以酯酶RMest是一种Alpha/Beta水解酶,它最可能的功能是Lysophospholipase或Esterase。另外,由于酯酶RMest是树中第二个蛋白谱系的唯一成员,它与树中的其他蛋白均存在较大的进化距离,表明它是一个相对独立进化的Alpha/Beta水解酶(本文证明它是一个酯酶)。
 |
| 图 10 酯酶RMest的蛋白系统发育树 Figure 10 Protein phylogenetic tree of esterase RMest. The tree was constructed by N-J method with bootstrap values calculated from 1000 resampling. The numbers on branches indicate bootstrap values. 0.050 Bar indicates 5% sequence divergence. The serial numbers in parentheses represent protein ID in Unitprot. |
| 图选项 |
2.5.2 酯酶RMest与EHest (水解甲霜灵中间体MAP)的氨基酸序列比对和催化性质比较: 将酯酶RMest (对甲霜灵有R-选择性水解活性)与酯酶EHest[14](对甲霜灵中间体MAP有良好R-选择性水解活性,本实验室报道)的氨基酸序列进行比对,结果显示(图 11)二者存在较大差异。同大多数丝氨酸水解酶一样,两种酯酶均含有α/β水解酶家族的五肽保守区域(Gly-x-Ser-x-Gly)。酯酶RMest的五肽保守区域为GHSAG与EHest的GHSFG有一个氨基酸不同(图 11黑框处)。
 |
| 图 11 酯酶RMest与EHest的氨基酸序列比对 Figure 11 Alignment of amino acid sequence of esterase RMest with Ehest. *: identical amino acid; :: highly similar; .: low similar. |
| 图选项 |
甲霜灵[N-(2, 6-二甲基苯基)-N-(2-甲氧基乙酰)丙氨酸甲酯]与甲霜灵中间体MAP [N-(2, 6-二甲基苯基丙氨酸甲酯)]的结构相比,只在N原子上多了一个“2-甲氧基乙酰基”支链。两种重组酯酶RMesterase和EHesterase对这两种外消旋底物的催化性质见表 2。首先,两种酯酶都对MAP有强水解活性,说明两者的活性中心结构有一定的相似之处。上文提到,两者氨基酸序列的差异较大,因此对底物MAP的水解而言,两者是一个异源同功的关系。另一方面,RMesterase对R, S-MAP无立体选择性,而EHesterase对它却有较强的R-选择性,说明它们的底物结合口袋的结构有一定的差异性。其次,RMesterase对甲霜灵有较强的活性和极高的R-选择性,说明RMesterase的底物结合口袋与R-甲霜灵的结合具有很强的专一性。而EHesterase对甲霜灵无活性,可能是甲霜灵结构中多出的支链造成了EHesterase与其结合的巨大障碍,这也反映了两种酶底物结合口袋结构的差异性。
表 2. 重组酯酶RMesterase和EHesterase对外消旋甲霜灵和甲霜灵中间体MAP*的催化性质 Table 2. Catalytic properties of RMesterase and EHesterase on hydrolysis of racemic metalaxyl and MAP*
| Recombinant enzyme | R, S-MAP* | R, S-metalaxyl | |||
| Activity | Enatioselectivity | Activity | Enatioselectivity | ||
| RMesterase | High | No | Fairly high | R-, Very high | |
| EHesterase[14] | High | R-, high | No | ||
| *R, S-MAP: R, S-methyl N-(2, 6-dimethylphenyl) alanine, the precursor for production of R, S-metalaxyl. | |||||
表选项
3 讨论 将本文获得的重组酯酶RMesterase和文献[13]报道的组成型酯酶(分离于Albibacters sp. zjut528胞内液)的主要酶学性质进行比较,结果如下:(1)两者分子量大小一致。本文报道的重组酯酶的分子量约46 kDa (图 3),文献[13]报道的组成型酯酶的分子量约40 kDa。首先,在构建重组菌时,因酶切位点的选择问题以及His标签的添加等,重组酶N端多了33个氨基酸,分子量多了4 kDa多。此外,两个分子量均来自SDS-PAGE图,有一定的估计误差。(2)两者立体选择性一致。本文用重组酯酶水解外消旋甲霜灵,底物转化率49.8%时,主产物为R-甲霜灵酸,eep > 99.3%。文献[13]报道,用含组成型酯酶的菌株Albibacters sp. zjut528水解外消旋甲霜灵,产物收率47.1% (约等于底物转化率)时,主产物为R-甲霜灵酸,eep > 99.9%;(3)温度和pH对两者的活性和稳定性的影响一致。温度和pH对重组酶和组成型酯酶的活性和稳定性的影响曲线完全类似,两种酯酶的最优温度和pH完全相同,均为40 ℃和pH 9.0。(4)两者的酶反应动力学一致。重组酶和组成型酯酶反应动力学均符合米氏方程。重组酶的米氏常数Km (2.04 mmol/L)与组成型酶(2.29 mmol/L)相当,而重组酶的kcat值(0.73 min–1)小于组成型酶(0.85 min–1),可能原因是纯化的重组酯酶的纯度不如组成型酶。通过以上比较可以确定:本文研究的酯酶基因RMest就是使Albibacters sp. zjut528菌具有R, S-甲霜灵水解拆分活性的组成型酯酶的基因。
本文报道了一种酯酶的基因序列RMest,该基因来自于Albibacters sp. zjut528的基因组,是该菌株具有R, S-甲霜灵拆分能力的根本原因。本研究的新意主要表现在以下两点:(1)具有本文性能的酯酶基因在国内外属首次报道,该报道对生物拆分法生产精甲霜灵(R体为主)具有很大的应用价值,对进一步研究该酶结构和活性关系也具有重要的意义。(2)通过与Uniprot KB数据库中其他蛋白质的氨基酸序列进行比对,结果显示酯酶RMest与某些Lysophospholipases、AB hydrolase-1 domain-containing proteins和Esterases的同源性较高,它与同源性最高的AB hydrolase-1 domain- containing proteins的氨基酸序列一致性只有40.2%,序列相似性只有57.3% (表 1),表明该酶是一种序列特异性强的新酯酶蛋白。
4 结论 本文从Albibacters sp. zjut528的基因组中找到一种可以高选择性水解R-甲霜灵的脂酶基因RMest,全长969 bp,编码322个氨基酸残基,属于α/β水解酶家族。本文成功构建了重组菌RMest- pET-28a(+)-E. coli BL21 Gold(DE3),它能表达大小约为46 kDa的重组酶蛋白。用胞内重组酶液催化水解外消旋甲霜灵,当底物转化率为49.8%时,产物(甲霜灵酸)的eep为99.3%,对底物的对映体R-构型具有专一(选择)性,并且只有当R型底物水解完之后,才会缓慢水解S型底物。该酶最适温度和pH分别为40 ℃和pH 9.0。该酶的活性受到产物甲醇的抑制。与Uniprot KB数据库中其他蛋白质的氨基酸序列进行比对,采用邻近法构建蛋白系统发育树,结果显示酯酶RMest与某些Lysophospholipases、AB hydrolase-1 domain- containing proteins和Esterases的同源性最高,但是与它们均存在较大的进化距离,表明该酶是一种相对独立进化的新酯酶蛋白。
References
| [1] | Fisher DJ, Hayes AL. Mode of action of the systemic fungicides furalaxyl, metalaxyl and ofurace. Pesticide Science, 1982, 13(3): 330-339. DOI:10.1002/ps.2780130316 |
| [2] | Liu XL, Ma AJ, Lin JB, Liu PF. The comparison of inhibitory action between stereoisomers of metalaxyl. Chinese Journal of Pesticide Science, 2003, 5(3): 45-49. (in Chinese) 刘西莉, 马安捷, 林吉柏, 刘鹏飞. 精甲霜灵与外消旋体甲霜灵对掘氏疫霉菌的抑菌活性比较. 农药学学报, 2003, 5(3): 45-49. |
| [3] | Zadra C, Marucchini C, Zazzerini A. Behavior of metalaxyl and its pure R-enantiomer in sunflower plants (Helianthus annus). Journal of Agricultural and Food Chemistry, 2002, 50(19): 5373-5377. DOI:10.1021/jf020310w |
| [4] | Sun JL. Modern pesticide synthesis technology. Beijing: Chemical Industry Press, 2011: 386. (in Chinese) 孙家隆. 现代农药合成技术. 北京: 化学工业出版社, 2011: 386. |
| [5] | Park OJ, Lee SH, Park TY, Lee SW, Cho KH. Enzyme-catalyzed preparation of methyl (R)-N-(2, 6-dimethylphenyl) alaninate:a key intermediate for (R)-metalaxyl. Tetrahedron:Asymmetry, 2005, 16(6): 1221-1225. DOI:10.1016/j.tetasy.2005.01.033 |
| [6] | Huang LQ, Chen DW, Yang H. Enzymatic resolution of methyl (±)-N-(2, 6-dimethylphenyl) alanine. Chinese Journal of Organic Chemistry, 2005, 25(12): 1575-1579. (in Chinese) 黄丽琴, 陈道文, 杨红. 酶法拆分(±)-N-(2, 6-二甲苯基)-丙氨酸甲酯. 有机化学, 2005, 25(12): 1575-1579. |
| [7] | Huang LQ, Yang H. The lipase catalyzed reaction of methyl (±)-N-(2, 6-dimethylphenyl) alanine and determination of conversion. Journal of Nanjing Agricultural University, 2007, 30(4): 135-139. (in Chinese) 黄丽琴, 杨红. (±)-N-(2, 6-二甲苯基)-丙氨酸甲酯的脂肪酶酶促水解拆分方法. 南京农业大学学报, 2007, 30(4): 135-139. |
| [8] | 王岩.精甲霜灵的合成研究.吉林大学硕士学位论文, 2008. |
| [9] | 王世辉.微胶囊法固定脂肪酶及拆分手性胺的研究.吉林大学硕士学位论文, 2010. |
| [10] | 郑良玉.脂肪酶催化拆分N取代苯基α氨基丙酸的研究.吉林大学博士学位论文, 2004. |
| [11] | Park OJ, Lee SH, Park TY, Chung WG, Lee SW. Development of a scalable process for a key intermediate of (R)-metalaxyl by enzymatic kinetic resolution. Organic Process Research & Development, 2006, 10(3): 588-591. |
| [12] | Park OJ, Lee SH. Stereoselective lipases from Burkholderia sp., cloning and their application to preparation of methyl (R)-N-(2, 6-dimethylphenyl)alaninate, a key intermediate for (R)-metalaxyl. Journal of Biotechnology, 2005, 120(2): 174-182. |
| [13] | Zhang ZH, Zhang LK, Lu YL. Production of R-metalaxyl by resolution of racemic metalaxyl using biocatalyst. CIESC Journal, 2017, 68(11): 4229-4238. (in Chinese) 张朝晖, 张利坤, 陆跃乐. 生物法拆分外消旋甲霜灵制备R-甲霜灵. 化工学报, 2017, 68(11): 4229-4238. |
| [14] | Lu YN, Zhang ZH, Zhang LK, Lu YL. Cloning and expression of an esterase gene from a new strain capable of enantioselective hydrolyzing methyl (R, S)-N-(2, 6-dimethylphenyl) alaninate. Acta Microbiologica Sinica, 2016, 56(8): 1335-1347. (in Chinese) 卢亚南, 张朝晖, 张利坤, 陆跃乐. 不对称水解(R, S)-2, 6-二甲基苯基氨基丙酸甲酯新菌种的分离鉴定及酯酶基因的克隆、表达. 微生物学报, 2016, 56(8): 1335-1347. |
