王旭东1, 林鑫广1, 左佳坤2, 许媛媛1, 王志豪2, 陈兆国2, 韩先干2

 , 苗晋锋1
, 苗晋锋1

1. 南京农业大学动物医学院, 江苏 南京 210095;
2. 中国农业科学院上海兽医研究所, 上海 200241
收稿日期:2020-01-03;修回日期:2020-06-18;网络出版日期:2020-07-11
基金项目:政府间国际科技创新合作重点项目(2018YFE0102200);国家自然科学基金(31872483, 31972654);上海市科学技术标准基金(17140900400);兵团重点领域科技攻关计划(2020AB025)
*通信作者:韩先干, Tel:+86-21-54225517, E-mail:hanxgan@163.com;
苗晋锋, Tel:+86-25-84398669, E-mail:mjf171647@126.com.
摘要:c-di-GMP是细菌中广泛存在的第二信使,可通过效应蛋白参与调控细菌的生物被膜形成、运动性和毒力等生物学特性。YeaI因含有能结合c-di-GMP分子的EGEVF基序,可能作为c-di-GMP效应蛋白发挥作用。[目的] 研究yeaI基因缺失对奶牛源大肠杆菌临床分离株NJ17生物学特性的影响。[方法] 构建NJ17的yeaI缺失株(NJ17ΔyeaI)及回复株cNJ17ΔyeaI,分析yeaI对NJ17生物学特性(如生长特性、生物被膜形成能力和对小鼠乳腺上皮细胞(EpH4-Ev)的黏附)的影响。[结果] 成功构建NJ17的yeaI缺失株(NJ17ΔyeaI)及其回复株(cNJ17ΔyeaI);与野生株NJ17相比,缺失株NJ17ΔyeaI生长特性及耐药性无显著变化,生物被膜形成能力显著下降,运动性显著升高(P < 0.05);透射电镜检测结果表明,yeaI缺失影响NJ17菌毛和鞭毛的形成;实时定量PCR(qPCR)结果显示,yeaI基因显著抑制NJ17鞭毛基因filG和motB的转录水平(P < 0.05);血清杀菌实验表明,yeaI缺失能显著增强其抵抗血清杀菌作用(P < 0.05);对EpH4-Ev细胞黏附实验表明,yeaI缺失对NJ17黏附性无显著影响(P>0.05)。[结论] yeaI对奶牛源大肠杆菌NJ17的生物学特性具有重要的调控作用。
关键词:c-di-GMPyeaI奶牛源大肠杆菌生物学特性
Effect of yeaI gene on biological characteristics of Escherichia coli of cattle origin
Xudong Wang1, Xinguang Lin1, Jiakun Zuo2, Yuanyuan Xu1, Zhihao Wang2, Zhaoguo Chen2, Xiangan Han2

 , Jinfeng Miao1
, Jinfeng Miao1

1. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
2. Shanghai Veterinary Research Institure, Chinese Academy of Agricultural Sciences(CAAS), Shanghai 200241, China
Received: 3 January 2020; Revised: 18 June 2020; Published online: 11 July 2020
*Corresponding author: Xiangan Han, Tel: +86-21-54225517, E-mail: hanxgan@163.com;
Jinfeng Miao, Tel: +86-25-84398669, E-mail: mjf171647@126.com.
Foundation item: Supported by the Key Project of Inter-Governmental International Scientific Technological Innovation Cooperation (2018YFE0102200), by the National Natural Science Foundation of China (31872483, 31972654), by the Shanghai Science and Technology Standard Fund (17140900400) and by the Key Scientific Technological Project of XPCC (2020AB025)
Abstract: c-di-GMP is a widespread second messenger in bacteria and regulates many important bacterial biological characteristics (such as biofilm, motility and virulence) by binding effector proteins. YeaI protein containing EGEVF motifs can bind c-di-GMP and may regulate bacterial performance. [Objective] To study the roles of yeaI in Escherichia coli NJ17 strain. [Methods] The yeaI mutant (NJ17ΔyeaI) and complementary strain (cNJ17ΔyeaI) were constructed. Growth characteristics, biofilm formation ability, adhesion and other biological characteristics were analyzed in NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. [Results] We successfully constructed NJ17ΔyeaI and cNJ17ΔyeaI. Compared with NJ17, there was no significant changes in growth characteristics and drug resistance of NJ17ΔyeaI (P>0.05). However, biofilm formation ability of NJ17ΔyeaI significantly decreased and motility of NJ17ΔyeaI significantly improved (P < 0.05). Transmission electron micrographs shows that yeaI deletion affected the formation of NJ17 fimbriae and flagella. qPCR results also showthat the yeaI gene significantly inhibited the transcription level of the flagella-related genes motB and filG in NJ17. Furthermore, serum survival experiments results show that deletion of yeaI significantly enhanced survival abilities of NJ17 in rat serum (P < 0.05). However, compared with NJ17, there was no significant change in adhesion rate of yeaI mutant to EpH4-Ev (P < 0.05). [Conclusion] The yeaI plays an important role in regulating the biological characteristics of E. coli of cattle origin.
Keywords: c-di-GMPyeaIEscherichia colibiological characteristics
奶牛乳腺炎是奶牛的一种常见病,由于其降低牛奶产量和品质,且治愈费用高,因此严重制约养牛业的发展[1]。大肠杆菌是引起急性奶牛乳腺炎的重要环境性病原菌之一[2],其引起乳腺炎的致病机制仍有待进一步研究。
c-di-GMP是细菌中广泛存在的第二信使,参与调控病原菌的多种生理活动并影响其致病性。细菌通过编码合成酶或降解酶调控胞内c-di-GMP浓度的变化,进而调控其生物学特性[3-4]。c-di-GMP在病原菌体内的浓度受到严格调控,其代谢依赖于含有GGDEF、EAL、GGDEF-EAL或HD-GYP结构域的蛋白。具有鸟苷酸环化酶(diguanylate cyclase,DGC)活性的GGDEF结构域蛋白以及具有磷酸二酯酶(phosphodiesterases,PDE)活性的EAL或HD-GYP结构域蛋白分别负责c-di-GMP的合成与降解[5]。
YeaI不具备DGC或PDE活性,但其能够通过特异性结合c-di-GMP而发挥重要的调控作用[6]。比较分析编码GGDEF或者EAL结构域基因在61株致病性、共生性和益生性大肠杆菌基因组中的分布情况,发现yeaI在这些大肠杆菌菌株中是完全高度保守的[7]。研究表明,yeaI对细菌具有重要调控作用,例如在尿路致病性大肠杆菌CFT073中,yeaI能够促进其生物被膜形成[8],在大肠杆菌K-12菌株中,yeaI能够促进其生物被膜的形成和提高其运动性。但目前尚未见对奶牛源大肠杆菌yeaI的调控功能研究,因此,开展奶牛源大肠杆菌yeaI的生物学特性研究,可为由大肠杆菌引起的奶牛乳腺炎防控提供参考。
1 材料和方法 1.1 试验材料 小鼠乳腺上皮细胞(EpH4-Ev)购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。奶牛源大肠杆菌NJ17于2017年从患奶牛乳腺炎的病牛牛乳中分离,PCR分群鉴定其为B1群肠致病性大肠杆菌(EPEC),本实验室保存。细胞培养相关耗材购自美国Corning公司;细胞裂解液胰酶(Trypsin-EDTA solution)、磷酸盐缓冲液(PBS)、高糖DMEM购自Gibco公司;PrimeSTAR?Max DNA Polymerase、Premix TaqTM、DNA Marker均购自TaKaRa生物技术有限公司(中国大连);TIANprep快速微型质粒试剂盒购自天根生物技术有限公司;GeneJET凝胶提取试剂盒购自赛默飞世尔科技公司(中国上海);药敏纸片均购自杭州天河公司;酵母粉、蛋白胨、琼脂粉均购自英国Oxoid公司;氨苄西林钠、氯霉素、卡那霉素、考马斯亮蓝、刚果红、葡萄糖、氯化钠均购自生工生物工程(上海)股份有限公司;MgSO4购自美国Amresco公司;无维生素酪蛋白氨基酸购自美国BD公司。
1.2 奶牛源大肠杆菌NJ17缺失株及回复株的构建 根据大肠杆菌基因组序列(NC_000913.3),运用Primer Premier 5软件,设计表 1引物用于NJ17的yeaI基因缺失株和回复株的构建及鉴定。
表 1. 本研究所用引物 Table 1. Primers used in this study
| Primers | Oligonucleotide sequence (5'→3') | Description | Product size/bp |
| yeaI-UF | AGAACGTATAAGAACGTGGAAGTCG | The upstream sequence of yeaI | 880 |
| yeaI-UR | AACAAAGCCACAACAACCATCAG | ||
| yeaI-CFa | TGGCTTTGTTTGTAGGCTGGAGCTGCTT | Chloramphenicol resistance cassette (cat) | 1015 |
| yeaI-CRa | ACACCTCACCCATATGAATATCCTCCTTAG | ||
| yeaI-DF | GGTGAGGTGTTTGGCTTGCT | The downstream sequence of yeaI | 788 |
| yeaI-DR | TCAGTGGATGCGGTTTGTAGTG | ||
| cat-IF | ATTGGGATAAGTTAGAGC | Partial sequence of cat | 257 |
| cat-IR | GTAATAATGGGTAGAAGG | ||
| yeaI-IF | CATGTTAATGAAATATTTC | Partial sequence of yeaI | 213 |
| yeaI-IR | AGCGCCAGCGAGGTTAAACA | ||
| yeaI-OF | GGAACGTCTGCGCAAAGAAAT | Exogenous identification primer of yeaI | 2604 |
| yeaI-OR | GGAGTCTGCTTTCTGCACGAT | ||
| C-yeaI-Fb | CCGGAATTCAAATTATCTCATTTATTACATA | Used for constructing yeaI complementary plasmid | 1575 |
| C-yeaI-Rb | ACGCGTCGACTTAAATATGATGAATAATCA | ||
| M13-F | TGTAAAACGACGGCCAGT | Used for identifying complementary plasmids | 1675 |
| M13-R | CAGGAAACAGCTATGACC | ||
| a: Chloramphenicol resistance gene cat was amplified by primers yeaI-CF/yeaI-CR and the underlined sequence at the 5' end is homologous to the sequences on both sides of the yeaI gene; b: The restriction sites EcoR I and Sal I were respectively introduced into the upstream and downstream of primers C-yeaI-F/C-yeaI-R. | |||
表选项
参照文献描述的方法[9]略有改动,将含有卡那抗性pKD46质粒(由本实验室改造)的NJ17接种至液体LB培养基,制备NJ17电转化感受态细胞。
运用引物yeaI-UF/yeaI-UR和yeaI-DF/yeaI- DR分别扩增yeaI的上、下游同源臂,引物yeaI-CF/yeaI-CR扩增氯霉素抗性基因cat,以上述回收、纯化的PCR产物为模板,利用重叠PCR构建包含yeaI上游序列、氯霉素及yeaI下游序列3个部分的缺失打靶片段(大小为2683 bp)。将扩增纯化的打靶片段电转化(1 mm电击杯,1.8 kV,脉冲25 μF,电阻200 Ω)至NJ17感受态中,运用引物yeaI-UF/yeaI-CR筛选、鉴定含有氯霉素抗性基因cat的yeaI缺失株,将成功缺失yeaI并含有氯霉素抗性的菌株命名为NJ17ΔyeaI-Cm。
转化抗性消除质粒pCP20 (氨苄青霉素抗性)至NJ17ΔyeaI-Cm后,用cat-IF/cat-IR分别鉴定NJ17ΔyeaI-Cm和消除cat基因的缺失株,将不含氯霉素抗性的yeaI缺失株命名为NJ17ΔyeaI。
以NJ17菌株基因组为模板,利用引物C-yeaI-F/C-yeaI-R扩增含有完整yeaI阅读框的回复片段,克隆至pSTV28载体,运用引物M13-F/M13-R筛选、鉴定回复质粒pSTV-yeaI,并送公司测序,将测序结果正确的回补质粒电转化至NJ17ΔyeaI缺失菌株中,运用引物yeaI-IF/yeaI-IR和M13-F/M13-R筛选、鉴定回复菌株cNJ17ΔyeaI。
1.3 生长曲线及生物被膜 将NJ17、NJ17ΔyeaI和cNJ17ΔyeaI在LB中培养至对数中期后,以1︰100 (V/V)的比例接种至含100 mL LB液体培养基的锥形瓶中,放置于37 ℃、200 r/min摇床振荡培养,每1 h取样测量1次,实验重复3次,绘制菌株的生长曲线。
生物被膜的测定方法参照文献[10]进行,将上述3株菌在LB液体培养基中静置培养过夜后,离心收集菌体,用LB培养基稀释调整至OD600=0.1,将每种菌株悬液200 μL加至96孔板,37 ℃孵育36 h后,PBS洗涤3次,用0.1%的结晶紫在室温下染色30 min。PBS冲洗3次后,加入100 μL 95%乙醇溶解结晶紫,使用酶标仪测定595 nm处的结晶紫溶液光密度(OD595),每组样品重复6次。
1.4 透射电镜观察细菌鞭毛、菌毛形态 为了进一步评价yeaI对NJ17鞭毛、菌毛形成的影响,参照文献[11]方法将NJ17、NJ17ΔyeaI和cNJ17ΔyeaI接种至液体LB中37 ℃静置培养至OD600=1.0,用0.22 μm水系滤纸过滤菌液,过滤之后用PBS洗去培养基,用镊子将滤纸折叠,放入5 mL离心管中,用与过滤菌液等量的PBS将菌体从滤纸上冲洗下来。将上述处理的菌体悬液,与负染色剂按比例混合,滴在2–3 mm的铜网,吸除多余液体,白炽灯下稍烘干,并用透射电镜(Tecnai 12,飞利浦,阿姆斯特丹,荷兰)观察。
1.5 细菌rdar形态的变化 产生物被膜型肠杆菌(如大肠杆菌)会在刚果红培养基(Congo Red,CR)上形成红色、干燥和粗糙的菌落形态(rdar形态,red,dry and rough)[12]。将NJ17、NJ17ΔyeaI和cNJ17ΔyeaI分别接种LB液体培养基中,37 ℃静置培养过夜,4 ℃、3000 r/min离心10 min后收集菌体,PBS重悬并调整至OD600=3.0。按照文献[13]的方法,配置新鲜的200 mL CR培养基(200 mL:刚果红0.008 g,考马斯亮蓝0.004 g,蛋白胨2.000 g,酵母粉1.000 g,琼脂粉1.600 g),在高压灭菌后的CR固体培养基中央滴加0.5 μL菌体,28 ℃培养48 h后拍照观察。
1.6 细菌的运动性 将NJ17、NJ17ΔyeaI和cNJ17ΔyeaI分别静置培养至OD600=1.0后,4 ℃、3000 r/min离心10 min,收集菌体,PBS洗涤后,重悬调至OD600=3.0。配置200 mL的运动性培养基(200 mL:2.0 g蛋白胨,1.0 g氯化钠,1.6 g葡萄糖和0.5 g琼脂粉)[14],高压灭菌后倒入平皿,待冷却后在中央部位加入2 μL菌体,28 ℃培养24 h后拍照、测量。
1.7 细菌的耐药性 为了评价yeaI对NJ17耐药性的影响,参照NCCLS (National Committee for Clinical Laboratory Standards)标准,采用K-B纸片琼脂扩散法,选择16种抗生素对NJ17、NJ17ΔyeaI和cNJ17ΔyeaI的耐药性进行检测。将待检菌株均匀涂布于LB固体平板,贴上药敏纸片,37 ℃培养18 h后,测量各药敏纸片的抑菌圈直径,以毫米计,判定被检细菌对每种药物的敏感性:敏感(Susceptible,S)、中敏(Intermediate,I)和耐药(Resistance,R),实验独立重复3次。
1.8 细菌黏附试验 参照文献[3]测定野生株NJ17对小鼠乳腺上皮细胞EpH4-Ev的黏附能力。将EpH4-Ev接种到24孔板,并在10%犊牛血清的DMEM培养基中培养至细胞密度为3×105。用不同感染复数梯度(MOI=400、200、100、50、25和12.5)感染24孔板中的细胞,并在37 ℃、5% CO2细胞培养箱中孵育2 h。PBS (pH=7.4)洗涤后,将EpH4-Ev用0.2% Triton X-100裂解,裂解液稀释后涂布至LB平板,培养12 h后进行细菌菌落计数,计算细菌的黏附率。
1.9 血清杀菌实验 参照文献[9]的方法,取过夜培养的菌液,分别按1︰100 (V/V)接于5 mL的新鲜LB液体培养基中,37 ℃、200 r/min振荡培养2.5 h后,4 ℃、3000 r/min离心10 min,收集菌体,PBS (pH=7.2)洗涤3次后将沉淀物悬浮,并调节至浓度109 CFU/mL。将5 μL的细菌悬浮液添加到95 μL不同浓度梯度(100%、50%、20%和10%)的大鼠血清中,以60 ℃灭活30 min的大鼠血清(血清浓度为100%)作为阴性对照。将混合物在37 ℃下孵育1 h后,将反应混合物连续稀释10倍,稀释至合适浓度梯度后采用平板计数法进行细菌计数,实验重复3次。
1.10 鞭毛相关基因转录水平检测 参照文献[15-16],选择与细菌鞭毛合成和运动相关的基因motB、filG和filM,以dnaE为内参基因。分别设计引物(表 2),进行实时定量PCR检测,研究yeaI基因缺失对NJ17的鞭毛基因转录水平的影响。将NJ17、NJ17ΔyeaI及cNJ17ΔyeaI于37 ℃静置培养至OD600=1.0,分别取4 mL菌液提取mRNA后反转录为cDNA。
表 2. 实时定量PCR检测引物 Table 2. Real time quantitative PCR detection primers
| Primers | Oligonucleotide sequence (5'→3') | Description | Product size/bp |
| motB-F | CGGCTGCTTATTCACTTCCC | Partial sequence of motB | 159 |
| motB-R | ATCTCCAGCCCAAAAGAGCT | ||
| fliG-F | CAACTTTATGGAGCCACAGAGCG | Partial sequence of fliG | 225 |
| fliG-R | CCGTCGAGCAAGCCATTCAGTAC | ||
| fliM-F | GGCACTGGGCTGGTGGTGTTCTC | Partial sequence of fliM | 260 |
| fliM-R | ATGTCGTTCGGCGAGGTGGTGAT | ||
| dnaE-F | GATTGAGCGTTATGTCGGAGGC | Partial sequence of dnaE | 80 |
| dnaE-R | GCCCCGCAGCCGTGAT |
表选项
以cDNA为模板,实时定量PCR检测体系为20 μL:SYBR Green PCR Master Mix 10 μL,上下游引物各0.8 μL,cDNA模板为2 μL (25 ng)。使用Applied Biosystems? QuantStudio? 5荧光定量PCR仪,并设置反应参数:95 ℃预变性2 min;PCR反应阶段:95 ℃ 15 s;60 ℃ 30 s,40个循环;溶解曲线绘制阶段:95 ℃ 1 s;60 ℃ 1 min;95 ℃ 15 s。使用2–ΔΔCt法计算各菌株基因转录水平差异。
1.11 统计与分析 使用SPSS 19.0软件对数据进行差异性分析,数据以均数±标准差(Mean±SEM)形式表示,进行t检验分析,P < 0.05认为是变化显著。
2 结果和分析 2.1 yeaI缺失株及回复株的构建 yeaI测序结果表明,yeaI的ORF大小为1476 bp,编码491个氨基酸的c-di-GMP合成酶。运用yeaI基因内侧鉴定引物yeaI-IF/yeaI-IR可从野生菌株NJ17扩增出213 bp的产物(图 1-A:泳道1),而从缺失株NJ17-ΔyeaI未扩增出条带(图 1-A:泳道2–4)。运用外侧鉴定引物yeaI-OF/yeaI-OR,从野生菌株扩增出2604 bp的产物(图 1-A:泳道5),而缺失株NJ17ΔyeaI扩增出1682 bp的产物(图 1-A:泳道6–8);运用引物yeaI-IF/yeaI-IR对NJ17及其yeaI基因缺失株和回复株进行PCR鉴定,结果显示,野生株和回复株可以扩增到213 bp的条带(图 1-B:泳道1、3),而缺失株未能扩增到相应条带(图 1-B:泳道2),上述PCR检测结果表明,NJ17的yeaI野生株和回复株构建成功,并分别命名为NJ17ΔyeaI和cNJ17ΔyeaI。
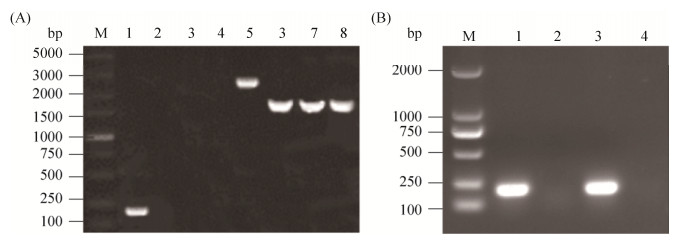 |
| 图 1 PCR鉴定NJ17的yeaI基因缺失株及回复株 Figure 1 Identification of the NJ17ΔyeaI and cNJ17ΔyeaI by PCR. A: Identification of yeaI deletion strain by PCR. M: DL5000; lane 1: PCR identification of wild strain by primers yeaI-IF/yeaI-IR; lanes 2–4: PCR identification of strain NJ17ΔyeaI by primers yeaI-IF/yeaI-IR; lane 5: PCR identification of strain NJ17 by primers yeaI-OF/yeaI-OR; lanes 6–8: PCR identification of strain NJ17ΔyeaI by primers yeaI-OF/yeaI-OR. B: PCR identification of yeaI complementary strain by PCR. M: DL2000; lanes 1–3: PCR identification of strain NJ17, NJ17ΔyeaI and cNJ17ΔyeaI by primers yeaI-IF/yeaI-IR. |
| 图选项 |
2.2 细菌的生长曲线 野生株、缺失株和互补株的生长曲线显示,缺失yeaI不影响NJ17的生长特性(P > 0.05)(图 2)。
 |
| 图 2 各菌株生长曲线测定结果 Figure 2 The growth curves of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. |
| 图选项 |
2.3 yeaI缺失对NJ17生物被膜形成能力的影响 对yeaI缺失株的生物被膜形成能力检测结果显示,与野生株NJ17 (OD595=0.71)相比,缺失株NJ17ΔyeaI (OD595=0.44)生物被膜形成能力显著下降(P < 0.05),而互补株c NJ17ΔyeaI (OD595=0.61)的生物被膜形成能力得到恢复(图 3)。
 |
| 图 3 yeaI野生型和缺失株生物被膜形成能力检测 Figure 3 Biofilm formation of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. *: P < 0.05. |
| 图选项 |
2.4 yeaI缺失影响NJ17菌毛及鞭毛的形成 电镜结果显示所示,与野生株NJ17相比,NJ17ΔyeaI的菌毛更多,但鞭毛长度及数量减少(图 4),表明缺失yeaI影响菌毛及鞭毛的形成。
 |
| 图 4 yeaI野生型和缺失株透射电镜图观察 Figure 4 Transmission electron micrographs of NJ17 and NJ17ΔyeaI. |
| 图选项 |
2.5 yeaI对NJ17的rdar形态影响 在CR平板上,野生株NJ17的菌落形态呈红色、粗糙菌落形态(rdar形态)。与野生株相比,NJ17ΔyeaI菌落形态裂纹增多,而cNJ17ΔyeaI的菌落颜色及裂纹无明显变化(图 5)。
 |
| 图 5 野生株、缺失株及回复株rdar形态观察 Figure 5 Rdar morphotype of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. |
| 图选项 |
2.6 yeaI基因缺失促进NJ17的运动性 对野生株、缺失株和回复株的的运动性检测结果表明,与野生株NJ17和回复株cNJ17ΔyeaI相比,NJ17ΔyeaI运动性显著增加(P < 0.05)(图 6),表明yeaI缺失会显著提高其运动性。
 |
| 图 6 各菌株运动性测定结果 Figure 6 Bacterial motility of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. *: P < 0.05. |
| 图选项 |
2.7 yeaI基因缺失对大肠杆菌NJ17耐药性的影响 根据NCCLS判定标准,头孢曲松对肠杆菌抑菌圈直径≤13 mm为耐药(R)、14–20 mm为中敏(I)和≥21 mm (S)为敏感。通过3次试验,测得NJ17、NJ17ΔyeaI和cNJ17ΔyeaI抑菌圈直径大小分别为(25.86±0.64) mm、(18.46±1.04) mm和(24.75±0.32) mm (表 3),表明yeaI基因缺失使得头孢曲松的耐药性由敏感变为中等敏感,而其他抗生素的耐药性无显著变化。
表 3. 各菌株抗菌活性测定 Table 3. Determination of antibacterial activity of each strain
| Antibacterial drugs | Antibacterial activity (inhibition zone diameter /cm) | ||
| NJ17 | NJ17ΔyeaI | cNJ17ΔyeaI | |
| Ceftriaxone | S | I | S |
| Rifampin | R | R | R |
| Kanamycin | I | I | I |
| Neomycin | I | I | I |
| Enrofloxacin | S | S | S |
| Ampicillin | I | I | I |
| Ciprofloxacin | S | S | S |
| Amoxicillin | I | I | I |
| Cefradine | R | R | R |
| Tetracycline | R | R | R |
| Azithromycin | R | R | R |
| Erythromycin | R | R | R |
| Clindamycin | R | R | R |
| Cefotaxime | R | R | R |
| Florfenicol | S | S | S |
| Spectamycin | R | R | R |
| R: resistence; I: intermediate; S: sensitivity. | |||
表选项
2.8 yeaI缺失对EpH4-Ev的黏附能力的影响 奶牛源大肠杆菌NJ17在MOI=400、200、100、50、25和12.5时对EpH4-Ev的黏附率分别为0.59%、1.22%、3.11%、4.60%、3.73%和3.66%,结果表明MOI=50时,NJ17对EpH4-Ev的黏附率最高,为最适感染复数(图 7-A)。
 |
| 图 7 各菌株对EpH4-Ev黏附率的测定结果 Figure 7 Determination of the adhesion rates of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI to EpH4-Ev. |
| 图选项 |
当感染复数MOI为50时,与野生株相比,yeaI基因缺失后对小鼠乳腺上皮细胞的黏附率无显著性影响(P > 0.05)(图 7-B)。
2.9 yeaI缺失对NJ17抗血清杀菌作用的影响 血清杀菌结果表明NJ17、NJ17ΔyeaI和cNJ17ΔyeaI在灭活大鼠血清中的存活能力无显著性差异(P > 0.05)。但在浓度为100%的未灭活的大鼠血清中,yeaI基因缺失显著增加NJ17ΔyeaI的抗血清杀菌能力(P < 0.05)(图 8)。cNJ17ΔyeaI与NJ17和NJ17ΔyeaI相比,其在不同浓度大鼠血清中的存活细菌数均显著下降(P < 0.05)。
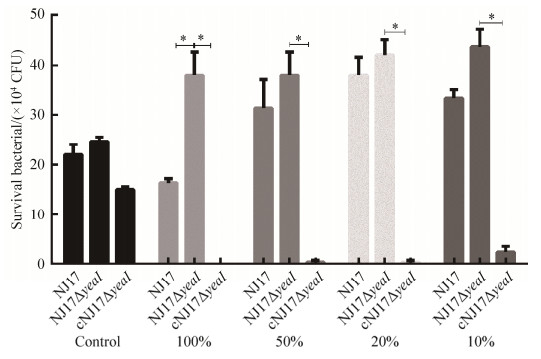 |
| 图 8 各菌株抗大鼠血清杀菌能力的测定结果 Figure 8 Determination of anti-rat serum bactericidal ability of NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. *: P < 0.05. |
| 图选项 |
2.10 yeaI基因缺失影响鞭毛基因转录水平 选择与细菌鞭毛合成和运动相关的基因motB、filG和filM,进行Real-time PCR检测,结果表明,yeaI基因缺失显著提高NJ17的motB和filG的转录水平(P < 0.05),表明yeaI缺失影响其鞭毛和运动性基因转录(图 9)。
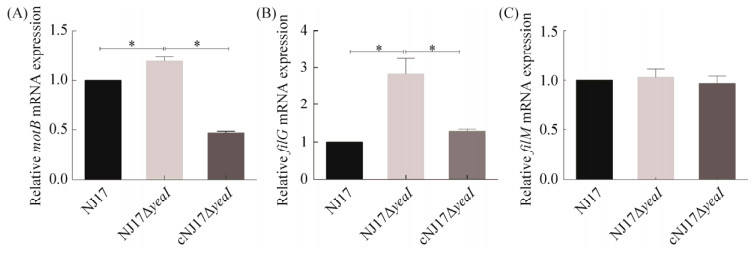 |
| 图 9 鞭毛基因motB、filG和filM的转录水平的测定 Figure 9 Determination of the transcription levels of flagella-related genes motB, filG and filM in NJ17, NJ17ΔyeaI and cNJ17ΔyeaI. *: P < 0.05. |
| 图选项 |
3 讨论 引起奶牛乳腺炎的大肠杆菌谱除涉及共生、环境性大肠杆菌外,还包括肠致病性大肠杆菌(EPEC)等类型[17]。虽然ETEC引起腹泻的致病机制已经得到广泛研究[18],但其作为奶牛乳腺炎致病菌的感染机制却鲜有报道。yeaI编码鸟苷酸酸环化酶(DGC),参与调控大肠杆菌的运动性、生物被膜等生物学特性[6],但yeaI在奶牛源大肠杆菌发挥的调控作用尚不清楚。
本研究结果表明,yeaI缺失对NJ17的生长特性和抗菌活性无显著影响,但影响NJ17ΔyeaI的rdar形态。rdar形态是指形成生物被膜的大肠杆菌在刚果红(CR)琼脂培养基上产生红色、干燥和粗糙的形态。研究表明,curli卷毛阳性的大肠杆菌在CR琼脂培养基上呈现特征性红色、粗糙、表面干燥的菌落形态,不产生curli卷毛的大肠杆菌呈现白色、光滑的菌落形态[19]。本研究结果表明,NJ17在刚果红平板上呈现红色、干燥和粗糙的形态,推测NJ17属于curli菌毛阳性大肠杆菌。此外,yeaI缺失后,在CR培养基上培养48 h后菌落裂纹增多可能与纤维素的合成相关[20],而胞内c-di-GMP的浓度影响纤维素的合成,因此推测yeaI基因通过调控NJ17胞内c-di-GMP水平,进而影响NJ17ΔyeaI的rdar形态。
与大肠杆菌K-12相同[6],NJ17的yeaI基因缺失后会显著增加细菌的运动性,本研究通过Real-time PCR检测结果表明,yeaI基因抑制鞭毛基因的motB和filG的转录水平,推测yeaI可能通过调节与运动性相关的鞭毛蛋白的表达从而改变细菌运动性。互补株与野生型菌株相比运动性显著降低,可能是由于互补菌株采用的pSTV28质粒是低拷贝质粒,与野生型菌株相比,互补菌株的yeaI表达水平更高所致,具体仍需进一步研究。在大肠杆菌CFT073(UPEC)中yeaI基因缺失会显著降低在LB无盐培养基和M9甘油培养基中生物被膜的形成,但是却不影响运动性[8]。因此,yeaI在不同类型的大肠杆菌中可能发挥着不同的作用。此外,本研究结果表明,通过电镜观察NJ17缺失yeaI后,其鞭毛和菌毛形成受到影响,鞭毛和菌毛是影响细菌生物被膜形成的重要因素之一。此外,包括c-di-GMP、群体感应信号分子和LPS等对细菌生物被膜形成具有重要调控作用,特别是胞内c-di-GMP浓度对生物被膜的形成具有重要调控作用,在本研究中yeaI编码c-di-GMP合成酶,推测yeaI缺失后,可通过影响胞内c-di-GMP水平,进而调控细菌的生物被膜形成,具体机制仍有待进一步研究。
血清抵抗能力是大肠杆菌的致病机制之一,本研究中,当大鼠血清浓度为100%时,yeaI缺失会显著增强NJ17的血清抵抗力,推测yeaI缺失可能通过影响NJ17的抗原表位从而不易被血清中的补体识别并清除[9]。此外,与野生株相比,互补菌株在血清中的存活能力显著降低,推测其原因也可能是由于本研究所用pSTV28质粒是低拷贝质粒,在cNJ17ΔyeaI中yeaI的表达水平高于NJ17所致。
本研究初步探讨了yeaI对奶牛源大肠杆菌NJ17生物学特性的影响,可为后续开展由大肠杆菌引起的奶牛乳腺炎研究提供参考。
References
| [1] | Petrovski KR, Trajcev M, Buneski G. A review of the factors affecting the costs of bovine mastitis. Journal of the South African Veterinary Association, 2006, 77(2): 52-60. |
| [2] | Blum SE, Heller ED, Sela S, Elad D, Edery N, Leitner G. Genomic and phenomic study of mammary pathogenic Escherichia coli. PLos ONE, 2015, 10(9): e0136387. DOI:10.1371/journal.pone.0136387 |
| [3] | Hu J, Wang BL, Fang X, Means WJ, McCormick RJ, Gomelsky M, Zhu MJ. c-di-GMP signaling regulates E. coli O157:H7 adhesion to colonic epithelium. Veterinary Microbiology, 2013, 164(3/4): 344-351. |
| [4] | Raterman EL, Shapiro DD, Stevens DJ, Schwartz KJ, Welch RA. Genetic analysis of the role of yfiR in the ability of Escherichia coli CFT073 to control cellular cyclic dimeric GMP levels and to persist in the urinary tract. Infection and Immunity, 2013, 81(9): 3089-3098. DOI:10.1128/IAI.01396-12 |
| [5] | R?mling U, Galperin MY, Gomelsky M. Cyclic di-GMP:the first 25 years of a universal bacterial second messenger. Microbiology and Molecular Biology Reviews, 2013, 77(1): 1-52. |
| [6] | Sanchez-Torres V, Hu HB, Wood TK. GGDEF Proteins YeaI, YedQ, and YfiN reduce early biofilm formation and swimming motility in Escherichia coli. Applied Microbiology and Biotechnology, 2011, 90(2): 651-658. |
| [7] | Povolotsky TL, Hengge R. Genome-based comparison of cyclic di-GMP signaling in pathogenic and commensal Escherichia coli Strains. Journal of Bacteriology, 2015, 198(1): 111-126. |
| [8] | Spurbeck RR, Tarrien RJ, Mobley HLT. Enzymatically active and inactive phosphodiesterases and diguanylate cyclases are involved in regulation of motility or sessility in Escherichia coli CFT073. mBio, 2012, 3(5): e00307-12. |
| [9] | Zuo JK, Tu CT, Wang YL, Qi KZ, Hu JG, Wang ZH, Mi RS, Huang Y, Chen ZG, Han XG. The role of the wzy gene in lipopolysaccharide biosynthesis and pathogenesis of avian pathogenic Escherichia coli. Microbial Pathogenesis, 2019, 127: 296-303. DOI:10.1016/j.micpath.2018.12.021 |
| [10] | Wu XK, Lv XL, Lu JY, Yu SQ, Jin YW, Hu JG, Zuo JK, Mi RS, Huang Y, Qi KZ, Chen ZG, Han XG. The role of the ptsI gene on AI-2 internalization and pathogenesis of avian pathogenic Escherichia coli. Microbial Pathogenesis, 2017, 113: 321-329. DOI:10.1016/j.micpath.2017.10.048 |
| [11] | Hu JG, Zuo JK, Chen ZG, Fu LX, Lv XL, Hu SJ, Shi XC, Jing YW, Wang YL, Wang ZH, Mi RS, Huang Y, Liu DH, Qi KZ, Han XG. Use of a modified bacterial ghost lysis system for the construction of an inactivated avian pathogenic Escherichia coli vaccine candidate. Veterinary Microbiology, 2019, 229: 48-58. DOI:10.1016/j.vetmic.2018.12.020 |
| [12] | Cimdins A, Simm R. Semiquantitative analysis of the red, dry, and rough colony morphology of Salmonella enterica serovar typhimurium and Escherichia coli using congo red//Sauer K. c-di-GMP Signaling: Methods and Protocols. New York: Humana Press, 2017: 225-241. |
| [13] | R?mling U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cellular and Molecular Life Sciences CMLs, 2005, 62(11): 1234-1246. DOI:10.1007/s00018-005-4557-x |
| [14] | Dressaire C, Moreira RN, Barahona S, de Matos APA, Arraiano CM. BolA is a transcriptional switch that turns off motility and turns on biofilm development. mBio, 2015, 6(1): e02352-14. |
| [15] | O'Neill J, Roujeinikova A. Cloning, purification and crystallization of MotB, a stator component of the proton-driven bacterial flagellar motor. Acta Crystallographica Section F Structural Biology and Crystallization Communications, 2008, 64: 561-563. |
| [16] | Croxen MA, Finlay BB. Erratum:molecular mechanisms of Escherichia coli pathogenicity. Nature Reviews Microbiology, 2013, 11(2): 141. DOI:10.1038/nrmicro2953 |
| [17] | Murinda SE, Ibekwe AM, Rodriguez NG, Quiroz KL, Mujica AP, Osmon K. Shiga Toxin-producing Escherichia coli in mastitis:an international perspective. Foodborne Pathogens and Disease, 2019, 16(4): 229-243. DOI:10.1089/fpd.2018.2491 |
| [18] | Pearson JS, Giogha C, Lung TWF, Hartland EL. The genetics of enteropathogenic Escherichia coli virulence. Annual Review of Genetics, 2016, 50: 493-513. DOI:10.1146/annurev-genet-120215-035138 |
| [19] | Cimdins A, Simm R, Li FY, Lüthje P, Thorell K, Sj?ling ?, Brauner A, R?mling U. Alterations of c-di-GMP turnover proteins modulate semi-constitutive rdar biofilm formation in commensal and uropathogenic Escherichia coli. MicrobiologyOpen, 2017, 6(5): e00508. DOI:10.1002/mbo3.508 |
| [20] | Ahmad I, Cimdins A, Beske T, R?mling U. Detailed analysis of c-di-GMP mediated regulation of csgD expression in Salmonella typhimurium. BMC Microbiology, 2017, 17(1): 27. |
