李小媚, 江虹锐, 尹秀华

 , 刘小玲, 李树波
, 刘小玲, 李树波 广西大学轻工与食品工程学院, 广西 南宁 530004
收稿日期:2019-12-17;修回日期:2020-02-29;网络出版日期:2020-03-13
基金项目:广西科技重大专项(桂科AA17204075);广西青年八桂****团队基金;广西自然科学资金(2016GXNSFEA380003);2020年广西研究生教育创新计划项目”(YCSW2020030)
*通信作者:尹秀华,E-mail:hrjiang@gxu.edu.cn.
摘要:[目的] 本研究从北部湾海域光裸方格星虫(Sipunculus nudus)肠道中分离鉴定可培养微生物,并对筛选菌株的代谢物活性进行研究,为后续开发和利用光裸方格星虫肠道微生物代谢产物提供理论支持。[方法] 通过微生物培养、菌株分离纯化和16S rRNA基因序列分析,分析鉴定湛江、北海、防城港三地光裸方格星虫肠道可培养微生物;采用透明圈法、可见分光光度法、平板打孔法等对产胞外活性代谢物的菌株进行筛选和活性分析。[结果] 中国北部湾不同海域光裸方格星虫肠道可培养微生物包括弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、假交替单胞菌属(Pseudoalteromonas)、发光杆菌属(Photobacterium)和芽孢杆菌属(Bacillus)等12个细菌属。弧菌属(Vibrio)是3个地区样本共有的优势菌群。具有产胞外水解蛋白酶、壳聚糖酶、多糖以及抑菌活性等能力的菌株主要来自假交替单胞菌属(Pseudoalteromonas)、发光杆菌属(Photobacterium)和芽孢杆菌属(Bacillus)。[结论] 中国北部湾不同海域光裸方格星虫肠道可培养微生物在属的种类上存在显著性差异,且光裸方格星虫肠道菌株具有产生多种胞外活性代谢物的能力,是一种良好的海洋活性代谢物来源。
关键词:光裸方格星虫可培养微生物胞外活性代谢物
Isolation and identification of cultivable microbes to screen bioactive metabolite producing bacteria from Sipunculus nudus in the Beibu Gulf of China
Xiaomei Li, Hongrui Jiang, Xiuhua Yin

 , Xiaoling Liu, Shubo Li
, Xiaoling Liu, Shubo Li Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004, Guangxi Province, China
Received: 17 December 2019; Revised: 29 February 2020; Published online: 13 March 2020
*Corresponding author: Xiuhua Yin, E-mail:hrjiang@gxu.edu.cn.
Foundation item: Supported by the Guangxi Science and Technology Major Project (AA17204075), by the Guangxi Bagui Youth Scholar Team; Guangxi Natural Science Foundation (2016GXNSFEA380003), and by the Guangxi Postgraduate Education Innovation Plan Project in 2020 (YCSW2020030)
Abstract: [Objective] The present work aims to screen cultivable microbes and bioactive metabolite producing bacteria in the gut of Sipunculus nudus from different areas of Beibu Gulf, so as to provide theoretical support for the subsequent development and utilization of gut microbial metabolites of Sipunculus nudus. [Methods] We isolated cultivable microbes from Zhanjiang, Beihai and Fangchenggang by plate and streak cultivation, and identified those microbes according to 16S rRNA gene sequence analyses. Meanwhile, we investigated the extracellular bioactive metabolites producing bacteria by transparent ring method, visible spectrophotometer and inhibition zone methods. [Results] We successfully screened 12 cultivable microbial genera from the gut of Sipunculus nudus in three Beibu Gulf regions, including Vibrio, Shewanella, Pseudomonas, Photobacterium, Bacillus. Vibrio is the dominant bacterium among the three regions. The strains producing extracellular protease, chitosanase, polysaccharide and bacteriostatic activity were mainly from Pseudomonas, Photobacterium, Bacillus. [Conclusion] There are significant differences on the bacteria genus level among the gut of Sipunculus nudus from different area of Beibu Gulf in China. Meanwhile, the cultivable symbiotic microorganisms of Sipunculus nudus can produce various extracellular active substances, which indicated that Sipunculus nudus is a good source of marine bioactive metabolites.
Keywords: Sipunculus nuduscultivable microbesextracellular active metabolites
海洋微生物是海洋天然生态系统中重要组成成分之一,其与宿主——海洋动植物的关系非常复杂。海洋动植物能为与其共附生的微生物提供有利的生长环境,同时,宿主的共附生微生物能产生各种活性物质促进宿主的生长代谢或者提供化学保护[1]。近年来,海洋微生物多样性以及微生物代谢活性物质的开发与研究越来越受到国内外****的关注。Abdelmohsen等[2]从11个地区的海绵中分离鉴定出18株不同种属的放线菌,其中10株菌具有潜在的抗细菌、抗真菌和抗寄生虫等活性。Jorn等[3]利用宏基因组技术提取Theonella swinhoei海绵组织微生物的总DNA,建立了包含约60000个克隆的宏基因组库,并从文库中筛选到具有抗肿瘤活性的聚酮化合物基因(onnamides和theopederins)。张文姬等[4]利用传统的微生物分离技术方法对大连地区仿刺参肠道可培养微生物种群进行了分析,共分离得到10个种属的细菌,包括假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、芽孢杆菌属(Bacillus)、希瓦氏菌属(Shewanella)、不动杆菌属(Acinetobacter)、发光杆菌属(Photobacterium)等。由于海洋微生物种类繁多,且能产生大量结构新颖并具良好活性的代谢产物,如功能酶、多糖、抑菌多肽等,可应用于医药研究、病害防控、环境保护、化妆品与酶制剂的研发等行业,具有广阔的开发前景和应用价值[5]。
近年来,已有研究对海洋微生物进行分离鉴定并对其代谢物生物活性进行评价。Krishnamurthy等[6]发现海洋粘质沙雷氏菌(Mucous sarreella)代谢物含有体外溶栓作用功能的蛋白酶。Osawa等[7]从流感弧菌(Vzbrio fluvialis)、副溶血性弧菌(V. parahaemolyticus)、拟态弧菌(V. alginolyticus)、溶藻弧菌(V. mimicus)、鳗利斯顿氏菌(Listonella anguillarum)和嗜水性单胞菌(Aeromonas hydrophila)代谢物中鉴定出能专一性降解壳聚糖的壳聚糖酶。Custafson等[8]从海洋细菌中分离得到具有抗病毒、抗肿瘤及细胞毒性的大环内酯类化合物。尹慢慢等[9]从发形霞水母共附生微生物筛出了对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(E. coli)和枯草芽孢杆菌(Bacillus subtilis)生长具有抑制作用的海洋细菌。但是,由于野生菌株活性物质产量低、产量不稳定和生产成本高等原因,海生菌产生的活性物质还没有在工业化生产中得到应用,继续从海洋资源中寻找到更为合适和产活性物质稳定的功能菌株仍然是至关重要的。
光裸方格星虫(Sipunculus nudus),属于星虫科动物,生长繁殖在中国南部近海域,对水质要求极高,存活于干净的海域中,可作为环境洁净的标志物,其体内存在多种活性成分,如多糖、纤溶酶等[10-11]。关于光裸方格星虫附生微生物的研究较少,李小媚等[12]从光裸方格星虫中发现具有纤溶活性的蜡状芽孢杆菌(Bacillus cereus),Fan等[13]从中国海口光裸方格星虫中筛选出对金黄色葡萄球菌(Staphylococcus aureus)具有抑制作用的青霉菌(Penicillium)。光裸方格星虫体内的菌株是否存在能产生其他活性物质还未见报道。本研究拟对来自中国北部湾的湛江、防城港和北海3个地区光裸方格星虫可培养微生物种类进行鉴定,并对其中部分具有代表性菌株进行产胞外水解蛋白酶、壳聚糖酶、多糖及抑菌能力等活性进行筛选和评价。
1 材料和方法 1.1 样品采集 2019年3月16号、3月28号、4月26号分别于广东湛江、广西北海及防城港采集新鲜光裸方格星虫,于海沙保湿送至实验室。采集的光裸方格星虫平均质量(20±2) g,长度(11±0.5) cm。
1.2 试剂 2×Es Taq MasterMix购于康为世纪;壳聚糖、L-酪氨酸购于上海麦克林生物有限公司;Chelex-100树脂购于索莱宝生物科技有限公司,其他试剂均为国产分析纯。
1.3 培养基的配制 采用2216E、高氏Ⅰ号、PDA培养基分别对细菌、放线菌、真菌和酵母进行分离纯化。所有培养基均由经0.22 μm膜过滤后的天然海水配制。
水解蛋白酶初筛培养基由10%的脱脂奶粉(A液)和4%的琼脂(B液)配制而成。将A液、B液分开灭菌,待A液、B液冷却到50 ℃以下进行l:1混合。水解蛋白酶复筛培养基含有0.3%牛肉膏、10%蛋白胨、0.5% NaCl等成分,使用0.5 mol/L的HCl或NaOH调pH 7.5。
壳聚糖酶初筛培养基由A液和B液组成,A液为1%的壳聚糖胶体,B液为0.5% (NH4)2SO4,0.14% K2HPO4,0.06% KH2PO4,0.5% NaCl,0.1% MgSO4·7H2O,0.2%酵母提取物,4.0%琼脂,A液和B液分开灭菌后冷却进行l:1混合。壳聚糖酶复筛培养基为不添加琼脂的初筛培养基。
LB培养基主要由1% NaCl、0.5%酵母提取物、1%蛋白胨组成,经0.5 mol/L的HCl或NaOH调pH 7.5。
1.4 光裸方格星虫肠道可培养微生物的鉴定
1.4.1 样品前处理: 新鲜光裸方格星虫样品用无菌生理盐水清洗样本表面4次,再用75%酒精棉球擦拭星虫表面3次,于无菌条件下取出肠体,按1:2 (W/V)加入0.85% NaCl溶液充分研磨。研磨液经无菌生理盐水按10–1倍进行梯度稀释,选取合适的浓度梯度在微生物分离培养基中涂布培养,25 ℃倒置培养7–9 d,挑取平板中完整的单菌落进行可培养微生物的分离,每组3个平行。
1.4.2 光裸方格星虫肠道可培养微生物分离: 经微生物分离培养基在25 ℃培养条件下对3个地区光裸方格星虫肠道及内容物存在的菌株进行分离纯化。每隔12 h观察培养基上单菌落生长情况,挑取完整的单菌落在相应的分离培养基上划线3–5次,直至整个平板所有菌落的外观形态一致。
1.4.3 16S rRNA基因序列分析: 采用Chelex-100树脂法[14]提取微生物总DNA作为PCR扩增模板。PCR扩增引物采用细菌16S rRNA基因扩增通用引物27F和1492R,扩增条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 5 min。PCR产物用1.0%琼脂糖凝胶电泳检测。菌株测序工作由广西南宁国拓生物科技有限公司完成,使用NCBI的搜索工具BLAST在GenBank数据库进行菌株测序结果的比对。
1.5 产胞外功能酶活性菌株的初筛 根据光裸方格星虫肠道及内容物分离纯化菌株的菌落形态、16S rRNA基因序列分析的微生物种属信息,排除致病微生物,筛选具有代表性的菌株进行胞外代谢物的活性研究。利用LB液体培养基对菌株进行活化培养,产胞外水解蛋白酶、壳聚糖酶的菌株分别使用对应活性的初筛培养基进行筛选。将3 μL活化后的菌液接种于初筛培养基中,26 ℃倒置培养2 d,观察菌苔周边是否出现溶解圈,Scan1200全自动菌落计数仪(购于Interscience公司)测量溶解圈直径(D)和菌落直径(d),计算D/d值(K),每株菌做3组平行实验。选取溶解圈K≥2的菌株进行复筛并测定其代谢物酶活。
1.6 产胞外水解蛋白酶菌株的筛选及活力测定 初筛后的菌株经LB液体培养基活化后,当菌液OD600值达到3.9左右时(菌株生长对数期),将种子液按照4%接种量移入水解蛋白酶复筛培养基中,于26 ℃进行摇瓶发酵72 h后,发酵液经10000 r/min离心15 min,取上清。菌株发酵上清液分别在pH 3.5、pH 7.0和pH 10.0下与1%酪蛋白溶液于40 ℃反应20 min,按照福林酚法[15]测定菌株胞外代谢物水解蛋白酶酶活,以经三氯乙酸变性的酶液为空白对照。测定10、20、40、60、80、100 μg/mL L-酪氨酸标准品在680 nm处的吸光度值,建立蛋白酶酶活力标准曲线y=0.0056x–0.0018 (R2=0.9985)。菌株胞外代谢物水解蛋白酶酶活力定义为:每毫升发酵液在40 ℃时与不同pH条件下水解酪蛋白产生1 μg酪氨酸的酶量为一个活力单位(U)。
1.7 产胞外壳聚糖酶菌株的筛选及活力测定 初筛后的菌株经LB液体培养基活化后,当菌液OD600值达到3.9左右时,按照4%接种量移入壳聚糖酶复筛培养基中,于26 ℃条件下进行摇瓶发酵72 h后,发酵液经10000 r/min离心15 min,取上清。菌株发酵上清液在pH 6.0条件下与1%壳聚糖胶体溶液于40 ℃反应20 min,按照DNS法[16]测定产胞外壳聚糖酶菌株代谢物酶活,以底物和缓冲液作为空白对照。于520 nm处测定0.928、1.855、2.783、3.710、4.638、5.565、6.493 μmol/mL浓度的氨基葡萄糖吸光度值,建立壳聚糖酶酶活力标准曲线y=0.0891x–0.0247 (R2=0.9932)。菌株代谢物壳聚糖酶酶活力定义为:每毫升发酵液在37 ℃、pH 6.0条件下每分钟产生1 μmol还原糖所需的酶量为一个活力单位(U)。
1.8 产胞外多糖活性菌株筛选 菌株接种至LB培养基,于26 ℃、200 r/min发酵72 h,发酵液经10000 r/min、10 min离心去除菌体沉淀,取出10 mL上清液加入3倍体积的乙醇混匀,置于4 ℃条件下静置过夜,经10000 r/min、10 min离心,弃上清。采用硫酸-苯酚法[17]测定发酵液中多糖的含量,收集沉淀物,加入5.0 mL蒸馏水溶解后,分别移取0.8、1.2、1.4 mL三个样品体积,测定多糖含量,以未加入发酵液的试管作为空白对照。通过测定0.040、0.060、0.080、0.100、0.120、0.140 mg恒重后的葡萄糖在490 nm处吸光度值,建立多糖含量标准曲线y=1.0789x–0.0004 (R2=0.9936)。样品吸光度值代入标准曲线中得出多糖含量。每个体积的样品做3组平行,按照各体积样品计算出的多糖含量求均值即为每株菌单位体积发酵代谢物的多糖浓度。
1.9 菌株胞外代谢物对大肠杆菌的抑菌作用 菌株接种至LB培养基,于26 ℃、200 r/min发酵72 h,发酵液经10000 r/min、10 min离心去除菌体,收集上清液进行冷冻干燥,冻干物用0.85%生理盐水复溶为10 mg/mL溶液。以大肠杆菌作为指示菌,采用平板打孔法评价菌株代谢物对大肠杆菌的抑菌效果,每孔加入50 μL发酵液冻干复溶物,每菌株3个平行组。
1.10 产胞外纤溶酶菌株筛选 血栓是一种栓塞性疾病,其主要成分为纤维蛋白。选取蛋白酶初筛结果K值最大的三株菌进行产纤溶酶菌株筛选,采用纤维蛋白板法测定发酵液纤溶酶酶活[12],粗酶液在纤维蛋白板中形成的溶解圈越大,说明其溶栓能力越强,以尿激酶为阳性对照,生理盐水为阴性对照。
2 结果和分析 2.1 光裸方格星虫可培养细菌的鉴定 从湛江、北海、防城港3个地区采集的光裸方格星虫肠道中分离纯化得到153株细菌,未获得可培养的真菌、霉菌、酵母菌等其他菌株,其中北海光裸方格星虫分离鉴定出38株细菌,防城港光裸方格星虫分离鉴定出37株细菌,湛江光裸方格星虫则为78株细菌。经测序比对,所有菌株的16S rRNA序列相似性分布在97%–100%。所分离菌株分布于12个菌属,包括弧菌属(Vibrio)、发光杆菌(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)、希瓦氏菌属(Shewanella)、芽孢杆菌(Bacillus)、葡萄球菌属(Staphylococcus)、乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)、节杆菌属(Arthrobacter)、短杆菌属(Brevibacterium)、环丝菌属(Brochothrix)、变形菌属(Proteus),优势菌群为弧菌属(Vibrio)。北部湾海域3个地区光裸方格星虫肠道可培养微生物组成如表 1所示。根据目前已有关于海洋微生物产胞外活性代谢物的研究和菌株的安全性,分别选取5株发光杆菌属(Photobacterium) BE3、BE4、BE6、BE21、BE22;6株假交替单胞菌属(Pseudoalteromonas) BE5、BE7、BE14、BE17、BE25、BT3;1株芽孢杆菌属(Bacillus) BE36;4株乳球菌属(Lactococcus) FT2、FT13、FT6、FT9;1株短杆菌属(Brevibacterium) FM3;共5个细菌属的17株代表性菌株(表 2)进行产胞外水解蛋白酶、壳聚糖酶、多糖和抑菌活性物质等菌株的筛选及其活性研究。
表 1. 北部湾地区的光裸方格星虫肠道可培养微生物 Table 1. The cultivable microorganisms in intestine of Sipunculus nudus from Beibu Gulf area
| Bacterium | Zhanjiang (ZH) | Beihai (BH) | Fangchenggang (FCG) |
| Vibrio | 50 | 19 | 24 |
| Photobacterium | – | 5 | – |
| Pseudoalteromonas | – | 6 | – |
| Shewanella | 5 | 1 | 4 |
| Bacillus | 17 | 7 | – |
| Staphylococcus | – | – | 2 |
| Lactococcus | – | – | 4 |
| Acinetobacter | 3 | – | 1 |
| Arthrobacter | – | – | 1 |
| Brevibacterium | – | – | 1 |
| Brochothrix | 2 | – | – |
| Proteus | 1 | – | – |
| Total | 78 | 38 | 37 |
| –: under the detection limit. | |||
表选项
表 2. 来自北部湾海域光裸方格星虫的17株代表菌株种属信息 Table 2. The species information about 17 representative strains of Sipunculus nudus from Beibu Gulf area
| Nearest neighbor of partial 16S rRNA sequence | GenBank accession number | Strain number | Similarity/% |
| Photobacterium swingsii | HE584767 | BE3, BE4, BE6, BE21 | 99.00–100.00 |
| Photobacterium sp. 04104 | AM422803 | BE22 | 99.86 |
| Pseudoalteromonas mariniglutinosa strain WAB2206 | MH169260 | BE5, BE14 | 99.00–100.00 |
| Pseudoalteromonas sp. VS-2 | FJ497709 | BE7, BT3 | 100.00 |
| Pseudoalteromonas sp. R5 | KM054692 | BE17 | 99.93 |
| Pseudoalteromonas sp. OC-5 | AY669166 | BE25 | 97.94 |
| Bacillus velezensis strain LGB12 | KY962352 | BE36 | 99.41 |
| Lactococcus garvieae JRC-LG3 | LC377166 | FT2, FT6, FT9 | 99.00–100.00 |
| Lactococcus garvieae strain ICMP 20896 | MG786414 | FT13 | 99.93 |
| Brevibacterium sp. strain BS258 | KU883150 | FM3 | 98.55 |
表选项
2.2 产胞外水解蛋白酶活性菌株筛选 通过脱脂乳平板进行产水解蛋白酶菌株的初筛,发现有10株菌具有水解蛋白酶活性,包括发光杆菌属(Photobacterium) BE3、BE6、BE21、BE22,假交替单胞菌属(Pseudoalteromonas) BE17、BE25、BT3,乳球菌属(Lactococcus) FT6、FT13,芽孢杆菌属(Bacillus) BE36。将脱脂乳平板初筛结果K≥2的菌株进行发酵培养,其中BE36的K值最大(K=2.25),如图 1-A所示,并采用福林酚法[15]对K≥2的菌株发酵液的酸性、中性和碱性水解蛋白酶酶活进行测定,获得产酸性水解蛋白酶、中性水解蛋白酶、碱性水解蛋白酶活力最高的菌株分别为FT13 (1.787 U/mL)、BT3 (17.325 U/mL)、BE36 (12.477 U/mL) (表 3)。
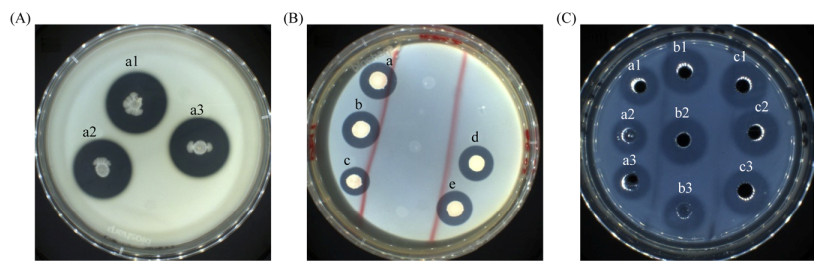 |
| 图 1 产胞外水解功能酶菌株的筛选 Figure 1 The results of screening of partial isolates with extracellular hydrolytic enzyme activity. A: screening of extracellular proteases, a1, a2 and a3 are three parallel samples of BE36. B: screening of extracellular chitosanase, a, b, c, d and e are dissolving rings for BE17, BT3, BE36, BE6, BE14, respectively. C: screening of strains producing fibrinolytic enzyme, a1, a2 and a3 are three parallel samples of FT13 strain, b1, b2 and b3 are three parallel samples of BE36 strain, c1, c2 and c3 are three parallel samples of BT3 strain. |
| 图选项 |
表 3. 产胞外代谢活性物质菌株的筛选结果(平均值±标准误) Table 3. Screening of strains producing extracellular active metabolites (mean±standard errors)
| Strain number | Acid protease activity/(U/mL) | Neutral protease activity/(U/mL) | Alkaline protease activity/(U/mL) | Polysaccharide/ (mg/mL) | Chitosanase enzyme activity/(U/mL) | Antibacterial activity/mm | Fibrinolytic enzyme/(U/mL) |
| BT3 | – | 17.325±0.539b | 9.042±1.102c | 0.101±0.04a | 0.062±0.009c | – | 514.8±8.56a |
| BE36 | 1.117±0.299ab | 16.816±1.721b | 12.477±1.561b | – | 0.041±0.011b | 15±0.721b | 583.14±2.04b |
| FT13 | 1.787±0.770b | 4.346±1.440a | 2.790±0.847a | – | ND | 15.133±0.231b | 161.8±10.55c |
| BE5 | ND | ND | ND | 0.153±0.04b | ND | – | ND |
| BE25 | ND | ND | ND | 0.153±0.02 c | 0.037±0.019d | – | ND |
| BE6 | ND | ND | ND | – | 0.040±0.006b | 19.767±0.416c | ND |
| BE14 | ND | ND | ND | – | 0.003±0.0004a | – | ND |
| BE17 | ND | ND | ND | – | 0.076±0.008cd | – | ND |
| BE7 | ND | ND | ND | – | ND | 13.133±1.551a | ND |
| BE3 | ND | ND | ND | – | ND | – | ND |
| BE4 | ND | ND | ND | – | ND | – | ND |
| BE21 | ND | ND | ND | – | ND | – | ND |
| BE22 | ND | ND | ND | – | ND | – | ND |
| FT2 | ND | ND | ND | – | ND | – | ND |
| FT6 FT9 | ND ND | ND ND | ND ND | – – | ND ND | – – | ND ND |
| FM3 | ND | ND | ND | – | ND | – | ND |
| a, b, c, and d represent significant differences between data of the same column and different rows (P < 0.05); ND: the dissolving ring value of the initial screening strain is negligible (K < 2), therefore the activity of metabolite is not determined; –: under the detection limit. | |||||||
表选项
2.3 产胞外多糖活性菌株筛选 方格星虫肠道筛选菌经LB液体培养基发酵后采用硫酸-苯酚法[17]测定17株细菌上清液的多糖含量。共获得三株菌的胞外代谢物多糖含量达到0.1 mg/mL以上,其中假交替单胞菌属(Pseudoalteromonas) BE5、BE25发酵上清液多糖浓度超过0.15 mg/mL (表 3)。
2.4 产胞外壳聚糖酶活性菌株筛选 通过壳聚糖酶活性初筛与DNS法[16]复筛相结合的方法对菌株进行产胞外壳聚糖酶的筛选,获得6株菌具有明显的壳聚糖酶透明溶解圈且K≥2 (图 1-B),分别为发光杆菌属(Photobacterium) BE6,假交替单胞菌属(Pseudoalteromonas) BE17、BE25、BT3、BE14,芽孢杆菌属(Bacillus) BE36。在菌株发酵粗酶液与1%壳聚糖胶体溶液反应时,BE17产壳聚糖酶能力最强,为0.076 U/mL (表 3)。
2.5 胞外抑菌代谢物生产菌的筛选 以大肠杆菌作为指示菌,将光裸方格星虫肠道筛选菌经LB液体培养基发酵、离心、收集到的上清液经冷冻干燥后复溶,初步探究菌株发酵液是否具有抑菌活性。获得3株菌的代谢产物具有显著的抑菌活性,发光杆菌属(Photobacterium) BE6产生的抑菌圈直径达到19.767 mm,其他两株菌乳球菌属(Lactococcus) FT13和芽孢杆菌属(Bacillus) BE36抑菌圈直径则较BE6低,分别为15.133 mm、15 mm (表 3)。
2.6 产胞外纤溶酶菌株筛选 对脱脂乳平板溶解圈直径比值K值最大的3株假交替单胞菌属(Pseudoalteromonas) BT3、芽孢杆菌属(Bacillus) BE36、乳球菌属(Lactococcus) FT13进行具有纤溶作用的蛋白酶菌株筛选,采用纤维蛋白板测定纤溶活力(相当于尿激酶活力),获得3株菌具有明显的纤维蛋白板溶解能力(图 1-C)。其中,BT3和BE36纤溶酶活力均超过500 U/mL,而FT13仅有161.8 U/mL (表 3)。
3 讨论 3.1 中国北部湾地区光裸方格星虫可培养细菌的分离鉴定 本研究结果表明,不同地区来源光裸方格星虫肠道微生物的种类存在一定的共性和差异性,3个地区的星虫共分离鉴定153株细菌,包括12个细菌属。其中,从北海光裸方格星虫肠道鉴定出的可培养微生物有弧菌属(Vibrio)、发光杆菌属(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)、希瓦氏菌属(Shewanella)、芽孢杆菌属(Bacillus)等5个细菌属;从湛江光裸方格星虫肠道鉴定出的有弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、短杆菌属(Brevibacterium)、变形菌属(Proteus) 6个细菌属;从防城港的北海光裸方格星虫肠道鉴定出的有弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、葡萄球菌属(Staphylococcus)、乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)、节杆菌属(Arthrobacter)、短杆菌属(Brevibacterium) 7个细菌属。3个地区光裸方格星虫肠道可培养微生物中共有的细菌种属为弧菌属(Vibrio)和希瓦氏菌属(Shewanella),弧菌属(Vibrio)是3个地区最大的优势菌群。北海和湛江的光裸方格星虫肠道中的第二优势菌群为芽孢杆菌属(Bacillus),但防城港的样本并未筛到该菌属,这可能是因为不同地区来源的光裸方星虫生长环境不同,从而导致了肠道微生物种群结构不相同。在已有的报道中,来自湛江的的光裸方格星虫微生物菌群包括Nitratireductor、Pseudomonas、Bacillus等10多个属的菌[18]。而本研究湛江光裸方格星虫肠道微生物6个属中,仅有Bacillus、Pseudomonas与该报道相同,这可能与样品微生物可培养性有关。张文姬等[4]从大连仿刺参肠道得到的可培养微生物种类包括假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、芽孢杆菌属(Bacillus)、希瓦氏菌属(Shewanella)和假交替单胞菌属(Pseudoalteromonas)等10个细菌属。该报道中的菌属种类与本研究从光裸方格星虫肠道中得到的可培养微生物种类较为接近。Fan等[13]从中国海口光裸方格星虫中筛选出产萜类化合物的青霉菌,但在本研究中并未筛选到青霉菌,这可能与样品采集的地点和时间差异等环境因素、分离培养基种类和培养条件有关[17]。本研究首次系统地探究北部湾不同地区来源的光裸方格星虫可培养微生物种类,结果说明北部湾海域光裸方格星虫可培养微生物是良好的微生物来源,可为光裸方格星虫肠道微生物的理论和应用研究提供理论基础。
3.2 产胞外蛋白酶菌株的筛选及活力测定 筛选得到的光裸方格星虫肠道产水解蛋白酶菌株主要为芽孢杆菌属(Bacillus)、发光杆菌属(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)及乳球菌属(Lactococcus),其中假交替单胞菌属(Pseudoalteromonas) BT3产生的中性蛋白酶活为17.325 U/mL,芽孢杆菌属(Bacillus) BE36产生的碱性蛋白酶酶活为12.477 U/mL。这与目前已报道的产蛋白酶海洋微生物种属是一致的[19-20]。Bairagi等[21]从鱼肠道筛选得到的10株菌蛋白酶活范围1.6–23.8 U/mL。王福强等[22]从一种牙鲆肠道中分离出了25株产蛋白酶细菌,30 ℃时有4株菌的酶活力范围为2.19–4.47 U/mL。本研究对筛选自光裸方格星虫肠道产酶微生物产水解蛋白酶活性进行测定发现,BT3和BE36两株菌的碱性水解蛋白酶和中性水解蛋白酶活力介于上述两者报道之间。
3.3 产胞外多糖菌株的筛选 本研究发现光裸方格星虫肠道产胞外多糖菌株主要为发光杆菌和假交替单胞菌,其中发光杆菌属(Photobacterium) BE5、BE25发酵液多糖浓度达到0.15 mg/mL。刘天华等[23]从威海近海分离筛选得一株具有产胞外多糖能力的假交替单胞菌(Pseudoalteromonas),经过培养基优化发酵上清液多糖最高可达到1.62 mg/mL。与上述报道相比,本研究所筛选的野生菌株产胞外多糖能力较弱,后续可通过如培养基优化、紫外诱变等方法提高菌株产多糖能力。
3.4 产胞外壳聚糖酶菌株的筛选及活力测定 近年来产壳聚糖酶海洋微生物的筛选报道较多,野生菌株的酶活范围广。本研究采用DNS法对光裸方格星虫肠道菌株进行产胞外壳聚糖酶的筛选,发现假交替单胞菌(Pseudoalteromonas) BE17产胞外壳聚糖能力最强(0.076 U/mL),该菌酶活高于来自鲜活的中华乌塘體、矛尾复虫下虎鱼以及养虾场的菌株酶活(0.03–0.06 U/mL)[24]。李剑峰等[25]从沙塘泥底中分离到1株高产壳聚糖酶的菌株QY01,初始酶活为1.38 U/mL,经过优化发酵培养基后,酶活提高近1倍。光裸方格星虫肠道细菌可通过优化培养条件提高产胞外壳聚糖酶能力。
3.5 胞外抑菌代谢物生产菌的筛选 以大肠杆菌为指示菌,探究所筛菌株胞外代谢物的抑菌作用。从研究结果可知,发光杆菌属(Photobacterium) BE6胞外代谢物抑制大肠杆菌生长活性最强,抑菌圈直径为19.767 mm。目前鲜有报道表明发光杆菌属发酵代谢物具有抑菌活性。筛选出的假交替单胞菌(Pseudoalteromonas) BE7和芽孢杆菌属(Bacillus) BE36具有抑菌活性与现有关于假交替单胞菌属与芽孢菌属代谢物抑菌研究报道相一致[9, 26]。
3.6 产胞外纤溶酶菌株筛选 从方格星虫肠道中筛选得到芽孢杆菌属(Bacillus) BE36、乳球菌属(Lactococcus) FT13、假交替单胞菌属(Pseudoalteromonas) BT3的酶活范围为100–600 U/mL,其中,BE36纤溶酶活力最高(583.14 U/mL)。李占强等[27]从海绵微生物、深海微生物中筛选出30株纤溶活性较好的菌株,其中一株芽孢杆菌活性为258 U/mL,低于本研究获得的菌株活性。菌株BT3和BE36纤溶酶活力均超过500 U/mL,属于产纤溶酶能力强的野生菌株。
4 结论 本研究以北部湾的防城港、北海、湛江3个地区采集新鲜光裸方格星虫为样本,鉴定出肠道可培养细菌153株,包括弧菌属(Vibrio)、发光杆菌属(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)、希瓦氏菌属(Shewanella)、芽孢杆菌属(Bacillus)等12个细菌属。三地共有的优势菌群为弧菌属(Vibrio),防城港光裸方格星虫肠道微生物种类多于其他2个地区。对发光杆菌属(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)、芽孢杆菌属(Bacillus)、乳球菌属(Lactococcus)、短杆菌属(Brevibacterium)中的17株代表性菌株产胞外水解蛋白酶、壳聚糖酶、多糖、抑菌活性及纤溶酶活性评价,发现具有较高功能活性代谢物菌株是发光杆菌属(Photobacterium)、假交替单胞菌属(Pseudoalteromonas)、芽孢杆菌属(Bacillus)。从中国北部湾星虫肠道中分离出来的菌株产胞外代谢物活性物质种类多,是海洋微生物产胞外活性代谢物的良好菌株来源。芽孢杆菌属(Bacillus) BE36胞外代谢物有水解蛋白酶、壳聚糖酶、大肠杆菌抑制作用等活性成分,并具有较强的产纤溶酶活性,后续可对该菌株进行产纤溶酶机制进行研究,可通过生物信息手段从基因表达水平上揭示该菌株表达产胞外纤溶酶的关键基因,可为构建高产纤溶酶工程菌株提供理论依据。此外,本研究发现发光杆菌属(Photobacterium) BE6胞外代谢物具有很强的抑制大肠杆菌生长活性,目前关于发光杆菌代谢物抑菌活性报道较少,今后可继续探究该菌株抑制其他微生物生长的能力,为研究开发海洋新型抗菌药物提供新的菌株来源。
本文揭示了北部湾不同海域光裸方格星虫肠道可培养微生物种类及活性代谢物产生菌的筛选,可为今后利用方格星虫肠道微生物产活性物质提供数据基础和理论参考。
References
| [1] | Fenical W. Chemical studies of marine bacteria:developing a new resource. Chemical Reviews, 1993, 93(5): 1673-1683. DOI:10.1021/cr00021a001 |
| [2] | Abdelmohsen UR, Pimentel-Elardo SM, Hanora A, Radwan M, Abou-El-Ela SH, Ahmed S, Hentschel U. Isolation, phylogenetic analysis and anti-infective activity screening of marine sponge-associated actinomycetes. Marine Drugs, 2010, 8(3): 399-412. DOI:10.3390/md8030399 |
| [3] | Piel J, Hui DQ, Wen GP, Butzke D, Platzer M, Fusetani N, Matsunaga S. Antitumor polyketide biosynthesis by an uncultivated bacterial symbiont of the marine sponge Theonella swinhoei. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(46): 16222-16227. DOI:10.1073/pnas.0405976101 |
| [4] | Zhang WJ, Hou HM, Zhang GL, Li YQ, Du CM. Study on diversity of intestine cultivable microorganisms from Apostichopus japonicus. Science and Technology of Food Industry, 2011, 32(9): 149-151, 155. (in Chinese) 张文姬, 侯红漫, 张公亮, 李琴艳, 杜晨萌. 仿刺参肠道可培养微生物多样性研究. 食品工业科技, 2011, 32(9): 149-151, 155. |
| [5] | Jaiganesh R, Kumar NSS. Marine bacterial sources of bioactive compounds. Advances in Food and Nutrition Research, 2012, 65: 389-408. DOI:10.1016/B978-0-12-416003-3.00025-1 |
| [6] | Krishnamurthy A, Belur PD. A novel fibrinolytic serine metalloprotease from the marine Serratia marcescens subsp. sakuensis:purification and characterization. International Journal of Biological Macromolecules, 2018, 112: 110-118. DOI:10.1016/j.ijbiomac.2018.01.129 |
| [7] | Osawa R, Koga T. An investigation of aquatic bacteria capable of utilizing chitin as the sole source of nutrients. Letters in Applied Microbiology, 1995, 21(5): 288-291. DOI:10.1111/j.1472-765X.1995.tb01062.x |
| [8] | Dong ZF, Li XP, Qin S, Zeng CK. Genetic engineering and marine drug research. Marine Sciences, 1998(1): 16-20. (in Chinese) 董志峰, 李新萍, 秦松, 曾呈奎. 基因工程与海洋药物研究. 海洋科学, 1998(1): 16-20. |
| [9] | Yin MM, Xu F, Xiao L, Wang QQ, Zheng JM, Zhang LM. Isolation and identification of the symbiotic and epiphytic microorganisms from the jellyfish Cyanea capillata and antibacterial activities of their fermentation broths. Chinese Journal of Marine Drugs, 2014, 33(1): 31-39. (in Chinese) 尹慢慢, 徐凤, 肖良, 王倩倩, 郑杰民, 张黎明. 发形霞水母共附生微生物的分离鉴定及其发酵液的抑菌活性研究. 中国海洋药物, 2014, 33(1): 31-39. |
| [10] | Zhang GH, Zhao MM, Wang W. Isolation, purification and property identification of polysaccharide contained in Sipunculus nudus. Journal of Food Science and Biotechnology, 2006, 25(4): 63-66. (in Chinese) 张桂和, 赵谋明, 王炜. 方格星虫多糖分离纯化及性质鉴定. 食品与生物技术学报, 2006, 25(4): 63-66. |
| [11] | Ge YH, Chen YY, Zhou GS, Liu X, Tang YP, Liu R, Liu P, Li N, Yang J, Wang J, Yue SJ, Zhou HP, Duan JA. A novel antithrombotic protease from marine worm Sipunculus nudus. International Journal of Molecular Sciences, 2018, 19(10): 3023. DOI:10.3390/ijms19103023 |
| [12] | Li XM, Zhou ZH, Yin XH, Jiang HR, Liu XL. Dentification of bacillus cereus strain producing fibrinolytic enzyme from Sipunculus nudus. Biotechnology Bulletin, 2019, 35(7): 70-75. (in Chinese) 李小媚, 周宗慧, 尹秀华, 江虹锐, 刘小玲. 来自光裸方格星虫产纤溶酶蜡状芽孢杆菌的鉴定. 生物技术通报, 2019, 35(7): 70-75. |
| [13] | Kong FD, Ma QY, Huang SZ, Wang P, Wang JF, Zhou LM, Yuan JZ, Dai HF, Zhao YX. Chrodrimanins K?N and related meroterpenoids from the fungus Penicillium sp. SCS-KFD09 Isolated from a marine worm, Sipunculus nudus. Journal of Natural Products, 2017, 80(4): 1039-1047. DOI:10.1021/acs.jnatprod.6b01061 |
| [14] | Yao G, Hu HY, Liang H, Zhang JP. Rapid extraction of genomic DNA from gram-positive bacilli by Chelex-100 method. Contemporary Medicine, 2013, 19(25): 15-17. (in Chinese) 姚纲, 胡红焱, 梁慧, 张健鹏. Chelex-100法快速提取革兰氏阳性杆菌基因组DNA. 当代医学, 2013, 19(25): 15-17. |
| [15] | Quan SJ, Ma H, Liu DH, Xie FH. Screening and enzymatic properties of cold-active protease marine strain. Henan Science, 2017, 35(1): 78-82. (in Chinese) 权淑静, 马焕, 刘德海, 解复红. 产低温蛋白酶海洋菌筛选、鉴定及性质的初步研究. 河南科学, 2017, 35(1): 78-82. |
| [16] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [17] | Zhang Y, Luan XH. Screening of marine bacteria producing exopolysaccharide from sea coast. Modern Fisheries Information, 2010, 25(4): 13-17. (in Chinese) 张云, 栾小惠. 产胞外多糖的近海海洋细菌的筛选. 现代渔业信息, 2010, 25(4): 13-17. |
| [18] | Ouyang YC, Chen FL, Sun CB, Zhou JZ. Study on the diversity of bacteria from peanut worm (Sipunculus nudus). Guangdong Agricultural Sciences, 2019, 39(21): 178-181. (in Chinese) 欧阳永长, 陈富霖, 孙朝波, 周家柱. 方格星虫共附生微生物多样性的初步研究. 广东农业科学, 2019, 39(21): 178-181. |
| [19] | Guo QL, Yang SX, Zhao J, Zeng RY. Screening and characterization of protease from metagenomic library of deep sea sediment. Journal of Applied & Environmental Biology, 2009, 15(4): 507-510. (in Chinese) 郭巧玲, 杨祥胜, 赵晶, 曾润颖. 深海沉积物宏基因组文库中产蛋白酶克隆的筛选及性质分析. 应用与环境生物学报, 2009, 15(4): 507-510. |
| [20] | Niu CH, Gao Y, Li YQ, Wang CY, Wang JH. Selection of high protease-producing strain of Bacillus subtilis by UV mutation. China Brewing, 2011(12): 67-69. (in Chinese) 牛春华, 高岩, 李玉秋, 王成业, 王景会. 紫外诱变选育高产蛋白酶枯草芽孢杆菌. 中国酿造, 2011(12): 67-69. |
| [21] | Bairagi A, Ghosh KS, Sen SK, Ray A K. Enzyme Producing bacterial flora isolated from fish digestive tracts. Aquaculture International, 2002, 10(2): 109-121. DOI:10.1023/A:1021355406412 |
| [22] | Wang FQ, Chen Y, Shao ZT, Guo YM. Isolation and screening of bacteria produced proteinase from gastrointestinal tract of flounder. Chinese Journal of Microecology, 2004, 16(5): 259-262. (in Chinese) 王福强, 陈营, 邵占涛, 呙于明. 牙鲆肠道内产蛋白酶菌的分离与筛选. 中国微生态学杂志, 2004, 16(5): 259-262. |
| [23] | Liu TH, Qiao M, Li LL, Xie F, Du ZJ. Optimization of fermentation conditions for exocellular polysaccharide by marine bacterium 0417. China Brewing, 2011(6): 107-110. (in Chinese) 刘天华, 乔梦, 李乐乐, 解斐, 杜宗军. 海洋细菌0417产胞外多糖发酵条件的优化. 中国酿造, 2011(6): 107-110. |
| [24] | 戴秋萍. 产壳聚糖酶海洋微生物菌株的筛选鉴定、发酵产酶条件和酶解产物性能研究. 浙江大学硕士学位论文, 2012. |
| [25] | Li JF, Liu BF, Hong SB, Sun SS, Ye XQ. Screening of a chitosan-hydrolytic bacterium and optimazation of its fermentation conditions. Journal of Hydroecology, 2010, 3(3): 127-131. (in Chinese) 李剑峰, 刘必谦, 洪松柏, 孙双双, 叶夏青. 高产壳聚糖酶菌株的筛选及其产酶条件的优化. 水生态学杂志, 2010, 3(3): 127-131. |
| [26] | Qin Y, Wang W, Guo BJ, Wang XC, Zhang WJ, Zhou X, Wang XL. Study on Bacillus subtilis Strains Q4 and Q10 Inhibiting the Growth of E. coli and Salmonella in vitro. China Animal Husbandry & Veterinary Medicine, 2014, 41(1): 207-210. (in Chinese) 秦瑶, 王苇, 郭秉娇, 王熙楚, 张文举, 周霞, 王晓兰. 2株枯草芽孢杆菌对大肠杆菌和沙门氏菌的体外抑菌试验研究. 中国畜牧兽医, 2014, 41(1): 207-210. |
| [27] | Li ZQ, Hu JC, Pan HQ, Wang SJ. Screening and identification of fibrinolytic enzyme producing marine bacterium B5815. Journal of Microbiology, 2009, 29(6): 41-44. (in Chinese) 李占强, 胡江春, 潘华奇, 王书锦. 产纤溶酶海洋微生物B5815菌株的筛选及鉴定. 微生物学杂志, 2009, 29(6): 41-44. |
