高侃, 慕春龙, 朱伟云


动物消化道营养国家级国际联合研究中心, 江苏省消化道营养与动物健康重点实验室, 南京农业大学消化道微生物研究室, 江苏 南京 210095
收稿日期:2018-08-17;修回日期:2018-12-03;网络出版日期:2019-01-03
基金项目:国家自然科学基金(31430082);国家重点基础研究发展计划(973项目)(2013CB127300)
作者简介:朱伟云,博士,南京农业大学动物科技学院教授、博导。毕业于英国阿伯丁大学,国家****科学基金获得者,国家重点基础研究发展计划(973)项目首席科学家。现任国家动物消化道营养国际联合研究中心主任,中国畜牧兽医学会动物营养分会理事长,国际反刍动物生理学国际咨询委员会委员,动物营养学国家重点实验室学术委员会委员,江苏省消化道营养与动物健康重点实验室主任和动物营养分会消化道微生物专业委员会主任。主要研究领域为动物消化道微生物与功能、单胃动物营养等,围绕“动物消化道微生物与宿主营养代谢互作”开展工作,已发表学术论文100余篇,全面解析了猪消化道微生物菌群时空变化规律,揭示了消化道微生物对营养素的响应规律、肠道微生物代谢主要营养素的特征,阐明了肠道微生物影响机体营养素利用的机制.
*通信作者:朱伟云, Tel:+86-25-84395523, E-mail: zhuweiyun@njau.edu.cn.
摘要:肠道微生物群能够调节宿主肠道稳态,同时参与调节宿主神经系统功能和行为。肠道菌群失调可能导致宿主神经系统功能障碍,从而引发神经退行性疾病。因此,研究微生物在肠-脑轴中发挥的作用及其机制,靶向调控肠道微生物菌群结构和功能,将为神经系统疾病的诊断与治疗提供新的手段。近年来,有关肠道微生物与机体神经系统间的互作研究受到了广泛关注,然而其具体的调控机制还未明晰。因此,本文综述了肠道微生物对宿主神经健康的调节作用,以及肠道微生物与宿主间的互作在调节神经功能、行为的潜力等研究进展,为更好地了解肠道微生物在调控宿主神经系统功能和行为的作用机制提供参考。
关键词:肠道微生物代谢产物肠-脑轴神经系统
Advances in microbiota-gut-brain axis
Kan Gao, Chunlong Mu, Weiyun Zhu


Laboratory of Gastrointestinal Microbiology, Jiangsu Key Laboratory of Gastrointestinal Nutrition and Animal Health, National Center for International Research on Animal Gut Nutrition, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
Received: 17 August 2018; Revised: 3 December 2018; Published online: 3 January 2019
*Corresponding author: Weiyun Zhu, Tel:+86-25-84395523, E-mail: zhuweiyun@njau.edu.cn.
Foundation item: Supported by Key Program of National Natural Science Foundation of China (31430082) and by the National Key Basic Research Program of China (2013CB127300)
Abstract: The gut microbiota regulates intestinal homeostasis, and also participates in the modulation of brain function and behaviors of hosts. Disorders of gut microbiota are associated with the dysfunction of host nervous system, causing the development of neurodegenerative diseases. Thus, better understanding the role of gut microbiota in the gut-brain axis can provide new strategies for the diagnosis and treatment of nervous system diseases by the targeted modulation of gut microbiota composition and function. In recent years, studies on the interaction between gut microbiota and brain function have been reported, but the underlying mechanisms are still not fully understood. Therefore, combining with the latest research findings from our laboratory, we review here the modulatory effects of gut microbiota on nervous system and the potential role of interaction between gut microbiota and host in the modulation of brain function and behaviors of hosts, aiming to deepen our understanding about the role of gut microbiota in the modulation of brain function and behaviors in hosts.
Keywords: intestinal microbiotamicrobial metabolitesgut-brain axisnervous system
据估计,肠道微生物基因组比宿主(人和动物)基因组含有更多的基因[1]。肠道菌群功能多样,主要参与碳水化合物代谢、纤维降解和免疫应答等。此外,肠道菌群也参与调节宿主的神经生理功能,如神经信号传导、突触可塑性、递质合成和转运等[2]。肠道菌群主要通过免疫、内分泌和神经通路等途径调控神经生理功能[1]。大量研究已经表明,肠脑间的通信是双向的。一方面,肠道微生物菌群结构的改变会影响宿主的行为[3-4];另一方面,宿主行为上的变化能够影响肠道菌群的组成[5]。肠道微生物菌群结构受到环境因素和宿主相关因素的影响[2]。由于肠道菌群组成的变化与宿主认知和行为的改变密切相关,因此健康、稳定、多样的肠道微生物菌群对于微生物-肠-脑轴至关重要。在调节肠-脑轴的潜在因素中,微生物代谢产物可能是重要的调节因子[1]。本文结合作者所在实验室微生物-肠-脑轴最新的研究结果,讨论了近几年关于微生物对大脑健康的调节以及宿主-微生物互作在调节神经生理功能的潜力等方面的研究,为深入解析肠道微生物对宿主神经系统功能和行为的调控作用及其机制提供参考。
1 肠道微生物及其影响因素 1.1 肠道微生物组成 宿主(人和动物)肠道内包含有超过1000多种的微生物,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是肠道内的优势菌门[2]。实验室研究表明,宿主的肠道微生物在分布上具有区室化、动态性等特点[6-7]。具有不同代谢和免疫调节能力的微生物定殖在肠道内,与宿主形成复杂的互作网络。肠道微生物的复杂性、多样性、稳定性和恢复力,使肠道菌群能够更好地适应肠道内环境[2]。肠道内纤维降解和利用过程是微生物与宿主互作的典型体现。肠道微生物利用糖苷水解酶和多糖水解酶将纤维并发酵产生短链脂肪酸(short-chain fatty acids, SCFA),SCFA对宿主产生益生作用[8]。此外,近年来我们研究表明,肠道微生物大量参与肠道中氨基酸代谢[9-10],其中微生物介导芳香族氨基酸代谢[11],而芳香族氨基酸与神经功能密切相关[1]。恢复力也是肠道微生物的重要特性。某些微生物具有对脂多糖(liposaccharides, LPS)进行去磷酸化的能力,参与炎症诱导干扰后的菌群恢复[12]。
1.2 影响肠道微生物的主要因素 基因型、日粮、环境等因素,均会影响肠道菌群的组成和功能[2]。Bian等[13]通过新生仔猪交互寄养研究品种(遗传)和母乳(环境)对仔猪肠道菌群建立的影响,发现基因型背景和母乳明显影响仔猪肠道菌群组成,母乳的影响主要在哺乳期,品种的影响可延续到断奶后。Mu等[14]进一步发现,母乳中不同结构的N-链寡糖与仔猪肠道微生物种类丰度密切相关。众所周知,日粮影响肠道菌群的组成。Mu等[15]发现,高蛋白日粮显著改变了大鼠结肠菌群结构。长期饲喂抗性淀粉会改变生长猪结肠菌群结构[16]。同时,生长猪肠道不同区室微生物,如肠腔微生物和肠黏膜微生物,在菌群组成和氨基酸利用能力上存在明显差异[9-10]。此外,这些改变肠道微生物组成的因素同样能够影响宿主的肠道生理、肠神经系统(enteric nervous system, ENS)和中枢神经系统(central nervous system, CNS)功能(图 1)。
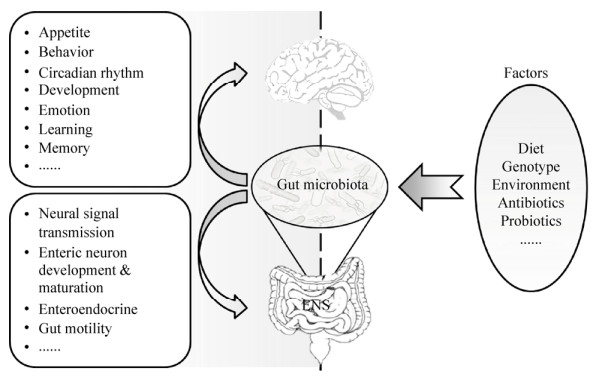 |
| 图 1 影响肠道微生物菌群结构的因素及其对宿主神经系统功能的影响[2] Figure 1 Factors driving the variation of gut microbiota may affect the function of nervous system in host[2] |
| 图选项 |
2 肠道菌群与神经系统 2.1 肠道菌群与神经发育 动物和人的神经发育主要包括神经细胞的增殖、迁移、定殖和分化过程[2]。ENS影响肠道蠕动,并负责将神经信号传入CNS。与正常小鼠相比,无菌小鼠空肠和回肠的肌间神经丛结构发生改变,该结构性改变与神经密度的降低和神经元数量的减少有关[17],表明肠道微生物对肠道内神经元的数量具有调控作用。ENS神经细胞5-羟色胺受体4 (5-HT4 receptor)的活化与宿主神经发育密切有关[18]。最新研究发现,在无菌小鼠中定殖正常小鼠的肠道菌群促进了其ENS神经元及黏膜5-羟色胺的分泌,激活5-HT4受体并增强了肠道神经元祖细胞的增殖[19]。以上研究表明,肠道微生物菌群参与介导宿主ENS发育过程。
肠道微生物对机体CNS的发育过程至关重要。M?hle等[20]利用抗生素混剂(氨苄西林、万古霉素、环丙沙星和甲硝唑)灌喂小鼠7周后发现,肠道微生物菌群数量显著下降;同时,小鼠海马区神经细胞数量显著下降,神经形成过程减慢;益生菌VSL#3能够恢复小鼠海马区神经形成过程,使神经细胞数量恢复至正常水平。该研究表明,宿主神经形成过程受肠道微生物介导。脑源神经营养因子(brain-derived neurotrophic factor,BDNF)作为一类重要的神经营养因子,能够促进宿主神经细胞的成熟和分化[1]。与新生正常小鼠相比,新生无菌小鼠脑部海马区和杏仁核BDNF表达水平较低,同时伴随着脑部神经成熟过程迟缓[21]。此外,肠道微生物定殖并不能有效改善成年无菌小鼠神经发育迟缓的表型[22]。以上研究表明,肠道微生物在生命早期可能通过介导营养因子BDNF的表达诱导不同脑部区域神经元的成熟与分化,进而调控宿主CNS的发育过程。
2.2 肠道菌群与神经功能、行为 利用无菌动物模型或者抗生素干预等手段研究发现,肠道微生物菌群参与了宿主的神经系统功能和行为的调控[2]。与正常大鼠相比,无菌大鼠下丘脑促肾上腺皮质激素释放因子表达较高,下丘脑-垂体-肾上腺轴活性更强,应激反应更为剧烈[23]。与正常小鼠相比,无菌Swiss小鼠[24]和NMRI小鼠[25]焦虑水平较低。相反,无菌F344大鼠[23]和BALB/c小鼠[26]的焦虑水平较高。以上研究表明,肠道微生物能够影响宿主产生焦虑情绪的敏感性。与Swiss和NMRI小鼠相比,F344大鼠和BALB/c小鼠更容易产生焦虑情绪[23],由此推测肠道微生物调节情绪敏感性的差异可能是由于动物模型不同的遗传背景引起的。
除了调节宿主情绪相关的神经功能,肠道菌群还通过影响胃肠激素的产生来调节食欲[2]。食欲在很大程度上受到肠-脑轴的调节,主要通过平衡能量摄入和消耗来控制能量平衡,从而保持机体的能量储备[3]。目前已知,酪酪肽(peptide tyrosine-tyrosine,PYY)和胰高血糖素样肽-1 (glucagon-like peptide 1, GLP-1)等胃肠激素能够通过与ENS特异性受体结合,将神经信号上传至CNS,进而调控机体食欲[8]。微生物降解纤维产生的SCFA能够影响肠道PYY和GLP-1的分泌。乙酸和丁酸能够被肠道内分泌细胞表面的SCFA受体GPR41 (G protein coupled receptor 41)和GPR43受体特异性识别,从而激活细胞分泌胃肠激素[8]。结肠源乙酸能够上调下丘脑促阿片-黑素细胞皮质素原(pro-opiomelanocortin, POMC)的表达,并下调刺鼠相关蛋白(agouti-related peptides,AgRP)的表达,从而抑制小鼠食欲[27]。以上研究表明,肠道微生物及其代谢产物能够通过肠-脑轴调控机体食欲。
肠道微生物菌群组成的变化与宿主认知、行为的改变密切相关。有研究发现,与正常人相比,自闭症患者肠道菌群结构变化明显,主要伴随着乳酸杆菌属(Lactobacillus)丰度的增加和普氏菌属(Prevotella)、双歧杆菌属(Bifidobacterium)丰度的减少[28]。Fr?hlich等[4]研究发现,肠道微生物菌群数量及其菌群多样性的下降,伴随着小鼠学习和记忆力的减退,以及探索性行为的减少。粪菌移植技术(fecal microbiota transplantation,FMT)的发展进一步揭示了肠道微生物菌群组成的变化与神经系统功能紊乱之间的因果联系。有研究发现,将抑郁患者的粪样移植至无菌受体小鼠肠道内引起了小鼠抑郁样行为的产生[29]。肠易激综合征(irritable bowel syndrome,IBS)是一种常见的肠道ENS功能紊乱疾病,常伴有焦虑等精神异常[29]。De Palma等[30]研究发现,将IBS患者的粪样移植至无菌小鼠肠道内,引起了小鼠肠道蠕动加快、黏膜屏障功能失调,同时还导致小鼠焦虑样行为的产生。以上研究揭示了肠道微生物和神经系统之间的紧密联系,表明了肠道微生物在调控神经系统认知、行为等方面是一个重要的因果因素。
抗生素可抑制微生物,引起肠道微生物菌群紊乱,因此,抗生素对肠道微生物的干预被作为研究肠道菌群对宿主神经功能的一种策略。有研究发现,小鼠口服抗生素混剂(氨苄西林、链霉素和克林霉素) 2周后,小鼠肠道微生物菌群多样性降低,小鼠海马区BDNF表达下调,并伴随着探索性行为减少、认知能力减弱[31]。成年早期是肠道微生物菌群稳态形成的关键时期。有研究发现,抗生素混剂(如两性霉素B、万古霉素、新霉素等)灌胃新生小鼠后,小鼠肠道微生物数量和菌群多样性减少,成年后的小鼠焦虑样行为减少、认知功能障碍、脑部色氨酸代谢途径改变[3]。Leclercq等[32]研究发现,小鼠出生早期使用低剂量青霉素引起了肠道微生物菌群持续性的改变,额叶皮层免疫应答激活,血脑屏障完整性受损,小鼠成年后焦虑样、侵略性等行为增加。以上研究表明,早期抗生素对宿主肠道菌群的干预会对宿主神经系统功能产生持久性的影响。
使用益生菌来改善肠道菌群平衡是调节神经系统功能的有效策略。如前所述,益生菌能够减少宿主的焦虑水平,减少应激反应,并帮助改善宿主的认知能力和行为[2]。鼠李糖乳酸杆菌(Lactobacillus rhamnosus JB-1)能够改善由应激诱导的小鼠神经功能和行为的紊乱[33]。O’Hagan等[34]研究发现,长期饲喂嗜酸乳杆菌(Lactobacillus acidophilus)和双歧杆菌(Bifidobacterium bifidum)显著改善了大鼠由衰老引起的认知、记忆能力的减退。以上研究揭示了益生菌作为治疗神经功能障碍的可能性。
3 肠道微生物介导宿主神经系统功能的机制 3.1 模式识别受体介导的互作机制 模式识别受体(pattern recognition receptor, PRR)和微生物相关分子模式(microbiota-associated molecular pattern, MAMP)的互作是宿主识别微生物的重要机制[2]。一些革兰氏阳性菌能够产生脂磷壁酸(lipoteichoic acid, LTA),作为宿主Toll样受体2 (toll-like receptor, TLR2)的配体。TLR2主要分布于小鼠ENS神经元、神经胶质细胞和肠平滑肌表面。与正常小鼠相比,TLR2基因缺失导致了小鼠ENS结构和神经生理功能发生紊乱[35]。Caputi等[36]研究发现,抗生素诱导的肠道微生物紊乱引起了小鼠回肠ENS神经胶质细胞结构损伤、肌间神经丛神经元缺失。使用LTA激活小鼠回肠TLR2信号通路能够部分恢复ENS功能[36]。以上研究表明,LTA-TLR2是肠道微生物与ENS间的重要媒介之一。
脂多糖LPS是革兰氏阴性菌外膜的主要组成成分,可作为宿主TLR4的特异性配体。TLR4识别LPS后激活下游免疫应答信号通路,继而引起免疫因子表达。肠道炎症导致肠道屏障功能受损,使LPS、免疫因子等致炎物质更多地进入血液循环[1]。最新研究发现,微生物源LPS通过与小鼠大脑皮质TLR4受体结合激活脑部免疫应答,导致小鼠认知能力(学习、记忆能力)受损[37]。Femenia等[38]研究发现,与正常小鼠相比,TLR4基因敲除型小鼠焦虑样行为增加、探索性行为减少。以上研究表明,细菌成分的易位及其对免疫系统的影响,可能在微生物-肠-脑轴调控过程中具有广泛的神经病理相关性。
3.2 微生物代谢产物介导的调控机制 肠道微生物能够代谢营养素产生多种代谢产物。已有研究报道,微生物降解纤维产生的SCFA具有调控宿主神经功能的重要作用[1]。此外,微生物介导的色氨酸代谢产物同样能够调控宿主神经功能。Yano等[39]研究发现,来自小鼠和人肠道微生物的孢子形成类细菌(spore-forming bacteria)能够促进结肠5-羟色胺的合成,5-羟色胺被ENS神经元表面的5-羟色胺受体识别,从而参与调控肠道蠕动。此外,Rothhammer等[40]研究发现,色氨酸被肠道微生物利用产生的吲哚、吲哚-3-乙醛、吲哚-3-丙酸等代谢产物,能够通过血液循环进入CNS,激活芳香烃受体信号通路,抑制脑部炎症反应。以上研究表明,微生物色氨酸代谢产物对宿主神经功能具有重要的调控作用。
3.3 肠道微生物调控神经功能的机制探索 越来越多的研究通过无菌动物模型、抗生素干预等手段证实了微生物-肠-脑轴的存在[2]。然而,肠道微生物调控神经功能的复杂机制还不明晰,需要做进一步的探索。如前所述,在宿主小肠和大肠中的微生物菌群的空间组成和分布不同。肠道不同位点形成的微环境,在pH值、氧气浓度、细菌密度等方面存在差异[2]。以猪肠道为例,在小肠中,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是主要的优势菌门,小肠微生物(103–107 CFU/mL)主要参与宿主的营养吸收、碳水化合物和氨基酸代谢[9-10];与小肠微生物相比,大肠微生物数量更多(1011–1012 CFU/mL),菌群组成更加多样,同时具有较强的发酵能力,能够利用进入大肠的营养素产生各种代谢产物[6-7]。那么,小肠和大肠中的微生物菌群是否对宿主微生物-肠-脑轴做出了相同的贡献?为了解决这一科学问题,采取合适的微生物靶向干预手段至关重要。
本实验室利用瘘管猪为研究对象,研究发现大肠灌注抗生素(氨苄西林、庆大霉素和甲硝唑混剂)和碳水化合物(玉米淀粉)特异性地改变大肠微生物菌群[41-42]。抗生素灌注减弱大肠微生物碳水化合物代谢,而增强芳香族氨基酸代谢[41];相反,玉米淀粉灌注增强大肠微生物碳水化合物代谢,而减弱芳香族氨基酸代谢[42]。芳香族氨基酸包括色氨酸、酪氨酸和苯丙氨酸,在机体中是一类非常重要的氨基酸,尤其是作为神经递质5-羟色胺和多巴胺的合成前体物[1]。研究发现,抗生素灌注后,大肠、血液和下丘脑芳香族氨基酸的浓度下降,同时下丘脑5-羟色胺和多巴胺的浓度减少[41];玉米淀粉灌注后,大肠、血液和下丘脑芳香族氨基酸的浓度增加,伴随着下丘脑5-羟色胺和多巴胺浓度的上升[42] (图 2)。以上研究表明,大肠微生物可能通过影响芳香族氨基酸水平调控宿主脑部神经递质的表达。本实验室进一步借助小鼠模型和体外神经细胞模型对其做了深入的机制研究,证实了芳香族氨基酸是大肠微生物调控宿主神经递质表达的介质之一[42] (图 2)。
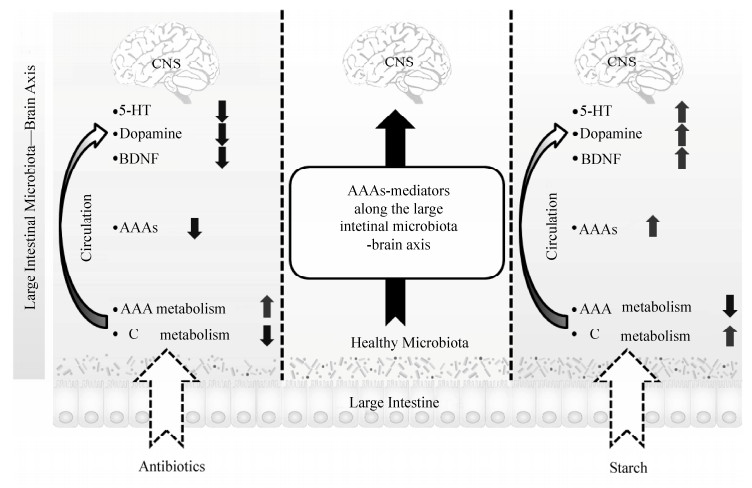 |
| 图 2 大肠微生物通过调控机体芳香族氨基酸水平进而介导宿主神经因子表达的模型[42] Figure 2 The model of the impact of alteration in large intestinal microbiota on brain neurochemistry. AAA: aromatic amino acid; C metabolism: carbohydrate metabolism[42]. |
| 图选项 |
4 小结和展望 肠道菌群可参与调控神经系统发育、情绪、食欲、认知和行为等[2]。一方面,肠道菌群紊乱与宿主神经功能失调密切相关,如肠道菌群数量减少、多样性降低,往往伴随着情绪、行为等异常[4]。另一方面,改善肠道菌群失调和重构肠道内稳态(如益生菌)则可帮助机体神经系统功能的恢复[34]。因此,健康、稳定、多样的肠道菌群对于维持宿主神经功能稳定至关重要。微生物-肠-脑轴的相关研究在近10年取得了巨大的进展,然而,肠道微生物与宿主神经系统间的互作机制还未明晰。这可能是由于忽视了肠道微生物在组成和功能上具有区室化、动态性等特点[6-7]。因此,不同区室的肠道微生物在肠-脑轴中的调控作用需要做进一步的精准研究。本实验室通过靶向调控大肠菌群组成和代谢,初步揭示了大肠微生物与宿主神经功能之间的联系(图 2)。这些研究表明,对肠道微生物的破坏如抗生素,不利于大脑健康,而增加大肠碳水化合物如通过膳食纤维等小肠不消化的碳水化合物,可能促进大脑健康。因此,通过特异性干预肠段微生物来调控宿主神经系统功能的潜在手段将为临床医学领域中神经疾病的治疗提供新的思路。
References
| [1] | Farzi A, Fr?hlich EE, Holzer P. Gut microbiota and the neuroendocrine system. Neurotherapeutics, 2018, 15(1): 5-22. DOI:10.1007/s13311-017-0600-5 |
| [2] | Mu CL, Yang YX, Zhu WY. Gut microbiota:the brain peacekeeper. Frontiers in Microbiology, 2016, 7: 345. |
| [3] | Desbonnet L, Clarke G, Traplin A, O'Sullivan O, Crispie F, Moloney RD, Cotter PD, Dinan TG, Cryan JF. Gut microbiota depletion from early adolescence in mice:Implications for brain and behaviour. Brain, Behavior, and Immunity, 2015, 48: 165-173. DOI:10.1016/j.bbi.2015.04.004 |
| [4] | Fr?hlich EE, Farzi A, Mayerhofer R, Reichmann F, Ja?an A, Wagner B, Zinser E, Bordag N, Magnes C, Frohlich E, Kashofer K, Gorkiewicz G, Holzer P. Cognitive impairment by antibiotic-induced gut dysbiosis:analysis of gut microbiota-brain communication. Brain, Behavior, and Immunity, 2016, 56: 140-155. DOI:10.1016/j.bbi.2016.02.020 |
| [5] | Dunphy-Doherty F, O'Mahony SM, Peterson VL, O'Sullivan O, Crispie F, Cotter PD, Wigmore P, King MV, Cryan JF, Fone KCF. Post-weaning social isolation of rats leads to long-term disruption of the gut microbiota-immune-brain axis. Brain, Behavior, and Immunity, 2018, 68: 261-273. DOI:10.1016/j.bbi.2017.10.024 |
| [6] | Gao K, Pi Y, Peng Y, Mu CL, Zhu WY. Time-course responses of ileal and fecal microbiota and metabolite profiles to antibiotics in cannulated pigs. Applied Microbiology and Biotechnology, 2018, 102(5): 2289-2299. DOI:10.1007/s00253-018-8774-2 |
| [7] | Mu CL, Yang YX, Su Y, Zoetendal EG, Zhu WY. Differences in microbiota membership along the gastrointestinal tract of piglets and their differential alterations following an early-life antibiotic intervention. Frontiers in Microbiology, 2017, 8: 797. DOI:10.3389/fmicb.2017.00797 |
| [8] | Gao K, Mu CL, Yu KF, Zhu WY. Enteroendocrine and nutrient sensing system. Chinese Journal of Animal Nutrition, 2016, 28(6): 1633-1640. (in Chinese) 高侃, 慕春龙, 余凯凡, 朱伟云. 肠道内分泌与营养素感应系统. 动物营养学报, 2016, 28(6): 1633-1640. DOI:10.3969/j.issn.1006-267x.2016.06.001 |
| [9] | Dai ZL, Wu ZL, Hang SQ, Zhu WY, Wu GY. Amino acid metabolism in intestinal bacteria and its potential implications for mammalian reproduction. Molecular Human Reproduction, 2015, 21(5): 389-409. DOI:10.1093/molehr/gav003 |
| [10] | Yang YX, Dai ZL, Zhu WY. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs. Amino Acids, 2014, 46(11): 2489-2501. DOI:10.1007/s00726-014-1807-y |
| [11] | Ma ML, He XY, Zhu WY. Metabolic pattern of pig hindgut bacteria on aromatic amino acids by an in vitro fermentation method. Acta Microbiologica Sinica, 2016, 56(11): 1786-1793. (in Chinese) 马梅蕾, 何香玉, 朱伟云. 体外法研究猪后肠道对芳香族氨基酸的发酵特性. 微生物学报, 2016, 56(11): 1786-1793. |
| [12] | Cullen TW, Schofield WB, Barry NA, Putnam EE, Rundell EA, Trent MS, Degnan PH, Booth CJ, Yu H, Goodman AL. Antimicrobial peptide resistance mediates resilience of prominent gut commensals during inflammation. Science, 2015, 347(6218): 170-175. DOI:10.1126/science.1260580 |
| [13] | Bian GR, Ma SQ, Zhu ZG, Su Y, Zoetendal EG, Mackie R, Liu JH, Mu CL, Huang RH, Smidt H, Zhu WY. Age, introduction of solid feed and weaning are more important determinants of gut bacterial succession in piglets than breed and nursing mother as revealed by a reciprocal cross-fostering model. Environmental Microbiology, 2016, 18(5): 1566-1577. DOI:10.1111/1462-2920.13272 |
| [14] | Mu CL, Cai ZP, Bian GR, Du YM, Ma SQ, Su Y, Liu L, Voglmeir J, Huang RH, Zhu WY. New insights into porcine milk N-glycome and the potential relation with offspring gut microbiome. Journal of Proteome Research, 2018, 18(3): 1114-1124. |
| [15] | Mu CL, Yang YX, Luo Z, Guan LL, Zhu WY. The colonic microbiome and epithelial transcriptome are altered in rats fed a high-protein diet compared with a normal-protein diet. The Journal of Nutrition, 2016, 146(3): 474-483. DOI:10.3945/jn.115.223990 |
| [16] | Sun Y, Zhou LP, Fang LD, Su Y, Zhu WY. Responses in colonic microbial community and gene expression of pigs to a long-term high resistant starch diet. Frontiers in Microbiology, 2015, 6: 877. |
| [17] | Collins J, Borojevic R, Verdu EF, Huizinga JD, Ratcliffe EM. Intestinal microbiota influence the early postnatal development of the enteric nervous system. Neurogastroenterology & Motility, 2014, 26(1): 98-107. |
| [18] | Liu MT, Kuan YH, Wang JW, Hen R, Gershon MD. 5-HT4 receptor-mediated neuroprotection and neurogenesis in the enteric nervous system of adult mice. The Journal of Neuroscience, 2009, 29(31): 9683-9699. DOI:10.1523/JNEUROSCI.1145-09.2009 |
| [19] | De Vadder F, Grasset E, Manner?s Holm L, Karsenty G, Macpherson AJ, Olofsson LE, B?ckhed F. Gut microbiota regulates maturation of the adult enteric nervous system via enteric serotonin networks. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(25): 6458-6463. DOI:10.1073/pnas.1720017115 |
| [20] | M?hle L, Mattei D, Heimesaat MM, Bereswill S, Fischer A, Alutis M, French T, Hambardzumyan D, Matzinger P, Dunay IR, Wolf SA. Ly6Chi monocytes provide a link between antibiotic-induced changes in gut microbiota and adult hippocampal neurogenesis. Cell Reports, 2016, 15(9): 1945-1956. DOI:10.1016/j.celrep.2016.04.074 |
| [21] | Diaz Heijtz R, Wang SG, Anuar F, Qian Y, Bj?rkholm B, Samuelsson A, Hibberd ML, Forssberg H, Pettersson S. Normal gut microbiota modulates brain development and behavior. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(7): 3047-3052. DOI:10.1073/pnas.1010529108 |
| [22] | Ogbonnaya ES, Clarke G, Shanahan F, Dinan TG, Cryan JF, O'Leary OF. Adult hippocampal neurogenesis is regulated by the microbiome. Biological Psychiatry, 2015, 78(4): e7-e9. DOI:10.1016/j.biopsych.2014.12.023 |
| [23] | Crumeyrolle-Arias M, Jaglin M, Bruneau A, Vancassel S, Cardona A, Daugé V, Naudon L, Rabot S. Absence of the gut microbiota enhances anxiety-like behavior and neuroendocrine response to acute stress in rats. Psychoneuroendocrinology, 2014, 42: 207-217. DOI:10.1016/j.psyneuen.2014.01.014 |
| [24] | Clarke G, Grenham S, Scully P, Fitzgerald P, Moloney RD, Shanahan F, Dinan TG, Cryan JF. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry, 2013, 18(6): 666-673. DOI:10.1038/mp.2012.77 |
| [25] | Neufeld KM, Kang N, Bienenstock J, Foster JA. Reduced anxiety-like behavior and central neurochemical change in germ-free mice. Neurogastroenterology & Motility, 2011, 23(3): 255. |
| [26] | Nishino R, Mikami K, Takahashi H, Tomonaga S, Furuse M, Hiramoto T, Aiba Y, Koga Y, Sudo N. Commensal microbiota modulate murine behaviors in a strictly contamination-free environment confirmed by culture-based methods. Neurogastroenterology & Motility, 2013, 25(6): 521-e371. |
| [27] | Frost G, Sleeth ML, Sahuri-Arisoylu M, Lizarbe B, Cerdan S, Brody L, Anastasovska J, Ghourab S, Hankir M, Zhang S, Carling D, Swann JR, Gibson G, Viardot A, Morrison D, Louise Thomas E, Bell JD. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nature Communications, 2014, 5: 3611. DOI:10.1038/ncomms4611 |
| [28] | Doenyas C. Gut microbiota, inflammation, and probiotics on neural development in autism spectrum disorder. Neuroscience, 2018, 374: 271-286. DOI:10.1016/j.neuroscience.2018.01.060 |
| [29] | Zheng P, Zeng B, Zhou C, Liu M, Fang Z, Xu X, Zeng L, Chen J, Fan S, Du X, Zhang X, Yang D, Yang Y, Meng H, Li W, Melgiri ND, Licinio J, Wei H, Xie P. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host's metabolism. Molecular Psychiatry, 2016, 21(6): 786-796. DOI:10.1038/mp.2016.44 |
| [30] | De Palma G, Lynch MDJ, Lu J, Dang VT, Deng YK, Jury J, Umeh G, Miranda PM, Pigrau Pastor M, Sidani S, Pinto-Sanchez MI, Philip V, McLean PG, Hagelsieb MG, Surette MG, Bergonzelli GE, Verdu EF, Britz-McKibbin P, Neufeld JD, Collins SM, Bercik P. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Science Translational Medicine, 2017, 9(379): eaaf6397. DOI:10.1126/scitranslmed.aaf6397 |
| [31] | Guida F, Turco F, Iannotta M, De Gregorio D, Palumbo I, Sarnelli G, Furiano A, Napolitano F, Boccella S, Luongo L, Mazzitelli M, Usiello A, De Filippis F, Iannotti FA, Piscitelli F, Ercolini D, De Novellis V, Di Marzo V, Cuomo R, Maione S. Antibiotic-induced microbiota perturbation causes gut endocannabinoidome changes, hippocampal neuroglial reorganization and depression in mice. Brain, Behavior, and Immunity, 2018, 67: 230-245. DOI:10.1016/j.bbi.2017.09.001 |
| [32] | Leclercq S, Mian FM, Stanisz AM, Bindels LB, Cambier E, Ben-Amram H, Koren O, Forsythe P, Bienenstock J. Low-dose penicillin in early life induces long-term changes in murine gut microbiota, brain cytokines and behavior. Nature Communications, 2017, 8: 15062. DOI:10.1038/ncomms15062 |
| [33] | Bharwani A, Mian MF, Surette MG, Bienenstock J, Forsythe P. Oral treatment with Lactobacillus rhamnosus attenuates behavioural deficits and immune changes in chronic social stress. BMC Medicine, 2017, 15(1): 7. DOI:10.1186/s12916-016-0771-7 |
| [34] | O'Hagan C, Li JV, Marchesi JR, Plummer S, Garaiova I, Good MA. Long-term multi-species Lactobacillus and Bifidobacterium dietary supplement enhances memory and changes regional brain metabolites in middle-aged rats. Neurobiology of Learning and Memory, 2017, 144: 36-47. DOI:10.1016/j.nlm.2017.05.015 |
| [35] | Brun P, Giron MC, Qesari M, Porzionato A, Caputi V, Zoppellaro C, Banzato S, Grillo AR, Spagnol L, De Caro R, Pizzuti D, Barbieri V, Rosato A, Sturniolo GC, Martines D, Zaninotto G, Palù G, Castagliuolo I. Toll-like receptor 2 regulates intestinal inflammation by controlling integrity of the enteric nervous system. Gastroenterology, 2013, 145(6): 1323-1333. DOI:10.1053/j.gastro.2013.08.047 |
| [36] | Caputi V, Marsilio I, Filpa V, Cerantola S, Orso G, Bistoletti M, Paccagnella N, De Martin S, Montopoli M, Dall'Acqua S, Crema F, Di Gangi IM, Galuppini F, Lante I, Bogialli S, Rugge M, Debetto P, Giaroni C, Giron MC. Antibiotic-induced dysbiosis of the microbiota impairs gut neuromuscular function in juvenile mice. British Journal of Pharmacology, 2017, 174(20): 3623-3639. DOI:10.1111/bph.13965 |
| [37] | Zhang J, Yu CB, Zhang X, Chen HW, Dong JC, Lu WL, Song ZC, Zhou W. Porphyromonas gingivalis lipopolysaccharide induces cognitive dysfunction, mediated by neuronal inflammation via activation of the TLR4 signaling pathway in C57BL/6 mice. Journal of Neuroinflammation, 2018, 15(1): 37. DOI:10.1186/s12974-017-1052-x |
| [38] | Femenia T, Qian Y, Arentsen T, Forssberg H, Diaz Heijtz R. Toll-like receptor-4 regulates anxiety-like behavior and DARPP-32 phosphorylation. Brain, Behavior, and Immunity, 2018, 69: 273-282. DOI:10.1016/j.bbi.2017.11.022 |
| [39] | Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 2015, 161(2): 264-276. DOI:10.1016/j.cell.2015.02.047 |
| [40] | Rothhammer V, Mascanfroni ID, Bunse L, Takenaka MC, Kenison JE, Mayo L, Chao CC, Patel B, Yan R, Blain M, Alvarez JI, Kébir H, Anandasabapathy N, Izquierdo G, Jung S, Obholzer N, Pochet N, Clish CB, Prinz M, Prat A, Antel J, Quintana FJ. Type Ⅰ interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nature Medicine, 2016, 22(6): 586-597. DOI:10.1038/nm.4106 |
| [41] | Gao K, Pi Y, Mu CL, Peng Y, Huang Z, Zhu WY. Antibiotics-induced modulation of large intestinal microbiota altered aromatic amino acid profile and expression of neurotransmitters in the hypothalamus of piglets. Journal of Neurochemistry, 2018, 146(3): 219-234. DOI:10.1111/jnc.14333 |
| [42] | Gao K, Pi Y, Mu CL, Farzi A, Liu Z, Zhu WY. Increasing carbohydrate availability in the hindgut promotes hypothalamic neurotransmitter synthesis:aromatic amino acids linking the microbiota-brain axis. Journal of Neurochemistry, 2019, 149(5): 641-659. DOI:10.1111/jnc.14709 |
