贺帅兵, 胡文革

 , 靳希桐, 周婷婷, 钟镇涛, 王月娥
, 靳希桐, 周婷婷, 钟镇涛, 王月娥 新疆石河子大学生命科学学院, 新疆 石河子 832000
收稿日期:2018-11-15;修回日期:2019-02-12;网络出版日期:2019-03-07
基金项目:国家自然科学基金(31160026,31560040)
*通信作者:胡文革, Tel:+86-13519922061;E-mail:hwg-t@163.com.
摘要:[目的] 旨在揭示耐盐植物芦苇根际与非根际土壤AOA群落结构间的差异,为深入研究盐生植物根际土壤微生物与耐盐性之间的关系提供理论基础。[方法] 应用高通量测序技术以氨单加氧酶基因(amoA)为分子标记,对新疆艾比湖湿地荒漠生态系统不同季节(春、夏、秋)芦苇根际与非根际土壤氨氧化古菌(AOA)的多样性和群落结构进行研究。[结果] 结果表明,不同季节芦苇根际土壤AOA多样性和丰富度存在差异,相比非根际土壤,夏季和秋季芦苇根际土壤AOA多样性较低丰富度较高,春季多样性较高丰富度较低。芦苇根际土壤中AOA的多样性为春季>夏季>秋季。AOA群落组成分析表明,土壤样品中AOA群落主要集中在泉古菌门(Crenarchaeota)和奇古菌门(Thaumarchaeota),其中泉古菌门为主要优势菌门。RDA分析表明,含水量(SM)、有机质(SOM)、总氮(TN)和pH是影响芦苇根际土壤AOA群落多样性和丰富度的主要环境因子。[结论] 不同季节芦苇根际土壤AOA多样性及丰富度存在差异,相比非根际土壤,芦苇根际土壤AOA更丰富。
关键词:艾比湖湿地根际土壤氨氧化古菌(AOA)多样性及丰富度相关性分析
Diversity and community structure of ammonia oxidizing archaea in rhizosphere soil of reed in Ebinur Lake Wetland
Shuaibing He, Wenge Hu

 , Xitong Jin, Tingting Zhou, Zhentao Zhong, Yuee Wang
, Xitong Jin, Tingting Zhou, Zhentao Zhong, Yuee Wang College of Life Sciences, Shihezi University, Shihezi 832000, Xinjiang Uygur Autonomous Region, China
Received: 15 November 2018; Revised: 12 February 2019; Published online: 7 March 2019
*Corresponding author: Hu Wenge, Tel:+86-13519922061;E-mail:hwg-t@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31160026, 31560040)
Abstract: [Objective] The aim of this study was to reveal the differences in the community structure of ammonia-oxidizing archaea (AOA) between rhizosphere and non-rhizosphere soil, to provide a theoretical basis for further study on the relationship between halophyte rhizosphere soil microorganisms and salt tolerance. [Methods] Using ammonia monooxygenase gene (amoA) as molecular marker, the diversity and community structure of AOA in rhizosphere soil of Reed in different seasons (spring, summer, autumn) in Ebinur Lake Wetland were studied by high-throughput sequencing technique. [Results] The diversity and richness of AOA were different in rhizosphere soil of Reed in different seasons. In summer and autumn, the richness of AOA in rhizosphere soil of Reed was higher than that in non-rhizosphere soil, the diversity was lower than that in non-rhizosphere soil. In spring, the diversity of AOA in rhizosphere soil of Reed was higher than that in non-rhizosphere soil, the richness was lower than that in non-rhizosphere soil. The diversity magnitude of AOA in terms of the season was spring > summer > autumn in rhizosphere soil of Reed. Community composition analysis of AOA showed that the main AOA communities in all soil samples were Crenarchaeota and Thaumarchaeota, and Crenarchaeota were the dominant phylum. RDA analysis showed that soil moisture, soil organic matter, total potassium and pH were the main factors affecting the diversity and richness of AOA community in rhizosphere soil of Reed. [Conclusion] The diversity and richness of AOA in rhizosphere soil of Reed were season dependent, compared with non-rhizosphere soil, AOA was more abundant in rhizosphere soil of Reed.
Keywords: Ebinur Lake Wetlandrhizosphere and non-rhizosphere soilammonia-oxidizing archaea (AOA)diversity and richnesscorrelation analysis
近几十年,随着生态系统富营养化日益严重,人们对氮循环中氮素的转化也越来越感兴趣[1]。氮循环的4个主要过程——固氮作用、硝化作用、反硝化作用及氨化作用均由微生物驱动[2]。氨氧化微生物驱动的氨氧化作用是通过氨单加氧酶(AMO)将NH3转化成羟胺(NH2OH),再由羟胺氧化还原酶(HAO)将羟胺(NH2OH)转化为NO2-,它是硝化作用的第一个反应步骤,也是限速步骤,是全球氮循环的中心环节[3]。长期以来,氨氧化细菌一直被认为是氨氧化作用的唯一参与者,通过氧化NH3获得能量,同化CO2获得碳源,是地球氨氧化过程的主要推动者,直到发现泉古菌中的氨氧化古菌也能参与氨氧化过程,自此打破了氨氧化细菌在此过程中的主导地位[4]。编码氨单加氧酶α亚基的amoA基因保守性较高[5],相对16S rRNA基因其分子序列差异更能反映特定种群的差异,因此常被作为研究氨氧化微生物的分子标记,用来分析氨氧化微生物的遗传多样性。随着氨氧化古菌(AOA)在土壤[6]、海洋沉积物[7]、热泉[8]、湖口和人工环境[9-10]中被监测,对其功能的研究逐渐成为环境微生物研究的重点。
艾比湖湿地是新疆现有最大的湖泊湿地,具有沼泽及河流湿地的共同特性,属于温带干旱区湿地荒漠生态系统。新疆艾比湖湿地盐生植物芦苇拥有很强的耐盐能力,是盐渍环境中重要的建群植物,对维护艾比湖湿地生态功能具有至关重要的作用[11]。目前,只有少数****对建群植物根际土壤氨氧化微生物群落结构及其与土壤环境因子相关性进行研究。因此,对新疆艾比湖湿地盐生植物根际土壤中参与氮循环的氨氧化古菌的多样性、群落结构及其与土壤环境的相关性进行研究很有必要。
本文基于高通量测序技术对艾比湖湿地春、夏、秋3个季节芦苇根际与非根际土壤氨氧化古菌的变化及其与土壤环境之间的关系进行研究,旨在了解艾比湖湿地芦苇根际和非根际土壤氨氧化古菌的群落组成和多样性特点。通过分析其群落结构变化特征来预测艾比湖湿地环境变化,为艾比湖湿地微生物生态学研究及生态环境修复提供基础的理论依据。
1 材料和方法 1.1 样品采集 研究区域位于新疆准噶尔盆地西南缘的艾比湖湿地自然保护区,是重要的鸟类迁徙、繁殖和越冬的场所,同时也是多种植物的栖息地。艾比湖湿地是我国内陆干旱区独特的生物基因宝库,因其处于阿拉山口主风道区,使得该地区形成了盐湖、沼泽、沙漠、盐漠等多种地类,由此形成了多种植被群落,其中包括旱生、盐生、沙生、湿生、水生等植被类群。芦苇、盐角草、盐节木和花花柴等是该地区典型的盐生植被代表。
2017年7月、2017年10月和2018年4月,对艾比湖湿地盐生植物芦苇群落根际与非根际土壤样本通过五点采样法进行定点采样。采样的基本情况见表 1。在芦苇群落区随机设置10 m×10 m的样方,每个样方设置5个不同方向的采样点,5个采样点的根际土壤混合均匀后作为芦苇根际土壤样本。根际土壤采集步骤:去除表层土壤,挖出整株植物根系后,轻拍使根系疏松的土块全部脱落,之后用无菌毛刷收集依附在根系表面的土壤。收集根际土壤的同时,在样方内芦苇周围无根的空旷区域,取垂直方向10-35 cm的土样作为相对的非根际土样。将以上土样过筛,除去根系、植物体残渣及其他杂质后分成3部分处理:(1)装入铝盒,用于土壤含水量的测定;(2)装入无菌袋,于-80℃冰箱保存,用于土壤总DNA的提取;(3)自然风干,研磨,过筛后用于生物地球化学性质的测定。
表 1. 艾比湖湿地采样点基本情况及采样时间和样本编号 Table 1. The basic information of the samples in Ebinur Lake Wetland, and sampling time and numbers (Clay, Sandy loam soil)
| Sample ID | Soil name | Latitude and longitude | Season |
| RR7/RN7 | Rhizosphere/non-rhizosphere | 82°49′50.0″E 44°49′58.7″N | Summer |
| RR10/RN10 | Rhizosphere/non-rhizosphere | Autumn | |
| RR4/RN4 | Rhizosphere/non-rhizosphere | Spring |
表选项
1.2 土壤理化性质分析 土壤pH、含水量(SM)、电导率(EC)、有机质(SOM)、全氮(TN)、碱解氮(AN)的分析测定采用土壤常规分析方法[12]。每个土壤样品设置3个生物学重复。
1.3 土壤总DNA的提取及PCR扩增 土壤预处理:于50 mL离心管中加入20 g土样及30 mL缓冲液PBS,涡旋振荡5-10 min后静置,转移上清液于新的50 mL离心管中,12000×g离心2 min,弃上清,保留底部50-150 μL溶液用于土壤总DNA的提取。用HiPure Soil DNA Kits试剂盒提取土壤样品的总DNA。用琼脂糖凝胶电泳检测DNA的大小,并用NanoDrop检测DNA的纯度及浓度。氨氧化古菌amoA基因的扩增引物序列如下:Arch-amoA26F:5′-GACTACATMTTC TAYACWGAYTGGGC-3′,Arch-amoA417F:5′-GG KGTCATRTATGGWGGYAAYGTTGG-3′。
该引物可从土壤样品中扩增到约415 bp的目的基因片段。PCR反应体系(25 μL):2×PCR mix 10 μL,上、下游引物(10 μmol/L)各1 μL,模板3 μL,补足ddH2O至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。设置3个平行实验,以无菌水为空白阴性对照。将3个平行实验的PCR产物混合均匀,经2%琼脂糖凝胶电泳检测其扩增效果后,将PCR产物送至北京诺禾致源科技有限公司Illumina-Hiseq2500 PE250平台上进行高通量测序。
1.4 数据分析处理 截去Barcode和引物序列,FLASH拼接、过滤、去嵌合体序列,得到有效数据(Effective Tags)。按照97%的一致性(Identity)将序列划分操作分类单元OTUs (operational taxonomic units)。通过Mothur方法和SSUrRNA数据库对物种进行注释分析(设定阈值为0.8-1.0),统计各样本的氨氧化古菌群落组成。MUSCLE软件用于多序列比对分析,确定氨氧化古菌的系统发生关系。均一化处理后的数据用于后续氨氧化古菌Alpha和Beta多样性分析。利用Mothur软件中的thetayc算法计算样品间理化因子的差异,运行pcoa语句进行冗余分析(RDA),分析影响芦苇根际土壤氨氧化古菌多样性和丰富度的主要因子。
2 结果和分析 2.1 土壤样品理化性质分析 由表 2可知,不同季节芦苇根际与非根际土壤均为pH值7.5以上的碱性土壤;春季和夏季,根际土壤理化因子的数值均高于非根际土壤;秋季,除EC与SM外,根际土壤其他理化因子的数值均高于非根际土壤;RN4样本的盐度(EC)最低,RR7样本的盐度最高;土样中的含水量(SM)普遍偏低,但春季的含水量明显高于夏季和秋季的,这可能与艾比湖湿地荒漠生态系统本身特性有关,荒漠区域降水少,土壤的水分蒸发快,使得总体含水量较低。春季含水量较高可能是因为初春天山积雪融化,流入艾比湖的径流量增多,使得湖平面上升,土壤含水量升高;相比常规土壤,本研究中6个土样的有机质含量均较低,但芦苇根际土壤有机质含量均高于非根际土壤。
表 2. 土壤理化性质的测定结果 Table 2. Analysis of physical and chemical properties
| Sample | SM/% | pH | EC/(mS/cm) | SOM/(g/kg) | TN/(g/kg) | AN/(mg/kg) |
| RR7 | 13.89 | 7.79 | 5.33 | 18.62 | 0.35 | 41.42 |
| RN7 | 7.34 | 7.68 | 3.68 | 8.55 | 0.16 | 55.17 |
| RR10 | 5.04 | 7.60 | 3.73 | 19.71 | 0.28 | 44.17 |
| RN10 | 6.27 | 7.58 | 3.97 | 6.26 | 0.07 | 35.42 |
| RR4 | 20.43 | 7.71 | 1.08 | 19.71 | 0.14 | 32.83 |
| RN4 | 11.95 | 7.60 | 1.03 | 6.26 | 0.08 | 24.73 |
| RR7, RR10 and RR4 were rhizosphere soil of Reed in July, October and April respectively. RR7, RR10 and RR4 were non-rhizosphere soil of Reed in July, October and April respectively. | ||||||
表选项
2.2 氨氧化古菌多样性及群落结构
2.2.1 测序数据分析: 对高通量测序后的芦苇根际和非根际土壤氨氧化古菌amoA基因进行序列分析后,获得有效序列数在55745-80245范围,样品中有效OTUs数的范围为179-699 (表 3)。RN4中的OTUs数最多,RR4中物种多样性最高。RR7中物种丰富度最高。Shannon指数的稀释曲线(图 1)表明,测序量超过40000条,整个曲线已趋于平缓,说明取样合理,土壤样品测序文库已达到饱和,能比较真实地反映土壤样本氨氧化古菌的群落。测序覆盖率均高于99.4%,说明测序合理,样本的真实情况得到了合理展现(表 3)。
表 3. 土壤样品基因组DNA测序数据统计及Alpha多样性分析 Table 3. Genomic DNA sequence data statistics and Alpha diversity analysis for soil samples
| Sample name | Seq amount | OTUs amount | Shannon index | Simpson index | ACE index | Chao 1 index | Coverage |
| RR7 | 72596 | 595 | 4.273 | 0.891 | 924.366 | 834.784 | 0.994 |
| RN7 | 58853 | 179 | 5.023 | 0.946 | 195.752 | 193.526 | 0.999 |
| RR10 | 76368 | 573 | 3.948 | 0.869 | 872.598 | 814.024 | 0.994 |
| RN10 | 61107 | 334 | 5.381 | 0.945 | 391.096 | 380.500 | 0.998 |
| RR4 | 80245 | 508 | 5.672 | 0.956 | 599.236 | 598.016 | 0.997 |
| RN4 | 55745 | 699 | 4.312 | 0.875 | 842.656 | 814.321 | 0.995 |
表选项
 |
| 图 1 艾比湖湿地6种土壤样品AOA的稀疏曲线 Figure 1 Rarefaction curves of AOA in 6 soil samples in Ebinur Lake Wetland. |
| 图选项 |
2.2.2 氨氧化古菌多样性: 通过覆盖度、Simpson指数、ACE指数和Chao 1指数评估3个季节芦苇根际和非根际土壤amoA基因文库的多样性(表 3)。Shannon指数和Simpson指数结果表明,夏季和秋季,芦苇根际土壤氨氧化古菌多样性低于非根际土壤,春季芦苇根际土壤氨氧化古菌多样性高于非根际土壤;ACE指数和Chao 1指数结果与多样性结果相反,在夏季和秋季,芦苇根际土壤氨氧化古菌ACE指数和Chao 1指数显著高于非根际土壤,在春季,根际土壤ACE指数和Chao 1指数低于非根际土壤,说明,夏季和秋季芦苇根际土壤氨氧化古菌丰富度较高、多样性较低;春季芦苇根际土壤氨氧化古菌丰富度较低、多样性较高。相比夏、秋两个季节,春季芦苇根际土壤的氨氧化古菌多样性较高。
2.2.3 氨氧化古菌的群落组成: 各样本中氨氧化古菌群落在门分类水平上的分布比例见图 2。土壤样品中氨氧化古菌群落结构组成相同,主要集中在泉古菌门(Crenarchaeota)和奇古菌门(Thaumarchaeota),但在不同土壤样本中所占比例不同。泉古菌门(Crenarchaeota)中的氨氧化古菌,在夏季芦苇根际(39.9%)和非根际土壤(40.7%)中丰富度差异不明显,但在春季(52.0%)和秋季(35.2%)的根际土壤中占主要优势;奇古菌门(Thaumarchaeota)中的氨氧化古菌,在3个季节的芦苇根际土壤中的丰富度均高于非根际土壤。由此可知,秋季芦苇根际土壤氨氧化古菌的丰富度最高(82.76%),夏季次之(56.50%),春季最少(40.41%)。通过对不同季节芦苇根际与非根际土壤氨氧化古菌群落结构比较发现,泉古菌门(Crenarchaeota)是所有土壤样品中的优势门类。氨氧化古菌的多样性和丰富度随着季节的变化呈现差异,表明季节变化是影响芦苇根际土壤氨氧化古菌多样性的重要因子。
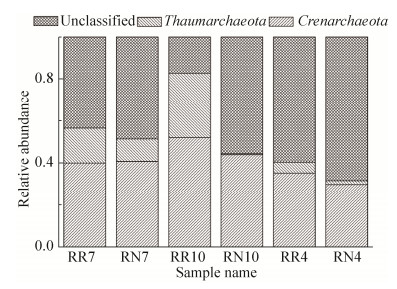 |
| 图 2 艾比湖湿地氨氧化古菌在门分类水平上的群落结构 Figure 2 Ammonia-oxidizing archaea community composition at phylum level in Ebinur Lake Wetland. |
| 图选项 |
2.3 氨氧化古菌多样性与土壤理化性质的关系 基于OTU聚类结果,利用Mothur软件中的thetayc算法计算样品间的差异,运行pcoa语句进行冗余分析(RDA)(图 3)。结果显示,PC1和PC2轴对不同季节芦苇根际和非根际土壤氨氧化古菌群落多样性解释率分别为97.1%和2.3%。春季芦苇根际和非根际土壤间理化差异性较小,夏季和秋季的差异性均较大。Crenarchaeota和Thaumarchaeota与SOM、TN、EC和AN呈正相关。Shannon指数和Simpson指数与pH、SM呈正相关,与其他指标呈负相关。ACE和Chao 1指数与SM、SOM和TN呈正相关,与其他指标呈负相关,即Shannon、Simpson、ACE和Chao 1指数均与SM呈正相关关系,说明SM是影响芦苇根际土壤氨氧化古菌多样性和丰富度的主要影响因子。
 |
| 图 3 环境因子对AOA群落多样性和丰度影响RDA分析 Figure 3 RDA analysis of the effects of environmental factors on AOA community diversity and abundance. |
| 图选项 |
3 讨论 3.1 艾比湖湿地不同季节芦苇根际非根际氨氧化古菌群落结构多样性和丰富度特征 本研究参考邵劲松[13]关于3种不同土壤微生物基因组提取方法,在提取土壤总DNA前对土样进行预处理以提高土壤微生物基因组DNA的浓度,确保后序数据处理分析的顺利进行。本研究结果显示,3个季节芦苇根际土壤氨氧化古菌多样性指数均较高,Shannon指数均达到3.948以上。何园等[14]研究表明艾比湖湿地盐节木根际土壤氨氧化细菌和氨氧化古菌Shannon指数分别为1.730、1.210。相比芦苇,盐节木根际土壤氨氧化古菌多样性指数较低,这可能与植被类型与植物根系的特点有关。盐节木和芦苇虽均为盐生植物,但其根系状况差异极大,对营养及水分的吸收也存在差异[15]。这可能是氨氧化古菌在芦苇和盐节木根际土壤中多样性指数存在差异的原因。
氨氧化古菌多样性结果显示,在春季芦苇根际土壤氨氧化古菌群落多样性高于非根际土壤,在夏季和秋季低于非根际土壤。春季芦苇根际氨氧化古菌多样性较高可能与根系环境及土壤含水量有关。植物可以影响土壤理化指标的变化间接地影响土壤微生物的多样性[15-16]。植物根系能够分泌糖、有机酸、氨基酸、激素、胞外酶等多种分泌物,这些物质可为微生物提供足够的能源[17]。研究表明,根际分泌物等因素会使芦苇产生根际效应,使其根际土壤微生物活性及群落稳定性均高于非根际土壤[18],植物根际微生物的存在会形成特定的根际效应,这可能是芦苇根际氨氧化古菌多样性较高的原因之一;相关性结果显示,氨氧化古菌多样性及丰富度均与含水量呈正相关关系(图 3)。春季,新疆天山冰雪融化、降雨量增多使得艾比湖湖面上升,土壤含水量增加,相对于夏秋两季,春季土壤含水量最高。芦苇根系发达,能够充分吸收土壤水分和养分来适应盐渍环境,维持根际微生物群落的稳定性[19]。根际土壤微生物的高活性及群落的稳定性能够为氨氧化古菌提供适合其生长的稳定根系环境,这可能也是春季芦苇根际土壤氨氧化古菌多样性高于非根际土壤的原因。根际效应对土壤微生物活性有着强烈的影响,包括氮循环等微生物学过程[20]。一些研究已经表明了氨氧化作用根际正效应的存在[21],但根际土壤也存在潜在的硝化抑制剂可轻微抑制根际微生物的硝化活性[22]。本研究中夏秋两季非根际土壤中氨氧化古菌多样性高于根际土壤,证实了根际分泌物中可能存在抑制硝化作用的物质。
研究结果显示,相比夏秋两季,春季芦苇根际土壤氨氧化古菌丰富度最低,这可能与新疆春季时间较短、气温偏低有关。研究表明温度能影响AOA的群落结构。温度低时,生物酶催化新陈代谢的速率减慢,氨氧化微生物活性会受到影响[23]。Urakawa等[24]研究表明,低温使AOA的丰度降低。芦苇虽为典型的耐盐碱植物,但春季气温偏低,其呼吸代谢速率减慢,导致根际微生物群落发生变化[25]。以上可能是春季氨氧化古菌丰富度最低的原因。
3.2 氨氧化古菌群落结构多样性和丰富度在芦苇根际非根际土壤中的环境异质性特点 微生物群落多样性和组成在不同生境之间的差异与土壤理化性质密切相关,生境不同,根际微生物群落结构不同[26],植被组成、植物残体、根系分泌物等生态因子是导致差异的可能原因[27]。本研究结果表明,EC含量的变化可能影响泉古菌门和奇古菌门中氨氧化古菌群落结构的变化。AOA的群落特征受多种环境因子的影响,本研究中盐度(EC)是AOA群落生境分异的一个重要因子。研究表明,盐度(EC)是解释AOA群落结构模式的主要因素,因为盐度能阻止频繁的环境变化[28],Zhang等[29]指出,中等的盐浓度更加适宜AOA的生长。一般盐渍化土壤偏碱性,养分含量低,不利于土壤微生物的生长和繁殖[30],表明EC是土壤微生物群落结构重要限制因子。本研究中3个季节芦苇根际土壤EC含量不同,氨氧化古菌群落结构也存在差异。推测原因可能是EC含量的不同使根际土壤其他类群微生物群落发生变化,改变了芦苇根际土壤微生态环境从而间接影响氨氧化古菌的群落结构。
本研究结果显示SM含量的变化可能影响芦苇根际氨氧化古菌多样性和丰富度的变化。郑有坤[31]在研究若尔盖高原湿地土壤氨氧化古菌多样性时发现,氨氧化微生物与SM相关性不显著,这与本研究结果不一致,可能是因为采样地的不同。艾比湖湿地属于干旱区荒漠生态系统,为典型的大陆型气候,研究区干燥、少雨、多风,四季气候悬殊,夏、冬季漫长,春、秋季短暂。此外本研究区土壤盐渍化程度高,盐生植物覆盖少,土壤普遍贫瘠,土壤含水量成为了限制植被及其他微生物生长繁殖的主要环境因子。本研究结果中SM与氨氧化古菌多样性及丰富度均呈正相关关系证实了此观点(图 3)。
冗余分析(RDA)显示不同季节氨氧化古菌的群落结构及多样性存在差异,这可能与春、夏、秋3个季节的温度变化有关,研究区气候干燥,昼夜温差大,季节性温度差异更为明显。温度可能会影响AOA群落结构。研究表明在旧金山海湾河口中发现的AOA群落与温度显著相关[32]。陈杨武[33]、Avrahami[34]、Hugoni[35]也指出温度会引起AOA群落结构的改变。在水簇箱过滤系统中,温度较低时,AOA的多样性也较低[24]。Tourna等[36]设计了不同温度(10-30 ℃,5 ℃/梯度)的微生态系统培养试验,其DGGE结果显示,不同培养温度条件下的AOA群落结构及多样性均呈现出差异。这可能是艾比湖湿地不同季节AOA多样性及群落结构存在差异的原因。
4 结论 研究表明,夏季和秋季芦苇根际土壤氨氧化古菌多样性低于非根际土壤,丰富度高于非根际土壤,春季结果相反。不同季节根际土壤氨氧化古菌多样性存在差异,芦苇根际土壤氨氧化古菌的多样性在春季最高,夏季次之,秋季最低。冗余分析表明,SOM、EC、AN和TN与泉古菌门和奇古菌门中氨氧化古菌类群呈正相关关系;SM是影响芦苇根际土壤氨氧化古菌多样性和丰富度的主要环境因子。
References
| [1] | Liu JG, Liu WG. Advances in microbial-mediated nitrogen cycling. Acta Agrestia Sinica, 2018, 26(2): 277-283. (in Chinese) 刘建国, 刘卫国. 微生物介导的氮循环过程研究进展. 草地学报, 2018, 26(2): 277-283. |
| [2] | Yang XQ, Lian YL, Yan QY, He ZL. Microbially-driven nitrogen cycling in coastal ecosystems. Acta Microbiologica Sinica, 2018, 58(4): 633-648. (in Chinese) 杨雪琴, 连英丽, 颜庆云, 贺志理. 滨海湿地生态系统微生物驱动的氮循环研究进展. 微生物学报, 2018, 58(4): 633-648. |
| [3] | Liu Y, Chen JS, Liu Q, Chen LW. Advances in studies of soil nitrification and denitrification and controlling factors. Journal of Sichuan Forestry Science and Technology, 2006, 27(2): 36-41. (in Chinese) 刘义, 陈劲松, 刘庆, 陈林武. 土壤硝化和反硝化作用及影响因素研究进展. 四川林业科技, 2006, 27(2): 36-41. DOI:10.3969/j.issn.1003-5508.2006.02.007 |
| [4] | He JZ, Shen JP, Zhang LM, Zhu YG, Zheng YM, Xu MG, Di HJ. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese Upland red soil under long-term fertilization practices. Environmental Microbiology, 2007, 9(9): 2364-2374. DOI:10.1111/j.1462-2920.2007.01358.x |
| [5] | Xu JY, Mao YP. From canonical nitrite oxidizing bacteria to complete ammonia oxidizer: discovery and advances. Microbiology China, 1-15 (2018-06-25)[2019-03-12]. https://doi.org/10.13344/j.microbiol.china.180194. 徐建宇, 毛艳萍.从典型硝化细菌到全程氨氧化微生物: 发现及研究进展.微生物学通报, 1-15 (2018-06-25)[2019-03-12]. https://doi.org/10.13344/j.microbiol.china.180194. |
| [6] | Chen Z, Wu WL, Shao XM, Li L, Guo YB, Ding GC. Shifts in Abundance and diversity of soil ammonia-oxidizing bacteria and archaea associated with land restoration in a semi-arid ecosystem. PLoS One, 2015, 10(7): e0132879. DOI:10.1371/journal.pone.0132879 |
| [7] | Zhou XH, Li YM, Zhang JP, Liu B, Wang MY, Zhou YW, Lin ZJ, He ZL. Diversity, abundance and community structure of ammonia-oxidizing archaea and bacteria in riparian sediment of Zhenjiang ancient canal. Ecological Engineering, 2016, 90: 447-458. DOI:10.1016/j.ecoleng.2016.01.068 |
| [8] | Song ZQ, Wang L, Zhou EM, Wang FP, Xiao X, Zhang CL, Li WJ. Abundances of ammonia-oxidizing archaeal accA and amoA genes in response to NO2- and NO3- of hot springs in Yunnan province. Acta Microbiologica Sinica, 2014, 54(12): 1462-1470. (in Chinese) 宋兆齐, 王莉, 周恩民, 王风平, 肖湘, 张传伦, 李文均. 云南热泉中氨氧化古菌的accA基因与amoA基因丰度与环境因子NO2-和NO3-的相关性. 微生物学报, 2014, 54(12): 1462-1470. |
| [9] | Ye L, Zhu GB, Wang Y, Feng XJ, Wang WD, Wang SY, Yin CQ. Abundance and biodiversity of ammonia-oxidizing archaea and bacteria in littoral wetland of Baiyangdian Lake, North China. Acta Ecologica Sinica, 2011, 31(8): 2209-2215. (in Chinese) 叶磊, 祝贵兵, 王雨, 冯晓娟, 王为东, 王衫允, 尹澄清. 白洋淀湖滨湿地岸边带氨氧化古菌与氨氧化细菌的分布特性. 生态学报, 2011, 31(8): 2209-2215. |
| [10] | Liang ZY. Occurrence of ammonia-oxidizing archaea in wastewater treatment plant. Master Dissertation of Harbin Institute of Technology, 2013. (in Chinese) 梁昭云.污水处理系统中氨氧化古菌的种群分布研究.哈尔滨工业大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10213-1013038459.htm |
| [11] | Zhou HH, Chen YN, Li WH. Species diversity and dominance population distribution pattern in oasis-desert ecotone. Journal of Desert Research, 2009, 29(4): 688-696. (in Chinese) 周洪华, 陈亚宁, 李卫红. 塔里木河下游绿洲-荒漠过渡带植物多样性特征及优势种群分布格局. 中国沙漠, 2009, 29(4): 688-696. |
| [12] | Lu RK. Methods of Analysis of soil and agro-chemistry. Beijing, China: China Agricultural Science and Technology Press, 2000. |
| [13] | Shao JS, Pu MY, Gu ZJ. Comparison of the three methods of extracting the genome DNA of microorganism in soil. Journal of Nanjing Xiaozhuang University, 2013(3): 64-67. (in Chinese) 邵劲松, 浦牧野, 顾祝军. 3种土壤微生物基因组DNA提取方法的比较. 南京晓庄学院学报, 2013(3): 64-67. DOI:10.3969/j.issn.1009-7902.2013.03.016 |
| [14] | He Y, Hu WG, Ma DC, Yang Y, Lan HZ, Gao Y. Diversity and abundance of ammonia-oxidizing microorganisms in relation to soil environment in rhizosphere soil of Halocnemum strobilaceum in Ebinur Lake wetland. Acta Scientiae Circumstantiae, 2017, 37(5): 1967-1975. (in Chinese) 何园, 胡文革, 马得草, 杨扬, 兰鸿珠, 高岩. 艾比湖湿地盐节木根际土壤氨氧化微生物多样性和丰度及其与环境因子的相关性分析. 环境科学学报, 2017, 37(5): 1967-1975. |
| [15] | Wang JY, Wang ML, Zhang FH. Soil microbial properties under typical halophytic vegetation communities in arid regions. Acta Ecologica Sinica, 2016, 36(8): 2363-2372. (in Chinese) 王静娅, 王明亮, 张凤华. 干旱区典型盐生植物群落下土壤微生物群落特征. 生态学报, 2016, 36(8): 2363-2372. |
| [16] | Su XL, Li YB, Yang B, Li Q. Effects of plant diversity on soil microbial communities in subtropical forests. Chinese Journal of Ecology, 2018, 37(8): 2254-2261. (in Chinese) 宿晓琳, 李英滨, 杨波, 李琪. 植物多样性对亚热带森林土壤微生物群落的影响. 生态学杂志, 2018, 37(8): 2254-2261. |
| [17] | Zhang F, Shen J, Li L, Liu X. An overview of rhizosphere processes related with plant nutrition in major cropping systems in China. Plant and Soil, 2004, 260(1/2): 89-99. DOI:10.1023/B:PLSO.0000030192.15621.20 |
| [18] | Xiang XM, Song CX, Li YS, Sun XY. Microorganism features of Typha latifolia and Phragmites australis at rhizosphere. Environmental Protection Science, 2004, 30(4): 35-38. (in Chinese) 项学敏, 宋春霞, 李彦生, 孙祥宇. 湿地植物芦苇和香蒲根际微生物特性研究. 环境保护科学, 2004, 30(4): 35-38. DOI:10.3969/j.issn.1004-6216.2004.04.013 |
| [19] | Wang JW, Zhao CZ, Zhao LC, Wang XP, Li Q. Response of root morphology and biomass of Phragmites australis to soil salinity in inland salt marsh. Acta Ecologica Sinica, 2018, 38(13): 4843-4851. (in Chinese) 王继伟, 赵成章, 赵连春, 王小鹏, 李群. 内陆盐沼芦苇根系形态及生物量分配对土壤盐分因子的响应. 生态学报, 2018, 38(13): 4843-4851. |
| [20] | Herman DJ, Johnson KK, Jaeger CH, Schwartz E, Firestone MK. Root influence on nitrogen mineralization and nitrification in Avena barbata rhizosphere soil. Soil Science Society of America Journal, 2006, 70(5): 1504-1511. DOI:10.2136/sssaj2005.0113 |
| [21] | Chen XP, Zhu YG, Xia Y, Shen JP, He JZ. Ammonia-oxidizing archaea: important players in paddy rhizosphere soil?. Environmental Microbiology, 2008, 10(8): 1978-1987. DOI:10.1111/j.1462-2920.2008.01613.x |
| [22] | Subbarao GV, Rondon M, Ito O, Ishikawa T, Rao IM, Nakahara K, Lascano C, Berry WL. Biological nitrification inhibition (BNI)-is it a widespread phenomenon?. Plant and Soil, 2007, 294(1/2): 5-18. |
| [23] | Xiang Y, Li JG, Guan M, Wang JL. Advances in microbial ecology of aerobic ammonia-oxidizing microorganisms. Guizhou Agricultural Sciences, 2012, 40(9): 115-120. (in Chinese) 向燕, 李建光, 关梅, 王金乐. 好氧氨氧化微生物生态学研究进展. 贵州农业科学, 2012, 40(9): 115-120. DOI:10.3969/j.issn.1001-3601.2012.09.032 |
| [24] | Urakawa H, Tajima Y, Numata Y, Tsuneda S. Low temperature decreases the phylogenetic diversity of ammonia-oxidizing archaea and bacteria in aquarium biofiltration systems. Applied and Environmental Microbiology, 2008, 74(3): 894-900. DOI:10.1128/AEM.01529-07 |
| [25] | Zhang XH, Hu WG, Mo C, Wang CH, Wu F, Guo Y. Correlation of actinobacteria community diversity in three different rhizospheres and physicochemical properties in natural reserve of Ebinur Lake Wetland. Environmental Science & Technology, 2015, 38(12): 22-31. (in Chinese) 张晓红, 胡文革, 莫超, 王翠华, 武菲, 郭飏. 艾比湖湿地根际放线菌多样性及其环境响应. 环境科学与技术, 2015, 38(12): 22-31. |
| [26] | Wang X, Jie WG, Cai BY. Community composition of the AM fungi of Phellodendron amurense in different habitats. Scientia Silvae Sinicae, 2012, 48(9): 99-107. (in Chinese) 王雪, 接伟光, 蔡柏岩. 不同生境黄檗AM真菌菌群结构分析. 林业科学, 2012, 48(9): 99-107. |
| [27] | Kowalchuk GA, Buma DS, de Boer W, Klinkhamer PGL, van Veen JA. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. Antonie Van Leeuwenhoek, 2002, 81(1/4): 509. |
| [28] | Cao HL, Auguet JC, Gu GD. Global ecological pattern of ammonia-oxidizing archaea. PLoS One, 2013, 8(2): e52853. DOI:10.1371/journal.pone.0052853 |
| [29] | Zhang Y, Chen LJ, Dai TJ, Tian JP, Wen DH. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment: a microcosm study. Applied Microbiology and Biotechnology, 2015, 99(22): 9825-9833. DOI:10.1007/s00253-015-6804-x |
| [30] | Yang H, Hu JX, Long XH, Liu ZP, Rengel Z. Salinity altered root distribution and increased diversity of bacterial communities in the rhizosphere soil of Jerusalem artichoke. Scientific Reports, 2016, 6: 20687. DOI:10.1038/srep20687 |
| [31] | Zheng YK, Wang XB, Gu YF, Zhang XP. Diversity of ammonia-oxidizing archaea in Tibetan Zoige plateau wetland. Acta Microbiologica Sinica, 2014, 54(9): 1090-1096. (in Chinese) 郑有坤, 王宪斌, 辜运富, 张小平. 若尔盖高原湿地土壤氨氧化古菌的多样性. 微生物学报, 2014, 54(9): 1090-1096. |
| [32] | Mosier AC, Francis CA. Relative abundance and diversity of ammonia-oxidizing archaea and bacteria in the San Francisco Bay estuary. Environmental Microbiology, 2008, 10(11): 3002-3016. DOI:10.1111/j.1462-2920.2008.01764.x |
| [33] | Chen YW, Hu S, Fang L, Jiang DM, Tan ZL, Li XD. Progress on ammonia-oxidizing archaea and their response to environmental factors. Chinese Journal of Applied & Environmental Biology, 2014, 20(6): 1117-1123. (in Chinese) 陈杨武, 胡爽, 方露, 蒋登梅, 谭周亮, 李旭东. 氨氧化古菌及其对环境因子的响应研究进展. 应用与环境生物学报, 2014, 20(6): 1117-1123. |
| [34] | Avrahami S, Liesack W, Conrad R. Effects of temperature and fertilizer on activity and community structure of soil ammonia oxidizers. Environmental Microbiology, 2003, 5(8): 691-705. DOI:10.1046/j.1462-2920.2003.00457.x |
| [35] | Hugoni M, Etien S, Bourges A, Lepère C, Domaizon I, Mallet C, Bronner G, Debroas D, Mary I. Dynamics of ammonia-oxidizing Archaea and Bacteria in contrasted freshwater ecosystems. Research in Microbiology, 2013, 164(4): 360-370. DOI:10.1016/j.resmic.2013.01.004 |
| [36] | Tourna M, Freitag TE, Nicol GW, Prosser JI. Growth, Activity and temperature responses of ammonia-oxidizing archaea and bacteria in soil microcosms. Environmental Microbiology, 2008, 10(5): 1357-1364. DOI:10.1111/j.1462-2920.2007.01563.x |
