曹子敏, Banda Joseph Frazer, 裴理鑫, 卫朋飞, 辛瑞瑞, 董慧渊, 郝春博


中国地质大学(北京)水资源与环境学院, 北京 100083
收稿日期:2018-12-15;修回日期:2019-05-05;网络出版日期:2019-05-13
基金项目:中央高校基本科研业务费项目(2652015114)
作者简介:郝春博,男,内蒙古包头人,副教授,硕士生导师。2006年毕业于中国科学院生态环境研究中心,获博士学位。2009年6-9月在香港大学地球科学系任访问****。2013年入选北京高等学校“青年英才计划”。2017年11月-2018年12月在美国迈阿密大学微生物学系任访问****。主要研究方向为极端环境微生物学。主持国际自然科学基金、教育部博士点基金等科研项目20余项;在Environmental Pollution、Extremophiles等杂志上发表学术论文20多篇.
*通信作者:郝春博, Tel:+86-10-82322332, E-mail:chunbohao@cugb.edu.cn.
摘要:[目的] 研究安徽某铁矿不同矿山废水库中微生物群落结构特征及其影响因素。[方法] 对比分析了该铁矿3个大型废水库的地球化学特征,并用高通量测序技术研究了水体中微生物群落组成,进而用统计学方法解析了环境因子对微生物群落结构的影响。[结果] 3个废水库中有2个为酸性,1个为中性,理化性质有明显的差异。近年形成的塌方采场废水库(TF)pH仅为2.55±0.01,Fe浓度高达154.95±0.78 mg/L,SO42-浓度为3374.86±3.81 mg/L;形成于20世纪70年代的排土场废水库(PT)酸性略弱(pH 2.9±0.02),Fe浓度(34.57±4.00 mg/L)与TF相比明显降低,SO42-浓度则高达10398.98±626.70 mg/L;东沙采场废水库(DS)则为中性(pH 7.55),但SO42-仍高达4162.99 mg/L,主要的金属离子为Mg(594.90 mg/L)、Ca(650.10 mg/L)。3个废水库的原核生物多样性随pH的升高而升高。两个酸性废水库的原核生物组成较为接近,但TF的化能自养菌含量较高(69.54%±2.89%),PT的化能异养菌含量较高(64.45%±13.81%)。自养铁氧化菌Ferrovum在TF中的比例高达(64.17±1.84)%,在PT中则下降为(35.39±13.74)%。但PT中含有丰富的化能异养嗜酸菌如Acidicapsa(15.75%±3.99%)、Acidiphilium(10.65%±2.05%)、Acidisphaera(6.34%±1.02%)等。DS中虽然也含有较高的金属离子和SO42-,但其中的原核生物组成与TF和PT截然不同,主要为Limnohabitans(18.47%)、Rhodobacter(8.42%)等。3个废水库的真核生物群落主要由藻类组成,酸水库TF和PT中主要为棕鞭藻属(Ochromonas)和胶球藻属(Coccomyxa),棕鞭藻属在TF中(53.65%±2.02%)占优势,胶球藻属在PT中(68.84±10.4%)占优势,中性废水库DS中则主要是小环藻属(Cyclotella)(49.85%)。经统计学分析,pH是影响矿山废水微生物多样性和群落组成的主要环境因素。
关键词:矿山废水高通量测序嗜酸菌群落结构
Microbial community structure characteristics in different mine drainage lakes of an iron mine in Anhui Province
Zimin Cao, Joseph Frazer Banda, Lixin Pei, Pengfei Wei, Ruirui Xin, Huiyuan Dong, Chunbo Hao


School of Water Resources and Environment, China University of Geosciences, Beijing 100083, China
*Corresponding author: Chunbo Hao, Tel:+86-10-82322332, E-mail:chunbohao@cugb.edu.cn.
Foundation item: Supported by the Central University Basic Research Business Expenses Project (2652015114)
Abstract: [Objective] To study the prokaryotic and eukaryotic community structure and the physicochemical factors influencing their distribution in three mine wastewater lakes from a pyrite mine in Anhui Province. [Methods] Geochemical analysis characteristics of three wastewater lakes were measured, and microbial community compositions of the lakes were studied using high-throughput sequencing. The relationship between microbial community structure and environmental factors was also analyzed based on statistical methods. [Results] Samples from three wastewater lakes included two acidic and one neutral, with significant differences in physicochemical properties. Lake TF, typically acidic, formed about 5 years ago and is characterized by low pH (2.55±0.01), Fe (154.95±0.78 mg/L) and SO42- (3374.86±3.81 mg/L). Lake PT is also acidic, pH (2.9±0.02), however, it formed in the 1970's, and has significantly lower Fe (34.57±4.00 mg/L) and higher SO42- (10398.98±626.70 mg/L) than lake TF. Lake DS is neutral (freshwater), characterized by pH (7.55), high content of SO42- (4162.99 mg/L), while other main metal ions detected were Mg (594.90 mg/L) and Ca (650.10 mg/L). It was observed that the prokaryotic biodiversity of the three wastewater lakes generally increased with increasing pH. The prokaryotic composition of the two acidic wastewater lakes was relatively close. However, lake TF was dominated by autotrophic iron oxidizing bacteria (69.54%±2.89%), while lake PT by heterotrophic bacteria (64.45%±13.81%). The ratio of autotrophic iron oxidizing bacteria Ferrovum in TF was (64.17±1.84)%, and it decreased to (35.39±13.74)% in PT. However, heterotrophic bacteria were abundant in PT as observed by the distribution of Acidicapsa (15.75%±3.99%), Acidiphilium (10.65%±2.05%), and Acidisphaera (6.34%±1.02%). Lake DS had a typically distinct microbial community compared to acid lakes (TF and PT) despite of a high content SO42-. Lake DS had an abundance of Limnohabitans (18.47%) and Rhodobacter (8.42%). The eukaryotic community of three wastewater lakes was mainly composed of algae. The acidic lakes (TF and PT) were mainly populated by Ochromonas and Coccomyxa, accounting for (53.65%±2.02%) in TF and (68.84%±10.4%) in PT respectively. Lake DS was mainly characterized by Cyclotella (49.85%). From our analyses of physicochemical factors, we found that pH was the main factor affecting microbial community composition in acidic wastewater lakes.
Keywords: mine drainagehigh-throughput sequencingacidophilemicrobial community structure
矿山废水是在矿山开采过程中产生的各种废水的总称。地下水渗流到矿井中,之后这些水被排放到地表,汇集在一起形成矿山废水;采矿过程中产生大量的矿山废石或尾矿,在露天堆放储存时,经过风化、雨水冲刷也可形成矿山废水[1]。矿山废水中通常含有高浓度的重金属和有机污染物[2],排放后会对土壤和水体造成严重污染,导致动植物大量死亡,并通过食物链最终危害人体健康。在采矿停止数百年后,矿山废水仍然可以持续造成污染[3]。
按照矿山废水的酸碱度可以分为碱性矿山废水和酸性矿山废水[4]。碱性矿山废水来源于选矿作业。在对矿石进行浮选过程中,为获取最佳的分离效果,需要对矿浆体系加入酸碱调整剂进行调整,由此而产生的矿山废水通常呈碱性。但在矿山环境中,分布最广、危害最严重的是酸性矿山废水(acid mine drainage,AMD),它是全球工业和后工业区域最严重的水污染形式之一[5]。酸性矿山废水的pH值通常为2–4,含有高浓度的铁、铝、锰、铅、镉、锌和砷等有毒金属和准金属,危害十分严重[6]。酸性矿山废水是在采矿或者硫化矿石(如黄铁矿或砷黄铁矿)加工时所产生的废物与含氧水接触时所产生的。以黄铁矿为例,其总体化学反应式为:FeS2+14Fe3++8H2O→15Fe2++2SO42–+ 16H+。从方程式中可以看出,Fe3+是黄铁矿最主要的氧化剂。Fe3+氧化黄铁矿形成H2SO4,而产物中的Fe2+又会被氧气氧化成Fe3+,Fe3+再与黄铁矿反应,这样就形成了一个循环。不过在酸性条件下,水体中大量的H+使得Fe2+的非生物氧化速度变慢[3]。但是在低pH条件下,一些嗜酸铁氧化微生物可以将Fe2+氧化为Fe3+来获得能量,用于自身的生长。这些微生物的存在大大提高了黄铁矿氧化速率,加速了酸性矿山废水的形成[7]。已经有许多研究者报道了各种酸性条件下的微生物群落结构组成和变化规律[8]。这些研究为全面了解酸性微生物在酸性矿山废水的产生和在酸性条件下元素循环中的作用提供了可能,对修复矿山环境也具有极其重要的意义。
中国安徽省东部某铁矿于20世纪初开始开采,开采过程中形成了大量矿坑。这些矿坑经过自然降水和人工排水,形成了大小不一的矿山废水库。这些矿山废水库中的废水经过下渗、漫流,严重污染环境,是中国矿山废水污染的典型案例。这些不同时期形成的矿山废水库,是研究矿山废水形成机制、微生物群落结构和功能演变过程的良好样本。因此本研究选择了3个不同时期形成的矿山废水库采集样品,研究了矿山废水中微生物多样性及群落结构的变化规律,进而探索了环境因子对微生物群落的影响。研究结果可以为控制矿山废水的产生及生物修复提供理论依据。
1 材料和方法 1.1 采样区描述及样品采集 研究区域位于安徽省东部,属亚热带季风气候,年平均气温16 ℃,年降水量为1100 mm[9]。本研究选取了3个规模较大且形成过程不同的废水库作为研究对象。塌方采场废水库(TF)原为一个露天采坑,发生山体滑坡后停止生产。由于降水对矿坑内矿石的氧化,于2013年前后在采坑内形成大量酸性废水。目前该废水库长约460 m,宽约300 m,水域面积约8.42×104 m2。
排土场废水库(PT)在TF废水库的东侧,直线距离大约相距2 km。该废水库形成于20世纪70年代,水库周边是该矿区主要废石堆放地。大量的含硫废矿石经风吹雨淋,经过一系列氧化反应形成酸性废水汇集到一起形成如今的废水库。该水库目前长约700 m,宽约300 m,总汇水面积约3 km2,水域面积约1.0×105 m2。
东沙采场废水库(DS)在TF废水库的西南约500 m。该废水库原为该矿区最早形成的大型采坑。经过长年采矿,矿石已经枯竭,现已闭坑十余年,目前用于储存尾矿浆。该废水库目前长约750 m,宽约590 m,水域面积约3.32×105 m2。
虽然这3个废水库直线距离很近,但由于形成时间和形成方式不同,所以物理化学参数有明显差异,是研究矿山废水中微生物群落结构和演变的良好样本。
1.2 样品采集 本研究于2015年10月采集了这3个矿山废水库的表层水样。采样点距离库边大约50 cm,采集深度约为10–20 cm,采样点如图 1所示。塌方废水库采集样品2个,命名为TF1、TF2,两点相距约150 m。在排土场废水库采集样品3个,分别命名为PT1、PT2、PT3,PT2距离PT1约有320 m,PT3和PT1相距约250 m,PT2与PT3相距约230 m。因为东沙采场废水库仍在生产,无法进入内部区域采样,所以仅在矿浆排放口附近采集样品1个,命名为DS。
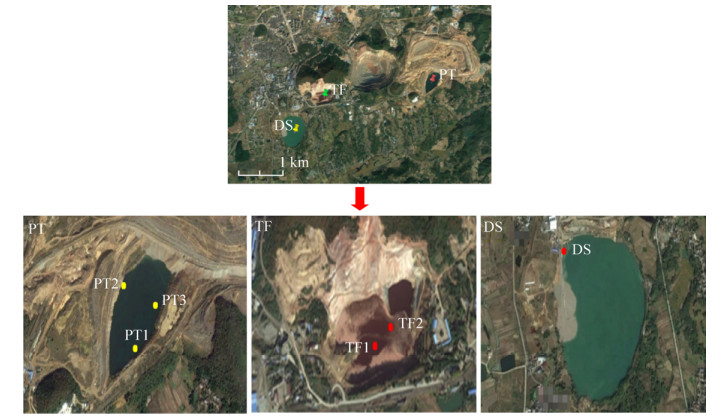 |
| 图 1 采样点位置图 Figure 1 Locations of sampling sites |
| 图选项 |
用于测定TIC/TOC的样品在现场用0.45 μm的滤器过滤到棕色玻璃瓶中,并加入HgCl2进行生物灭活。用于其他物化指标测试的样品均过滤到聚乙烯瓶中,测定金属的样品加适量硝酸酸化。用0.22 μm的水系无菌滤膜过滤1000 mL的水样收集菌体,用于后续生物分析。所有的样品采集完成后都保存于4 ℃保温箱,并立即带回实验室进行分析。
1.3 物化参数测定 水样的温度和pH利用哈纳水质测定仪(Hanna,Italy)现场进行测定,其他指标均在实验室测定。利用离子色谱仪(Thermo,USA)测定SO42–、Cl–,有机碳测定分析仪(Analytikjena,Germany)测定TIC/TOC,ICP (ICP-AES,Thermo,USA)测定金属元素[10]。在105 ℃将样品蒸发至恒重测定矿化度。依据水和废水监测分析方法(第四版)中的标准方法测定二价铁、总磷、硝氮、氨氮,具体方法为:利用邻菲罗啉分光光度法测定二价铁,利用钼锑抗分光光度法测定总磷,利用紫外分光光度法测定硝氮,利用纳氏试剂分光光度法测定氨氮[11]。
1.4 DNA提取、PCR扩增及高通量测序 利用MPBio FastDNA? DNA试剂盒提取水样DNA,提取后于–80 ℃冰箱保存。用高通量测序引物F515 (5'-GTGCCAGCMG CCGCGGTAA-3')和R806 (5'-GGACTACVSGGGT ATCTAAT-3')[12]扩增原核生物16S rRNA基因。用F528 (5'-GCGGTAATTCCAGCTCCAA-3')和R706 (5'-AATCCRAGAATTTCACCTCT-3')扩增真核微生物18S rRNA基因。其中,上述引物R806和R706各有一段12 bp的Barcode序列,用以区分不同的样品。原核生物和真核生物16S/18S rRNA基因PCR反应条件为:预变性94 ℃ 3 min;变性94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 90 s,共35个循环;最后在72 ℃下延伸10 min。
PCR扩增产物用1%的琼脂糖凝胶进行电泳检测,若扩增片段符合要求,则用2%琼脂糖凝胶进行电泳跑胶,并将目的片段于紫外灯下切下,利用DNA凝胶回收试剂盒KitVer.2.0 (TaKaRa)进行纯化。扩增纯化后的样品送至上海美吉生物医药科技有限公司采用Illumina Miseq测序仪进行测序。
1.5 数据分析 获得的高通量数据利用Mothur软件鉴定并去除低质序列和嵌合体,不同样品获得的高质量序列为15930–29496。为了减少由于不同测序深度引起的潜在偏差,统一测序深度为15900。用cluster命令得到相似性大于97%的OTU(operational taxonomic unit),再使用classify.seqs命令把代表性OTU与silva.na_v128数据库进行对比分析,置信度阈值为80%。用summary.single命令计算Shannon多样性指数。
所有的统计分析都使用R包(http://www.r-project.org/)来实现的。使用R包gplots对不同样品中的属的相对丰度进行聚类和可视化。基于OTU相对丰度的Bray-Curtis距离,进行相似性分析(ANOSIM)比较不同样品的微生物群落。用Pearson相关系数来评价属组成与环境因子之间的关系和多样性指数与环境因子之间的关系,评价主要物理化学参数对微生物群落结构的影响。使用Mantel分析微生物群落结构与环境变量之间的关系。用Canoco 4.5计算各主要环境因子对原核微生物群落结构的影响。
1.6 序列登录号 本文的序列已提交GenBank,登录号为SRR7958232–SRR7958237 (16S rRNA基因序列)、SRR8205360–SRR8205362 (18S rRNA基因序列)。
2 结果和分析 2.1 矿山废水的理化性质 3个矿山废水库的物理化学性质差异明显(表 1)。新形成的酸水库TF的pH值仅为2.55左右,Fe浓度高达154.95±0.78 mg/L,SO42–浓度达3374.86±3.81 mg/L,其他主要的金属离子为Mg (222.74±1.93 mg/L)、Ca (322.20±13.20 mg/L)、Al (139.29±3.72 mg/L)。
表 1. 样品物理化学参数 Table 1. Physicochemical parameters of the samples
| Sample | TF1 | TF2 | PT1 | PT2 | PT3 | DS |
| pH | 2.54 | 2.55 | 2.97 | 2.92 | 2.93 | 7.55 |
| T/ ℃ | 24.37 | 23.06 | 21.13 | 22.39 | 22.62 | 25.55 |
| NH4+-N/(mg/L) | 2.29 | 2.38 | 2.94 | 3.48 | 2.78 | 2.79 |
| TP/(mg/L) | 0.40 | 4.08 | 0.24 | 6.27 | 2.38 | 1.00 |
| Fe2+/(mg/L) | 9.02 | 5.55 | 12.93 | 8.17 | 8.72 | 0.13 |
| SO42–/(mg/L) | 3378.67 | 3371.06 | 9565.16 | 11076.06 | 10555.71 | 4162.99 |
| Salinity/(g/L) | 5.54 | 4.95 | 13.37 | 14.62 | 14.40 | 6.32 |
| Al/(mg/L) | 135.57 | 143.01 | 551.10 | 623.40 | 627.30 | 0.12 |
| Ca/(mg/L) | 309.00 | 335.40 | 484.20 | 509.40 | 510.90 | 650.10 |
| Cu/(mg/L) | 10.59 | 11.16 | 25.78 | 29.28 | 29.81 | 0.02 |
| Fe/(mg/L) | 154.17 | 155.73 | 40.23 | 31.56 | 31.92 | 0.12 |
| K/(mg/L) | 1.13 | 1.97 | 2.12 | 5.83 | 4.64 | 30.78 |
| Mg/(mg/L) | 220.80 | 224.67 | 979.20 | 1178.10 | 1153.80 | 594.90 |
| Mn/(mg/L) | 18.16 | 18.01 | 172.44 | 215.16 | 212.19 | 38.39 |
| Na/(mg/L) | 20.29 | 22.18 | 29.14 | 35.55 | 33.51 | 97.98 |
| Zn/(mg/L) | 2.11 | 3.08 | 7.90 | 10.20 | 10.23 | 0.03 |
| TIC/(mg/L) | 4.63 | 0.54 | 2.04 | 0.27 | 0.6 | 11.65 |
| TOC/(mg/L) | 0.7 | 0.45 | 0.87 | 0.67 | 0.67 | 1.67 |
表选项
废水库PT的pH值为2.9±0.02,比TF酸性要弱,Fe (34.57±4.00 mg/L)浓度明显低于TF,但SO42–含量远远高于TF,达到10398.98±626.70 mg/L,其他主要的金属离子Mg (1103.70±88.59 mg/L)、Al (600.60±35.04 mg/L)、Ca (501.50±12.25 mg/L)、Mn (199.93±19.48 mg/L)含量也明显比TF要高。
与上述两个酸水库不同,DS是一个中性矿山废水库,pH值为7.55;SO42–的浓度也高达4162.99 mg/L,介于PT和TF两者之间;主要金属离子为Mg (594.90 mg/L)、Ca (650.10 mg/L)。
可以看出,3个废水库中均含有高浓度的金属离子和SO42–。如此高浓度的阴阳离子,即使废水库中的废水不外溢,仅仅通过下渗以及地下水循环也会对周边农田以及居民饮用水造成严重的影响。
2.2 原核微生物群落多样性 所有样品的菌群丰富度指数(Chao/Ace)、多样性指数(Shannon/Simpson)以及测序深度指数(Good’s Coverage)见表 2。6个样品共获得1236个OTUs,其中,样品DS的OTUs数最多,为352个,样品PT1的OTUs数最少,为258个。6个样品的覆盖度均在98%以上,表明本次研究的测序深度已覆盖环境样品微生物群落组成。香农指数在TF、PT和DS这3个废水库依次为1.53±0.03、2.46±0.33和3.71,随着pH值的升高而升高;辛普森指数依次为0.44±0.02、0.18±0.09和0.04,随着pH的升高而降低,由此可以看出样品的多样性是随着pH的升高而增加的。
表 2. 样品的α-多样性指数表 Table 2. α-diversity index of the samples
| Sample | OTUs | Good’s Coverage/% | Richness and diversity indices | |||
| Ace | Chao | Shannon | Simpson | |||
| TF1 | 293 | 99.01 | 886.70 | 584.57 | 1.56 | 0.46 |
| TF2 | 277 | 98.86 | 1423.27 | 802.48 | 1.52 | 0.43 |
| PT1 | 258 | 99.08 | 798.66 | 544.08 | 2.09 | 0.29 |
| PT2 | 300 | 98.85 | 1232.32 | 888.25 | 2.70 | 0.12 |
| PT3 | 299 | 98.91 | 1139.78 | 649.14 | 2.61 | 0.14 |
| DS | 352 | 98.88 | 1229.46 | 710.02 | 3.78 | 0.04 |
表选项
2.3 原核微生物群落组成 在95400条有效序列中,仅有460条古菌序列,细菌在所有的样品中都占据绝对优势地位。β-变形菌门(Betaproteobacteria)在6个样品中均有分布,在TF的两个样品中的比例最高,达到(64.29±1.82)%,在PT三个样品的平均比例为(35.78±13.72)%,在DS样品中的比例也高达38.20% (图 2)。α-变形菌门(Alphaproteobacteria)是第二丰富的细菌类群,它在3个废水库的比例分别为PT (28.6%±4.63%)、TF (21.84%±2.72%)、DS (20.64%)。酸杆菌门(Acidobacteria)在PT的3个样品中较为丰富,而在TF和DS中的比例很低。酸杆菌门是一类化能异养嗜酸菌,在酸性生态系统中可降解植物残体多聚物、参与铁循环和单碳化合物代谢[13]等。而拟杆菌门(Bacteroidetes)在DS样品中的比例为10.17%,在其他两个样品中的比例都接近为0。其他的门类在所有的样品中所占的比例比较接近。
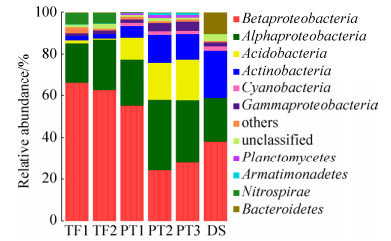 |
| 图 2 样品中主要原核微生物在门水平所占比例 Figure 2 Relative abundance of prokaryotic microbes phyla in the samples |
| 图选项 |
以属作为分类单元来考察微生物群落组成,可以得到如图 3所示的结果(取所占比例高于1%的属进行分析)。经分析发现,TF和PT样品与DS样品主要属种类有很大的差别,TF和PT样品的属组成则比较相近,但主要属所占的比例有所差别,这可能与样品的pH值以及金属离子的浓度有关。Ferrovum在TF和PT样品中占有绝对的优势地位,所占比例高达(64.17±1.84)%和(35.39±13.74)%,而在DS样品中则为0。Ferrovum在含铁的酸性废水中分布比较广泛,由于其难以分离培养,目前只有Ferrovum myxofaciens P3G一个种被分离纯化。Ferrovum属于无机化能自养型细菌,严格好氧,嗜酸耐寒耐金属,通过氧化二价铁获取能量,利用卡尔文-班森循环固定CO2[14]。目前,该属细菌已在全球各地的酸性环境中被大量检出,在许多酸性矿山废水样点及废水处理厂都是主要的铁氧化菌[15-16]。
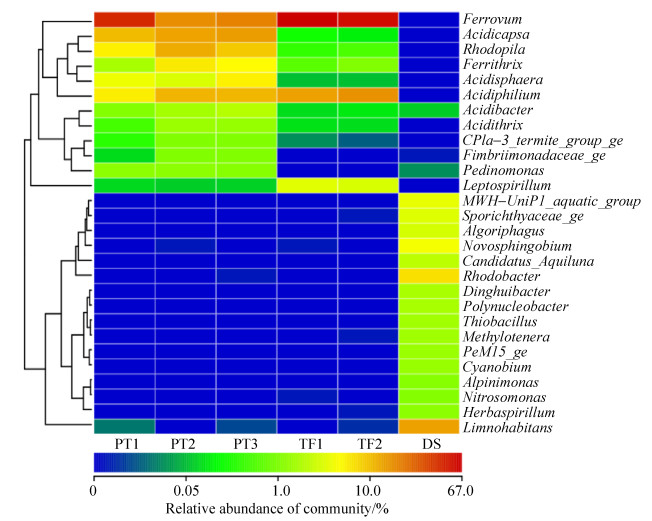 |
| 图 3 样品中主要原核微生物属水平所占的比例 Figure 3 Relative abundance of prokaryotic microbes genus in the samples |
| 图选项 |
Acidiphilium在TF样品中占的比例为(20.56±2.49)%,是第二大菌属,在PT样品中的比例也比较高,为(10.65±2.05)%,但是在DS样品中几乎没有。它是一种需氧的革兰氏阴性杆状菌,通过鞭毛进行运动。该属生长在酸性环境中,最适pH在3.0左右。该属既可以将氧作为最终的电子受体,进行呼吸作用获得能量,有些菌种也可以在好氧或厌氧环境下,将Fe3+作为电子受体氧化有机物,在缺氧的条件下,通过Fe3+和O2进行共呼吸[17-18]。
Acidicapsa属于酸杆菌门(Acidobacteria),为严格好氧有机营养菌。该属在PT样品中所占比例为(15.75±3.99)%,是PT中的第二大菌属,而在TF样品中所占的比例很低,DS样品中比例为0。该属是一种嗜酸的酸杆菌,有荚膜,进行无性繁殖,菌落颜色由无色至淡粉色,它们能够分解多种多糖(纤维素和甲壳素除外)来获得能量,多数菌株生长的最适pH值为3.0–5.0[19-20]。由于PT的pH值适合多数Acidicapsa的生长,而TF的pH值远低于Acidicapsa的生长范围,所以该菌属仅在PT样品中的比例比较高。
Leptospirillum属于硝化螺旋菌门(Nitrospirae),在TF样品中占的比例为(5.37±0.21)%,在其他样品中的比例几乎为0。该属是革兰氏阴性菌,呈螺旋状[(0.9-3.0)μm×(0.3-0.5)μm],严格化学自养的专性需氧菌,使用亚铁作为电子供体,氧作为电子受体获得能量。该菌极度嗜酸,最适pH为1.3–2.0,对Fe2+有很强的亲和力,对高浓度Fe3+则有很强的耐受性,主要生活在强酸性的水环境中,在酸性矿山废水产生及生物冶金反应器中发挥着重要的作用[21]。
Ferrithrix在PT样品中的比例为(5.97±2.22)%,在其他样品中几乎没有,属于放线菌门(Actinobacteria)。该属为革兰氏阴性菌,专性嗜酸,中度嗜热,化能异养菌,最佳生长温度为43 ℃,能够进行亚铁氧化和三价铁还原。
Limnohabitans同样属于β-变形菌门(Betaproteobacteria),该属在DS样品中占有绝对的优势地位,比例为18.47%,而在另外的样品中几乎为0。该属是兼性厌氧的有机化能细菌,氧化酶和过氧化氢酶呈现阳性,不耐盐,非运动型,适合在4–34 ℃环境中生存[22]。Limnohabitans在中性或碱性环境中比较丰富[23],它们生长速率快,代谢活跃,且与藻类衍生的有机物和藻类渗出物具有密切的关系[24]。
Rhodobacter属于α-变形菌门(Alphaproteobacteria),该菌属仅在DS样品中出现,比例为8.42%。该属细菌具有囊泡光合膜,细胞呈卵圆形或杆状,有运动型或非运动型,可利用硫化氢作电子供体进行光自养生长。它们需要硫胺素作为生长因子[25]。
2.4 真核生物群落组成 与原核生物相比,样品中的真核生物的群落结构简单。6个样品经过Mothur分析,主要得到3个已知门类:金藻门(Chrysophyta)、绿藻门(Chlorophyta)和硅藻门(Bacillariophyta)。TF样品中最丰富的类群则为金藻门,比例为(48.64±7.01)%;绿藻门在PT样品中占优势地位,所占比例高达(66.67±15.59)%;硅藻门则是DS样品中的优势类群,比例为49.85%。
样品中的主要属所占的比例见图 4。棕鞭藻属(Ochromonas)属于金藻门,它是TF样品的优势藻类,比例达(53.65±2.02)%,在PT中的比例为(27.72±10.17)%,而在DS样品比例只有0.36%。棕鞭藻属是酸性矿山废水中最常见的真核微生物之一。它们不仅可以进行光合作用,还可以摄入细菌、其他藻类甚至鞭毛虫。在一些酸性矿山废水中,棕鞭藻属是最大的捕食者,可以通过捕食来控制细菌丰度和结构[26]。
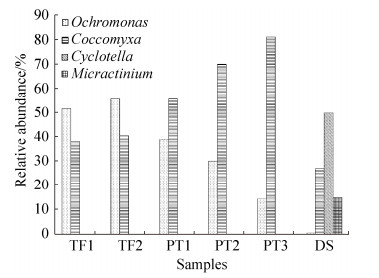 |
| 图 4 样品中真核微生物各属所占的比例 Figure 4 Relative abundance of eukaryotic genus in the samples |
| 图选项 |
胶球藻属(Coccomyxa)隶属于绿藻门,它在PT中的比例高达(68.84±10.4)%,在TF样品中的比例为(39.19±1.24)%,DS样品中的比例为26.9%。胶球藻属在水生生态系统和陆地生态系统中都被广泛发现。胶球藻属细胞普遍细长,呈椭圆形,通常为单细胞存在,每个细胞都有顶叶,外侧位置有叶绿体,是酸性极端环境中的主要生产者。在不同的生长条件下,其细胞形态有明显的差异,其改变细胞形态的能力,有助于胶球藻属在极端酸性条件下生长[27]。
小环藻属(Cyclotella)属于硅藻门,是仅在DS样品中发现的真核属,比例为49.85%。小环藻属细胞多呈圆盘形,很少呈椭圆形。壳面构造分成两圈,壳面平或有起伏,色素体多,主要生活在中性环境下。它能够产生一种由几丁质和N-乙酰氨基葡萄糖聚合物构成的纳米纤维,这种纤维及其衍生物具有广泛的生物医学和营养保健应用[28]。
微芒藻属(Micractinium)同样属于绿藻门,仅在样品DS中有,比例为14.68%。微芒藻属细胞为扁球形,有薄的细胞壁,集结体多为球形或扁平状。它在含氮的水体中生长,是混合营养体,在常温条件下进行厌氧硝化产油,积累在体内的脂肪酸主要由棕榈酸、油酸、亚油酸和α-亚麻酸组成。目前该藻多用于生活污水中营养物的去除和生物燃料原料生成[29]。
2.5 原核微生物群落构成与环境因子的关系 将所有的环境参数与原核微生物的α多样性指数通过R语言Pearson计算方法计算其相关性,发现pH和钠(Na)与香农指数(Shannon Index)呈显著正相关,样品中的微生物多样性随pH的升高和Na浓度的增加而增加(图 5)。
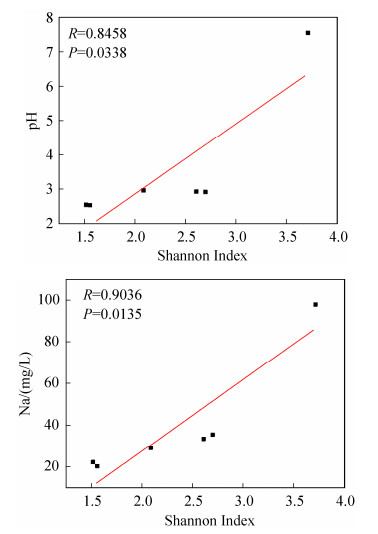 |
| 图 5 物化参数与Shannon指数的Pearson相关性 Figure 5 Pearson correlation between physicochemical parameters and Shannon index |
| 图选项 |
对6个样品进行原核微生物群落组成的相似性(ANOSIM)分析显示,3个不同的废水库原核微生物群落结构明显不同(R = 0.9,P < 0.02)。Mantel(R = 0.7249,P < 0.03)检验揭示了主要环境变量与微生物群落组成之间具有密切关系。
通过R语言的Bioenv命令来寻找对微生物群落影响最大的环境因子组合。结果表明:pH、Na、K、Mn的组合与微生物群落之间的相关性最高,达到0.9899,贡献率达到98.43%,说明这四种环境参数对微生物群落变化有很大的影响。
用Canoco 4.5对环境参数和微生物群落分析后发现,pH、Na、K是对微生物群落结构影响最大的环境因子(图 6),它们对微生物群落组成变化的贡献率依次为67.43%、21.19%、7.43%,P值均小于0.05。所以,pH是影响微生物群落组成最显著的环境因子,其次是Na和K。
 |
| 图 6 微生物群落组成和环境因素的典范对应分析(CCA) Figure 6 Canonical correspondence analysis (CCA) between microbial community composition and environmental factors |
| 图选项 |
3 讨论 本研究的3个矿山废水库,虽然距离非常近,但由于形成的时间和方式不同,所以它们的物理化学性质有明显的差异。酸水库TF形成于2013年左右,本身为未开采完成的矿坑,矿石中含有高品位的铁硫,极易发生氧化产生酸性矿山废水,所以TF的酸性最强。酸水库PT位于排土场中央,废矿石中铁硫的含量本来就低,又经过40多年的风化[9],使周边废矿石中的铁硫已逐渐氧化殆尽,所以与TF相比酸性较弱,且Fe含量较低。但由于长时间的积累,PT废水库中的SO42–浓度高达10398.98±626.70 mg/L,是TF的3倍以上。废水库DS的开采历史最久,闭坑后也曾是大型酸水库,近年来被开辟为尾矿浆的储存地。周边废矿石经过长期的氧化过程,导致废水中含有较高浓度的SO42–,虽然低于PT,但明显高于TF。由于近年来尾矿浆的中和作用,目前DS的pH值为中性。
矿山废水理化性质的差异,导致水体中微生物群落存在明显差异[30-32]。TF的酸性最强,Fe含量最高,所以嗜酸铁氧化菌的比例很高,主要是Ferrovum (64.17%±1.84%),以及Leptospirillum (5.37%±0.21%),二者比例接近70%。这些铁氧化菌在酸性矿山废水的形成过程中发挥着重要的作用[30-31]。TF中的化能异养菌主要为Acidiphilium。因为TF的环境非常极端,所以原核微生物群落的多样性很低,主要由上述3种细菌构成。PT由于形成时间较长,酸性较弱,所以微生物多样性明显比TF丰富。除Ferrovum和Acidiphilium外,PT中还有大量化能异养嗜酸菌,例如Acidicapsa、Rhodopila、Ferrithrix、Acidisphaera等。与上述两个酸水库不同,DS形成后由于大量尾矿浆的排入,使得水体环境呈中性,所以微生物组成与两个酸水库截然不同,且微生物多样性远远高于两个酸性矿山废水库。令人奇怪的是,在酸性环境中常见的嗜酸硫杆菌属(Acidithiobacillus)在两个酸水库中并未检出,而是Ferrovum占优势地位。Ferrovum属细菌很难分离纯化,常和Acidiphilium伴生,目前只有2014年分离纯化出的一个种Ferrovum myxofaciens P3G[13]。该细菌耐冷,可产胞外聚合物,耐酸性能比Acidithiobacillus、Leptospirillum、Sulfobacillus等常见嗜酸菌弱,所以它常分布在pH 2.0–4.8和低于25 ℃的酸性水体中[33]。本课题组在该矿山区域多年的研究表明,Acidithiobacillus和Leptospirillum往往在酸性更强(pH < 2.5)、温度更高(>30 ℃)的小型酸水中占优势地位;而在pH较高(pH > 2.5)、温度较低(<30 ℃)的大型酸水库中,优势类群一般为Ferrovum和Acidiphilium[9,34-35]。
从统计学分析结果可以看出,pH是影响废水原核微生物群落结构和多样性最重要的环境因素。除pH外,Na和K也对微生物的群落组成和多样性有明显的影响。Na和K是微生物生长的重要营养元素,在维持细胞渗透压等方面发挥着关键的作用。在酸性环境中,Na和K还可帮助嗜酸菌维持中性的细胞内环境。目前已知所有嗜酸微生物细胞质pH都接近中性,很多微生物可以在细胞膜内侧累积高浓度的Na/K来抑制细胞外高浓度的H+的流入[36]。
pH对废水库中真核微生物群落的影响同样巨大。酸性废水库中主要分布有两种嗜酸藻类,胶球藻属(Coccomyxa)和棕鞭藻属(Ochromonas)。胶球藻属(Coccomyxa)在PT中比例明显高于棕鞭藻属(Ochromonas),且在DS中也有分布,比例也达26.89%。这是因为胶球藻属对酸碱性有很强的适应性,在pH 2.5–9.0都可以生长。胶球藻属最适生长pH为2.5–4.5[37],因此它在PT (pH约3.0)中的丰度最高。棕鞭藻属(Ochromonas)则有很强的耐酸性,主要生活在pH值低于3.0的环境中[38],所以它在酸性更强的TF中占优势地位。除胶球藻属外,中性废水库DS中还有两种嗜中性的微芒藻属(Micractinium)和小环藻属(Cyclotella)。无论是酸性还是中性矿山废水库,真核生物群落主要由光合藻类构成,它们是各自的生存环境初级生产力的主要贡献者,在生态系统的碳循环中发挥着重要的作用。
References
| [1] | Blodau C. A review of acidity generation and consumption in acidic coal mine lakes and their watersheds. Science of the Total Environment, 2006, 369(1/3): 307-332. |
| [2] | Deng C, Chen YZ, Li Y. Review of research on mine wastewater treatment. Chemical Intermediate, 2017(11): 57-58. (in Chinese) 邓川, 陈韵竹, 李瑶. 矿山废水处理的研究综述. 当代化工研究, 2017(11): 57-58. DOI:10.3969/j.issn.1672-8114.2017.11.035 |
| [3] | Baker BJ, Banfield JF. Microbial communities in acid mine drainage. FEMS Microbiology Ecology, 2003, 44(2): 139-152. DOI:10.1016/S0168-6496(03)00028-X |
| [4] | Dai X, Huang JX, Guo SX. Research on treatment of mine tailings wastewater by alkaline oxidation process. Architectural Engineering Technology and Design, 2017(30): 1778. (in Chinese) 戴汛, 黄家新, 郭胜祥. 碱性氧化法处理矿山尾矿库废水技术研究. 建筑工程技术与设计, 2017(30): 1778. |
| [5] | Johnson DB. Acidophilic microbial communities: candidates for bioremediation of acidic mine effluents. International Biodeterioration & Biodegradation, 1995, 35(1/3): 41-58. |
| [6] | Bruneel O, Volant A, Gallien S, Chaumande B, Casiot C, Carapito C, Bardil A, Morin G, Brown Jr GE, Personne CJ, Le Paslier D, Schaeffer C, van Dorsselaer A, Bertin PN, Elbaz-Poulichet F, Arsene-Ploetze F. Characterization of the active bacterial community involved in natural attenuation processes in arsenic-rich creek sediments. Microbial Ecology, 2011, 61(4): 793-810. DOI:10.1007/s00248-011-9808-9 |
| [7] | Singer PC, Stumm W. Acidic mine drainage: the rate-determining step. Science, 1970, 167(3921): 1121-1123. DOI:10.1126/science.167.3921.1121 |
| [8] | Méndez-García C, Peláez AI, Mesa V, Sánchez J, Golyshina OV, Ferrer M. Microbial diversity and metabolic networks in acid mine drainage habitats. Frontiers in Microbiology, 2015, 6: 475. |
| [9] | Hao CB, Wei PF, Pei LX, Du ZR, Zhang Y, Lu YC, Dong HL. Significant seasonal variations of microbial community in an acid mine drainage lake in Anhui Province, China. Environmental Pollution, 2017, 223: 507-516. DOI:10.1016/j.envpol.2017.01.052 |
| [10] | Hou WG, Wang S, Dong HL, Jiang HC, Briggs BR, Peacock JP, Huang QY, Huang LQ, Wu G, Zhi XY, Li WJ, Dodsworth JA, Hedlund BP, Zhang CL, Hartnett HE, Dijkstra P, Hungate BA. A comprehensive census of microbial diversity in hot springs of Tengchong, Yunnan Province China using 16S rRNA gene pyrosequencing. PLoS One, 2013, 8(1): e53350. DOI:10.1371/journal.pone.0053350 |
| [11] | 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002. |
| [12] | Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Huntley J, Fierer N, Owens SM, Betley J, Fraser L, Bauer M, Gormley N, Gilbert JA, Smith G, Knight R. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. The ISME Journal, 2012, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8 |
| [13] | Wang GH, Liu JJ, Yu ZH, Wang XZ, Jin J, Liu XB. Research progress of Acidobacteria ecology in soils. Biotechnology Bulletin, 2016, 32(2): 14-20. (in Chinese) 王光华, 刘俊杰, 于镇华, 王新珍, 金剑, 刘晓冰. 土壤酸杆菌门细菌生态学研究进展. 生物技术通报, 2016, 32(2): 14-20. |
| [14] | Johnson DB, Hallberg KB, Hedrich S. Uncovering a microbial enigma: isolation and characterization of the streamer-generating, iron-oxidizing, acidophilic bacterium "Ferrovum myxofaciens". Applied and Environmental Microbiology, 2014, 80(2): 672-680. DOI:10.1128/AEM.03230-13 |
| [15] | Hallberg KB, Coupland K, Kimura S, Johnson DB. Macroscopic streamer growths in acidic, metal-rich mine waters in north wales consist of novel and remarkably simple bacterial communities. Applied and Environmental Microbiology, 2006, 72(3): 2022-2030. DOI:10.1128/AEM.72.3.2022-2030.2006 |
| [16] | Heinzel E, Hedrich S, Janneck E, Glombitza F, Seifert J, Schl?mann M. Bacterial diversity in a mine water treatment plant. Applied and Environmental Microbiology, 2009, 75(3): 858-861. DOI:10.1128/AEM.01045-08 |
| [17] | Hiraishi A, Imhoff JF. Genus Acidiphilium//Boone DR, Castenholz RW, Garrity GM. Bergey's Manual of Systematic Bacteriology. 2nd ed. New York: Springer, 2005: 54-62. |
| [18] | Küsel K, Roth U, Drake HL. Microbial reduction of Fe(Ⅲ) in the presence of oxygen under low pH conditions. Environmental Microbiology, 2002, 4(7): 414-421. DOI:10.1046/j.1462-2920.2002.00314.x |
| [19] | Falagán C, Foesel B, Johnson B. Acidicapsa ferrireducens sp. nov., Acidicapsa acidiphila sp. nov., and Granulicella acidiphila sp. nov.: novel acidobacteria isolated from metal-rich acidic waters. Extremophiles, 2017, 21(3): 459-469. DOI:10.1007/s00792-017-0916-4 |
| [20] | Kulichevskaya IS, Kostina LA, Valá?ková V, Rijpstra WIC, Damsté JSS, de Boer W, Dedysh SN. Acidicapsa borealis gen. nov., sp. nov. and Acidicapsa ligni sp. nov., subdivision 1 Acidobacteria from Sphagnum peat and decaying wood. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(7): 1512-1520. |
| [21] | Schrenk MO, Edwards KJ, Goodman RM, Hamers RJ, Banfield JF. Distribution of Thiobacillus ferrooxidans and Leptospirillum ferrooxidans: implications for generation of acid mine drainage. Science, 1998, 279(5356): 1519-1522. DOI:10.1126/science.279.5356.1519 |
| [22] | Hahn MW, Kasalicky V, Jezbera J, Brandt U, Jezberová J, ?imek K. Limnohabitans curvus gen. nov., sp. nov., a planktonic bacterium isolated from a freshwater lake. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(6): 1358-1365. DOI:10.1099/ijs.0.013292-0 |
| [23] | ?imek K, Kasalicky V, Jezbera J, Jezberová J, Hejzlar J, Hahn MW. Broad habitat range of the phylogenetically narrow R-BT065 cluster, representing a core group of the Betaproteobacterial Genus Limnohabitans. Applied and Environmental Microbiology, 2010, 76(3): 631-639. DOI:10.1128/AEM.02203-09 |
| [24] | ?imek K, Kasalicky V, Jezbera J, Horňák K, Nedoma J, Hahn MW, Bass D, Jost S, Boenigk J. Differential freshwater flagellate community response to bacterial food quality with a focus on Limnohabitans bacteria. The ISME Journal, 2013, 7(8): 1519-1530. DOI:10.1038/ismej.2013.57 |
| [25] | Imhoff JF, Trüper HG, Pfennig N. Rearrangement of the species and genera of the phototrophic "purple nonsulfur bacteria". International Journal of Systematic and Evolutionary Microbiology, 1984, 34(3): 340-343. |
| [26] | Schmidtke A, Bell EM, Weithoff G. Potential grazing impact of the mixotrophic flagellate Ochromonas sp. (Chrysophyceae) on bacteria in an extremely acidic lake. Journal of Plankton Research, 2006, 28(11): 991-1001. DOI:10.1093/plankt/fbl034 |
| [27] | Barcyt? D, Nedbalová L. Coccomyxa: a dominant planktic alga in two acid lakes of different origin. Extremophiles, 2017, 21(2): 245-257. DOI:10.1007/s00792-016-0899-6 |
| [28] | Ozkan A, Rorrer GL. Effects of light intensity on the selectivity of lipid and chitin nanofiber production during photobioreactor cultivation of the marine diatom Cyclotella sp. Algal Research, 2017, 25: 216-227. DOI:10.1016/j.algal.2017.04.032 |
| [29] | Abou-Shanab RAI, El-Dalatony MM, El-Sheekh MM, Ji MK, Salama ES, Kabra AN. Cultivation of a new microalga, Micractinium reisseri, in municipal wastewater for nutrient removal, biomass, lipid, and fatty acid production. Biotechnology and Bioprocess Engineering, 2014, 19(3): 510-518. DOI:10.1007/s12257-013-0485-z |
| [30] | Chen LX, Li JT, Chen YT, Huang LN, Hua ZS, Hu M, Shu WS. Shifts in microbial community composition and function in the acidification of a lead/zinc mine tailings. Environmental Microbiology, 2013, 15(9): 2431-2444. DOI:10.1111/emi.2013.15.issue-9 |
| [31] | Johnson DB, Hallberg KB. The microbiology of acidic mine waters. Research in Microbiology, 2003, 154(7): 466-473. DOI:10.1016/S0923-2508(03)00114-1 |
| [32] | Hallberg KB. New perspectives in acid mine drainage microbiology. Hydrometallurgy, 2010, 104(3/4): 448-453. |
| [33] | Quatrini R, Johnson DB. Microbiomes in extremely acidic environments: functionalities and interactions that allow survival and growth of prokaryotes at low pH. Current Opinion in Microbiology, 2018, 43: 139-147. DOI:10.1016/j.mib.2018.01.011 |
| [34] | Pei LX, Lu QY, Hao CB, Du ZR, Lu YC, Zhang F. Shifts of the microbial community structure of an acid mine drainage from summer to autumn in Anhui Province. Acta Scientiae Circumstantiae, 2016, 36(7): 2397-2407. (in Chinese) 裴理鑫, 鲁青原, 郝春博, 杜泽瑞, 鲁艳春, 张帆. 安徽某铁矿酸性矿山废水夏季和秋季微生物群落结构特征. 环境科学学报, 2016, 36(7): 2397-2407. |
| [35] | Hao CB, Wang LH, Gao YA, Zhang LN, Dong HL. Microbial diversity in acid mine drainage of Xiang Mountain sulfide mine, Anhui Province, China. Extremophiles, 2010, 14(5): 465-474. DOI:10.1007/s00792-010-0324-5 |
| [36] | Baker-Austin C, Dopson M. Life in acid: pH homeostasis in acidophiles. Trends in Microbiology, 2007, 15(4): 165-171. DOI:10.1016/j.tim.2007.02.005 |
| [37] | Fuentes JL, Huss VAR, Montero Z, Torronteras R, Cuaresma M, Garbayo I, Vílchez C. Erratum to: phylogenetic characterization and morphological and physiological aspects of a novel acidotolerant and halotolerant microalga coccomyxa onubensis sp. nov. (Chlorophyta, Trebouxiophyceae). Journal of Applied Phycology, 2016, 28(6): 3281-3282. DOI:10.1007/s10811-016-0922-4 |
| [38] | Nixdorf B, Mischke U, Le?mann D. Chrysophytes and chlamydomonads: pioneer colonists in extremely acidic mining lakes (pH < 3) in Lusatia (Germany). Hydrobiologia, 1998, 369-370: 315-327. DOI:10.1023/A:1017010229136 |
