莫永亮1,2, 郑燕3, 金凤4,5, 宝音陶格涛4, 贾仲君1,2


1. 中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室, 江苏 南京 210008;
2. 中国科学院大学, 北京 100049;
3. 郑州轻工业学院食品与生物工程学院, 河南 郑州 450002;
4. 内蒙古大学生态与环境学院, 内蒙古 呼和浩特 010021;
5. 内蒙古师范大学生命科学与技术学院, 内蒙古 呼和浩特 010022
收稿日期:2018-09-27;修回日期:2018-11-30;网络出版日期:2019-01-02
基金项目:国家自然科学基金(31270147,41530857,91751204,41501276);中国科学院战略性先导科技专项(B类)(XDB15040000)
作者简介:贾仲君,博士生导师,中国科学院南京土壤研究所,中国科学院特聘研究员,主要从事土壤微生物研究。2002年获博士学位后连续在美国农业部、日本名古屋大学和德国马普陆地微生物所工作。2008年入选中国科学院“****”,2012年获终期评估优秀。连续入选江苏省“333高层次人才培养工程”。曾获国际全球变化分析研究青年科学家奖、江苏省科技进步一等奖等。担任了中国植物营养与肥料学会生物与有机肥料专业委员会副主任、中国矿物岩石地球化学学会地表与生物地球化学专业委员会、中国微生物学会环境微生物专业委员会委员等;主持了国家基金委重大项目课题、重点项目、重大研究计划重点项目、中国科学院战略性科技先导专项B类项目,科技部国际科技合作项目和973项目课题等。建立了稳定同位素示踪环境微生物DNA/RNA-SIP及高通量测序技术平台;揭示了氨氧化古菌和细菌适应土壤地理环境分异的竞争排斥机制,发现古菌能更好适应低氧环境并通过脲酶进化适应酸性低氨胁迫;阐明了湿地微生物氧化极低浓度甲烷的环境遗传代谢机制。近5年发表SCI论文53篇,一半以上发表于TOP一区刊物。担任欧洲地球学会Biogeosciences和Frontiers in Microbiology等3份SCI期刊副主编及领域编辑,《土壤学报》和《微生物学报》编委.
*通信作者:贾仲君, Tel:+86-25-86881311, Fax:+86-25-86881000, E-mail:jia@issas.ac.cn.
摘要:[目的] 内蒙古岗更诺尔湖退化为碱地、草地情景下,研究好氧甲烷氧化过程及其微生物群落的变化规律。[方法] 针对湖泊沉积物及其退化后形成的碱地、草地土壤,在不同初始甲烷浓度下培养,研究其甲烷氧化速率,通过实时荧光定量PCR、高通量测序技术分析甲烷氧化菌的群落构成及其变化规律。[结果] 湖泊退化过程中,沉积物和碱地的土壤理化性质、甲烷氧化速率变化规律基本一致,但与草地土壤有显著差异。在微生物属水平,甲烷氧化菌Methylococcus的丰度显著增加,在沉积物、碱地和草地中的丰度分别为19.2%、48.8%和78.3%,而Crenothrix的丰度明显降低,依次为54.7%、32.1%、和13.9%。进一步室内模拟不同初始浓度下甲烷氧化过程,发现沉积物中Crenothrix和Methylocaldum的增幅最大;碱地土壤中Methylococcus和Methylomonas的增幅远高于其他甲烷氧化菌;而在草地土壤中,Crenothrix增加高达7.81%,增幅达196倍。这些显著增加的微生物可能在不同浓度甲烷氧化过程中发挥了重要作用。[结论] 湖泊退化过程中,甲烷氧化潜力降低。沉积物中的甲烷氧化菌发生了显著分异,Methylococcus逐渐成为碱地和草地的优势微生物,而Crenothrix则逐渐成为弱势类群。然而,草地土壤氧化高浓度甲烷过程中,数量上占弱势的Crenothrix迅速变为优势类群,可能发挥了重要作用。
关键词:湖泊退化生态演替CH4甲烷氧化菌pmoA基因
Aerobic methane oxidation under distinct shrinkage scenario of Lake Ganggeng in Inner Mongolia Autonomous Region
Yongliang Mo1,2, Yan Zheng3, Feng Jin4,5, Taogetao Baoyin4, Zhongjun Jia1,2


1. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, Jiangsu Province, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Food and Biological Engineering, Zhengzhou University of Light Industry, Zhengzhou 450002, Henan Province, China;
4. School of Ecology and Environment, Inner Mongolia University, Huhehot 010021, Inner Mongolia Autonomous Region, China;
5. College of Life Science and Technology, Inner Mongolia Normal University, Huhehot 010022, Inner Mongolia Autonomous Region, China
*Corresponding author: Zhongjun Jia, Tel:+86-25-86881311, Fax:+86-25-86881000, E-mail:jia@issas.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31270147, 41530857, 91751204, 41501276) and by the Strategic Priority Research Program of the CAS (XDB15040000)
Abstract: [Objective] To elucidate the variation patterns of aerobic methanotrophy under the shrinkage process from sediment to saline land and grassland. [Methods] Lake sediment, saline and grassland soils were collected from the shrinkage gradient of Lake Ganggeng in Inner Mongolia, and incubated under different initial CH4 concentrations to determine their CH4 oxidation potentials. We analyzed methanotrophic community composition and their abundance change by real-time quantitative PCR and high-throughput sequencing techniques. [Results] During lake shrinkage, soil properties of lake sediment and saline soil showed similar variation trends with methane oxidation rates, and were significantly different from that of grassland soil. In response to shrinkage, the relative abundance of Methylococcus increased significantly (with the relative abundance of 19.2%, 48.8% and 78.3% in lake sediment, saline and grassland soils, respectively), whereas Crenothrix decreased from 54.7% to 32.1% and 13.9%. Microcosm incubation of these samples under different initial CH4 concentrations demonstrated the predominant increase of Crenothrix and Methylococcus in lake sediment; While Methylococcus and Methylomonas dominated the increase in saline soil; Crenothrix increased 7.81% in grassland soils (196 folds). [Conclusion] Lake shrinkage significantly decreased methane oxidation potential, and methanotrophic community also changed, with numerically dominant Methylococcus and Crenothrix in sediment and grassland respectively. However, it is noteworthy that under high CH4 concentration, Crenothrix increased rapidly, most likely playing important roles during methane oxidation in all samples tested.
Keywords: lake shrinkageecological successionCH4methanotrophpmoA gene
准确评估湖泊退化及其元素生物地球化学过程对全球甲烷(CH4)的收支平衡及其增温效应评估有重要意义[1]。据估算,湖泊每年的CH4排放量约为8-48 Tg,占全球CH4年排放总量的6%-16%[2]。同时,在湖泊中也存在甲烷氧化[3],但甲烷氧化活性的影响因素较复杂,包括pH、温度、碳氮含量、环境含水量、氧气和甲烷浓度等[4-7]。一般认为,湖泊退化显著影响大气甲烷源和汇的准确估算,遥感分析表明,在1975-2007的近30年期间,中亚地区9个主要湖泊的面积从9.14×104 km2锐减至4.60×104 km2[8],有近一半湖泊发生退化,形成草地或者荒漠。湖泊退化不仅降低湖泊的生物多样性、影响生态景观,还会引起湖泊的水分、通气等理化性质发生改变,进而作用于甲烷氧化菌,极大改变湖泊作为甲烷源或汇的功能。然而,目前国内外关于湖泊甲烷氧化的研究多集中于湖泊水体和底泥,包括好氧和厌氧甲烷氧化菌的氧化活性[9-10]、甲烷氧化菌的群落结构[11-12]及其影响因素研究[13]。关于湖泊退化过程中好氧甲烷氧化的微生物过程研究,目前国内外似乎尚未见报道。据此,本研究针对内蒙古自治区的岗更诺尔湖及其退化后形成的碱地、草地生态演替梯度,研究湖泊退化过程中,不同初始甲烷浓度下甲烷氧化的微生物过程,以期为湖泊退化情景下甲烷氧化微生物的生理生态研究提供理论参考。
1 材料和方法 1.1 采样点概况 内蒙古自治区的岗更诺尔湖位于赤峰市克什克腾旗(116° 53′ 29″ E-116° 57′ 52″ E,43° 15′ 52″ N-43° 18′ 42″ N),属于蒙新高原区,为中温带大陆性季风气候,年平均气温2-4 ℃,无霜期60-150 d,年降雨量250-500 mm,湖泊面积约为21.5 km2,海拔1247 m。碱地的主要植被种类有芦苇(Phragmites communis)、湿生狗舌草(Senecio arcticus)、宽叶香蒲(Typha latifolia Linn.)、杉叶藻(Hippuris vulgaris L.)、狐尾藻(Myriophyllum verticillatum L.)等,而草地的植被主要是欧亚草原植物,如大针茅(Stipa grandis)、克氏针茅(Krylov Needlegrass),多属于菊科、禾本科、豆科、蔷薇科、毛茛科等。于2015年6月,沿着岗更诺尔湖泊-碱地-草地退化的生态演替梯度采样(3个采样点两两之间的直线距离小于1 km,图 1-A),分别采集淹水的湖泊底部沉积物(水深约1 m处、表层0-20 cm的沉积物)、湖泊周围的盐渍化碱地土壤(0-20 cm的表层土壤,碱地)以及外围的草地土壤(0-20 cm的表层土壤,图 1-B、1-C、1-D),三种类型土样各采集3个空间重复土样,带回实验室,于4 ℃下保存,直至分析。将湖泊沉积物、碱地和草地土壤样品均风干1周、磨细、过2 mm筛,混匀,并将每种类型(湖泊沉积物、碱地、草地土壤)的3个空间重复土样混匀,代表该类型土样,备用。此后,采用土壤常规分析方法测定了湖泊沉积物、碱地和草地土壤的主要理化性质(表 1)。
 |
| 图 1 内蒙古岗更诺尔湖退化演替梯度的采样点分布(A)、以及湖泊(B)、碱地(C)和草地(D)的生态景观图 Figure 1 Sampling sites of the shrinkage gradients across Lake Ganggeng in Inner Mongolia Autonomous Region (A), the photographs of lake (B), saline land (C) and grassland (D) |
| 图选项 |
表 1. 内蒙古岗更诺尔湖泊沉积物、碱地和草地土壤的基本理化性质 Table 1. Physico-chemical properties of lake sediment, saline and grassland soils during the shrinkage of Lake Ganggeng, Inner Mongolia Autonomous Region
| Property | Lake sediment | Saline soil | Grassland soil |
| Water content/% | 51.53±1.35 a | 48.90±0.36 b | 10.25±1.69 c |
| pH | 7.92±0.02 c | 7.99±0.03 bc | 9.34±0.02 a |
| TC/g/kg | 42.78±2.57 b | 63.95±3.54 a | 29.03±0.62 c |
| TN/g/kg | 3.90±0.16 b | 5.89±0.16 a | 1.73±0.05 c |
| Sand/% | 66.60±2.69 b | 62.37±0.68 c | 76.97±1.27 a |
| Silt/% | 21.43±3.04 a | 20.60±0.70 a | 10.80±0.95 b |
| Clay/% | 11.97±0.42 b | 17.03±1.17 a | 12.23±0.32 b |
| Values were showed as mean±standard deviation (N=3); Different letters in the same line indicate significant difference between three treatments (P < 0.05). | |||
表选项
1.2 室内处理设置 称取相当于6.0 g干重的风干湖泊沉积物、碱地和草地土壤,置于120 mL玻璃培养瓶中,加入去离子水至40%最大持水量,加橡胶塞密封,于避光、28 ℃条件下预培养24 h,激活微生物活性。预培养结束后,加入去离子水至60%最大持水量,加橡胶塞密封,并外加铝盖固定。分别从以上培养瓶中抽出0.08、0.74、13.0 mL空气,并加入等体积的甲烷气体(CH4纯度大于99.9%),即为0.06%、0.6%和10% (V/V) 3个CH4浓度梯度,每个处理3次重复,于28 ℃下培养。在培养开始时,注入甲烷气体、混匀后,立即采集零时刻气体样品,即为初始CH4浓度。此后,分别在第1、2、4周测定培养瓶顶空气体中的CH4浓度,至甲烷浓度不再下降时,破坏性采集土样,用于后续的分子生物学实验。所有土壤样品于-80 ℃下保存,直至分析。
1.3 甲烷氧化速率测定 在培养过程中,用气相色谱仪(Agilent 7890A,USA)动态测定培养瓶顶空气体中的甲烷浓度。根据甲烷浓度随时间的变化来计算甲烷氧化速率(Rmethane) (公式1)。
 | 公式(1) |
1.4 环境样品DNA提取、定量PCR和高通量测序 称取0.50 g土样,采用Fast DNA? Spin Kit for Soil (MP Biomedicals,California,USA)试剂盒,按照厂商的说明书提取土壤中微生物的总DNA。并采用NanoDrop超微量光度计测定DNA的浓度和纯度。DNA存放于-20 ℃。
使用Bio-Rad CFX96定量PCR仪对各处理的pmoA基因进行定量。所用引物为A189f/mb661r[14]。反应体系为20 μL,其中DNA模板1 μL (DNA模板浓度为2-8 ng/μL),引物A189f和引物mb661r各0.5 μL (引物浓度为10 μmol/L),10 μL SYBR Premix Ex TaqTM (Tli RNaseH Plus,TaKaRa,Japan),灭菌的去离子水8 μL。PCR程序为95 ℃预变性2 min,(95 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s) ×39个循环。标准曲线所用质粒使用pEASY-T1 Cloning Kit (Beijing TransGen Biotech Co.,Ltd)和TaKaRa MiniBEST Plasmid Purification Kit Ver. 4.0 (TaKaRa,Japan)制备。
16S rRNA基因的高通量测序使用的引物为通用引物515F/907R[15]。其中,在引物515F的5′端有12个base-pair的barcode,用以区分不同样品。PCR反应体系为50 μL:2 μL DNA模板(模板浓度为2-8 ng/μL),引物515F和引物907R各1 μL (引物浓度为10 μmol/L),25 μL SYBR Premix Ex TaqTM (Tli RNaseH Plus,TaKaRa,Japan),21 μL灭菌的去离子水。PCR反应程序为:94 ℃预变性2 min,(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s) ×30个循环。用1.2%的琼脂糖检测PCR产物的大小和扩增的特异性。此后,将各样品的DNA按照等摩尔混合,所用建库试剂盒为TruSeq Nano DNA LT Sample Prep Kit Set A,用于Illumina MiSeq测序(MiSeq Reagent Kit v3,600个循环)。高通量测序所得的全部DNA序列(raw sequence reads)全部提交至NCBI网站(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/),存储于Sequence Read Archive (SRA)数据库,Submission ID为SUB4109369,检索号(Accession Number)为SRR7796625-SRR7796660 (共计36个样品)。
1.5 数据处理与统计分析 采用SPSS 16.0对不同处理的甲烷氧化速率、pmoA基因拷贝数、甲烷氧化菌相对丰度进行统计分析(SPSS Inc.,USA),用QIIME (Quantitative Insights Into Microbial Ecology,version 1.9.1)分析高通量测序数据[16]。主要分析步骤参考http://qiime.org/scripts/index.html,主要参数如下:序列质控标准为q25 (Phred quality score),并使用usearch61的identify_chimeric_seqs.py”命令检查和去除嵌合体,微生物的OTU分类在97%相似度进行。
2 结果和分析 2.1 内蒙古岗更诺尔湖泊退化对土壤理化性质的影响 湖泊退化对土壤理化性质有显著影响。如表 1所示,土壤含水量(质量含水率)随湖泊退化而显著降低(P < 0.05),湖泊沉积物和碱地土壤的含水量差异较小(分别为51.5%和48.9%),二者显著高于草地土壤(其含水量仅为10.3%);湖泊退化为碱地后,土壤pH略有升高(从7.92增至7.99),但不显著(P > 0.05),退化为草地后,土壤pH显著增加至9.34;湖泊退化还引起土壤总碳、总氮含量发生显著变化,碱地土壤含量最高,湖泊沉积物次之,草地土壤最低。此外,湖泊退化影响土壤质地(颗粒组成),使其砂粒含量增加,粉粒含量降低(表 1)。
2.2 内蒙古岗更诺尔湖泊退化对甲烷氧化潜力的影响 在三种不同初始甲烷浓度下(0.06%、0.6%、10%),甲烷氧化速率均表现为碱地土壤 > 湖泊沉积物 > 草地土壤。初始甲烷浓度0.06%下,湖泊沉积物、碱地和草地土壤的甲烷氧化速率分别为0.54、0.67和0.27 μg CH4/(g·d) (培养瓶中甲烷浓度下降曲线见图 S1,S1链接:http://journals.im.ac.cn/html/actamicrocn/2019/6/20190612.htm),三者的差异达到显著水平(P < 0.05,图 2-A);当初始甲烷浓度增加至0.6%时,湖泊沉积物、碱地和草地土壤的甲烷氧化速率分别增加到7.10、7.44、2.73 μg CH4/(g·d),但湖泊和碱地的速率无统计显著差异(图 2-B);当初始甲烷浓度增加到10%时,也得到类似规律,湖泊沉积物、碱地和草地土壤的甲烷氧化速率增加至109.2、112.3和47.0 μg CH4/(g·d) (图 2-C)。此外,我们也在其他初始甲烷浓度下,发现了相同的结果(图 S2、S3),S2、S3链接:http://journals.im.ac.cn/html/actamicrocn/2019/6/20190612.htm)。说明湖泊退化为碱地、草地过程中,甲烷氧化潜力总体呈减弱的趋势,且随着初始甲烷浓度的升高,甲烷氧化速率增加(其他初始浓度下,甲烷氧化速率随浓度的变化见图 S4,S4链接:http://journals.im.ac.cn/html/actamicrocn/2019/6/20190612.htm)。
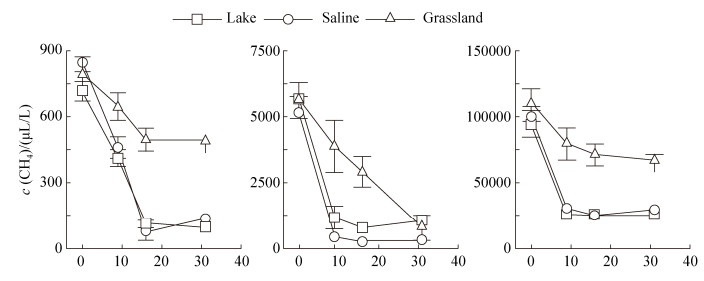 |
| 图 S1 培养过程中甲烷浓度变化 Figure S1 Change of methane concentration during the incubation |
| 图选项 |
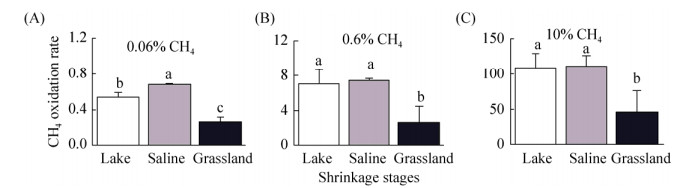 |
| 图 2 内蒙古岗更诺尔湖退化过程中沉积物、碱地和草地土壤在初始甲烷浓度为0.06%(V/V)(A)、0.6% (B)和10%(C)下的甲烷氧化速率 Figure 2 Changes of methane oxidation rate in lake sediment (Lake Ganggeng), saline and grassland soils under initial methane concentration of 0.06% (V/V) (A), 0.6% (B) and 10% (C). Different letters above columns indicate statistically significant difference, P < 0.05 |
| 图选项 |
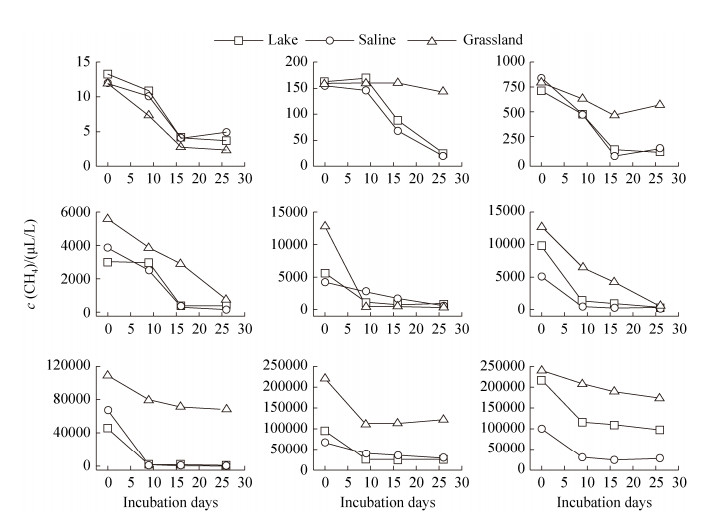 |
| 图 S2 不同初始浓度下的甲烷浓度变化 Figure S2 Change of methane concentration under different initial methane concentration |
| 图选项 |
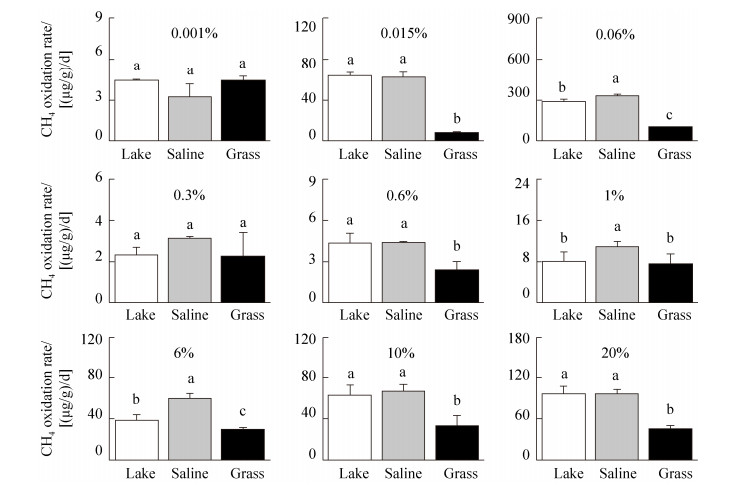 |
| 图 S3 不同初始甲烷浓度下的甲烷氧化速率 Figure S3 Methane oxidation rates under different initial methane concentrations |
| 图选项 |
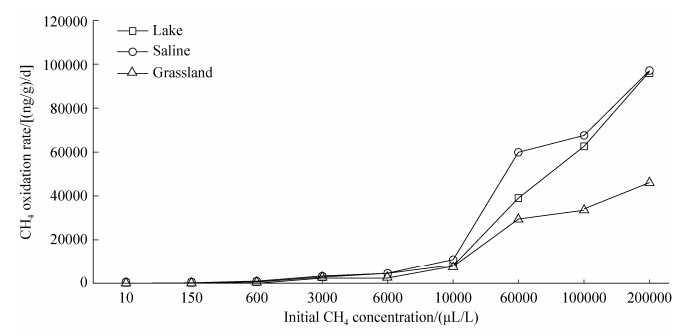 |
| 图 S4 初始甲烷浓度与甲烷氧化速率之间的关系 Figure S4 The relationship between initial methane concentration and methane oxidation rate |
| 图选项 |
2.3 好氧甲烷氧化菌对湖泊退化和不同甲烷初始浓度的响应 基于pmoA基因的实时荧光定量PCR结果表明,甲烷氧化菌随着湖泊退化而增加。原位湖泊沉积物、碱地和草地土壤中(Day0),甲烷氧化菌的数量分别为1.21×105、2.05×105和3.44×105 copies/ (g d.w.s.) (dry weight soil) (图 3-A)。然而,值得注意的是,采用高通量测序16S rRNA基因发现,原位Day0湖泊沉积物、碱地和草地土壤中,甲烷氧化菌占整体微生物群落的比例分别为1.33%、0.22%和0.26% (图 3-B),表现出下降的趋势。
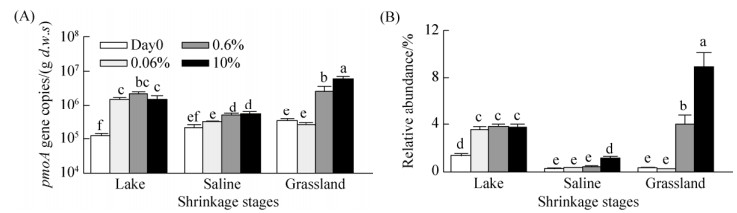 |
| 图 3 内蒙古岗更诺尔湖泊底泥退化为碱地和草地过程中甲烷氧化菌的变化规律 Figure 3 Variations of methanotrophs under the shrinkage process from lake sediment to saline and grassland soils (Lake Ganggeng). Quantification of pmoA gene by real-time qPCR (A) and relative abundance of methanotrophs against total bacteria (B) under different initial concentrations of methane. Lake, saline and grassland represent environmental samples for DNA extractions of lake sediments, saline soils and grassland soils. Different letters above each column indicate significant difference, P < 0.05 |
| 图选项 |
与零时刻相比,0.06%初始甲烷被氧化后,湖泊沉积物中甲烷氧化菌的pmoA基因数量增加了12倍,为1.46×106 copies/(g d.w.s.)、而碱地和草地土壤的增幅不显著(图 3-A)。甲烷氧化菌的相对丰度也表现出类似规律(图 3-B)。而0.6%初始甲烷被氧化后,除草地土壤增加显著外,湖泊沉积物、碱地土壤中pmoA基因拷贝数及甲烷氧化菌数量的相对丰度仅仅较0.6%初始甲烷浓度处理略有增加(P > 0.05)。但10%初始甲烷被氧化后,湖泊沉积物、碱地和草地土壤中pmoA基因拷贝数分别增加到1.50×106、5.15×105和6.08×106 copies/(g d.w.s.) (图 3-A),增加倍数分别为12.4、2.51和17.7。同时,甲烷氧化菌的相对丰度也分别增加至3.75%、1.13%、8.90% (图 3-B),增加倍数分别为2.82、5.14和34.2。
2.4 内蒙古岗更诺尔湖泊退化对甲烷氧化菌群落组成的影响 在微生物分类学属的水平,针对高通量16S rRNA基因序列进行分析,发现类型Ⅰ甲烷氧化菌(type Ⅰ methanotrophs,γ- Proteobacteria)是原位环境中的优势甲烷氧化菌,在各演替阶段分别表现为:Crenothrix (湖泊沉积物)、Methylococcus和Crenothrix (碱地土壤)以及Methylococcus (草地土壤)。湖泊沉积物中,Crenothrix在总甲烷氧化菌中的占比达到54.7%,Methylocaldum和Methylococcus的占比稍低,分别为22.7%和19.2%;在碱地土壤中,优势甲烷氧化菌为Methylococcus (48.8%)和Crenothrix (32.1%),二者的相对丰度远高于其他甲烷氧化菌;草地土壤中,Methylococcus的占比高达78.3%,在甲烷氧化菌中占有绝对优势(图 4-A)。
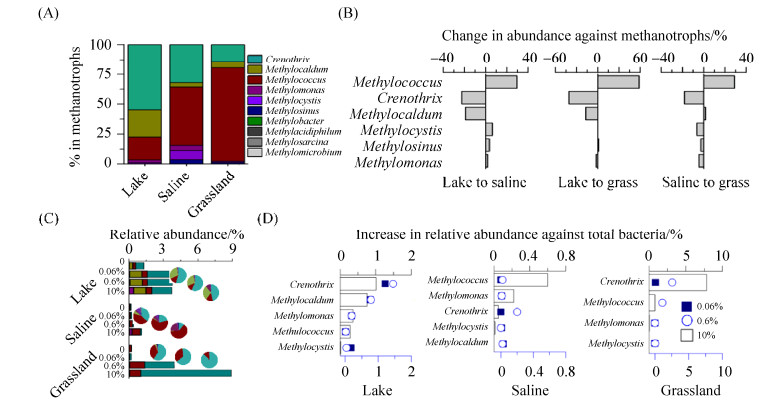 |
| 图 4 岗更诺尔湖退化过程中不同浓度甲烷培养前后甲烷氧化菌的群落组成和变化 Figure 4 The abundance and composition of methanotrophic community in the field during the shrinkage of Lake Ganggeng (A), and the net change in relative abundance (B). The changes in abundance and composition of methanotrophs communities during microcosms incubations with different initial methane concentrations under lake shrinkage (C), and the net increase in relative abundance of different methanotrophic lineages (D). Pie charts in (C) denote the percentage of distinct lineage against total methanotrophic community in different habitats under lake shrinkage |
| 图选项 |
在湖泊退化为碱地、草地的演替过程中,Methylococcus的占比从19.2%分别增加到48.8%、78.3%,而Crenothrix的占比从54.7%分别降低到32.1%、13.9%,Methylocaldum的占比从22.7%降低为3.6%、5.5%。此外,在湖泊退化为碱地阶段,也发现适应低浓度甲烷的类型Ⅱ甲烷氧化菌(Methylocystis和Methylosinus,type Ⅱ methanotrophs,α-Proteobacteria)的占比增加(图 4-B)。这些结果表明,湖泊退化导致Crenothrix和Methylocaldum的相对丰度显著降低,而Methylococcus相对丰度显著增加。
室内微宇宙培养表明,湖泊退化过程中,Crenothrix、Methylocaldum和Methylococcus在高浓度甲烷氧化过程中可能发挥了重要作用。湖泊沉积物氧化初始浓度0.06%、0.6%和10%甲烷之后,Crenothrix的相对丰度从0.73%分别增至1.94%、2.17%和1.74%,占甲烷氧化菌的比例分别为54.6%、57.3%和46.3%;Methylocaldum的相对丰度从0.25%分别增至1.06%、1.08%和1.06%,占甲烷氧化菌比例分别为30.0%、28.4%和28.2%,仅次于Crenothrix。而碱地土壤在氧化初始浓度0.06%、0.6%和10%甲烷之后,Methylococcus的相对丰度从0.105%逐渐增加到0.114%、0.27%和0.71%,其在甲烷氧化菌中的占比分别为43.2%、64.2%和63.2%,相对丰度增加最多,且是其中的优势甲烷氧化菌;草地土壤在氧化初始浓度0.06%、0.6%和10%甲烷后,Crenothrix的相对丰度从0.04%迅速增加至0.14%、2.58%和7.85%,在甲烷氧化菌中的占比也相应地从13.9%剧烈增加至59.1%、65.0%、88.2%,丰度增加最多且为优势甲烷氧化菌,而在0.6%和10%初始甲烷浓度下,草地土壤中Methylococcus的相对丰度从0.20%增加到1.32%和0.98%,增幅仅次于Crenothrix (图 4-C、图 4-D)。
这些结果表明,内蒙古岗更诺尔湖泊退化情景下,原位演替各个阶段(湖泊沉积物、碱地和草地土壤)的优势甲烷氧化菌的类型明显不同;并且不同初始甲烷氧化过程可能的活性甲烷氧化菌具有显著差异,可能在一定程度上反映了好氧甲烷氧化菌对湖泊退化环境长期适应的结果。
3 讨论 内蒙古岗更诺尔湖泊退化形成碱地、草地过程中,甲烷、氧气和水分含量发生显著变化,极有可能影响好氧甲烷氧化菌的生理生态过程[17]。本研究发现湖泊退化后,甲烷氧化潜力总体呈降低的趋势,原位好氧甲烷氧化微生物群落具有明显的演替规律,优势类群为:湖泊,Crenothrix;碱地,Crenothrix和Methylococcus;草地,Methylococcus。而在高浓度甲烷氧化条件下,湖泊、碱地和草地中可能的活性甲烷氧化菌分别是Crenothrix、Methylococcus和Crenothrix。这些结果为湖泊退化不同情景下温室气体减排的微生物机制研究提供了一定的参考。
湖泊退化为草地后导致甲烷氧化潜力降低,可能是因为草地土壤中的甲烷浓度远低于湖泊沉积物和碱地土壤。土壤含水量与氧气浓度紧密相关,原位湖泊底泥和碱地土壤中含水量远高于草地土壤,表明前两者可能存在大量的厌氧微域,促进了产甲烷古菌生长,产甲烷潜力较大,导致好氧甲烷氧化菌长期处于较高浓度甲烷环境之中。例如,有研究表明,湖泊沉积物中的甲烷浓度甚至高于250 μmol/L,即每升沉积物中的甲烷约为5.6 mL[18]),约为本研究的0.6%浓度处理;考虑到湖底水压、沉积物孔隙率低且易被水填充,其中的甲烷浓度极有可能超过10%;而草地的含水率低,长期暴露于大气高氧环境中,导致厌氧微域较少,而其中的甲烷浓度甚至可能低于0.01%,一般认为是大气甲烷的吸收汇[19]。针对新西兰草地和德国湖泊的研究表明,甲烷氧化速率与甲烷浓度呈正相关关系[20-21]。Amaral等[4]也发现,在最佳甲烷和氧气混合比例下,甲烷氧化活性最高。此外,土壤含水量也可能影响甲烷氧化过程:Einola等[22]指出,土壤含水量低于50%WHC时,甲烷氧化速率随着含水量的增加而增加,但当含水量高于50% WHC时,甲烷氧化速率则随着含水量的增加而降低,即甲烷氧化速率仅在最适含水量下最大,本研究中底泥和碱地的含水量远高于草地(表 1),因而甲烷氧化速率也表现出类似的规律。
湖泊退化情景下甲烷氧化潜力与甲烷氧化菌群落结构变化紧密相关。湖泊退化为碱地和草地过程中,Crenothrix在甲烷氧化菌群落中的优势地位逐渐被Methylococcus所取代,同时,Methylosinus在甲烷氧化菌中的占比增加(图 4-A、4-B)。针对甲烷氧化菌的丰度,Zhou等[23]的报道指出,与湖泊沉积物相比,湖泊退缩后形成的沼泽、草甸土壤DNA和RNA中,甲烷氧化菌在总细菌中的比例显著减少,与本研究的结果一致。这可能是因为湖泊退化导致底物匮乏,甲烷氧化菌生长缓慢,其相对丰度降低。湖泊不同退化环境也可能选择了生理特征各异的甲烷氧化菌。早在2006年,Stoecker等首次发现Crenothrix具有甲烷氧化活性[24],2017年,Oswald等采用先进的纳米二次离子质谱(NanoSIMS)和荧光原位杂交技术(CARD-FISH)进一步证实湖泊中的Crenothrix能氧化甲烷,且在缺氧条件下也具有较强的甲烷氧化活性[25],是水生环境中非常重要的甲烷氧化菌,与本研究结果一致;而Methylococcus则是严格好氧型微生物,可利用糖类,也可通过氧化氢气、硫等获得能量[26],通常在好氧和微好氧环境中大量检出,如淹水和非淹水的农田土壤、湿地土壤、湖泊和海洋沉积物及其氧跃层等[27],与本研究中碱地、草地的结果类似。值得注意的是,类型Ⅱ甲烷氧化菌Methylosinus能氧化低浓度甲烷,可利用56-188 nmol/L低浓度甲烷生长[28],对底物的亲和力远高于类型Ⅰ甲烷氧化菌,这也可能是碱地、草地中检测到少量类型Ⅱ甲烷氧化菌的原因。
在室内高浓度甲烷培养下,湖泊沉积物、碱地和草地土壤在氧化甲烷后,类型Ⅰ甲烷氧化菌的相对丰度显著增加(图 4),可能是活性甲烷氧化菌。这可能是因为长期不同甲烷和氧气环境“驯化”形成了稳定的甲烷氧化菌群落。大量的研究结果显示,湖泊中类型Ⅰ甲烷氧化菌主导甲烷氧化过程[12],与本研究的结果一致;但也有研究发现,类型Ⅱ甲烷氧化菌可能主导湖泊甲烷氧化[11],这可能与该湖泊中甲烷浓度较低有关(仅为0.02-2.9 mmol/L)。据报道,在低浓度甲烷环境下(约2 μL/L),Ⅱ型甲烷氧化菌主导甲烷氧化,而在高浓度甲烷下(大于10000 μl/L),则由Ⅰ型甲烷氧化菌主导甲烷氧化[29]。在碱地土壤中,氧化甲烷的微生物主要是Methylococcus,可能是因为该类群属于严格好氧型甲烷氧化菌[27],适应通气相对良好的碱地环境。特别值得注意的是,针对草地土壤,我们的结果也发现,Crenothrix的相对丰度增加最多(图 4-D)。这些结果暗示Crenothrix的生理多样性可能远高于已有报道,不仅在原位水生环境中发挥重要作用,在好氧非淹水陆地生态系统中可能也具有一定的活性,未来仍需采用稳定性同位素示踪和纳米二次离子质谱等先进技术,深入研究这些微生物类群在不同地理环境中的重要作用。
总体而言,湖泊退化引起土壤水分、氧气、甲烷含量、土壤结构、土壤碳氮含量等发生明显变化,这些因素直接或间接地作用于甲烷氧化菌群落并改变其生理活性,影响湖泊及其退化生态系统的甲烷源和汇的变化。然而,尽管我们的研究发现湖泊退化的生态演替过程显著改变了好氧甲烷氧化过程通量及其功能微生物群落结构,但湖泊退化情景下甲烷氧化微生物群落发生渐变式演替的时空变异规律及其关键节点仍然未知,在较大的时间尺度下,原位不同初始甲烷浓度和环境条件如何影响好氧甲烷氧化菌并形成稳定的甲烷氧化菌群落结构,其具体微生物分子机制仍待进一步研究。
4 结论 针对内蒙古岗更诺尔湖泊退化为碱地、草地过程,发现湖泊退化为草地后,甲烷氧化潜力降低,甲烷氧化菌群落发生了显著变化。湖泊沉积物中Crenothrix为优势甲烷菌(占比高达54.7%);碱地中Crenothrix和Methylococcus是优势类群(占比分别高达48.8%和32.1%);而Methylococcus是草地中的优势甲烷氧化菌(占比高达78.3%)。然而,湖泊底泥氧化高浓度甲烷过程中,Crenothrix和Methylocaldum显著增加(3.0和4.3倍),而碱地和草地土壤中Methylococcus和Crenothrix显著增加(分别为7.1和196.3倍)。这些结果表明,湖泊退化过程选择了生理生态特征迥异的好氧甲烷氧化菌,原位环境中好氧甲烷氧化菌的演替规律与活性的好氧甲烷氧化菌并不完全一致。
References
| [1] | Bastviken D, Cole JJ, Pace ML, van de Bogert MC. Fates of methane from different lake habitats: Connecting whole-lake budgets and CH4 emissions. Journal of Geophysical Research: Biogeosciences, 2008, 113(G2): G02024. |
| [2] | Bastviken D, Cole J, Pace M, Tranvik L. Methane emissions from lakes: Dependence of lake characteristics, two regional assessments, and a global estimate. Global Biogeochemical Cycles, 2004, 18(4): GB4009. |
| [3] | Eller G, K?nel L, Krüger M. Cooccurrence of aerobic and anaerobic methane oxidation in the water column of Lake Plu see. Applied and Environmental Microbiology, 2005, 71(12): 8925-8928. DOI:10.1128/AEM.71.12.8925-8928.2005 |
| [4] | Amaral JA, Knowles R. Growth of methanotrophs in methane and oxygen counter gradients. FEMS Microbiology Letters, 1995, 126(3): 215-220. DOI:10.1111/fml.1995.126.issue-3 |
| [5] | Tate KR. Soil methane oxidation and land-use change-from process to mitigation. Soil Biology and Biochemistry, 2015, 80: 260-272. DOI:10.1016/j.soilbio.2014.10.010 |
| [6] | Ho A, Angel R, Veraart AJ, Daebeler A, Jia ZJ, Kim SY, Kerckhof FM, Boon N, Bodelier PLE. Biotic interactions in microbial communities as modulators of biogeochemical processes: Methanotrophy as a model system. Frontiers in Microbiology, 2016, 7: 1285. |
| [7] | Pol A, Heijmans K, Harhangi HR, Tedesco D, Jetten MSM, Den Camp HJMO. Methanotrophy below pH 1 by a new Verrucomicrobia species. Nature, 2007, 450(7171): 874-878. DOI:10.1038/nature06222 |
| [8] | Bai J, Chen X, Li JL, Yang L, Fang H. Changes in the area of inland lakes in arid regions of central Asia during the past 30 years. Environmental Monitoring and Assessment, 2011, 178(1/4): 247-256. |
| [9] | Deutzmann JS, Stief P, Brandes J, Schink B. Anaerobic methane oxidation coupled to denitrification is the dominant methane sink in a deep lake. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(51): 18273-18278. DOI:10.1073/pnas.1411617111 |
| [10] | Martinez-Cruz K, Leewis MC, Herriott IC, Sepulveda-Jauregui A, Anthony KW, Thalasso F, Leigh MB. Anaerobic oxidation of methane by aerobic methanotrophs in sub-Arctic lake sediments. Science of the Total Environment, 2017, 607-608: 23-31. DOI:10.1016/j.scitotenv.2017.06.187 |
| [11] | Zigah PK, Oswald K, Brand A, Dinkel C, Wehrli B, Schubert CJ. Methane oxidation pathways and associated methanotrophic communities in the water column of a tropical lake. Limnology and Oceanography, 2015, 60(2): 553-572. DOI:10.1002/lno.10035 |
| [12] | Oswald K, Milucka J, Brand A, Hach P, Littmann S, Wehrli B, Kuypers MMM, Schubert CJ. Aerobic gammaproteobacterial methanotrophs mitigate methane emissions from oxic and anoxic lake waters. Limnology and Oceanography, 2016, 61(S1): S101-S118. DOI:10.1002/lno.10312 |
| [13] | Blees J, Niemann H, Wenk CB, Zopfi J, Schubert CJ, Kirf MK, Veronesi ML, Hitz C, Lehmann MF. Micro-aerobic bacterial methane oxidation in the chemocline and anoxic water column of deep south-Alpine Lake Lugano (Switzerland). Limnology and Oceanography, 2014, 59(2): 311-324. DOI:10.4319/lo.2014.59.2.0311 |
| [14] | Yun JL, Zhuang GQ, Ma AZ, Guo HG, Wang YF, Zhang HX. Community structure, abundance, and activity of methanotrophs in the Zoige wetland of the Tibetan Plateau. Microbial Ecology, 2012, 63(4): 835-843. DOI:10.1007/s00248-011-9981-x |
| [15] | Christner BC, Mosley-Thompson E, Thompson LG, Reeve JN. Isolation of bacteria and 16S rDNAs from Lake Vostok accretion ice. Environmental Microbiology, 2001, 3(9): 570-577. DOI:10.1046/j.1462-2920.2001.00226.x |
| [16] | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pe?a AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [17] | Ho A, Kerckhof FM, Luke C, Reim A, Krause S, Boon N, Bodelier PLE. Conceptualizing functional traits and ecological characteristics of methane-oxidizing bacteria as life strategies. Environmental Microbiology Reports, 2013, 5(3): 335-345. DOI:10.1111/j.1758-2229.2012.00370.x |
| [18] | Furlanetto LM, Marinho CC, Palma-Silva C, Albertoni EF, Figueiredo-Barros MP, de Assis Esteves F. Methane levels in shallow subtropical lake sediments: Dependence on the trophic status of the lake and allochthonous input. Limnologica, 2012, 42(2): 151-155. DOI:10.1016/j.limno.2011.09.009 |
| [19] | Dutaur L, Verchot LV. A global inventory of the soil CH4 sink. Global Biogeochemical Cycles, 2007, 21(4): GB4013. |
| [20] | Tate KR, Walcroft AS, Pratt C. Varying atmospheric methane concentrations affect soil methane oxidation rates and methanotroph populations in pasture, an adjacent pine forest, and a landfill. Soil Biology and Biochemistry, 2012, 52: 75-81. DOI:10.1016/j.soilbio.2012.04.011 |
| [21] | Ullrich N, Casper P, Otto A, Gessner MO. Proteomic evidence of methanotrophy in methane-enriched hypolimnetic lake water. Limnology and Oceanography, 2016, 61(S1): S91-S100. DOI:10.1002/lno.10333 |
| [22] | Einola JKM, Kettunen RH, Rintala JA. Responses of methane oxidation to temperature and water content in cover soil of a boreal landfill. Soil Biology and Biochemistry, 2007, 39(5): 1156-1164. DOI:10.1016/j.soilbio.2006.12.022 |
| [23] | Zhou X, Jin F, Lu CH, Baoyin T, Jia ZJ. Shifts in the community composition of methane-cycling microorganisms during lake shrinkage. Geoderma, 2018, 311: 9-14. DOI:10.1016/j.geoderma.2017.09.035 |
| [24] | Stoecker K, Bendinger B, Sch?ning B, Nielsen PH, Nielsen JL, Baranyi C, Toenshoff ER, Daims H, Wagner M. Cohn's Crenothrix is a filamentous methane oxidizer with an unusual methane monooxygenase. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(7): 2363-2367. DOI:10.1073/pnas.0506361103 |
| [25] | Oswald K, Graf JS, Littmann S, Tienken D, Brand A, Wehrli B, Albertsen M, Daims H, Wagner M, Kuypers MMM, Schubert CJ, Milucka J. Crenothrix are major methane consumers in stratified lakes. The ISME Journal, 2017, 11(9): 2124-2140. DOI:10.1038/ismej.2017.77 |
| [26] | Ward N, Larsen ?, Sakwa J, Bruseth L, Khouri H, Durkin AS, Dimitrov G, Jiang LX, Scanlan D, Kang KH, Lewis M, Nelson KE, Methé B, Wu M, Heidelberg JF, Paulsen LT, Fouts D, Ravel J, Tettelin H, Ren QH, Read T, DeBoy RT, Seshadri R, Salzberg SL, Jensen HB, Birkeland NK, Nelson WC, Dodson RJ, Grindhaug SH, Holt I, Eidhammer I, Jonasen I, Vanaken S, Utterback T, Feldblyum TV, Fraser CM, Lillehaug JR, Eisen JA. Genomic insights into methanotrophy: the complete genome sequence of Methylococcus capsulatus (Bath). PLoS Biology, 2004, 2(10): e303. DOI:10.1371/journal.pbio.0020303 |
| [27] | Garrity G, Brenner DJ, Krieg NR, Staley JR. Bergey's manual of systematic bacteriology. 2nd ed. New York: Springer, 2005: 271. |
| [28] | Dunfield PF, Liesack W, Henckel T, Knowles R, Conrad R. High-affinity methane oxidation by a soil enrichment culture containing a type Ⅱ methanotroph. Applied and Environmental Microbiology, 1999, 65(3): 1009-1014. |
| [29] | Cai YF, Zheng Y, Bodelier PLE, Conrad R, Jia ZJ. Conventional methanotrophs are responsible for atmospheric methane oxidation in paddy soils. Nature Communications, 2016, 7: 11728. DOI:10.1038/ncomms11728 |
