贺瑞含1,2, 杜宗军2, 俞勇1, 李会荣1


1. 自然资源部中国极地研究中心, 上海 200136;
2. 山东大学(威海)海洋学院, 山东 威海 264209
收稿日期:2018-09-27;修回日期:2018-12-22;网络出版日期:2019-03-13
基金项目:国家海洋局极地科学重点实验室开放研究基金(KP201705)
作者简介:李会荣,女,1972年生,云南玉溪人,研究员。2001年毕业于青岛海洋大学(现名中国海洋大学)海洋生命学院海洋生物专业,获得博士学位。2001年为复旦大学遗传所博士后。2003年出站到中国极地中心工作至今。先后主持完成国家自然科学基金面上项目2项,国家海洋局青年基金1项,中国极地中心创新基金重点1项,国家海洋局极地战略基金1项。主要参与承担南北极环境综合考察与评估极地专项、“973计划—极端微生物及其功能利用的基础研究”项目、科技部资源平台项目子课题“极地微生物资源标准化整理整合与共享”等多项科研重点项目的研究。主要从事极地、海洋微生物研究,从微生物分子生态学、功能基因、次生代谢产物等方面开展极地、海洋微生物的研究.
*通信作者:李会荣, Tel:+86-21-50385104, Fax:+86-21-58711663, E-mail:lihuirong@pric.org.cn.
摘要:[目的] 北极地区具有高纬度、低温、高辐射等独特的环境条件。北冰洋及周围大面积的陆地区域鲜有人类踪迹,其中微生物数量不可低估。本研究旨在了解北极土壤中的可培养微生物的多样性及其抗菌活性。[方法] 对来源于北极黄河站附近的7份不同植物根下苔原土壤进行直接涂布和富集培养后涂布。[结果] 共获得细菌菌株721株,对其中608株进行细菌16S rRNA基因序列测定,归属于86个属,229个种,主要分布于变形菌门(Proteobacteria,54.3%)、放线菌门(Actinobacteria,21.2%)、拟杆菌门(Bacteroidetes,12.8%)、厚壁菌门(Firmicutes,10.0%)和奇异球菌门(Deinococcus-Thermus,1.6%)。其中从16S rRNA基因序列同源性推测有22株细菌菌株为潜在新种/属。从分离菌株中筛选出16株可抑制金黄色葡萄球菌(Staphylococcus aureus)或鲍氏不动杆菌(Acinetobacter baumannii)生长的拮抗菌。[结论] 获得了北极土壤地区特有的微生物菌株资源,为进一步筛选拮抗菌的活性物质提供了菌株基础。
关键词:北极苔原细菌分离抗菌活性
Isolation of antibacterial and culturable bacteria from Arctic tundra soils
Ruihan He1,2, Zongjun Du2, Yong Yu1, Huirong Li1


1. Polar Research Institute of China, Ministry of Natural Resources, Shanghai 200136, China;
2. Marine College of Shandong University(Weihai), Weihai 264209, Shandong Province, China
*Corresponding author: Huirong Li, Tel:+86-21-50385104, Fax:+86-21-58711663, E-mail:lihuirong@pric.org.cn.
Foundation item: Supported by the Open Research Fund of Key Laboratory for Polar Science, State Oceanic Administration of China (KP201705)
Abstract: [Objective] The Arctic region has unique environmental characteristics such as high latitude, low temperature and high radiation. There are few human traces in the Arctic Ocean and the surrounding land area, but the number of microorganisms hidden in Arctic region is underestimated. We explored the culturable bacterial diversity and antibacterial activity in Arctic tundra soil. [Methods] We isolated bacteria from 7 soil samples collected from different plant roots near the Yellow River Station in Ny-?lesund (Svalbard) Arctic. [Results] A total of 721 strains were isolated from samples, 608 strains of which belong to 86 genera and 229 species after 16S rRNA gene sequencing. These 16S rRNA gene sequences mainly grouped into the following 5 phyla:Proteobacteria (54.3%), Actinobacteria (21.2%), Bacteroidetes (12.8%), Firmicutes (10.0%) and Deinococcus-Thermus (1.6%). It was suggested 22 strains could be potential novel species for their low sequence similarity. Furthermore, 16 antibacterial strains which could inhibit the growth of Staphylococcus aureus or Acinetobacter baumannii were screened. [Conclusion] The research obtained special bacteria resource of arctic soil, and solidified the foundation of studying bioactive substances.
Keywords: Arctictundrabacterial isolationantibacterial activity
北极斯瓦尔巴德群岛处于74°-81°N、10°-35°E,位于格陵兰海与巴比伦海之间,它由斯匹次卑尔根岛、巴伦支岛、东北地岛等岛屿组成,其中以斯匹次卑尔根岛为最大,总面积约62000 km2,且60%被冰川所覆盖。群岛具有海洋性气候特征,受北大西洋暖流支配,冬季较同纬度地区温暖,年平均温度约-5.1 ℃。极昼和极夜时间分别长达4个月,年降水量约200 mm[1]。
北极黄河站坐落于斯匹次卑尔根群岛的新奥尔松地区(78°55'N,11°56'E),三面环山,周边地貌包括冰川、潟湖、海湾、苔原等。新奥尔松地区属于典型的苔原气候和海洋性气候,受多雾影响,极昼期间的日照率仅为32.2%[2],因此该地区接收的太阳总辐射量远远低于南半球同纬度的冰原地区。该地区常见的动物主要有野鸭、北极狐、驯鹿以及在海上的海豹等。常见的苔原植物包括杨柳科极柳、虎耳草科挪威虎耳草、石竹科北极鼠耳草、无茎蝇子草、蔷薇科仙女木和莎草科苔草等。研究报道认为,不同区域环境的植被群落组成与该地区的冰川退缩迹地形成的时间是相关的。随冰川退缩迹地形成的时间延长,优势植物由挪威虎耳草及少量苔藓演变为木本植物及草本植物[3-4]。独特的生态环境往往孕育着独特的生物,常年低温、高辐射、苔原植被的北极新奥尔松地区土壤中,也存在有丰富微生物群落,并且北极苔原地区未受过干扰地区要比已受干扰地区的微生物群落多样性高[5]。
在临床上,金黄色葡萄球菌(Staphylococcus aureus)与鲍氏不动杆菌(Acinetobacter baumannii)是威胁到人类生命的耐药性致病菌,目前已发现对所有已知抗生素耐药的鲍氏不动杆菌菌株[6]。耐药菌具有多种耐药途径,包括产生多种降解抗生素的酶类、改变细胞膜的通透性、膜表面具备排药泵等[7]。另外,对于感染耐甲氧西林金黄色葡萄球菌(MRSA)的治疗在临床治疗上已变得更加棘手[8]。目前在已知的抗生素中,鲜有能够抑制临床上鲍氏不动杆菌与金黄色葡萄球菌的抗生素药物,多粘菌素是治疗鲍氏不动杆菌引起感染的最后一道防线。因此,筛选新型抗生素物质对于治疗临床细菌感染具有重要意义。极地土壤作为极端环境,其抗菌活性物质尚未被充分挖掘与研究。目前已有关于从北极苔原中的地衣上筛选拮抗菌的报道,但从北极土壤中筛选拮抗菌的研究还未见报道[9-10],所以如果从极地土壤中筛选出抗鲍氏不动杆菌与金黄色葡萄球菌的拮抗菌,那么该细菌极有可能具有生产新型抗菌物质的特性。因此为了充分挖掘极地资源,本研究通过筛选拮抗菌株实验,考察极地土壤抗菌活性能力及其开发价值,为后续进行新型抗菌物质的深入研究提供菌株资源。
1 材料和方法 1.1 样品采集 采样地点位于斯瓦尔巴群岛新奥尔松地区的北极黄河站周围的苔原地区(图 1)。每个采样点,无菌小铲采集图 2中所示7种植物根下0-5 cm的土壤,去除小石子,每份样品50-100 g装入无菌采样袋中,4 ℃冷藏保存和冰袋运输回国,实验前储存在4 ℃冰箱内(表 1)。
 |
| 图 1 北极黄河站周围的苔原地区及采样位点植物 Figure 1 Tundra and different sampling site plants near Yellow River Station. A: tundra; B: moss; C: Polar Willow (Salix polaris Wahlenb); D: Mountain Sorrel (Oxyria digyna); E: Northern Wood-rush (Luzula confusa Lindeb); F: Purple Saxifraga (Saxifraga oppositifolia); G: Moss Campion (Slene acaulis); H: Mountain Avens (Dryas octopetala) |
| 图选项 |
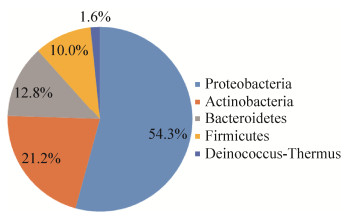 |
| 图 2 分离细菌在门水平上的群落组成 Figure 2 The community structure of isolated bacteria at phylum level |
| 图选项 |
表 1. 北极黄河站采样点及信息 Table 1. Soil samples collected from Yellow River Station of Arctic region
| Sample | Date | Geographical coordinates | Plants |
| NA01 | 20170814 | N 78°57'40", E 11°35'55" | Moss |
| NA02 | 20170813 | N 78°56'37", E 11°48'12" | Polar Willow (Salix polaris Wahlenb) |
| NA05 | 20170821 | N 78°55'21", E 11°55'04" | Mountain Sorrel (Oxyria digyna) |
| NA07 | 20170811 | N 78°54'44", E 11°58'15" | Northern Wood-rush (Luzula confusa Lindeb) |
| NA08 | 20170812 | N 78°53'53", E 12°04'07" | Purple Saxifraga (Saxifraga oppositifolia) |
| NA11 | 20170812 | N 78°54'35", E 12°05'16" | Moss Campion (Slene acaulis) |
| NA12 | 20170813 | N 78°57'59", E 12°03'34" | Mountain Avens (Dryas octopetala) |
表选项
1.2 样品处理及分离培养
1.2.1 直接涂布培养: 无菌条件下,将1 g土壤样品加至9 mL无菌生理盐水中,用混匀器(科兴SK-1)充分振荡5 min,静置10 min后取上清液1 mL再次用9 mL无菌生理盐水稀释,最终获得10-1、10-2、10-3、10-4、10-5共5个浓度梯度,每个梯度分别取100 μL稀释溶液在分离培养基(蛋白胨5.0 g,酵母粉1.0 g,除氯自来水1 L)平板上进行涂布。置于15 ℃培养箱,低温培养7-15 d。
1.2.2 无氧富集后涂布培养: 将5 g土壤样品加入装有2/3体积富集液的250 mL蓝盖瓶中,富集液的配方为:蛋白胨0.20 g,酵母粉0.20 g,NH4Cl 1.00 g,MgSO4·H2O 0.20 g,CH3COONa 2.00 g,丙酮酸钠1.25 g,EDTA 1.00 g,KH2PO4 0.20 g,NaHCO3 1.00 g,除氯自来水1 L[11]。加入样品后,用富集液将蓝盖瓶剩下的约1/3体积补满,从而形成一个无氧环境。15 ℃富集培养15、30、45、60 d后分别开瓶,取样品在分离培养基上进行稀释涂布,置于15 ℃培养箱,低温培养15 d。
1.2.3 有氧富集培养后涂布培养: 将3 g样品加入装有100 mL富集液的250 mL三角瓶中,有氧条件下,15 ℃摇床培养10、20、30 d,分别开瓶,取样品在分离培养基上进行稀释涂布,置于15 ℃培养箱,低温培养15 d。
1.3 细菌分离纯化、保藏及细菌16S rRNA基因测序 在15 ℃培养箱中培养后,挑取涂布平板上生长的单菌落,在分离培养基平板上进行划线纯化、编号并记录菌落形态特点。将纯化后的菌株保存在保种液(85%纯水,15%甘油,1% NaCl)中放于-80 ℃保藏。同时,使用通用引物27F与1492R[11]对细菌16S rRNA基因进行PCR扩增。经琼脂糖凝胶电泳检测,将扩增成功的PCR产物寄至青岛睿博测序公司,进行单向测序。截去双峰序列后获得长约600-700 bp的16S rRNA基因序列片段,利用BLAST核酸比对系统(https://blast.ncbi.nlm.nih.gov/)进行序列比对。对于进行分类鉴定的新菌,通过克隆16S rRNA基因,获得约1500 bp的序列,进一步确定其分类地位。最后将分离菌株的16S rRNA基因序列批量提交上传至NCBI数据库。
1.4 分离株抗菌活性筛选 本实验所用到的金黄色葡萄球菌与鲍氏不动杆菌为澳大利亚莫纳什大学李健教授赠送。调制麦氏浊度为0.5的菌悬液,分别涂布在LB培养基(蛋白胨10.0 g,酵母粉5.0 g,除氯自来水1 L)上,取分离纯化后菌株的单克隆菌落点种于涂布培养基平板,每个平板接种约20株分离菌株。置于25 ℃培养箱培养,3 d后观察是否有透明圈。有透明圈形成即表示有抗菌活性。
2 结果和分析 2.1 可培养细菌多样性统计 直接涂布和富集培养后涂布的平板于15 ℃培养15 d后,从形态上观察,主要为规则圆形的白色菌落,部分平板上长出红色、黑色等颜色鲜艳的单菌落,以及大小不一的单菌落。根据菌落形态、颜色、大小、光滑度等特点,每个平板上的菌落种类约为10种以上。
从7份土壤样品中共分离纯化细菌菌株721株,对所分离的608株菌株进行16S rRNA基因PCR、测序及序列比对,分属于86个属、229个种(表 2)。从图 2可以看出,测序鉴定的菌株主要分布在5个门,其中330株分属于变形菌门(Proteobacteria),占总数的54.3%;其次是放线菌门(Actinobacteria) 129株,占总数的21.2%;另外,拟杆菌门(Bacteroidetes) 78株,占总数的12.8%;厚壁菌门(Firmicutes) 61株,占总数的10.0%;奇异球菌门(Deinococcus-Thermus) 10株,占总数的1.6%。
表 2. 不同样品中分离细菌的数目及多样性情况 Table 2. The number and diversity of bacteria isolated from soil samples
| Sample | The number of isolates | The number of isolates identified by 16S rRNA gene sequencing | The number of genera/ species | The number of potential novel strains |
| NA01 | 125 | 114 | 29/65 | 6 |
| NA02 | 116 | 79 | 31/50 | 5 |
| NA05 | 106 | 79 | 32/36 | 2 |
| NA07 | 97 | 97 | 31/48 | 1 |
| NA08 | 114 | 104 | 25/51 | 2 |
| NA11 | 68 | 54 | 23/33 | 6 |
| NA12 | 95 | 81 | 23/37 | 3 |
表选项
2.2 不同培养方法对可培养细菌多样性的影响 为了从样品中获得更多的可培养细菌,本实验采用了直接涂布培养、不同时间段的无氧富集后涂布培养以及有氧富集后涂布培养3种方式。经过细菌培养及测序后发现,富集方法的不同影响了可培养细菌的种类与数目。3种方法均分离得到的属共有15个,包括Arthrobacter、Bacillus、Brevundimonas、Devosia、Janthinobacterium、Leifsonia、Massilia,Microbacterium、Nocardioides、Paenibacillus、Pedobacter、Pseudomonas、Rhodococcus、Sphingomonas及Stenotrophomonas。与其他2种培养方法相比较,直接涂布独有16个属,无氧富集方法独有27个属,有氧富集方法则独有8个属。这说明,无氧富集方法能更加有效地分离出更多的可培养细菌。直接涂布与无氧富集方法相比,共有的可培养细菌有34个属,但二者与有氧富集方法的共有菌株的数目则相对较少(图 3)。
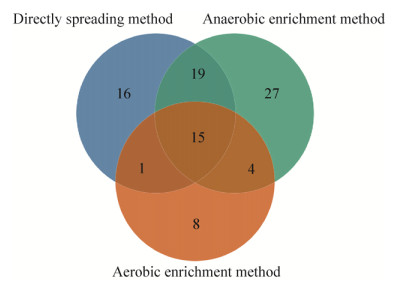 |
| 图 3 三种培养方法分离得到细菌属的数目韦恩图 Figure 3 The Venn diagram of the number of bacterial genera among three culture methods |
| 图选项 |
2.3 可培养细菌多样性在不同采样点之间的比较 在门水平上,分离得到的变形菌门细菌的数目最多(54.5%),其次是放线菌门(21.2%)。此外,奇异球菌门细菌在NA01、NA02、NA05、NA07、NA11这5个样品中均有分布(图 4)。
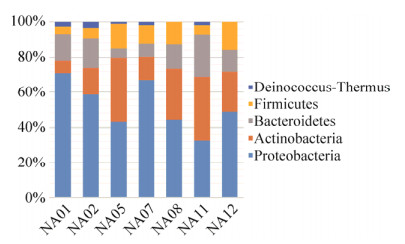 |
| 图 4 可培养细菌在门水平上的分布柱状图 Figure 4 The community structure of isolated bacteria in 7 different soils at phylum level |
| 图选项 |
在属水平上,7个样品中可培养细菌中优势属主要有20种,其中丰度最高的属为变形菌门阿尔法亚群的Brevundimonas,其作为优势类群,在样品NA01、NA02、NA07中均被分离得到。此外,变形菌门阿尔法亚群的Sphingomonas (6.3%)、变形菌门伽马亚群的Pseudomonas (6.6%)、厚壁菌门的Bacillius (6.1%)在7个样品中均能够被分离到,且都为各样品的优势类群。变形菌门伽马亚群的Stenotrophmonas、变形菌门阿尔法亚群的Pseudoxanthomonas、Massilia、Devosia、Deinococcus、Chryseobacterium、Brevundimonas以及放线菌门的Arthrobacter在5-6个样品中都有所分布。其中,Sphingomonas作为植物内生菌,曾在山蓼中被分离出[12]。Chryseobacterium是一种全球范围分布广泛的细菌,但研究发现该属内很多种都是根际微生物[13-15]。
然而不同样品之间在属水平分布上仍然具有差异(图 5、图 6)。NA01样品采样于湾口附近苔原,植被丰富,采样于苔藓根下土壤,濒临沼泽,土壤含水量相对较高,分离的菌株中,变形菌门的细菌丰度非常高,约占70%。该样品中特有的属有Sphingopyxis、Luteimonas、Fictibacillus、Kaistia、Roseococcus、Simplicispira。在NA02采样点发现有鹿角及动物粪便,且此地为植被丰富的苔原地貌,土壤营养相对充足,此样品中虽分离菌株数目不多,然而其细菌多样性较好,Arenimonas、Cellulosimicrobium、Ochrobactrum、Oerskovia、Prolinoborus、Sphingobacterium、Sphingorhabdus是其所特有的细菌,以往研究表明这些细菌往往在农场土壤、施肥土壤以及植被丰富的森林土壤中被发现[16]。而鲜有Cellulosimicrobium从极地分离得到,根据其降解纤维素的功能,推测本样品中分离得到的该属菌株来自于鹿等动物体内,并将其携带至此。NA05样品采样点位于站内建筑群附近,分离得到的属数目40个,稀有属(每个属的分离菌株数目 < 3株)数目较多,约占30%,在7个样品中其分离的细菌物种丰富度最好。与其他样品不同之处,Paenibacillus、Psychrobacter是其优势属,此外,该样品特有的属有Actnotalea、Altererythrobacter、Brachybacterium、Knoellia、Nitratireductor、Pseudokineococcus、Sphingobium、Sporosarcina。其中,Nitratireductor是一株硝酸盐还原细菌,属于叶瘤菌科(Phyllobacteriaceae)、根瘤菌目(Rhizobiales)[17],主要在低纬度分布。极地能够分离到该属的物种,一定程度上说明了极地土壤的细菌种类可能并没有人类推测的那么匮乏。NA08样品采样于中洛温冰川前缘,冰川融水不明显,苔原植物为演化的初级阶段[3],植物主要以挪威虎耳草(Saxifraga oppositifolia)为主。Bacillus、Chryseobacterium、Cryobacterium、Devosia、Microbacterium在NA08样品中作为优势属,丰度较高;其中Cryobacterium为典型的冰川环境分布的细菌,其往往在冰川土、冰川冰及北极冻土中被发现[18-21]。NA11样品中,分离菌株分布在23个属中,特有的属有Leifsonia、Aureimonas、Glaciihabitans、Lysobacter、Mycetocola。NA12采样点与其他6个采样点隔湾相望,位于伦敦岛,分离菌株分布在23个属中,特有的属为Caulobacter、Sanguibacter、Janthinobacterium、Dankookia、Duganella、Marinilabilia。
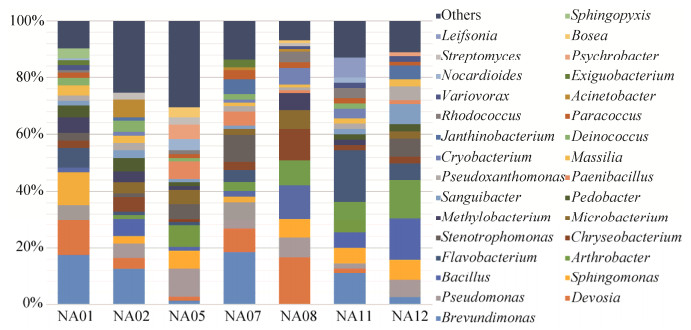 |
| 图 5 可培养细菌在属水平上的分布柱状图 Figure 5 The community structure of isolated bacteria at genus level |
| 图选项 |
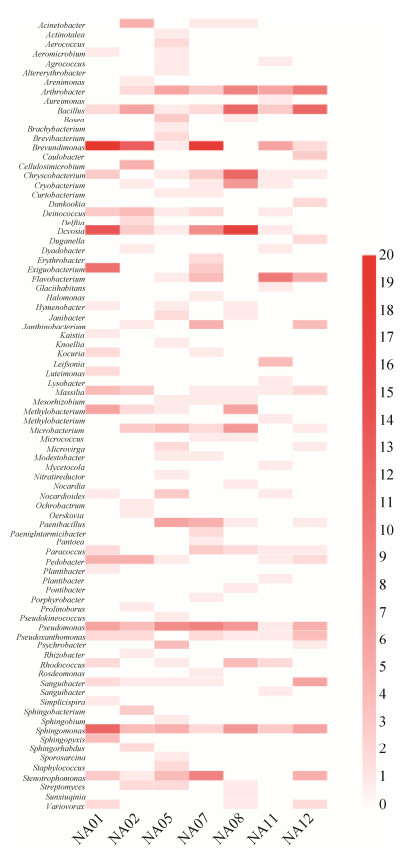 |
| 图 6 可培养细菌在属水平的分布热图 Figure 6 The community heatmap of isolated bacteria at genus level |
| 图选项 |
2.4 分离菌株中的潜在新菌 从所有测序菌株中,发现共有22株潜在新种(95%≤相似度≤97%)。在所分离出的潜在新菌中(表 3),拟杆菌门的菌株数目最多(12株),其次为变形菌门(5株)。此外奇异球菌门的新菌有1株,而所有分离的奇异球菌仅4个物种,奇异球菌门作为极地地区所特有的细菌门类,有大量的新菌未被人们所发现。
表 3. 分离菌株中筛选出的潜在新菌 Table 3. The potential novel species of isolated bacteria
| Sample | Strains | GenBank No. | The most similar strains (type strain) | GenBank No. | Similarity/% | Phylum |
| NA01 | 1E305 | MH929484 | Flavobacterium gossypii JM-222T | NR_158014 | 96.9 | Bacteroidetes |
| NA01 | 2E17 | MH929519 | Hymenobacter metallic A2-91T | NR_108905 | 97.1 | Bacteroidetes |
| NA01 | 2E01 | MH929506 | Nocardioides terrigena DS-17T | NR_044185 | 97.0 | Actinobacteria |
| NA01 | 2e04-2 | MH929510 | Roseococcus suduntuyensis SHETT | NR _044369 | 97.1 | Firmicutes |
| NA01 | 1E403 | MH209250 | Flavobacterium subsaxonicum WB4.1-42T | NR_115085 | 96.8 | Bacteroidetes |
| NA02 | OH19 | MH929990 | Flavobacterium aquidurensei WB 1.1-56T | NR_042470 | 96.2 | Proteobacteria |
| NA02 | 17H08 | MH930040 | Sphingobacterium daejeonense DSM 11724T | NR_042134 | 97.2 | Bacteroidetes |
| NA02 | 17H05 | MH930037 | Sphingobacterium daejeonense DSM 11724T | NR_042134 | 96.7 | Bacteroidetes |
| NA05 | G75 | MH930099 | Actinotalea fermentans DSM 3133T | NR_119160 | 97.3 | Actinobacteria |
| NA05 | G88 | MH930105 | Pedobacter borealis G-1T | NR_044381 | 97.0 | Bacteroidetes |
| NA07 | 0A151 | MH929962 | Roseomonas aerilata 5420S-30T | NR_044347 | 96.5 | Proteobacteria |
| NA08 | 2B07 | MH929685 | Paenibacillus wynnii LMG 22176T | NR_042244 | 97.1 | Firmicutes |
| NA08 | 2b14 | MG729207 | Pontibacter diazotrophicus H4XT | NR_126288 | 95.9 | Bacteroidetes |
| NA11 | 2D120 | MH929789 | Chryseobacterium soli JS6-6T | NR_044299 | 97.0 | Bacteroidetes |
| NA11 | 0D32 | MG696181 | Deinococcus radiotolerans ID1504T | NR_157673 | 96.3 | Deinococcus-Thermus |
| NA11 | 0D29 | MH929752 | Dyadobacter hamtensis HHST | NR_042226 | 97.1 | Bacteroidetes |
| NA11 | 0D23 | MH929749 | Flavobacterium branchiarum 57B-2-09T | NR_145954 | 97.4 | Bacteroidetes |
| NA11 | 0D200 | MH929757 | Flavobacterium collinsii 983-08T | NR_145952 | 96.4 | Bacteroidetes |
| NA11 | 0D28 | MH929751 | Actinotalea fermentans DSM 3133T | NR_119160 | 96.5 | Proteobacteria |
| NA12 | JT02 | MH929864 | Dankookia rubra WS-10T | NR_146664 | 97.0 | Proteobacteria |
| NA12 | F09-1 | MH929817 | Flavobacterium yonginense 412R-09T | NR_133746 | 96.1 | Bacteroidetes |
| NA12 | F422 | MH929847 | Massilia oculi CCUG 43427AT | NR_117180 | 97.7 | Proteobacteria |
表选项
2.5 拮抗菌的筛选及分析 从NA01、NA08、NA12样品中筛选出多株可抑制金黄色葡萄球菌生长的菌株,1E501、0B03、0B07、0B08、F5、0F08、0F01、JT12、JT13、1E502、0B02、F422以及0E10。另外,在NA02样品中筛选出2株抑制鲍氏不动杆菌生长的菌株3H14和3H15。抑菌圈的大小代表菌株抑制病原菌的能力,表 4为分离菌株中筛选出的抑制致病菌生长的拮抗菌。图 7所示为部分菌株抑制致病菌的生长而形成透明圈。
表 4. 筛选出抑制致病菌生长的拮抗菌 Table 4. The antibacterial strains inhabiting the growth of pathogenic bacteria
| Sample | Strains | GenBank No. | The most similar strains (type strain) | GenBank No. | Similarity/% | Phylum | Pathogenic bacteria |
| NA01 | 1E501 | MH929504 | Bacillus zhangzhouensis MCCC 1A08372T | NR_148786 | 99.9 | Firmicutes | S. aureus |
| NA08 | 0B03 | MH929635 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA08 | 0B07 | MH929639 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA08 | 0B08 | MH929640 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA12 | 0F01 | MH929811 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA12 | JT12 | MH929871 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA12 | JT13 | MH929872 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA01 | 1E502 | MH929505 | Bacillus aerius 2KT | NR_118439 | 100.0 | Firmicutes | S. aureus |
| NA12 | F326 | MH929837 | B. subtilis subsp.168T | NR_102783 | 99.9 | Firmicutes | S. aureus |
| NA12 | JT24 | MH929880 | B. subtilis subsp.168T | NR_102783 | 99.9 | Firmicutes | S. aureus |
| NA08 | 0B02 | MH929634 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Firmicutes | S. aureus |
| NA12 | F420 | MH929846 | B. zhangzhouensis MCCC 1A08372T | NR_148786 | 100.0 | Proteobacteria | S. aureus |
| NA01 | 0E10 | MH929463 | Pseudomonas prosekii AN/28/1T | NR_132724 | 100.0 | Proteobacteria | S. aureus |
| NA01 | 0E10 | MH929463 | P. prosekii AN/28/1T | NR_132724 | 100.0 | Proteobacteria | A. baumanni |
| NA02 | 3H14 | MH930025 | Microbacterium maritypicum DSM 12512T | NR_114986 | 99.9 | Actinobacteria | A. baumanni |
| NA02 | 3H15 | MH930026 | Pseudomonas silesiensis A3T | NR_156815 | 99.3 | Proteobacteria | A. baumanni |
表选项
 |
| 图 7 抑制致病菌生长而导致透明圈的产生 Figure 7 The clear zone produced by antibacterial isolates inhabiting the growth of S. aureus. 1: the control strain; 2: 0F01; 3: F420; 4: 0E10 |
| 图选项 |
3 讨论 本研究对北极黄河站附近的苔原土壤样品进行了细菌的分离培养,采样时间为2017年8月,即苔原土壤的夏季解冻时期,土壤微生物最为活跃。我们从7份土壤样品中获得细菌菌株721株,其中608株经细菌16S rRNA基因序列测定分析,分属于变形菌门、放线菌门、拟杆菌门、厚壁菌门和奇异球菌门。这一结果与以往研究发现基本一致。Wilhelm等[22]发现北极不同地区苔原冻土中主要的微生物门类为放线菌门、变形菌门、酸杆菌门及芽单胞菌门。Singh等[23]对北极斯瓦尔巴特群岛冻土的微生物群落研究发现优势属为Arthrobacter和Pseudomonas。Goordial等[24]利用Minlon原位核酸探测及测序技术发现加拿大高纬度北极地区微生物群落中的优势属为Pseudomonas、Flavobacterium、Sphingomonas。
与低纬度地区的土壤微生物多样性相比,在极地土壤样品中,放线菌门仍然是主要的细菌类群,但在属水平上,如Arthrobacter、Cryobacterium则是极地地区特有的优势属。Deinococcus- Thermus细菌作为极地常见的微生物类群,在多个样品中均被检出,其中一株疑似新物种Deinococcus sp. OD32 (与Deinococcus radiotolerans C1T相似度96%)属于该门。奇异球菌门细菌具有极强的抗辐射特性,因此能够适应辐射高的极地极端环境。北极地区具有高纬度、低温、高辐射等独特的环境特性,其中蕴藏着未知的微生物资源。本研究中共分离到22株潜在新种,后续将对其展开物种鉴定工作,进一步挖掘与分析它们的功能特性。
在分离得到的可培养细菌中,很多属具有潜在的应用价值。如NA01与NA07样品中发现的Exiguobacterium,在工业、农业、环境方面具有重要的潜在开发价值,如生产低温乳化剂、降解有毒物质及生物修复等[25-27]。NA01中分离得到的Sphingopyxis[28-30]及在NA02中分离得到的特有细菌Cellulosimicrobium[31-32]作为北极冻土中的耐冷微生物,多个物种曾在石油污染环境中分离得到,对于有机物污染降解方面具有一定的应用价值。已有报道的根际微生物有Chryseobacterium[33]、Leifsonia[34],且大部分的Leifsonia菌株主要从极地得分离获得[35-36],有研究通过全基因组测序分析表明该属具有促进植物生长的作用[37]。
筛选出的拮抗菌中,与Bacillus zhangzhouensis DW5-4T相似度最高的菌株较多,然而有些菌株的形态与该物种的模式菌株的形态描述有所差异,模式菌株B. zhangzhouensis DW5-4T的菌落直径为2-3 mm、颜色为乳白色[38],如菌株0B03与JT12的单菌落直径约1 mm、颜色为白色,其他菌株的单菌落均为乳黄色。推测它们是潜在新种或具有独特功能的潜在新亚种。此外,本实验分离得到了一株Microbacterium sp. 3H14 (与Microbacterium maritypicum IFO 15779T相似度99%)对鲍氏不动杆菌的生长具有抑制作用,Gos等[39]通过从药用植物内生菌中筛选拮抗菌的实验中发现与Microbacterium maritypicum IFO 15779T相近的Microbacterium sp. LGMB471T菌株具有抗菌活性,但关于Microbacterium maritypicum DW5-4T的抗菌活性研究并未见报道。这些实验结果说明Microbacterium具有潜在的抗菌活性研究价值。另已有研究发现Pseudomonas能够产生多种次级代谢产物如2, 4-二乙酰藤黄酚、吩嗪类、肽类以及抑菌肽与抑菌蛋白等物质抑制微生物的生长[40-41],然而并未有关于Pseudomonasprosekii LMG 26867T的抑菌物质的研究。从NCBI数据库中获取B. zhangzhouensis DW5-4T (JOTP00000000)、M. maritypicum IFO 15779T (ATAO00000000)及P.prosekii LMG 26867T (LT629762) 3个物种的基因组,将其在antiSMASH网站(https://antismash.secondarymetabolites.org)进行次级代谢产物基因簇的比对。比对结果表明,B.zhangzhouensis DW5-4T具有3个关键的抗菌次级代谢产物合成基因簇,包括:与地衣菌素(Lichenysin)合成基因相似的非核糖体肽合成复合酶(Nrps)基因簇,相似度为50%;与溶杆菌素(Bacilysin)合成基因相似的未知基因簇,相似度85%;与抗霉枯草菌素(Mycosubtilin)合成基因相似的未知基因簇,相似度50%。P.prosekii LMG 26867T中,含有1个关键的抗菌次级代谢产物合成基因簇,即与Mangotoxin合成基因相似度为71%的一个未知类型基因簇,Mangotoxin在Pseudomonas中被发现,它是一种具有抗菌活性的毒素类代谢产物[42]。然而,在antiSMASH中并未找到在M. maritypicum IFO 15779T基因组内的抗菌基因簇。由于基因组来自于NCBI数据库,而并非菌株本身测序结果,可能并不能代表菌株本身所含有的基因,但对与这些物种的抗性研究仍然具有参考价值,后续会对基因组进行测序,对其活性物质进行进一步的分析与研究。
7个样品采样于苔原不同植物根下土壤,但并未发现它们的细菌群落结构差异呈现出一定的规律性或者与植物具有明显的相关性。目前关于极地苔原植物如虎耳草、蝇子草、苔藓等植物与细菌群落结果的研究仍然较少,而本实验结果可为未来进一步研究极地植物根际微生物提供参考。此外受到实验室培养条件、人为主观因素、样品采集后保存时间过长等限制,未能分离得到北极土壤中分类地位更高的新物种。但是,本研究结果仍能够反映出北极苔原土壤微生物群落中的可培养细菌的优势菌群及一些鲜为人知的细菌的存在,如抗辐射细菌Deinococcus-Thermus、大量的嗜冷微生物、耐冷微生物以及具有潜在研究价值的石油降解细菌等。本研究在分离方法上有所改进,通过添加1.5%的丙酮酸钠,可帮助去除在细菌生长过程通常会产生的H2O2等过氧化物及其他有毒物质。未来我们拟通过优化培养方案以期获得更多的可培养微生物资源。比如针对北极地区营养贫瘠干燥的环境,在今后细菌分离实验中,可采用寡营养培养基进行细菌的分离,如稀释后的R2A培养基等,避免培养过程中优势菌数量过多,造成资源的过分争夺使得稀有微生物无法生长。另外,设置培养温度跨度为4-20 ℃,并延长低温培养的时间,以分离到更稀有的微生物物种资源。
References
| [1] | Cheng ZB, Shi XF, Chen ZH, Wu YH, Li XY, Ju XH, Shi FD. 2007 summer scientific expedition to and general information on Chinese arctic yellow river station. Advances in Marine Science, 2008, 26(1): 112-118. (in Chinese) 程振波, 石学法, 陈志华, 吴永华, 李小艳, 鞠晓华, 石丰登. 2007中国北极黄河站夏季科学考察及黄河站概况. 海洋科学进展, 2008, 26(1): 112-118. DOI:10.3969/j.issn.1671-6647.2008.01.015 |
| [2] | Deng HB, Lu LH, Bian LG. Surface radiation characteristics at Ny-?lesund over the arctic tundra area. Chinese Journal of Polar Research, 2006, 18(4): 254-264. (in Chinese) 邓海滨, 陆龙骅, 卞林根. 北极苔原新奥尔松地区的地表辐射特征. 极地研究, 2006, 18(4): 254-264. |
| [3] | Yao YF, Cao SN, Peng F, Li CS. Characteristics of species composition and community structure on the Austre Lovénbreen glacier foreland, Ny-?lesund, Svalbard. Chinese Journal of Polar Research, 2014, 26(3): 362-368. (in Chinese) 姚轶锋, 曹叔楠, 彭方, 李承森. 北极新奥尔松Austre Lovénbreen冰川退缩迹地不同演替阶段的植物组成与植被群落特征分析. 极地研究, 2014, 26(3): 362-368. |
| [4] | Kim M, Jung JY, Laffly D, Kwon HY, Lee YK. Shifts in bacterial community structure during succession in a glacier foreland of the High Arctic. FEMS Microbiology Ecology, 2017, 93(1): fiw213. DOI:10.1093/femsec/fiw213 |
| [5] | Neufeld JD, Mohn WW. Unexpectedly high bacterial diversity in arctic tundra relative to boreal forest soils, revealed by serial analysis of ribosomal sequence tags. Applied and Environmental Microbiology, 2005, 71(10): 5710-5718. DOI:10.1128/AEM.71.10.5710-5718.2005 |
| [6] | Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clinical Microbiology Reviews, 2008, 21(3): 538-582. DOI:10.1128/CMR.00058-07 |
| [7] | Lee CR, Lee JH, Park M, Park KS, Bae IK, Kim YB, Cha CJ, Jeong BC, Lee SH. Biology of Acinetobacter baumannii: Pathogenesis, antibiotic resistance mechanisms, and prospective treatment options. Frontiers in cellular and infection microbiology, 2017, 7(55): 1: 35. |
| [8] | Zhang XL, Li XH, Zhang F, Chen SC. Drug resistance analysis of staphylococcus aureus strains in Beijing Luhe Hospital in 2016. Medical Recapitulate, 2018, 24(2): 409-412. (in Chinese) 张晓兰, 李晓辉, 张芳, 陈世财. 医院2016年金黄色葡萄球菌耐药性分析. 医学综述, 2018, 24(2): 409-412. DOI:10.3969/j.issn.1006-2084.2018.02.038 |
| [9] | Kim MK, Park H, Oh TJ. Antibacterial and antioxidant capacity of polar microorganisms isolated from Arctic lichen Ochrolechia sp. Polish Journal of Microbiology, 2014, 63(3): 317-322. |
| [10] | Kim MK, Park H, Oh TJ. Antimicrobial properties of the bacterial associates of the Arctic lichen Stereocaulon sp. African Journal of Microbiology Research, 2013, 7: 3651-3657. |
| [11] | Liu QQ, Wang Y, Li J, Du ZJ, Chen GJ. Saccharicrinis carchari sp. nov., isolated from a shark, and emended descriptions of the genus Saccharicrinis and Saccharicrinis fermentans. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(7): 2204-2209. |
| [12] | Nissinen RM, M?nnist? MK, van Elsas JD. Endophytic bacterial communities in three arctic plants from low arctic fell tundra are cold-adapted and host-plant specific. FEMS Microbiology Ecology, 2012, 82(2): 510-522. DOI:10.1111/fem.2012.82.issue-2 |
| [13] | K?mpfer P, McInroy JA, Glaeser SP. Chryseobacterium zeae sp. nov., Chryseobacterium arachidis sp. nov., and Chryseobacterium geocarposphaerae sp. nov. isolated from the rhizosphere environment. Antonie van Leeuwenhoek, 2014, 105(3): 491-500. DOI:10.1007/s10482-013-0101-4 |
| [14] | K?mpfer P, McInroy JA, Glaeser SP. Chryseobacterium rhizoplanae sp. nov., isolated from the rhizoplane environment. Antonie van Leeuwenhoek, 2015, 107(2): 533-538. DOI:10.1007/s10482-014-0349-3 |
| [15] | Du J, Ngo HTT, Won K, Kim KY, Jin FX, Yi TH. Chryseobacterium solani sp. nov., isolated from field-grown eggplant rhizosphere soil. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(8): 2372-2377. DOI:10.1099/ijs.0.000266 |
| [16] | Pot B, Willems A, Gillis M, de Ley J. Intra- and Intergeneric relationships of the genus Aquaspirillum: Prolinoborus, a New Genus for Aquaspirillum fasciculus, with the species Prolinoborus fasciculus comb. nov. International Journal of Systematic and Evolutionary Microbiology, 1992, 42(1): 44-57. |
| [17] | Labbé N, Parent S, Villemur R. Nitratireductor aquibiodomus gen. nov., sp. nov., a novel α-proteobacterium from the marine denitrification system of the Montreal Biodome (Canada). International Journal of Systematic and Evolutionary Microbiology, 2004, 54(1): 269-273. DOI:10.1099/ijs.0.02793-0 |
| [18] | Bajerski F, Ganzert L, Mangelsdorf K, Lipski A, Wagner D. Cryobacterium arcticum sp. nov., a psychrotolerant bacterium from an arctic soil. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(8): 1849-1853. DOI:10.1099/ijs.0.027128-0 |
| [19] | Reddy GSN, Pradhan S, Manorama R, Shivaji S. Cryobacterium roopkundense sp. nov., a psychrophilic bacterium isolated from glacial soil. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(4): 866-870. DOI:10.1099/ijs.0.011775-0 |
| [20] | Liu Q, Xin YH, Chen XL, Liu HC, Zhou YG, Chen WX. Cryobacterium aureum sp. nov., a psychrophilic bacterium isolated from glacier ice collected from the ice tongue surface. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(4): 1173-1176. DOI:10.1099/ijsem.0.002647 |
| [21] | Liu Q, Liu HC, Wen Y, Zhou YG, Xin YH. Cryobacterium flavum sp. nov. and Cryobacterium luteum sp. nov., isolated from glacier ice. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(6): 1296-1299. |
| [22] | Wilhelm RC, Niederberger TD, Greer C, Whyte LG. Microbial diversity of active layer and permafrost in an acidic wetland from the Canadian high arctic. Canadian Journal of Microbiology, 2011, 57(4): 303-315. DOI:10.1139/w11-004 |
| [23] | Singh P, Singh SM, Singh RN, Naik S, Roy U, Srivastava A, B?lter M. Bacterial communities in ancient permafrost profiles of Svalbard, Arctic. Journal of Basic Microbiology, 2017, 57(12): 1018-1036. DOI:10.1002/jobm.v57.12 |
| [24] | Goordial J, Altshuler I, Hindson K, Chan-Yam K, Marcolefas E, Whyte LG. In situ field sequencing and life detection in remote (79°26'N) Canadian high arctic permafrost ice wedge microbial communities. Frontiers in Microbiology, 2017, 8: 2594. DOI:10.3389/fmicb.2017.02594 |
| [25] | Cai QH, Ye XD, Chen B, Zhang BY. Complete genome sequence of Exiguobacterium sp. strain N4-1P, a psychrophilic bioemulsifier producer isolated from a cold marine environment in north Atlantic Canada. Genome Announcements, 2015, 5(44): e01248-17. |
| [26] | Kasana RC, Pandey CB. Exiguobacterium?: an overview of a versatile genus with potential in industry and agriculture. Critical Reviews in Biotechnology, 2018, 38(1): 141-156. |
| [27] | Castro-Severyn J, Remonsellez F, Valenzuela SL, Salinas C, Fortt J, Aguilar P, Pardo-Esté C, Dorador C, Quatrini R, Molina F, Aguayo D, Castro-Nallar E, Saavedra CP. Comparative genomics analysis of a new Exiguobacterium strain from salar de huasco reveals a repertoire of Stress-related genes and arsenic resistance. Frontiers in Microbiology, 2017, 8: 456. |
| [28] | Chaudhary DK, Kim J. Sphingopyxis nepalensis sp. nov., isolated from oil-contaminated soil. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(1): 364-370. DOI:10.1099/ijsem.0.002514 |
| [29] | Verma H, Rani P, Kumar Singh A, Kumar R, Dwivedi V, Negi V, Lal R. Sphingopyxis flava sp. nov., isolated from a hexachlorocyclohexane (HCH)-contaminated soil. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(10): 3720-3726. DOI:10.1099/ijsem.0.000482 |
| [30] | Oelschl?gel M, Rückert C, Kalinowski J, Schmidt G, Schl?mann M, Tischler D. Sphingopyxis fribergensis sp. nov., a soil bacterium with the ability to degrade styrene and phenylacetic acid. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(9): 3008-3015. DOI:10.1099/ijs.0.000371 |
| [31] | Nkem BM, Halimoon N, Yusoff FM, Johari WLW, Zakaria MP, Medipally SR, Kannan N. Isolation, identification and diesel-oil biodegradation capacities of indigenous hydrocarbon-degrading strains of Cellulosimicrobium cellulans and Acinetobacter baumannii from tarball at Terengganu beach, Malaysia. Marine Pollution Bulletin, 2016, 107(1): 261-268. DOI:10.1016/j.marpolbul.2016.03.060 |
| [32] | Qin W, Fan FQ, Zhu Y, Huang XL, Ding AZ, Liu X, Dou JF. Anaerobic biodegradation of benzo(a)pyrene by a novel Cellulosimicrobium cellulans CWS2 isolated from polycyclic aromatic hydrocarbon-contaminated soil. Brazilian Journal of Microbiology, 2018, 49(2): 258-268. DOI:10.1016/j.bjm.2017.04.014 |
| [33] | Venil C, Nordin N, Zakaria Z, Ahmad W. Chryseobacterium artocarpi sp. nov., isolated from the rhizosphere soil of Artocarpus integer. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(9): 3153-3159. |
| [34] | Cai Y, Tao WZ, Ma YJ, Cheng J, Zhang MY, Zhang YX. Leifsonia flava sp. nov., a novel actinobacterium isolated from the rhizosphere of Aquilegia viridiflora. Journal of Microbiology, 2018, 56(8): 549-555. DOI:10.1007/s12275-018-8061-z |
| [35] | Pindi PK, Kishore KH, Reddy GSN, Shivaji S. Description of Leifsonia kafniensis sp. nov. and Leifsonia antarctica sp. nov. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(6): 1348-1352. DOI:10.1099/ijs.0.006643-0 |
| [36] | Reddy GSN, Prakash JSS, Srinivas R, Matsumoto GI, Shivaji S. Leifsonia rubra sp. nov. and Leifsonia aurea sp. nov., psychrophiles from a pond in Antarctica. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(4): 977-984. DOI:10.1099/ijs.0.02396-0 |
| [37] | Kang SM, Asaf S, Kim SJ, Yun BW, Lee IJ. Complete genome sequence of plant growth-promoting bacterium Leifsonia xyli SE134, a possible gibberellin and auxin producer. Journal of Biotechnology, 2016, 239: 34-38. DOI:10.1016/j.jbiotec.2016.10.004 |
| [38] | Liu Y, Lai QL, Du J, Shao ZZ. Bacillus zhangzhouensis sp. nov. and Bacillus australimaris sp. nov. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(3): 1193-1199. DOI:10.1099/ijsem.0.000856 |
| [39] | Gos FMWR, Savi DC, Shaaban KA, Thorson JS, Aluizio R, Possiede YM, Rohr J, Glienke C. Antibacterial activity of endophytic actinomycetes isolated from the medicinal plant Vochysia divergens (Pantanal, Brazil). Frontiers in Microbiology, 2017, 8: 1642. DOI:10.3389/fmicb.2017.01642 |
| [40] | Gross H, Loper JE. Genomics of secondary metabolite production by Pseudomonas spp.. Natural Product Reports, 2009, 26(11): 1408-1446. DOI:10.1039/b817075b |
| [41] | Ghequire MGK, De Mot R. Ribosomally encoded antibacterial proteins and peptides from Pseudomonas. FEMS Microbiology Reviews, 2014, 38(4): 523-568. DOI:10.1111/1574-6976.12079 |
| [42] | Carrión VJ, van der Voort M, Arrebola E, Gutiérrez-Barranquero JA, de Vicente A, Raaijmakers JM, Cazorla FM. Mangotoxin production of Pseudomonas syringae pv. syringae is regulated by MgoA. BMC Microbiology, 2014, 14: 46. DOI:10.1186/1471-2180-14-46 |
