刘爱霖1,3, 吴志国2,3, 江鑫2, 赵明源2, 杨宗政2,3


1. 天津科技大学海洋与环境学院, 天津 300457;
2. 天津科技大学化工与材料学院, 天津 300457;
3. 天津市卤水化工与资源生态化利用重点实验室, 天津 300457
收稿日期:2019-03-14;修回日期:2019-05-13;网络出版日期:2019-10-17
基金项目:国家自然科学基金(31400092)
*通信作者:杨宗政, Tel:+86-22-60601278;Fax:+86-22-60600300;E-mail:yzz320@tust.edu.cn.
摘要:[目的] 从电镀厂下水道的淤泥中分离筛选Cr(VI)高效还原菌,并对其生长和还原特性进行研究,以期为Cr(VI)污染的生物修复提供优质的菌种资源和应用参考。[方法] 采用富集培养法从淤泥中分离、筛选出Cr(VI)还原菌,通过生理生化及16S rRNA基因序列分析进行初步鉴定。采用单因素实验确定菌株的最佳培养条件和抵抗胁迫环境的能力,利用外加电子供体改善菌株的Cr(VI)还原能力,筛选出最佳电子供体研究对菌株还原的影响。[结果] 经分离筛选得到1株Cr(VI)耐受还原菌,初步鉴定为微杆菌属(Microbacterium sp.),命名为BD6。菌株BD6适宜在中温、偏碱性的环境条件下生长,能耐受50.0 g/L NaCl的高盐环境。Mn2+对菌种的生长表现出较高的抑制,Ni2+、Zn2+、Cd2+的抑制作用较小,Cu2+产生了一定的促进作用。Cr(VI)对BD6的最低抑菌浓度为1700 mg/L。添加甘油、果糖、乳糖、葡萄糖、丙酮酸钠作为电子供体促进了菌株对Cr(VI)的还原。选择甘油作为菌株还原Cr(VI)的最佳电子供体,无电子供体添加时菌株96 h内对100 mg/L Cr(VI)的还原率仅为69.63%,添加2 g/L的甘油菌株在36 h内的还原率达到了100%。通过加大甘油的添加量可以促进菌株对初始浓度较高Cr(VI)的还原,但要受到Cr(VI)的毒性限制。菌株的最适还原条件和最适生长条件吻合,在50.0 g/L NaCl的高盐条件和50 mg/L Cd2+的毒性环境中,添加2 g/L的甘油,菌株对100 mg/L Cr(VI)的还原率分别为72 h 96.79%、54 h 99.86%。[结论] 分离筛选得到的Microbacterium sp.BD6是一株潜在的可用于Cr(VI)污染生物还原修复的候选菌株。
关键词:Cr(VI)还原16S rRNAMicrobacterium sp.BD6电子供体
Isolation, identification and characterization of Cr(VI) reducing bacterium Microbacterium sp. BD6
Ailin Liu1,3, Zhiguo Wu2,3, Xin Jiang2, Mingyuan Zhao2, Zongzheng Yang2,3


1. College of Marine and Environmental Sciences, Tianjin University of Science & Technology, Tianjin 300457, China;
2. College of Chemical Engineering and Materials Science, Tianjin University of Science & Technology, Tianjin 300457, China;
3. Tianjin Key Laboratory of Brine Chemical Engineering and Resource Eco-utilization, Tianjin 300457, China
Received: 14 March 2019; Revised: 13 May 2019; Published online: 17 October 2019
*Corresponding author: Zongzheng Yang, Tel: +86-22-60601278; Fax: +86-22-60600300; E-mail: yzz320@tust.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31400092)
Abstract: [Objective] In order to provide high-efficient strains for bioremediation of Cr(VI) pollution, growth and reduction characteristics of a strain of highly efficient Cr(VI) reducing bacteria separated from sewer sludge of electroplating plant were studied. [Methods] Cr(VI) reducing strains were isolated and screened from sludge by enrichment culture method. The primary identification was carried out by physiological and biochemical analysis and 16S rRNA gene sequence analysis. Single factor experiments were used to determine the optimal culture conditions and the resistance characteristics to stress environment. In addition, the best electronic donor was screened out by investigating the effect of electronic donor on reduction ability of strain. [Results] An efficient Cr(VI) reducing strain was isolated and preliminarily identified as Microbacterium sp., named as BD6. Strain BD6 is suitable to grow in medium temperature and alkaline environment. Meanwhile, it can tolerate high-salt environment with NaCl concentration up to 50.0 g/L. The test showed that growth of the strain is strongly inhibited by Mn2+, slightly inhibited by Ni2+, Zn2+ and Cd2+ and promoted by Cu2+. The minimum inhibitory concentration of Cr(VI) on BD6 was 1700 mg/L. The reduction of Cr(VI) by BD6 is significantly improved by electronic donors, including glycerol, fructose, lactose, glucose and sodium pyruvate. Glycerol is considered as the best electron donor for the reduction of Cr(VI) by BD6. The reduction rate of 100 mg/L Cr(VI) is only 69.63% in 96 h without adding electron donor, however, it could reach 100% in 36 h after adding 2 g/L glycerol. The reduction of the strain to higher initial concentration of Cr(VI) can be enhanced by adding the amount of glycerol, but restrained by the toxicity of Cr(VI). Reduction test shows that the optimum reduction conditions and growth conditions of the strain are consistent. In the high-salt environment with NaCl concentration of 50.0 g/L and toxic environment with Cd2+ concentration of 50 mg/L, the reduction rate of the strain to 100 mg/L Cr(VI) are 96.79% within 72 h and 99.86% within 54 h respectively with presence of 2 g/L glycerol. [Conclusion] Microbacterium sp. BD6 is a potential candidate strain for bioremediation of Cr(VI) contamination.
Keywords: Cr(VI) reduction16S rRNAMicrobacterium sp. BD6electron donor
铬广泛应用于电镀、皮革鞣制、纺织印染、金属加工等行业[1],自然界中铬的化合物多以Cr(Ⅲ)和Cr(VI)两种形式存在[2]。Cr(VI)具有强氧化性、高水溶性和不易吸附的特点,对生物的毒性方面主要是能通过硫酸盐转运蛋白进入细胞,与蛋白质和核酸结合,从而对细胞产生破坏性的影响[3-5]。Cr(Ⅲ)是生物所必需的微量元素,相对难溶于水,其穿入细胞要比Cr(VI)慢约1000倍,毒性为Cr(VI)的1/100[2]。利用各种物理、化学和生物方法将Cr(VI)富集和还原是应对Cr(VI)污染的解毒方式。一些传统的物理和化学处理过程虽然简单、快速,但许多处理过程无法克服运营成本高和二次污染物产生的问题[6-8]。此外,大多数物理和化学方法只有在Cr(VI)浓度较高的情况下才能很好地工作,而且它们的效率还受干扰剂的限制[8]。微生物修复技术因具有低成本、无二次污染等优点,被普遍认可为一种经济、有效、生态友好的Cr(VI)解毒方法[9]。
Cr(VI)污染的微生物修复技术主要有生物吸附和生物还原。微生物细胞表面有多种能与Cr(VI)发生反应的活性基团,通过络合或螯合作用将Cr(VI)吸附沉淀在细胞表面。Srinath等[11]利用Bacillus coagulans和Bacillus megaterium的死细胞对溶液中的Cr(VI)进行吸附,pH=2.5时吸附量达到最大,分别为39.9 mg/g和30.7 mg/g。Ozdemir等[12]利用Ochrobactrum anthropi的冻干细胞对Cr(VI)进行吸附,溶液pH=2.0时达到最佳吸附量57.8 mg/g。以上研究表明,生物吸附能去除溶液中的Cr(VI),但最佳吸附pH一般较低,此外其他金属离子的干扰、吸附剂复杂的制备过程以及吸附后存在二次废物处理等问题,对实际应用都造成诸多限制[11-13]。利用微生物将Cr(VI)还原为Cr(Ⅲ)是降低Cr(VI)污染的更有效途径。Chatterjee等[14]利用Brevibacillus agri将100 mg/L的Cr(VI)在48 h内还原85%。杨宇等[15]利用Bacillus pumilus G12以甘油为电子供体60 h能完全还原50 mg/L的Cr(VI)。范琴等[16]利用Exiguobacterium sp. YM7对100 mg/L的Cr(VI)还原率为60%。可见多种种属的微生物菌株都能有效还原Cr(VI)。目前,筛选具有高效Cr(VI)耐受和还原能力的菌株仍是研究的热点。
本研究从某电镀厂下水道的淤泥中分离出一株对Cr(VI)具有较高耐受和还原能力的菌株BD6,对该菌株进行了鉴定,并对其生长以及还原特性进行了研究,以期为实际的污染修复过程提供高效的菌种资源和应用指导。
1 材料和方法 1.1 材料
1.1.1 菌株来源: 分离自福建省厦门市某电镀厂下水道的淤泥。
1.1.2 培养基: LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0,pH 7.0,若为固体培养基添加1.5%–2.0%的琼脂。所有培养基121 ℃高压湿热灭菌20 min后使用。含Cr(VI)培养基:LB培养基灭菌后放至室温,根据所需添加相应的Cr(VI)标准溶液来配制。
1.1.3 Cr(VI)标准溶液: 采用杨宇等[15]的方法用重铬酸钾配制10 g/L Cr(VI)的标准溶液,用0.22 μm的滤膜过滤,置于4 ℃的冰箱中备用。
1.1.4 种子液的制备: 参考李倩等[17]的方法制备浓度为3×108 CFU/mL的菌悬液备用。
1.1.5 重金属母盐溶液: 参考黄程等[18]的方法用NiCl2、ZnCl2、CuCl2、CdCl2、MnCl2分别配制重金属母盐溶液。
1.2 菌株分离、纯化与筛选 称取10 g淤泥加入90 mL LB液体培养基的三角瓶中,置于180 r/min、30 ℃的摇床中振荡培养48 h,将培养液以10倍梯度稀释,取100 μL涂布在含50 mg/L Cr(VI)的固体LB平板上,30 ℃恒温培养箱中倒置培养48 h,用接种针挑取不同形态的菌落划线纯化,直至得到纯培养的菌株[15-16]。
将纯化后的菌株分别接种在含50 mg/L Cr(VI)的液体LB培养基中,于180 r/min、30 ℃的摇床中振荡培养,用二苯碳酰二肼分光光度法测量Cr(VI)[16],选取还原能力较好的菌株作为实验菌株。
1.3 菌株的鉴定 生理生化实验参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》(第八版)。16S rRNA的序列扩增和系统发育树的构建:菌株BD6的DNA提取参照细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司),以菌株BD6的总DNA为模板,利用细菌通用引物27F (5′-AGAGTTTG ATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTT GTTACGACTT-3′)进行PCR扩增。PCR产物由苏州金唯智生物科技有限公司完成测序。所得序列采用MEGA 7.0软件构建系统发育树。
1.4 菌株BD6的培养特性 将筛选、纯化的菌株BD6用LB培养基培养,考察不同温度、初始pH值、盐浓度、重金属离子对其生长的影响,测定了Cr(VI)对菌株的最低抑菌浓度(minimum inhibitory concentration,MIC)。
(1) 温度对菌株生长的影响:将液体LB培养基的pH调节为7.0,分别取98 mL加入到250 mL的三角瓶中,按5% (V/V)的接种量接种,摇床转速设为180 r/min,分别在10、15、20、25、30、35、40、45 ℃条件下培养。
(2) pH对菌株生长的影响:按上述方法将菌株BD6的菌悬液分别转接到初始pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的LB液体培养基中,在最适温度、180 r/min恒温摇床中培养。
(3) 盐浓度对菌株生长的影响:按上述方法将菌悬液分别转接至NaCl浓度为10.0、20.0、30.0、40.0、50.0 g/L的LB液体培养基中,在最适温度、最适初始pH、180 r/min恒温摇床中培养。
(4) 重金属离子对菌株生长的影响:按上述方法将菌悬液分别转接至含50 mg/L Ni2+、Zn2+、Cu2+、Cd2+、Mn2+的LB培养基中,培养方式同上。
以上实验均设置3个重复,每隔6 h测定菌液的光密度值OD600。
(5) Cr(VI)对菌株的MIC测定:配制Cr(VI)浓度在100–3000 mg/L的固体LB平板,吸取50 μL菌液涂布在平板上,设3组重复,在30 ℃的恒温培养箱中倒置培养48 h,观察菌落的生长情况[18-19]。
1.5 电子供体的选择以及菌株还原能力的测定 (1) 分别在LB培养基中添加5 g/L的乳酸钠、甲酸钠、丙酸钠、果糖、乳糖、葡萄糖、甘油、丙酮酸钠、柠檬酸钠等作为电子供体,按5%的接种量接种,设置每种电子供体添加条件下的不接菌对照,每隔48 h取样测定培养基中Cr(VI)的含量。
(2) 选择最佳的电子供体,测定了菌株BD6在不同温度、pH、盐浓度、重金属离子添加等条件下对Cr(VI)的还原。实验方法同1.4,间隔一定时间测量Cr(VI)的含量。
2 结果和讨论 2.1 菌株的鉴定 菌株BD6呈短杆状,长1.0–1.5 μm,宽0.3– 0.5 μm,不运动,革兰氏染色为阳性,单个菌落呈圆形,直径3–4 mm,边缘齐整,中间凸起,浅黄色,表面湿润,有光泽。菌株BD6的扫描电镜照片及具体的菌落形态如图 1所示。
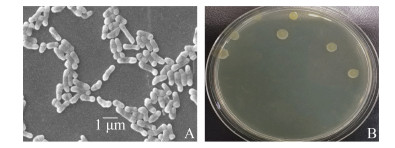 |
| 图 1 菌株BD6的扫描电镜照片(10000×) (A)及菌落形态图(B) Figure 1 SEM photograph (10000×) (A) and colony morphology of strain BD6 (B). |
| 图选项 |
菌株BD6的部分生理生化反应结果:硝酸盐还原、甲基红和接触酶实验为阳性,V-P反应、产H2S、吲哚实验以及过氧化氢酶实验为阴性,能利用葡萄糖、乳糖、果糖,不能利用淀粉。
以菌株BD6的DNA为模板,利用通用引物扩增得到1363 bp的16S rRNA基因片段。通过在基因序列数据库中的比对分析发现其与Microbacterium paraoxydans NBRC 103076的同源性达99.56%。将BD6与微杆菌菌株进行系统发育分析如图 2所示,菌株BD6的16S rRNA基因序列GenBank登陆号为MK611086。
 |
| 图 2 菌株BD6基于16S rRNA基因序列的系统发育分析 Figure 2 Phylogenetic analysis of strain BD6 based on the 16S rRNA gene sequence. |
| 图选项 |
通过以上生理生化测试和系统发育分析初步将菌株BD6鉴定为微杆菌属(Microbacterium sp.),暂命名为Microbacterium sp. BD6。
2.2 菌株BD6的生长特性 不同温度、pH、盐浓度、重金属离子对菌株BD6生长的影响,如图 3所示。
 |
| 图 3 不同培养条件对菌株BD6生长的影响 Figure 3 Effects of different culture conditions on the growth of strain BD6. A: temperature; B: pH; C: sodium chloride concentration; D: metal ions. |
| 图选项 |
菌株BD6在20–40 ℃的温度范围内生长较好,30 ℃获得了最佳生长,属于中温菌(图 3-A)。在6.0–10.0的pH范围内菌株均生长良好,pH 7.0条件下菌株获得最佳生长,pH 4.0–5.0的条件下不利于菌株生长,在pH 11.0的条件下菌株仍有一定的生长,说明菌株BD6适宜在中性偏碱性的环境中生存(图 3-B)。在生产实践中,高盐度含铬废水的出现要求功能菌株有一定的耐盐能力[20]。经考察菌株BD6在含有50.0 g/L NaCl的LB培养基中依然能够达到一定的生长浓度(图 3-C),说明其具有一定的耐盐特性。菌株BD6分别在50 mg/L的Zn2+、Mn2+、Cu2+、Ni2+、Cd2+条件下均能生长,与对照组相比Mn2+对菌株的生长产生了明显的抑制作用,Ni2+、Zn2+、Cd2+的抑制作用较为轻微,Cu2+则有一定的促进作用,这一特性与其他文献报道的相似[21],为今后将该菌应用于复杂金属离子条件下,特别是重金属条件下的Cr(VI)还原提供了可能(图 3-D)。
随着对细菌Cr(VI)耐受和还原机理认识的不断深入,****们普遍认为细菌对Cr(VI)的耐受和还原能力是两种独立的机能[8, 22],但一株高效Cr(VI)还原菌能够发挥作用的前提是具备良好的Cr(VI)耐受能力。通过大量实验获得了Cr(VI)对菌株BD6的MIC为1700 mg/L,仅从Cr(VI)耐受能力方面考虑,菌株BD6完全满足一般工程实例中对Cr(VI) (浓度在20–300 mg/L)的处理需求[23-25]。
2.3 添加不同电子供体对菌株BD6还原Cr(VI)的影响 LB培养基中,生长中的菌株96 h内对50 mg/L、100 mg/L以及200 mg/L Cr(VI)的还原率分别为89.79%、67.63%、29.18%。对大量的实验总结发现,在无电子供体添加的条件下,LB培养基中菌株BD6对初始浓度为100 mg/L的Cr(VI)还原率维持在60%–80%,这可能受制于LB培养基中作为Cr(VI)还原电子供体的底物限制[22]。有证据表明,具有Cr(VI)还原能力的菌株,在没有合适电子供体添加的情况下,对Cr(VI)的还原能力减弱[26-27]。因此,通过对文献的总结,选取乳酸钠、甲酸钠、丙酸钠、果糖、乳糖、葡萄糖、甘油、丙酮酸钠、柠檬酸钠等物质,其中包括糖类、有机酸、脂类、醇类,以期为菌株BD6还原Cr(VI)提供最佳的电子供体。在LB培养基中添加不同电子供体对菌株BD6还原Cr(VI)的影响,如图 4所示。
 |
| 图 4 添加不同电子供体对菌株BD6还原Cr(VI)的影响 Figure 4 Effects of adding different electron donors on the reduction of Cr(VI) by strain BD6. A: blank control; B: inoculation of BD6. |
| 图选项 |
未加菌条件下在LB培养基中添加电子供体对Cr(VI)的还原没有作用(图 4-A),可以排除因添加电子供体而使Cr(VI)直接得到还原的可能。与菌株BD6在LB中的还原相比,添加乳酸钠对还原的作用不明显,添加甲酸钠、柠檬酸钠、丙酸钠对菌株的还原有不同程度的抑制,添加果糖、乳糖、葡萄糖、甘油、丙酮酸钠对还原的促进作用较好,其中添加了果糖、甘油、丙酮酸钠的实验组48 h内对Cr(VI)的还原率均达到了100% (图 4-B)。Cr(VI)还原菌对不同电子供体利用能力的差异[21, 28-31],使得在添加电子供体时应加以选择。
本研究中对菌株BD6还原Cr(VI)促进较好的果糖、甘油、丙酮酸钠差别不大,从经济性和实际应用考虑选择甘油作为BD6还原Cr(VI)的最佳电子供体,并初步探究了甘油的添加量对菌株BD6生长和还原的影响,如图 5所示。
 |
| 图 5 甘油添加量对菌株BD6生长(A)和还原(B)的影响 Figure 5 Effects of glycerol addition on growth (A) and reduction (B) of strain BD6. |
| 图选项 |
图 5-A中随着甘油添加量的增加,逐渐对菌株BD6的生长产生抑制。有报道称在以甘油作为底物的微生物发酵工艺中,为避免高浓度的甘油对菌株的生长产生抑制,甘油的浓度一般控制在15–40 g/L[32]。图 5-A的实验结果表明,甘油的添加量不宜超过20 g/L。图 5-B中添加0.2 g/L的甘油即提高了菌株BD6对初始浓度为100 mg/L Cr(VI)的还原效果,但仍不足以完全还原Cr(VI)。2 g/L的添加量对还原反应较好,36 h的还原率为100%,超过此量对还原速率帮助不大。通过加大甘油的添加量来增加对Cr(VI)的还原,显然要受到多方面因素的限制,接下来的实验将作进一步的讨论。
2.4 甘油添加量对菌株BD6还原Cr(VI)的影响 菌株BD6在还原Cr(VI)时,要受电子供体添加量和初始Cr(VI)浓度的影响。本研究在菌株BD6的最适生长温度和pH范围内测定了不同甘油添加量对不同初始浓度Cr(VI)的还原,如图 6所示。
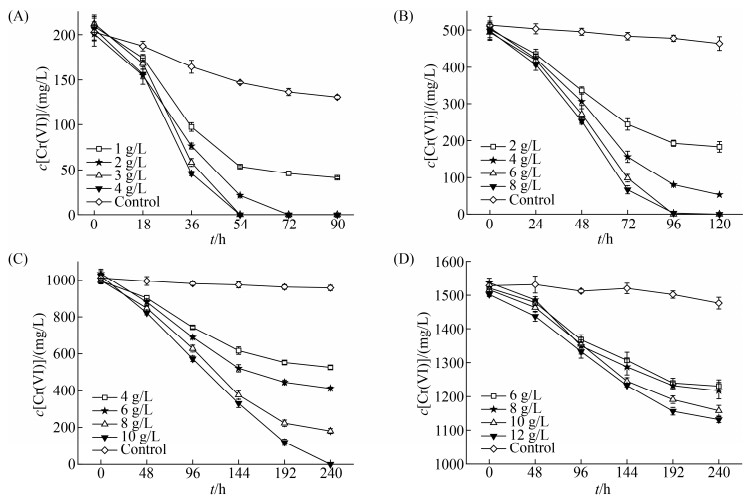 |
| 图 6 不同甘油添加量下菌株BD6对不同初始浓度Cr(VI)的还原情况 Figure 6 Reduction of Cr(VI) with different initial concentrations by strain BD6 with different glycerol additions. Initial concentrations of Cr(VI). A: 200 mg/L; B: 500 mg/L; C: 1000 mg/L; D: 1500 mg/L. |
| 图选项 |
由图 6-A、B、C、D可以看出在还原反应的初始阶段,因细菌处在生长的对数期菌种浓度有限,不同甘油添加量下的还原速率差别不大,但随着时间的推移还原速率的差异性逐渐显现,这可能和电子供体相对于还原酶的不饱和有关[28]。随着甘油添加量的增加,不同初始Cr(VI)浓度下的还原速率趋近于某个固定值,这个恒定值应该是不同浓度下的菌种还原反应速率[30-31, 33],为今后还原反应速率方程的建立提供了数据支撑。随着Cr(VI)初始浓度的增大通过增加电子供体的添加量可以提高菌株BD6的还原效果,但Cr(VI)浓度较大时其毒害作用也逐渐显现,严重影响菌株的还原效能。Cr(VI)初始浓度为1000 mg/L时,还原时间明显增长(图 6-C),1500 mg/L浓度下菌株BD6的去除效果更低(图 6-D)。
2.5 培养条件对菌株BD6还原Cr(VI)的影响 在LB培养基中添加2 g/L的甘油,Cr(VI)的初始浓度设定为100 mg/L,菌株BD6在各种培养条件下对Cr(VI)的还原如图 7所示。
 |
| 图 7 菌株BD6在各种条件下对Cr(VI)的还原情况 Figure 7 Reduction of Cr(VI) by strain BD6 under various conditions. A: temperature; B: pH; C: sodium chloride concentration; D: metal ions. |
| 图选项 |
菌株BD6对Cr(VI)的最适还原温度在20– 35 ℃,最适还原pH在6.0–9.0,与菌株的适宜生长范围相似(图 7-A, B)。当盐浓度为50 g/L时72 h内菌株对Cr(VI)的还原率达96.79%(图 7-C)。与一株具有耐盐能力的Cr(VI)还原菌相比[20],菌株BD6也是一株较好的耐盐Cr(VI)还原菌。重金属离子添加量为50 mg/L时,对生长和还原的抑制大小规律相似,为Mn2+ > Cd2+ > Zn2+ > Ni2+,Mn2+对生长和还原均有较为明显的抑制作用,Cu2+对生长和还原均起到了促进作用。对于较高毒性的Cd2+,菌株BD6的抗性表现较好,54 h内的Cr(VI)还原率达99.86% (图 7-D)。
3 结论 (1) 本研究从某电镀厂下水道的淤泥中分离筛选出一株Cr(VI)耐受还原菌,经鉴定为微杆菌属(Microbacterium sp.),暂命名为BD6。
(2) 对菌株BD6的生长测试表明,其适宜在中温、偏碱性的环境条件下生存,温度30 ℃、pH 7.0的条件下获得了最佳生长。菌株能在50.0 g/L NaCl培养条件下生长,表现出较好的耐盐性。Mn2+对菌株的生长表现出较高的抑制,Ni2+、Zn2+、Cd2+的抑制作用较小,Cu2+产生了一定的促进作用。Cr(VI)对菌株的MIC为1700 mg/L。
(3) 添加果糖、乳糖、葡萄糖、甘油、丙酮酸钠作为电子供体促进了菌株BD6对Cr(VI)的还原。选择甘油作为菌株还原Cr(VI)的最佳电子供体,无电子供体添加时菌株96 h内对100 mg/L Cr(VI)的还原率仅为69.63%,添加2 g/L的甘油菌株在36 h内的还原率达到了100%。通过加大甘油的添加量可以促进菌株对初始浓度较高Cr(VI)的还原,但要受到Cr(VI)的毒性限制。菌株的最适还原条件和最适生长条件吻合,在50.0 g/L NaCl的高盐条件和50 mg/L Cd2+的毒性环境中,添加2 g/L的甘油,菌株对100 mg/L Cr(VI)的还原率分别为72 h 96.79%、54 h 99.86%。
References
| [1] | Tahar LB, Oueslati MH, Abualreish MJA. Synthesis of magnetite derivatives nanoparticles and their application for the removal of chromium (VI) from aqueous solutions. Journal of Colloid and Interface Science, 2018, 512: 115-126. DOI:10.1016/j.jcis.2017.10.044 |
| [2] | Wang BJ, Yang HF, Li WZ. Studies on reduction of hexavalent chromium by fungi. Acta Microbiologica Sinica, 1998, 38(2): 108-113. (in Chinese) 王保军, 杨惠芳, 李文忠. 真菌还原Cr(VI)的研究. 微生物学报, 1998, 38(2): 108-113. |
| [3] | Kota? J, Stasicka Z. Chromium occurrence in the environment and methods of its speciation. Environmental Pollution, 2000, 107(3): 263-283. DOI:10.1016/S0269-7491(99)00168-2 |
| [4] | Holland SL, Avery SV. Chromate toxicity and the role of sulfur. Metallomics, 2011, 3(11): 1119-1123. DOI:10.1039/c1mt00059d |
| [5] | Gong YF, Werth CJ, He YX, Su YM, Zhang YL, Zhou XF. Intracellular versus extracellular accumulation of hexavalent chromium reduction products by Geobacter sulfurreducens PCA. Environmental Pollution, 2018, 240: 485-492. DOI:10.1016/j.envpol.2018.04.046 |
| [6] | Ahluwalia SS, Goyal D. Microbial and plant derived biomass for removal of heavy metals from wastewater. Bioresource Technology, 2007, 98(12): 2243-2257. DOI:10.1016/j.biortech.2005.12.006 |
| [7] | Zahoor A, Rehman A. Isolation of Cr(VI) reducing bacteria from industrial effluents and their potential use in bioremediation of chromium containing wastewater. Journal of Environmental Sciences, 2009, 21(6): 814-820. DOI:10.1016/S1001-0742(08)62346-3 |
| [8] | Jobby R, Jha P, Yadav AK, Desai N. Biosorption and biotransformation of hexavalent chromium[Cr(VI)]:a comprehensive review. Chemosphere, 2018, 207: 255-266. DOI:10.1016/j.chemosphere.2018.05.050 |
| [9] | Zouboulis AI, Loukidou MX, Matis KA. Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils. Process Biochemistry, 2004, 39(8): 909-916. DOI:10.1016/S0032-9592(03)00200-0 |
| [10] | Bharagava RN, Mishra S. Hexavalent chromium reduction potential of Cellulosimicrobium sp. isolated from common effluent treatment plant of tannery industries. Ecotoxicology and Environmental Safety, 2018, 147: 102-109. DOI:10.1016/j.ecoenv.2017.08.040 |
| [11] | Srinath T, Verma T, Ramteke PW, Garg SK. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere, 2002, 48(4): 427-435. DOI:10.1016/S0045-6535(02)00089-9 |
| [12] | Ozdemir G, Ozturk T, Ceyhan N, Isler R, Cosar T. Heavy metal biosorption by biomass of Ochrobactrum anthropi producing exopolysaccharide in activated sludge. Bioresource Technology, 2003, 90(1): 71-74. DOI:10.1016/S0960-8524(03)00088-9 |
| [13] | Ramírez Carmona ME, Pereira da Silva MA, Ferreira Leite SG, Vasco Echeverri OH, Ocampo-López C. Packed bed redistribution system for Cr(Ⅲ) and Cr(VI) biosorption by Saccharomyces cerevisiae. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43(3): 428-432. DOI:10.1016/j.jtice.2011.12.002 |
| [14] | Chatterjee S, Shekhawat K, Gupta N. Bioreduction of toxic hexavalent chromium by novel indigenous microbe Brevibacillus agri isolated from tannery wastewater. International Journal of Environmental Science and Technology, 2019, 16(7): 3549-3556. DOI:10.1007/s13762-018-1885-6 |
| [15] | Yang Y, Gao Y, Cheng Q, Zhu ZY, Hu TT, Xu Q, Li AM. Isolation, identification and Cr (VI) reducing characteristics of a chromium-reducing bacteria. Ecology and Environmental Sciences, 2018, 27(2): 322-329. (in Chinese) 杨宇, 高宇, 程潜, 朱振宇, 胡婷婷, 徐全, 李爱民. 一株铬还原菌的分离鉴定及铬还原特性研究. 生态环境学报, 2018, 27(2): 322-329. |
| [16] | Fan Q, Wang HY, Yan XH, Liu Y, Wang XR. Screening, identification and reduction characteristics of Cr(VI)-reducing bacteria from a typical site contaminated by chromium plant. Chinese Journal of Environmental Engineering, 2018, 12(3): 863-875. (in Chinese) 范琴, 王海燕, 颜湘华, 刘咏, 王兴润. 某典型铬盐厂污染场地Cr(VI)还原菌的筛选、鉴定及还原特性. 环境工程学报, 2018, 12(3): 863-875. |
| [17] | Li Q, Zhang P, Liao BH, Peng PQ, Mei JX, Xu JM. Isolation, identification and characterization of a Cd resistant bacterium. Acta Microbiologica Sinica, 2018, 59(1): 11-24. (in Chinese) 李倩, 张平, 廖柏寒, 彭佩钦, 梅金星, 徐继敏. 一株耐Cd菌株的分离、鉴定及基本特性. 微生物学报, 2018, 59(1): 11-24. |
| [18] | Huang C, Wu ZJ, He YH, Shi WS, Lu SN, Kong ZY, Wu L. Isolation, screening and identification of Cu, Zn and Pb resistant plant growth-promoting bacteria from Le'an River-Poyang Lake Wetland. Microbiology China, 2018, 45(6): 1283-1294. (in Chinese) 黄程, 吴子君, 何颖慧, 石文苏, 路世娜, 孔召玉, 吴兰. 鄱阳湖-乐安河段湿地耐Cu、Zn、Pb植物促生菌的分离、筛选及鉴定. 微生物学通报, 2018, 45(6): 1283-1294. |
| [19] | Aleem A, Isar J, Malik A. Impact of long-term application of industrial wastewater on the emergence of resistance traits in Azotobacter chroococcum isolated from rhizospheric soil. Bioresource Technology, 2003, 86(1): 7-13. DOI:10.1016/S0960-8524(02)00134-7 |
| [20] | Liu WJ, Liu C, Liu L, You YT, Jiang JH, Zhou ZK, Dong Z. Simultaneous decolorization of sulfonated azo dyes and reduction of hexavalent chromium under high salt condition by a newly isolated salt-tolerant strain Bacillus circulans BWL1061. Ecotoxicology and Environmental Safety, 2017, 141: 9-16. DOI:10.1016/j.ecoenv.2017.03.005 |
| [21] | Soni SK, Singh R, Awasthi A, Singh M, Kalra A. In vitro Cr(VI) reduction by cell-free extracts of chromate-reducing bacteria isolated from tannery effluent irrigated soil. Environmental Science and Pollution Research, 2013, 20(3): 1661-1674. DOI:10.1007/s11356-012-1178-4 |
| [22] | Viti C, Marchi E, Decorosi F, Giovannetti L. Molecular mechanisms of Cr(VI) resistance in bacteria and fungi. FEMS Microbiology Reviews, 2014, 38(4): 633-659. DOI:10.1111/1574-6976.12051 |
| [23] | Deng XH, Song ZR. Present research situation and development trend of treatment of electroplating chromium-containing wastewater. Journal of Chongqing University of Arts and Sciences (Natural Science Edition), 2008, 27(5): 70-73. (in Chinese) 邓小红, 宋仲容. 电镀含铬废水处理技术研究现状与发展趋势. 重庆文理学院学报(自然科学版), 2008, 27(5): 70-73. DOI:10.3969/j.issn.1673-8012.2008.05.015 |
| [24] | Shen QL. Chromium-containing electroplating wastewater treatment and recycling research. Chemical Industry Times, 2010, 24(6): 26-28. (in Chinese) 沈巧莲. 含铬电镀废水的处理和回收利用研究. 化工时刊, 2010, 24(6): 26-28. |
| [25] | Zhang WQ, Rao PH, Zhang XL. Engineering practice on electroplating chromium-containing wastewater reuse and waste chromic acid recycling. Industrial Water Treatment, 2012, 32(1): 75-78. (in Chinese) 张文启, 饶品华, 张兴林. 含铬电镀废水回用及铬酸回收工程实践. 工业水处理, 2012, 32(1): 75-78. DOI:10.3969/j.issn.1005-829X.2012.01.022 |
| [26] | Acevedo-Aguilar FJ, Espino-Salda?a AE, Leon-Rodriguez IL, Rivera-Cano ME, Avila-Rodriguez M, Wrobel K, Wrobel K, Lappe P, Ulloa M, Gutiérrez-Corona JF. Hexavalent chromium removal in vitro and from industrial wastes, using chromate-resistant strains of filamentous fungi indigenous to contaminated wastes. Canadian Journal of Microbiology, 2006, 52(9): 809-815. DOI:10.1139/w06-037 |
| [27] | Monsieurs P, Moors H, van Houdt R, Janssen PJ, Janssen A, Coninx I, Mergeay M, Leys N. Heavy metal resistance in Cupriavidus metallidurans CH34 is governed by an intricate transcriptional network. BioMetals, 2011, 24(6): 1133-1151. DOI:10.1007/s10534-011-9473-y |
| [28] | Ma ZM, Zhu WJ, Long HZ, Chai LY, Wang QW. Chromate reduction by resting cells of Achromobacter sp. Ch-1 under aerobic conditions. Process Biochemistry, 2007, 42(6): 1028-1032. DOI:10.1016/j.procbio.2007.03.007 |
| [29] | Zhu WJ, Yang ZH, Ma ZM, Chai LY. Reduction of high concentrations of chromate by Leucobacter sp. CRB1 isolated from Changsha, China. World Journal of Microbiology and Biotechnology, 2008, 24(7): 991-996. DOI:10.1007/s11274-007-9564-7 |
| [30] | Xu L, Luo MF, Li WL, Wei XT, Xie K, Liu LJ, Jiang CY, Liu HZ. Reduction of hexavalent chromium by Pannonibacter phragmitetus LSSE-09 stimulated with external electron donors under alkaline conditions. Journal of Hazardous Materials, 2011, 185(2/3): 1169-1176. |
| [31] | Shi Y, Chai LY, Yang ZH, Jing QX, Chen RH, Chen YC. Identification and hexavalent chromium reduction characteristics of Pannonibacter phragmitetus. Bioprocess and Biosystems Engineering, 2012, 35(5): 843-850. DOI:10.1007/s00449-011-0668-y |
| [32] | Sun J, Wang P, Zhang PP, Huang J. Application of glycerol in microbial biosynthesis and biocatalysis. Progress in Chemistry, 2016, 28(9): 1426-1434. (in Chinese) 孙佳, 王普, 章鹏鹏, 黄金. 甘油在微生物代谢合成及生物催化中的应用. 化学进展, 2016, 28(9): 1426-1434. |
| [33] | Mohapatra RK, Parhi PK, Thatoi H, Panda CR. Bioreduction of hexavalent chromium by Exiguobacterium indicum strain MW1 isolated from marine water of Paradip Port, Odisha, India. Chemistry and Ecology, 2017, 33(2): 114-130. |
