杨学智1,2, 沈日敏1,2, 孙雨2, 李润植1

 , 解志红2
, 解志红2

1. 山西农业大学农学院, 山西 太谷 030801;
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003
收稿日期:2018-09-30;修回日期:2018-12-17;网络出版日期:2019-03-20
基金项目:国家自然科学基金(31570063,31870020);山东省重点研发计划(2017GSF17129);边际土地产能效益扩增机理与藏粮于地技术模式(KFZD-SW-112);山东省农业科学院农业科技创新工程(+CXGC2016B10)
*通信作者:李润植, Tel/Fax:+86-354-6288344, E-mail:rli2001@126.com;
解志红, Tel:+86-535-2109183, Fax:+86-535-2109000, E-mail:zhxie@yic.ac.cn.
摘要:[目的] 考察茎瘤固氮根瘤菌ORS571中c-di-GMP合成酶AZC-2412的编码基因缺失的突变表型,初步探究其功能机理。[方法] 本实验构建基于cre-loxp重组酶系统的根瘤菌基因敲除系统,以及采用三亲接合技术构建突变株。测定野生型和突变株的生长速率、趋化能力、胞外多糖产量、生物膜形成等表型。[结果] 突变株与野生型生长速率几乎相同。与野生型相比突变株由于细胞内c-di-GMP水平降低,胞外多糖、生物膜产量等均有所下降。[结论] 实验表明,环二鸟苷酸合成酶AZC-2412缺失,使得c-di-GMP水平降低,对胞外多糖生成、细菌的运动能力、生物膜的形成、细胞絮凝、与植物的互作等均有调控作用。
关键词:茎瘤固氮根瘤菌ORS571环化酶DGC环二鸟苷酸c-di-GMP胞外多糖生物膜
Characterization of diguanylate cyclase metabolism-related gene in Azorhizobium caulinodans ORS571
Xuezhi Yang1,2, Rimin Shen1,2, Yu Sun2, Runzhi Li1

 , Zhihong Xie2
, Zhihong Xie2

1. College of Agriculture, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China;
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong Province, China
Received: 30 September 2018; Revised: 17 December 2018; Published online: 20 March 2019
*Corresponding author: Li Runzhi, Tel/Fax:+86-354-6288344, E-mail:rli2001@126.com;
Xie Zhihong, Tel:+86-535-2109183, Fax:+86-535-2109000, E-mail:zhxie@yic.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31570063, 31870020), by the Shandong Key Research and Development Program (2017GSF17129), by the Marginal Land Productivity Benefits Amplification Mechanism and Storing Food in Land Technology Model (KFZD-SW-112) and by the Shandong Academy of Agricultural Sciences (+CXGC2016B10)
Abstract: [Objective] To study the phenotypes of Azorhizobium caulinodans ORS571 mutant strain lacking the diguanylate cyclase AZC-2412, and to explore its functional mechanism. [Methods] We constructed the gene knockout system of rhizobia based on the homologous recombination of cre-loxp, and the mutant strain was constructed by the triparental conjugation. Growth rate, chemotactic ability, exopolysaccharide production, biofilm formation and other phenotypes of the wild type and mutant strains were studied. [Results] The mutant strain had almost the same growth rate as the wild type. Compared with the wild type, the mutant strain impaired in exopolysaccharide production, chemotaxis behavior and biofilm formation due to lower levels of c-di-GMP in cells. [Conclusion] The deletion of the diguanylate cyclase AZC-2412 reduces level of c-di-GMP levels. It had a regulatory effect on the exopolysaccharide production, bacterial motility, biofilm formation, cell flocculation of Azorhizobium caulinodans ORS571 and its interaction with host plant.
Keywords: Azorhizobium caulinodans ORS571diguanylate cyclasec-di-GMPexopolysaccharidebiofilm
茎瘤固氮根瘤菌(Azorhizobium caulinodans ORS571)是一种从热带植物毛萼田菁(Sesbania rostrata)中分离出来的共生菌株[1]。ORS571属于革兰氏阴性菌,杆状,具有周生菌毛,以及一条使之游动的鞭毛[2]。ORS571和其他根瘤菌一样能够与宿主植物共生结瘤[3],并固定空气中游离的氮,增加宿主氮源的获取途径。而与其他根瘤菌不同的是,ORS571不仅可以和宿主根部共生结瘤,还可在宿主茎杆上结瘤。此外,ORS571不但可以和宿主共生固氮,还能在自生状态下固氮[4]。因为其具有独特的生存方式和生命特征,使其存在非同一般的研究价值。
环二鸟苷酸(cyclic diguanylate,c-di-GMP)最初被发现是在木葡糖醋酸杆菌(Gluconacetobacter xylinus)中,作为膜结合纤维素合成酶的变构激活因子[5]。其被发现之后的十余年间,关于c-di-GMP的报道一直寥寥无几,直到进入21世纪后才引起人们的广泛重视。环二鸟苷酸(c-di-GMP)与钙离子Ca+、环鸟苷酸(cGMP)、环腺苷酸(cAMP)、1, 4, 5-三磷酸肌醇(IP3)等一样作为生命体的第二信使,在细胞信号转导中起重要作用,且普遍存在于细菌中。在近十多年的研究中人们认识到,细胞中的某些核糖开关的转录起始、蛋白分子的酶活表达、以及菌毛和鞭毛的运动等行为,都是由c-di-GMP信号来进行调控和启动的[6]。
如图 1所示[7],环二鸟苷酸(c-di-GMP)是由2分子的GTP通过二鸟苷酸环化酶(diguanylate cyclase,DGC)的催化,脱水缩合形成环状的二核苷酸[8-9],之后c-di-GMP可以选择性地被磷酸二酯酶(phosphodiesterase,PDE)降解成2分子的GMP[10]。含有保守结构域GGDEF (Gly-Gly-Asp- Glu-Phe)蛋白在c-di-GMP合成中起作用,而c-di-GMP PDE的活性则与保守结构域EAL (Glu- Ala-Leu)相关[9, 11]。细菌中的c-di-GMP含有广泛的调节作用,包括调控细胞的运动(motility)、细菌生物膜(biofilm)的形成、胞外多糖(exopolysaccharides,EPS)的产生、细菌的毒力(virulence)等[12-14]。c-di-GMP能够调节各种生理功能的前提是DGC和PDE可以接受到来自感应结构域如PAS、GAF、REC等的信号的传递[15-16],从而启动或关闭相关基因的转录和翻译,调节细胞内c-di-GMP水平的变化。
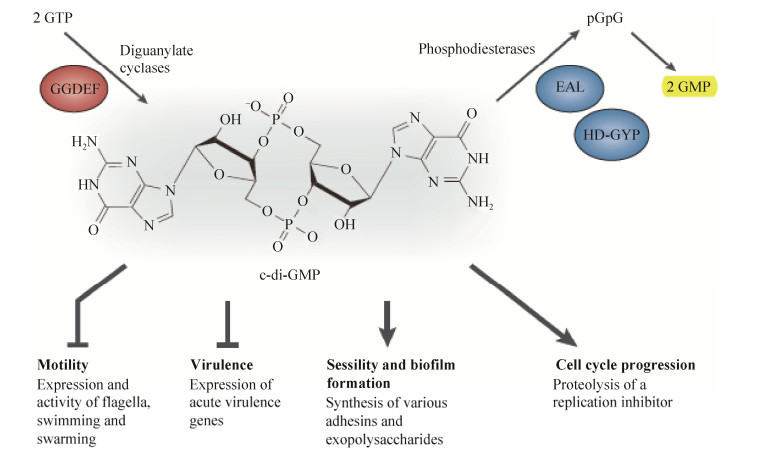 |
| 图 1 第二信使c-di-GMP的结构与生理功能 Figure 1 Structure and physiological functions of c-di-GMP. |
| 图选项 |
低水平的c-di-GMP可降低生物膜的形成,减少多糖产量,并有利于毒性因子的表达,高水平的c-di-GMP则与之相反。本文选择含有感应结构域REC和保守结构域GGDEF的c-di-GMP合成基因AZC-2412 (GenBank登录号:BAF88410.1),研究该基因的功能,进一步了解c-di-GMP的调节作用,阐明c-di-GMP代谢对细菌生物膜、多糖产生、运动能力等作用的调控。通过对AZC-2412基因的敲除,得到c-di-GMP合成量减少的菌株,通过竞争结瘤试验发现,突变株与宿主的结瘤能力下降,表明c-di-GMP在结瘤过程中起到重要调控作用。
1 材料和方法 1.1 材料
1.1.1 菌株和质粒: 表 1为所用质粒和菌株。
表 1. 实验所用菌株和质粒 Table 1. Plasmids and bacterial strains used in this study
| Strains and plasmids | Relevant characteristics | Source and reference |
| Strains | ||
| ??A. caulinodans ORS571 | Wild type strain, Nal+ and Amp+ | [2] |
| ??ΔA2C-2412 | ORS571 derivative, Gen+ | This study |
| Escherichia coli DH5α | General cloning strain | Transgen |
| Plasmids | ||
| ??pEASY Blunt Simple | The vector cloning PCR products, Kan+ | TaKaRa |
| ??pCM351 | The construction of mutant, Gen+, TC | [17] |
| ??pRK2013 | Helper plasmid, carries tra genes, Kan+ | [18] |
| Kan+: kanamycin; Gen+: gentamicin; TC: tetracycline; Nal+: nalidixic acid; Amp+: ampicillin. | ||
表选项
1.1.2 引物: 本实验所用引物详见表 2。
表 2. 本实验所用引物 Table 2. Primers used in this study
| The name of the primer | Direction (5?→3?) | Restriction enzyme cutting site |
| 2412-up-F | CAATTGTCATCCTGCTCGACGTGG | Mfe Ⅰ |
| 2412-up-R | GGTACCCACGGAATCAGAAGGCAA | Kpn Ⅰ |
| 2412-down-F | ACCGGTAAGAGGTGTCCGACGTGG | Age Ⅰ |
| 2412-down-R | GAGCTCAGGATGCCAATGGTCGAA | Sac Ⅰ |
| 2412-middle-F | CGCGCACCTCGTCATAGTGC | |
| 2412-middle-R | CTCGTAGGCGTCGCTCTCCG |
表选项
1.1.3 菌株培养条件: 茎瘤固氮根瘤菌ORS571使用TY[19]和L3[20]培养基,37培养。大肠杆菌使用LB[21]培养基,37培养。各抗生素使用浓度:Kan+ (卡那霉素) 50 μg/mL,Gen+ (庆大霉素) 30 μg/mL,Tc (四环素) 10 μg/mL,Nal+ (萘啶酮酸) 25 μg/mL,Amp+ (氨苄青霉素) 100 μg/mL。
1.1.4 主要仪器及试剂: PCR扩增仪和凝胶成像系统购自Bio-Rad。低温高速离心机(D-37520 Osterode,德国)。超微量分光光度计NANODROP 2000c。华大基因合成所用引物。限制性内切酶以及T4连接酶NEB公司生产。购买天根生物科技有限公司基因组DNA提取、质粒提取、切胶回收等试剂盒。DNA样品测序由瑞博兴科生物技术有限公司完成。抗生素购自烟台鼎锐生物科技有限公司。
1.2 基因片段的克隆及重组载体的构建 使用细菌基因组DNA提取试剂盒,提取过夜培养的ORS571总DNA,以此为模板使用目标片段上下游引物2412-up-F/R和2412-down-F/R (表 2)进行PCR扩增,得到710 bp上游片段和680 bp下游片段。将扩增的上下游片段分别连接到pEASY载体上,涂布培养IPTG诱导平板,筛选白色菌落,并进行测序验证。将测序正确的含上游片段菌株以及含载体pCM351的菌株纯培养提取质粒,使用NEB酶Mfe Ⅰ和Kpn Ⅰ进行酶切胶回收,用T4连接酶将含有相同酶切位点的两者连接。将得到的pCM351::2412-up片段转入大肠杆菌感受态中,平板涂布过夜培养,挑取单菌落进行菌落PCR验证,将验证正确的阳性克隆子提取质粒,用同样方法将下游片段连接到PCM351::2412-up上,最后得到含有上下游片段的pCM351::2412-up-down质粒。
1.3 构建AZC-2412缺失突变菌株 本实验采用三亲接合方法[22]构建实验所需突变株,取过夜摇培的携带辅助质粒pRK2013的大肠杆菌、携带pCM351:: 2412-up-down质粒的大肠杆菌DH5α、野生型ORS571,按2:3:10比例进行混合,利用同源序列重组交换原理,将质粒pCM351上编码Gen+的基因把野生型中AZC-2412的基因片段替换掉,使得突变菌株含有Gen+抗性。将三亲接合后的菌株涂布于含Gen+-Amp+-Nal+三种抗性的TY平板上筛选生长良好的菌株,之后用2412-up-F和2412-down-R引物或用AZC-2412基因的内部引物2412-middle-F和2412-middle-R (表 2)进行PCR验证,并用野生型ORS571作阳性对照,验证正确的即为构建成功的ΔAZC-2412突变株。
1.4 生长曲线测定 挑取事先在TY平板中活化好的野生型ORS571及突变株ΔAZC-2412的菌落,接种到含有5 mL TY培养基的相应抗性的试管中,37 ℃过夜摇培。取适量菌液,将OD600调至1.0左右,选取100 mL锥形瓶加入50 mL TY培养基,为保证菌液起始OD600为0.02左右,加入OD600值1.0的菌液1 mL,37、180 r/min培养,每2 h测定1次菌液OD600值,每组3次重复。
1.5 c-di-GMP水平测定 取10 mL培养至对数生长期的菌液,4、5000 r/min下离心收集菌体,按比例(甲醇︰乙腈︰水=40︰40︰20)加入细菌裂解液破碎细胞,并浸提c-di-GMP。菌株中c-di-GMP含量通过液相色谱串联质谱法(HPLC-MS/MS)[23]进行检测,菌内c-di-GMP浓度用pmol/mg蛋白表示。
1.6 趋化实验 使用半固体平板法进行趋化实验测定[24],将活化后的野生型ORS571和ΔAZC-2412突变株,接种到含相应抗性的液体培养基中。37、180 r/min过夜培养。将菌液洗去抗性,调OD600值为0.5,各取5 μL点加到0.3%琼脂的L3+N和L3-N (碳源:乳酸钠,氮源N:NH4Cl,下同)半固体平板上,37正置培养2 d左右,观察趋化圈大小,并测量趋化圈直径。
1.7 絮凝实验 将野生型和突变株接种至TY液体培养基,37、180 r/min过夜培养。将OD600值调为1.0左右,取每200 μL菌液加入到装有10 mL L3+1/2N寡营养培养基的50 mL含盖锥形管中,37、180 r/min竖直培养,分别培养至24 h和48 h进行絮凝观察和测定。(1)絮凝量观察:为方便观察,选取产生絮凝量相对多的48 h培养物,将锥形管中的絮凝菌液倒入平板中,拍照观察絮凝量。(2)絮凝量测定:分别取出24 h和48 h的锥形管竖直放置30 min,取静止后的上清菌液测定OD600值,记为ODs,将沉淀和上清使用组织研磨器混合研磨后测定OD600值,记为ODt,每组3次平行。通过公式:%絮凝(%flocculation)=[(ODt-ODs)×100]/ODt计算细胞絮凝百分比。
1.8 生物膜实验 参照Barnard介绍的方法[25]进行生物膜实验。(1)生物膜观察:使用有氮源的L3+N和无氮源的L3-N培养基,添加乳酸钠(10 mmol/L)为碳源,试管培养观察生物膜。吸取预先调节好OD600为2.5的各菌液150 μL,加入到含1.5 mL的各培养基的试管中,37竖直静置培养3 d,做3组平行。洗去废液及杂菌,加入2 mL 0.1%结晶紫染色30 min,后用流动的清水将多余的结晶紫冲洗干净,最后拍照观察生物膜形态。(2)生物膜测定:取调至OD600为2.5的菌液15 μL,加入到无菌的PVC96孔板中,每种培养基同时做3次平行。用封口密封后置于37培养3 d左右,轻微冲洗弃去培养液,每个孔中加入0.1%结晶紫200 μL染色30 min。用水洗去染色液,室温晾干后加入30%乙酸溶解壁上与生物膜结合的结晶紫,最后利用酶标仪测定OD540处的吸光度值。
1.9 胞外多糖实验 配置以乳酸钠(10 mmol/L)为碳源的无氮培养基L3-N,琼脂糖浓度为8 g/L。将各菌液OD600调至0.8,取0.5 μL菌液滴加到平板上,晾干倒置放入37培养箱中培养3 d,重复3组。在灯箱上拍照观察菌株胞外多糖(EPS)的生成情况,最后利用浓硫酸-蒽酮氧化法进行定量测定。
1.10 竞争性结瘤实验 取毛萼田菁种子用硫酸浸泡催芽30 min,用无菌水洗涤数次,将种子放入37培养箱中培养2 d。将生长出芽的种子浸泡于事先培养好的菌液中,按照野生型和突变株1︰1、1︰5、1︰10比例浸泡2 h。将浸泡后的幼苗种植于含有1×营养液的已灭菌的蛭石土花盆中,每个比例种植10盆,置于人工气候室生长45 d左右。取生长成熟的瘤体捣碎,划线于含有Nal+和Amp+的TY固体平板上,在37培养箱中倒置培养,将长出的菌落进行菌落PCR验证。统计并计算每个比例的结瘤数量的比值。
2 结果和分析 2.1 ΔAZC-2412突变株构建 经三亲接合后的突变株,不能在含有三抗(Nal+、Gen+、Tc)的TY平板上生长,但可以在含有双抗(Nal+、Gen+)的TY平板上生长,符合该对比生长状态的菌落,可能为构建成功的ΔAZC-2412突变株。利用AZC-2412内部引物2412-middle-F和2412-middle-R进行菌落PCR验证结果表明,在野生型ORS571中可扩增出703 bp的片段(图 2泳道2),由于目的基因缺失突变,因此潜在的突变菌株中不能扩增出相应大小的片段(图 2泳道1),即可获得成功构建的ΔAZC-2412突变株,如图 2。
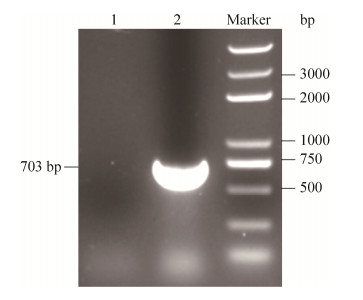 |
| 图 2 PCR验证突变株结果 Figure 2 The mutant strain was verified by PCR. Primers: 2412-middle-F/2412-middle-R; lane 1: Mutant genomic DNA; lane 2: Wild-type genomic DNA. Primer amplification showed a band in wild strain, but not in mutant strain. |
| 图选项 |
2.2 生长曲线测定结果 通过连续测定不同时期的OD600值,来记录菌株的生长情况。野生型ORS571和突变株ΔAZC-2412的生长状况如图 3。从图中可以明确看出,突变菌株ΔAZC-2412的生长曲线和野生型ORS571的生长曲线基本相同,其结果表明在菌株ORS571中c-di-GMP环化酶基因AZC-2412的缺失并不能导致菌株生长状态的改变。
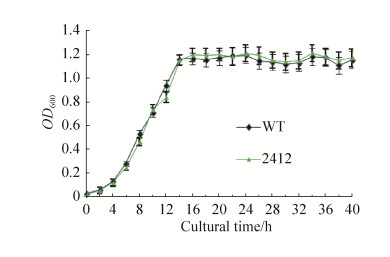 |
| 图 3 菌株的生长曲线测定 Figure 3 The growth curve of the strains ware determined. |
| 图选项 |
2.3 c-di-GMP水平测定结果 验证AZC-2412是否合成c-di-GMP,试验利用HPLC-MS/MS测定了野生型和突变株c-di-GMP含量。其结果如图 4所示,可以看出突变株中c-di-GMP含量低于野生型的,结果表明单独缺失AZC-2412使得ORS571中环化酶合成量降低,导致细胞中c-di-GMP的水平下降。
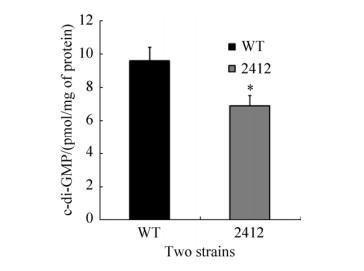 |
| 图 4 各菌株c-di-GMP水平测定结果 Figure 4 The c-di-GMP levels of all strains were determined. *P < 0.05. |
| 图选项 |
2.4 趋化能力测定 如图 5,测量结果表明,突变株ΔAZC-2412对运动性有一定影响。在L3+N和L3-N培养基的趋化圈都略大于野生型ORS571,趋化直径增大18%,表明运动能力有所增强,说明AZC-2412对细菌的运动性有一定调控作用。
 |
| 图 5 菌株的趋化能力表型与定量 Figure 5 Mutant strain and wild type chemotaxis analysis. A: In both L3+N and L3-N, the ΔAZC-2412 had higher chemotaxis than the ORS571; B: The chemotaxis was quantitatively measured using a ruler. *P < 0.05, **P < 0.01. |
| 图选项 |
2.5 絮凝实验结果 茎瘤固氮根瘤菌ORS571在有氧条件下培养[20],利用寡营养培养基L3+1/2N培养时可产生凝结沉淀。如图 6所示,结果表明,突变株ΔAZC-2412的凝结能力较野生型ORS571降低30%,表明在ORS571凝结过程中AZC-2412起到一定调节作用。而随着时间的延长,这里我们选择48 h的凝结情况(图 6-A)进行观察。由于菌株不断分裂生长,细胞总量不断增加,在48 h的凝结量明显高于24 h,但此时突变株的絮凝量依然低于野生型菌株。
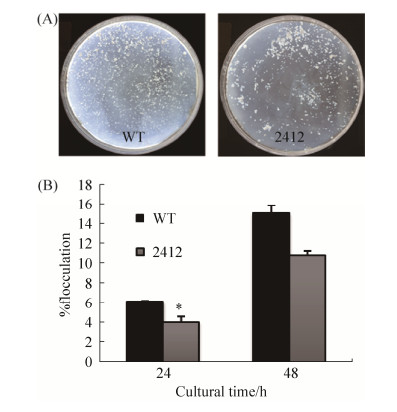 |
| 图 6 两种菌株絮凝结果对比 Figure 6 Comparison of flocculation results of two strains. A: Photographed after 48 hours of cultivation. Flocculation yield results for the wild-type and ΔAZC-2412; B: Analysis of quantitative results of flocculation. *P < 0.05. |
| 图选项 |
2.6 生物膜实验结果 环二鸟苷酸(c-di-GMP)对生物膜的形成起到重要作用。在试管试验中生物膜形成状态如图 7-A所示。从中观察到,在有氮源L3+N或无氮源L3-N培养时,突变株ΔAZC-2412的生物膜形成量都明显少于野生型ORS571的生物膜产量,但二者在有氮源时的生物膜产量要明显高于无氮源时的产量。如图 7-B,通过在96孔板中培养,进行定量分析发现,突变株与野生型相比,含氮培养基L3+N中生物膜量下降14.3%,无氮培养基L3-N中减少6.8%。
 |
| 图 7 两种菌株生物膜形成对比 Figure 7 Comparison of biofilm formation of two strains. A: Biofilm morphologies upon crystal violet staining of the WT and ΔAZC-2412. On the left: Culture strains in L3+N medium; on the right: Culture strains in L3+N medium. B: Biofilm quantitative measurement results. **P < 0.01. |
| 图选项 |
2.7 胞外多糖实验结果 在以乳酸钠为碳源的L3-N平板上培养3 d后,如图 8-A观察发现,突变株ΔAZC-2412的EPS分泌量明显少于野生型ORS571的分泌量。平板中野生型的菌落整体都被覆盖上一层光滑的胞外多糖,而突变株较比于野生型产生了更少的胞外多糖,野生型产生更多的多糖在菌落表面,菌落表面平滑,突变株多糖产量较少,表面多糖覆盖较少,菌落有凹陷。如图 8-B,使用浓硫酸-蒽酮比色法对各菌株EPS生产量进行测定,记录OD600值。以乳酸为碳源的L3-N情况下,突变株的胞外多糖含量比野生型下降了19.6%。
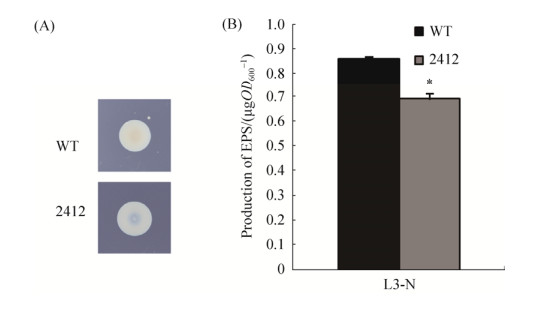 |
| 图 8 两种菌株的菌落形态和EPS测定结果 Figure 8 Colony morphology and EPS determination of the two strains. A: Observation of colony morphology of two strains. Wide-type strain and the mutant strains colonies are very different. Photographs were taken after 3 days of incubation; B: The EPS quantitative analysis results. *P < 0.05. |
| 图选项 |
2.8 竞争结瘤实验结果 取毛萼田菁上生长的瘤体,每个比例挑取100个长势良好的瘤体,捣碎后划板,将长出的菌落用AZC-2412基因内部引物做菌落PCR,观察扩出片段有无,进而辨别野生型和突变株数量。结果如图 9,当野生型和突变株分别按1︰1、1︰5、1︰10比例浸泡侵染田菁时,分离的瘤体中突变株所占比例分别为9%、34%、45%,提高突变株比例后,突变株结瘤数明显增加。结果表明,与野生型相比,突变株ΔAZC-2412的竞争结瘤能力明显减弱,说明该基因的缺失导致c-di-GMP水平下降,促使菌株胞外多糖形成量减少,不利于菌株在田菁根毛细胞侵染线的形成,进而影响在宿主根皮层内瘤原基的形成,最终导致结瘤能力下降。
 |
| 图 9 野生型与突变株的竞争性结瘤 Figure 9 Competitive nodulation tests between the WT and Δ2412. |
| 图选项 |
3 讨论 环二鸟苷酸(c-di-GMP)在过去十年中作为细菌中普遍存在的第二信使而受到广泛的研究,然而,我们对c-di-GMP的研究还是较为浅显的[26]。至于c-di-GMP信号传导由于细胞功能的多样性以及c-di-GMP表现出的多种作用机制,使得人们对于c-di-GMP研究变得更为复杂[27]。对于这种复杂现象,原因是许多细菌基因组编码了多种涉及c-di-GMP转运的蛋白,以及细菌的多样性和细菌生活方式的多样性,以及与宿主之间共同进化的关系[28]。这些因素与迄今为止已知的相对较少c-di-GMP接收器或效应器形成对比,与c-di-GMP的代谢蛋白不同,其在结构和功能上更为多样化,并且几乎不能通过生物信息学识别(除了PilZ结构域)[29-30]。因此,有必要使用除了基因组学和生物信息学之外的其他研究方法,用以发现新的c-di-GMP的调节途径,特别是在与植物相关的复杂的生活方式的细菌中。这一方法涉及了通过DGC或PDE的缺失或表达来改变细胞内的c-di-GMP水平,用以评定其对特定表型的影响。在我们的研究中,我们使用缺失DGC的AZC-2412来减少第二信使c-di-GMP在细菌中的水平,从而显示出细菌表型上的改变。
正如其他细菌中报道的[29, 31],提高c-di-GMP的水平导致细菌运动能力的显著降低,细菌群落形态的显著改变,生物膜形成量的增加,可能是通过胞外多糖增加而导致的,而c-di-GMP水平的降低则会起到相反的效应。而大多数细菌的胞外多糖合成会受到c-di-GMP的调控,因此c-di-GMP是细菌中参与各种生理功能调控十分重要的第二信使[32]。
总之,c-di-GMP细胞内水平的降低,增强运动能力,减少EPS生产促进生物膜的形成,最终影响细菌群落的变化和细菌与植物共生的方式。然而,也有报告证明c-di-GMP对植物病原菌如野油菜黄单胞菌(Xanthomonas campestris)[33-34]、软腐病菌(Dickeya dadantii)[35]、黑胫病菌(Pectobacterium atrosepticum)[36-37]、解淀粉欧文氏菌(Erwinia amylovora)[38]等的不良调控。其中低c-di-GMP降低叶缘焦枯病菌(Xylella fastidiosa)[39]毒力水平的情况似乎是独一无二的。而在几种植物有益菌中,如恶臭假单胞菌(Pseudomonas putida)[40]、荧光假单胞菌(P. fluorescens)[41-42]和根瘤菌(Rhizobium)[43]中,c-di-GMP则正向调节这些菌在根际定殖。
我们的研究结果表明,AZC-2412的缺失在不影响细菌生长的前提下,使得DGC合成减少,低水平的c-di-GMP导致胞外多糖的产量降低,运动能力增强,共同作用导致生物膜的减少,细菌群感效应降低,凝结量增加。与宿主植物互作能力下降,结瘤能力降低。
References
| [1] | Dreyfus B, Dommergues Y. Nitrogen-fixing nodules induced by Rhizobium on the stem of the tropical legume Sesbania rostrata. FEMS Microbiology Letters, 1981, 10(4): 313-317. DOI:10.1111/j.1574-6968.1981.tb06262.x |
| [2] | Dreyfus BL, Garcia JL, Gillis M. Characterization of Azorhizobium caulinodans gen. nov., sp. nov., a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania rostrata. International Journal of Systematic and Evolutionary Microbiology, 1988, 38(1): 89-98. |
| [3] | Dreyfus BL, Elmerich C, Dommergues YR. Free-living Rhizobium strain able to grow on N2 as the sole nitrogen source. Applied and Environmental Microbiology, 1983, 45(2): 711-713. |
| [4] | Donald RG, Ludwig RA. Rhizobium sp. strain ORS571 ammonium assimilation and nitrogen fixation. Journal of Bacteriology, 1984, 158(3): 1144-1151. |
| [5] | Ross P, Weinhouse H, Aloni Y, Michaeli D, Weinberger-Ohana P, Mayer R, Braun S, de Vroom E, van der Marel GA, van Boom JH, Benziman M. Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid. Nature, 1987, 325(6101): 279-281. DOI:10.1038/325279a0 |
| [6] | Jain R, Sliusarenko O, Kazmierczak BI. Interaction of the cyclic-di-GMP binding protein FimX and the Type 4 pilus assembly ATPase promotes pilus assembly. PLoS Pathogens, 2017, 13(8): e1006594. DOI:10.1371/journal.ppat.1006594 |
| [7] | Hengge R. Principles of c-di-GMP signalling in bacteria. Nature Reviews Microbiology, 2009, 7(4): 263-273. DOI:10.1038/nrmicro2109 |
| [8] | Amikam D, Benziman M. Cyclic diguanylic acid and cellulose synthesis in Agrobacterium tumefaciens. Journal of Bacteriology, 1989, 171(12): 6649-6655. DOI:10.1128/jb.171.12.6649-6655.1989 |
| [9] | Tal R, Wong HC, Calhoon R, Gelfand D, Fear AL, Volman G, Mayer R, Ross P, Amikam D, Weinhouse H, Cohen A, Sapir S, Ohana P, Benziman M. Three cdg operons control cellular turnover of cyclic di-GMP in Acetobacter xylinum: genetic organization and occurrence of conserved domains in isoenzymes. Journal of Bacteriology, 1998, 180(17): 4416-4425. |
| [10] | Christen M, Christen B, Folcher M, Schauerte A, Jenal U. Identification and characterization of a cyclic di-GMP-specific phosphodiesterase and its allosteric control by GTP. The Journal of Biological Chemistry, 2005, 280(35): 30829-30837. DOI:10.1074/jbc.M504429200 |
| [11] | Schmidt AJ, Ryjenkov DA, Gomelsky M. The ubiquitous protein domain EAL is a cyclic diguanylate-specific phosphodiesterase: enzymatically active and inactive EAL domains. Journal of Bacteriology, 2005, 187(14): 4774-4781. DOI:10.1128/JB.187.14.4774-4781.2005 |
| [12] | Huang BX, Whitchurch CB, Mattick JS. FimX, a multidomain protein connecting environmental signals to twitching motility in Pseudomonas aeruginosa. Journal of Bacteriology, 2003, 185(24): 7068-7076. DOI:10.1128/JB.185.24.7068-7076.2003 |
| [13] | Jimenez PN, Koch G, Thompson JA, Xavier KB, Cool RH, Quax WJ. The multiple signaling systems regulating virulence in Pseudomonas aeruginosa. Microbiology and Molecular Biology Reviews, 2012, 76(1): 46-65. DOI:10.1128/MMBR.05007-11 |
| [14] | Tischler AD, Camilli A. Cyclic diguanylate regulates Vibrio cholerae virulence gene expression. Infection and Immunity, 2005, 73(9): 5873-5882. DOI:10.1128/IAI.73.9.5873-5882.2005 |
| [15] | Hurley JH. GAF domains: cyclic nucleotides come full circle. Science's STKE, 2003, 2003(164): PE1. |
| [16] | Okegbe C, Fields BL, Cole SJ, Beierschmitt C, Morgan CJ, Price-Whelan A, Stewart RC, Lee VT, Dietrich LEP. Electron-shuttling antibiotics structure bacterial communities by modulating cellular levels of c-di-GMP. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(26): E5236-E5245. |
| [17] | Marx CJ, Lidstrom ME. Broad-host-range cre-lox system for antibiotic marker recycling in gram-negative bacteria. Biotechniques, 2002, 33(5): 1062-1067. DOI:10.2144/02335rr01 |
| [18] | Figurski DH, Helinski DR. Replication of an origin-containing derivative of plasmid RK2 dependent on a plasmid function provided in trans. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(4): 1648-1652. DOI:10.1073/pnas.76.4.1648 |
| [19] | Beringer JE. R factor transfer in Rhizobium leguminosarum. Microbiology, 1974, 84(1): 188-198. DOI:10.1099/00221287-84-1-188 |
| [20] | Nakajima A, Aono T, Tsukada S, Siarot L, Ogawa T, Oyaizu H. Lon protease of Azorhizobium caulinodans ORS571 is required for suppression of reb gene expression. Applied and Environmental Microbiology, 2012, 78(17): 6251-6261. DOI:10.1128/AEM.01039-12 |
| [21] | Delannoy S, Beutin L, Burgos Y, Fach P. Specific detection of enteroaggregative hemorrhagic Escherichia coli O104:H4 strains by use of the CRISPR locus as a target for a diagnostic real-time PCR. Journal of Clinical Microbiology, 2012, 50(11): 3485-3492. DOI:10.1128/JCM.01656-12 |
| [22] | 李岩. Sinorhizobium sp. NGR234的广宿主适应机制研究.中国农业大学博士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014111796.htm |
| [23] | Spangler C, B?hm A, Jenal U, Seifert R, Kaever V. A liquid chromatography-coupled tandem mass spectrometry method for quantitation of cyclic di-guanosine monophosphate. Journal of Microbiological Methods, 2010, 81(3): 226-231. DOI:10.1016/j.mimet.2010.03.020 |
| [24] | Bible AN, Stephens BB, Ortega DR, Xie ZH, Alexandre G. Function of a chemotaxis-like signal transduction pathway in modulating motility, cell clumping, and cell length in the alphaproteobacterium Azospirillum brasilense. Journal of Bacteriology, 2008, 190(19): 6365-6375. DOI:10.1128/JB.00734-08 |
| [25] | Barnard AML, Simpson NJL, Lilley KS, Salmond GP. Mutations in rpsL that confer streptomycin resistance show pleiotropic effects on virulence and the production of a carbapenem antibiotic in Erwinia carotovora. Microbiology, 2010, 156(4): 1030-1039. DOI:10.1099/mic.0.034595-0 |
| [26] | R?mling U, Galperin MY, Gomelsky M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiology and Molecular Biology Reviews, 2013, 77(1): 1-52. DOI:10.1128/MMBR.00043-12 |
| [27] | Pérez-Mendoza D, Aragón IM, Prada-Ramírez HA, Romero-Jiménez L, Ramos C, Gallegos MT, Sanjuán J. Responses to elevated c-di-GMP levels in mutualistic and pathogenic plant-interacting bacteria. PLoS One, 2014, 9(3): e91645. DOI:10.1371/journal.pone.0091645 |
| [28] | R?mling U, Gomelsky M, Galperin MY. C-di-GMP: the dawning of a novel bacterial signalling system. Molecular Microbiology, 2005, 57(3): 629-639. DOI:10.1111/j.1365-2958.2005.04697.x |
| [29] | Ryjenkov DA, Simm R, R?mling U, Gomelsky M. The PilZ domain is a receptor for the second messenger c-di-GMP: the PilZ domain protein YcgR controls motility in enterobacteria. The Journal of Biological Chemistry, 2006, 281(41): 30310-30314. DOI:10.1074/jbc.C600179200 |
| [30] | Amikam D, Galperin MY. PilZ domain is part of the bacterial c-di-GMP binding protein. Bioinformatics, 2006, 22(1): 3-6. |
| [31] | Simm R, Morr M, Kader A, Nimtz M, R?mling U. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility. Molecular Microbiology, 2004, 53(4): 1123-1134. DOI:10.1111/j.1365-2958.2004.04206.x |
| [32] | R?mling U, Amikam D. Cyclic di-GMP as a second messenger. Current Opinion in Microbiology, 2006, 9(2): 218-228. DOI:10.1016/j.mib.2006.02.010 |
| [33] | Hickman JW, Harwood CS. Identification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor. Molecular Microbiology, 2008, 69(2): 376-389. DOI:10.1111/j.1365-2958.2008.06281.x |
| [34] | Ryan RP, Fouhy Y, Lucey JF, Jiang BL, He YQ, Feng JX, Tang JL, Dow JM. Cyclic di-GMP signalling in the virulence and environmental adaptation of Xanthomonas campestris. Molecular Microbiology, 2007, 63(2): 429-442. DOI:10.1111/j.1365-2958.2006.05531.x |
| [35] | Yi X, Yamazaki A, Biddle E, Zeng Q, Yang CH. Genetic analysis of two phosphodiesterases reveals cyclic diguanylate regulation of virulence factors in Dickeya dadantii. Molecular Microbiology, 2010, 77(3): 787-800. DOI:10.1111/j.1365-2958.2010.07246.x |
| [36] | Pérez-Mendoza D, Coulthurst SJ, Humphris S, Campbell E, Welch M, Toth IK, Salmond GPC. A multi-repeat adhesin of the phytopathogen, Pectobacterium atrosepticum, is secreted by a Type I pathway and is subject to complex regulation involving a non-canonical diguanylate cyclase. Molecular Microbiology, 2011, 82(3): 719-733. DOI:10.1111/j.1365-2958.2011.07849.x |
| [37] | Pérez-Mendoza D, Coulthurst SJ, Sanjuán J, Salmond GPC. N-Acetylglucosamine-dependent biofilm formation in Pectobacterium atrosepticum is cryptic and activated by elevated c-di-GMP levels. Microbiology, 2011, 157(12): 3340-3348. DOI:10.1099/mic.0.050450-0 |
| [38] | Barnhart DM, Su SC, Baccaro BE, Banta LM, Farrand SK. CelR, an ortholog of the diguanylate cyclase PleD of Caulobacter, regulates cellulose synthesis in Agrobacterium tumefaciens. Applied and Environmental Microbiology, 2013, 79(23): 7188-7202. DOI:10.1128/AEM.02148-13 |
| [39] | Chatterjee S, Killiny N, Almeida RPP, Lindow SE. Role of cyclic di-GMP in Xylella fastidiosa biofilm formation, plant virulence, and insect transmission. Molecular Plant-Microbe Interactions, 2010, 23(10): 1356-1363. DOI:10.1094/MPMI-03-10-0057 |
| [40] | Matilla MA, Travieso ML, Ramos JL, Ramos-González MI. Cyclic diguanylate turnover mediated by the sole GGDEF/EAL response regulator in Pseudomonas putida: its role in the rhizosphere and an analysis of its target processes. Environmental Microbiology, 2011, 13(7): 1745-1766. DOI:10.1111/j.1462-2920.2011.02499.x |
| [41] | Newell PD, Monds RD, O'Toole GA. LapD is a bis-(3?, 5?)-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3461-3466. DOI:10.1073/pnas.0808933106 |
| [42] | Newell PD, Boyd CD, Sondermann H, O'Toole GA. A c-di-GMP effector system controls cell adhesion by inside-out signaling and surface protein cleavage. PLoS Biology, 2011, 9(2): e1000587. DOI:10.1371/journal.pbio.1000587 |
| [43] | Ausmees N, Mayer R, Weinhouse H, Volman G, Amikam D, Benziman M, Lindberg M. Genetic data indicate that proteins containing the GGDEF domain possess diguanylate cyclase activity. FEMS Microbiology Letters, 2001, 204(1): 163-167. DOI:10.1111/j.1574-6968.2001.tb10880.x |
