王明元1

 , 李建福2, 刘建福1, 徐志周1, 林萍1, 李雨晴1
, 李建福2, 刘建福1, 徐志周1, 林萍1, 李雨晴1 1. 华侨大学园艺系, 福建 厦门 361021;
2. 上海交通大学农业与生物学院, 上海 200240
收稿日期:2018-11-13;修回日期:2019-01-03;网络出版日期:2019-01-24
基金项目:国家自然科学基金(31101512);福建省科技厅高校产学研重大项目(2017N5009)
*通信作者:王明元, Tel:+86-592-6162300, E-mail:w_mingyuan@163.com.
摘要:[目的] 基于丛枝菌根(AM)真菌改变柑橘酚类现象,筛选外源酚酸诱导菌根共生差异基因,分析酚相关基因功能。[方法] 以枳(Poncirus trifoliate L.)接种AM真菌,并施加外源酚酸,采用随机引物扩增,获得差异表达片段;继而克隆酚相关基因并进行生物信息学分析。[结果] 试验采用20条随机引物和3条锚定引物扩增cDNA,共获得了154条差异显示的表达片段;对其中16条Northern杂交显示阳性的片段测序与比对,发现9条有相关功能注释,参与环境因子及内源信号的识别,调节共生体的形成;DD-11基因只有在外源酚酸添加和接种AM真菌的根系中表达,该片段cDNA全长序列长度为1382 bp,编码454个氨基酸,分子式为C2210H3427N603O657S31,其理论等电点和相对分子量分别为7.81和49950.03;磷酸化分析发现,该蛋白有22个丝氨酸残基、14个苏氨酸残基及7个酪氨酸残基可能成为蛋白激酶磷酸化位点。通过PredictProtein服务器对DD-11蛋白质的二级结构进行分析,该蛋白含有α螺旋22%、无规则卷曲58%、延伸链20%,不含有β折叠结构。[结论] 本试验获得菌根共生过程酚相关基因,其功能与植物内源信号识别密切相关,为探讨酚类在菌根共生过程中的分子机制提供了新的视角。
关键词:丛枝菌根真菌酚酸差异片段筛选蛋白结构
Screening of genes induced by exogenous phenolic on mycorrhized Poncirus trifoliate
Mingyuan Wang1

 , Jianfu Li2, Jianfu Liu1, Zhizhou Xu1, Ping Lin1, Yuqing Li1
, Jianfu Li2, Jianfu Liu1, Zhizhou Xu1, Ping Lin1, Yuqing Li1 1. Horticultural Department, Huaqiao University, Xiamen 361021, Fujian Province, China;
2. School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China
*Corresponding author: Mingyuan Wang, Tel:+86-592-6162300, E-mail:w_mingyuan@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31101512) and by the Special Project on Education and Research of Fujian Province (2017N5009)
Abstract: [Objective] It has been reported that phnolics contents could be changed by the inoculation with arbuscular mycorrhizal (AM) fungi. In the present study, the differentially expressed genes were screened, and the genes function was analyzed with the exogenous phenolic addition. [Methods] Poncitrus trifoliata (L.) inoculated with AM fungi was treated by exogenous phenolic. We obtained the differentially expressed bands by differential-display RT-PCR (DDRT-PCR), and then cloned the related genes and analyzed the bioninformation. [Results] A total of 154 differentially accumulated transcript-derived fragments were identified. After the sequencing and blast of 16 fragments, 9 genes were found related to putative functions which participated into the recognition of environment factors and internal signals, and the adjust of mycorrhizal formation. The bioinformatic analysis showed that the cDNA sequences of DD-11 was 1382 bp in length, containing a complete 1080 bp open reading frame and 454 amino acids were encoded, which was only expressed under mycorrhizal inoculation and exogenous phenolic. The molecular weight, theoretical pI of the DD-11 gene deduced protein were 49950.03 Da, 7.81, C2210H3427N603O657S31. The deduced DD-11 protein included 22 Ser, 14 Thr, 7 Tyr, which became the phosphorylation sites of protein kinase. The secondary structure of the deduced DD-11 protein mainly included Alpha helix, Random coil, Extended strand, Beta turn, which were 21.81%, 57.71%, 20.48% and have no Beta turn. [Conclusion] The genes related to phenolic expressed in mycorrhizal formation were obtained in our study, which were related closely to the plants signal recognition. Our study provide a new perspective of molecular mechanism of phnolics occurring in mycorrhizal formation.
Keywords: arbuscular mycorrhizal fungiphenolic acidscreening of differential fractionsprotein struction
菌根共生体的建立过程存在丛枝菌根(AM)真菌与植物根系间相互识别的过程。AM真菌能够识别植物根系释放的信号物质,诱导孢子萌发和菌丝分枝[1]。同样,在孢子萌发过程中,AM真菌能够释放信号物质促进根系中共生信号代谢途径的激活和根系生长模式的改变[2],为AM真菌的侵染做准备。
研究表明,植物信号识别、传导的物质是由包括黄酮类(Flavonoids)、倍半萜类(Sesquiterpenoids)、酚类(Phenols)以及脂肪酸类(Hydroxy fatty acids)在内的一类混合物构成[3-4]。其中,酚类物质作为重要的信号分子,已有研究相对较少[5]。
酚类物质不仅调控植物-微生物、植物-植物间的互作关系,更是参与植物抵抗逆境(病虫害侵袭等)环境的防御反应体系[6]。已有研究表明,AM真菌侵染宿主植物根系,能够引起根系酚类物质含量的显著变化(表 1)。
表 1. 接种AM真菌对寄主植物酚类相关物质的影响 Table 1. Effects of AM fungi on phenolics in their host plants
| Category | Host plants | AM fungi | Notes | References |
| Flavonoid | Allium cepa L. | Glomus mosseae | ↑ | Perner et al., 2008[7] |
| Ophiopogon Japonicus | Glomus mosseae | ↑ | Wang et al., 2008[8] | |
| Astraglus membranaceus | Glomus mosseae | ↑ | He et al., 2009[9] | |
| Seriphidium minchunense | Glomus mosseae | ↑ | He et al., 2011[10] | |
| Phenolics | Trifolium repens L. | Glomus mosseae | ↑ | Zhang et al., 2013[11] |
| Cynarascolymus L. | Glomus mosseae | ↑ | Ceccarelli et al., 2010[12] | |
| Arnica montana | Glomus intraradices | ↑ | Jurkiewicz et al., 2010[13] | |
| Glomus intraradices | ||||
| Ferulic acid | Cucumis sativus L. | Glomus mosseae | ↑ | Chen et al., 2013[14] |
| Lycopersicon esculentum Mill. | Glomus mosseae | ↑ | Lopez-Raez et al., 2011[15] | |
| Glomus intraradices | ||||
| Cynarin | Echinacea purpurea | Glomus intraradices | ↑ | Araim et al., 2009[16] |
| Romarinic acid | Ocimum sanctum var. purpurescens | Glomus caledonium | ↑ | Toussaint et al., 2007[17] |
| Cinnamic acid | Cucumis sativus L. | Glomus mosseae | – | Chen et al., 2013[14] |
| Glycyrrhizin | Glycyrrhiza uralensis Fisch. | Glomus mosseae Glomus versiforme | ↑ | Liu et al., 2007[18] |
| ↑: Content increased; ↓: Content decreased; –: Content unchanged | ||||
表选项
本课题组前期研究发现[19],接种AM真菌地表多样孢囊霉Diversispora epigaea显著增加了枳根系分泌物肉桂酸、香豆酸、没食子酸、原儿茶酸和丁香酸的含量,分别增加67%、33%、50%、71%和43%;近年来,菌根的信号传导研究取得了快速发展。特别是随着分子生物学及研究方法的发展,菌根形成过程中共生信号相关的基因取得了突破性的进展[20]。然而,在酚类信号领域分子生物学相关研究依然薄弱。
本试验为进一步了解酚类物质在菌根共生过程中的信号传导机制,对相关差异性表达基因进行深入研究,以探讨酚类相关基因在菌根共生过程中的功能作用与分子调控机制。
1 材料和方法 1.1 试验材料 供试丛枝菌根(AM)真菌为地表多样孢囊霉(Diversispora epigaea),孢子含量为每毫升704个,由北京市农林科学院植物营养与资源研究所“中国丛枝菌根真菌种质资源库(BGC)”提供,菌种编号BGC504,含有孢子及繁殖体的菌剂保存于4 ℃冰箱。
供试植物材料为枳(Poncirus trifoliate L.)。
供试基质为河沙、蛭石和粘土,按体积比1:1:1混合均匀后,121 ℃高温湿热灭菌4 h,取出冷却至室温,装入盆口直径为12 cm的塑料盆里,每盆2.5 kg。
1.2 主要试剂 DL2000 Marker、DL5000 Marker、DL15000 Marker、cDNA合成试剂盒、Ex Taq DNA聚合酶、质粒提取试剂盒、凝胶回收试剂盒、pMD18-T、BamH Ⅰ限制性内切酶和Hind Ⅲ限制性内切酶均购自宝生物工程(大连)有限公司;RNA提取试剂盒、RNA纯化试剂盒购自北京天根生化科技有限公司;DIG DNA标记试剂盒购自罗氏诊断产品(上海)有限公司;其他试剂均为分析纯,购自国药集团。
1.3 主要培养基 MS培养基(1 L):大量元素20 mL,微量元素5 mL,铁盐5 mL,有机溶液5 mL,蔗糖30 g,琼脂6 g,肌醇0.1 g溶于1 L蒸馏水中,pH 6.5。
1.4 试验设计 剪取枳新鲜幼茎,每个茎段至少留有两个芽点,自来水下冲洗1 h;70%酒精浸泡30 s后,用无菌水冲洗3次;接着用2%次氯酸钠浸泡20 min,无菌水冲洗5次;最后用1%升汞浸泡10 min,无菌水冲洗6次;无菌滤纸吸干植物表面水分;将消毒后的茎段插入到含有6-BA和IAA的MS培养基中,在27 ℃恒温培养室中进行芽诱导培养30 d,然后将新芽剪下转接到含有IBA和NAA的MS培养基中,在27 ℃恒温培养室中进行根诱导培养40 d。
将生根后的组培苗移栽至放有灭菌基质的塑料盆中,每盆3棵。试验采用双因素设计,(1) AM真菌处理:每盆接种20 g接种物,对照接种等量灭菌菌剂;(2)外源酚酸处理:每盆喷施100 mL浓度100 mg/L的肉桂酸,对照喷施等量无菌水,每周喷1次。试验供4个处理,随机排列,重复5次,盆栽试验于华侨大学温室中进行,温室温度夜间/白天16–18 ℃/26–28 ℃,培养40 d。取其新鲜根系,迅速置于液氮中保存。
1.5 根系总RNA提取 所有提取RNA使用的离心管、枪头、镊子、研钵、玻璃器皿均浸泡于1‰的DEPC溶液中预处理24 h,取出高压灭菌2 h后,备用。检测RNA的电泳装置同样使用DEPC处理水清洗一遍。
根据TIANGEN植物总RNA提取试剂盒说明提取枳根系总RNA。以去离子水为空白对照,吸取1 μL的RNA样品,在Implen超微量分光光度计上分别读取紫外分光光度计波长为230、260、280 nm下的吸光度值,通过计算检验RNA纯度与质量。
1.6 差异片段克隆与分析 cDNA第一链的合成:采用反转录试剂盒(PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit,TaKaRa公司)合成cDNA,于–20 ℃保存备用。
DDRT-PCR反应扩增:以cDNA为模板进行PCR扩增,随机引物26个,Oligo(dT)10G(C或A)锚定引物均为上海生工产品,组合成78对引物组合,进行PCR扩增(表 2)。
表 2. 试验所用引物 Table 2. Primers for the experiment
| No. | Primers sequence (5′→3′) | No. | Primers sequence (5′→3′) | |
| F301 | TACAACGAG G) | F316 | GATCACGTAC | |
| F302 | TGGATTGGTC | F317 | GATCTGACAC | |
| F303 | CTTTCTACCC | F318 | GATCTCAGAC | |
| F304 | TTTTGGCTCC | F319 | GATCATAGCC | |
| F305 | GGAACCAATC | F320 | GATCAATCGC | |
| F306 | AAACTCCGTC | F321 | GATCTAACCG | |
| F307 | TCGATACAGG | F322 | GATCGCATTG | |
| F308 | TGGTAAAGGG | F323 | GATCTGACTG | |
| F309 | TCGGTCATAG | F324 | GATCATGGTC | |
| F310 | GGTACATTGG | F325 | GATCATAGCG | |
| F311 | TACCTAAGCG | F326 | GATCTAAGGC | |
| F312 | CTGCTTGATG | F327(G) | AAGCTTTTTTTTTTG | |
| F313 | GTTTTCGCAG | F328(C) | AAGCTTTTTTTTTTA | |
| F314 | GATCAAGTCC | F329(A) | AAGCTTTTTTTTTTC | |
| F315 | GATCCAGTAC |
表选项
聚丙烯酰胺凝胶电泳及染色:本试验分离差异条带采用6%非变性聚丙烯酰胺凝胶电泳法。利用16孔垂直板电泳槽电泳。比较处理组与对照组之间、不同引物组合之间的条带差异。
Northern杂交:采用的是DIG High Prime DNA Labeling and Detection Starter Kit (Roche公司)试剂盒,操作均按说明书步骤进行。
差异片段的克隆、测序、分析及同源性比对:常规方法制备大肠杆菌感受态细胞;差异片段克隆采用TaKaRa公司pMD-18-T Vector试剂盒;本试验小提质粒采用TaKaRa公司的TaKaRa MiniBEST Plasmidmid Purification Kit试剂盒。
pMD-18-T载体在插入序列两端具有多个酶切位点,本试验选取适当酶切位点对重组质粒进行双酶切鉴定,并由上海生工完成测序。将所测得的序列利用NCBI (http://journals.im.ac.cn/html/actamicrocn/2019/7/http//www.ncbi.nlm.nih.gov/)在线工具中的BLASTn和BLASTx子选项进行同源序列比对及蛋白质序列相似性分析。利用DNAMAN软件对序列进行分析。将待分析的序列导入Channel,对片段序列进行剪切、截取等操作,以及多序列同源性比与以及酶切位点分析。
差异片段全长序列的克隆及生物信息学分析:根系总RNA提取、RNA纯度及完整性检测、cDNA第一链的合成方法同上述。
基因全长序列的扩增:通过序列比对获得NCBI数据库(http://journals.im.ac.cn/html/actamicrocn/2019/7/http//www.ncbi.nlm.nih.gov/)中已知的DD-11同源基因序列,用Primer Premier 5.0软件设计了一对特异性PCR引物:正向引物TGC TCT CTC CAA ACA AAG CA;反向引物TGA TAA CAA CCA CCT TGC ATT。
目的片段的回收纯化、克隆与测序同上述方法。
1.7 DD-11基因的生物信息学分析 (1) 运用DNAMAN软件分析核酸序列的分子质量、碱基组成和碱基分布。
(2) 通过NCBI (http://www.ncbi.nlm.nih.gov/)在线工具,进行同源序列比对;采用信息库的BLAST模块进行蛋白质序列相似性分析。
(3) 运用protParam软件(http://web.expasy.org/protparam/)对ORF翻译的蛋白的分子量、等电点、氨基酸组成等基本性质进行分析。
(4) 利用瑞士生物信息学研究所(Swiss Institute of Bioinformatics,SIB)的ExPASy服务器上的ProtScale程序(http://us.expasy.org/cgi-bin/protscale.pl)分析ORF翻译后的氨基酸序列疏水性。
(5) 利用丹麦科技大学的CBS服务器(http://www.cbs.dtu.dk/services/SignalP/)对蛋白质序列的信号肽(signal peptide)预测。
(6) 利用丹麦科技大学(DTU)的CBS服务器上的NetPhos2.0 Server程序(http://www.cbs.dtu.dk/services/NetPhos/)对蛋白质Ser、Thr和Tys进行磷酸化位点预测。
(7) 通过网站SWISS-MODEL (http://swissmodel.expasy.org/)提供的同源建模法,对蛋白质进行同源建模,获得蛋白质三级结构,使用RasMol软件查看其三级结构[21]。
2 结果和分析 2.1 枳根系总RNA提取及cDNA合成 本试验利用微量分光光度计检测总RNA吸光值。结果表明,OD260/280比值在1.9–2.0之间,说明所提取的RNA无污染;OD260/230为1.9–2.1,说明RNA无其他小分子及离子污染。试验用琼脂糖凝胶电泳检测RNA完整性,结果显示RNA条带清晰完整且亮度较高,说明本试验提取的RNA纯度较高且完整性良好,可适用于后续实验。
2.2 DDRT-PCR技术筛选菌根过程酚相关差异表达片段
2.2.1 DDRT-RCR扩增: 以处理组和对照组cDNA为模板,采用TaKaRa公司的Ex Taq DNA聚合酶,进行PCR扩增。PCR扩增产物采用2%琼脂糖凝胶电泳检测(图 1)。所有的引物组合均能产生丰度不同的差异条带,PCR扩增产生的条带丰度较高,且大部分引物均能扩增出差异条带(图 1)。
 |
| 图 1 PCR扩增产物2%琼脂糖凝胶电泳 Figure 1 2% agarose gel electrophoresis of PCR amplified products. Lane 1–12: treatments; M: marker. |
| 图选项 |
2.2.2 RCR产物凝胶电泳检测: 分别以Oligo(dT)10A/ C/G作为锚定引物与26条随机引物组合的78对引物对合成的cDNA进行PCR扩增。扩增共得到1000余条带,其中差异较明显的差异条带有154条。G为锚定引物,分别与编号为F301、F302、F303、F305、F306、F308、F309、F311、F312、F315、F317、F318、F321、F322、F325、F326的随机引物组合进行PCR扩增得到差异条带36条;C为锚定引物,分别与编号为F301、F303、F305、F304、F306、F307、F308、F309、F310、F311、F312、F313、F314、F315、F316、F317、F318、F321、F322、F323、F324、F325、F326的随机引物组合进行PCR扩增得到差异条带78条;A为锚定引物,分别与编号为F301、F302、F304、F306、F309、F311、F312、F313、F315、F316、F317、F319、F322、F324的随机引物组合进行PCR扩增得到差异条带40条。其中外源添加酚酸获得的差异条带有131条(图 2)。
 |
| 图 2 部分聚丙烯酰胺凝胶电泳图 Figure 2 Partial polyacrylamide gel electrophoresis of PCR amplified products. A: PCR with an anchoring primer Oligo G; B: PCR with an anchoring primer Oligo A; C: PCR with an anchoring primer Oligo C. Different fragments were labelled with arrows. |
| 图选项 |
2.2.3 差异条带回收与二次扩增: 以聚丙烯酰胺凝胶回收得到的DNA为模板,选取对应的随机引物和锚定引物进行二次扩增,扩增后的产物在1.1%的琼脂糖凝胶上电泳。从结果可知,琼脂糖凝胶电泳图显示的条带单一、明亮,且无非特异片段污染的条带共有26条,其大小与聚丙烯酰胺变性凝胶上回收带大小一致(图 3),可以用于下一步试验。
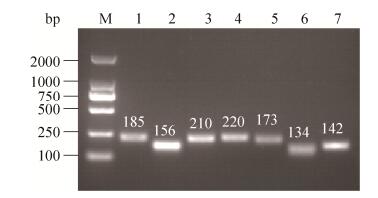 |
| 图 3 部分差异片段再扩增结果(1%琼脂糖凝胶电泳) Figure 3 Agarose gel electrophoresis results of re-amplified production. |
| 图选项 |
2.2.4 克隆及测序: 对上述差别显示的23个cDNA条带进行PCR二次扩增、回收、标记,分别与对照和处理组的总RNA进行Northern杂交,杂交的结果中共有16个差异表达的cDNA片段显示为阳性杂交信号。选取其中杂交为阳性且效果较为明显的16条片段进行克隆,测序。
BamH Ⅰ和Hind Ⅲ双酶切重组质粒后电泳,结果表明,酶切后的质粒条带及相应大小的差异片段,与插入片段大小相等(图 4),说明目的片段己插入质粒相应位点。
 |
| 图 4 部分差异片段重组质粒酶切鉴定结果 Figure 4 The identification results of the different clips recombinant. |
| 图选项 |
将差异片段进行TA克隆,测序工作由上海(生工)生物工程有限公司完成。在NCBI网站对测序结果进行BLAST比对分析(表 3)。
表 3. 差异片段比对结果 Table 3. Sequence comparison results of differential fragments
| No. | Homology analysis | E value | Identity/% | Query cover/% |
| DD-1 | Serine/threonine-protein phosphatase 2A catalytic subunit | 6e-74 | 99 | 91 |
| DD-2 | Sulfite reductase | 3e-46 | 94 | 94 |
| DD-4 | Gibberellin receptor GID1 | 5e-53 | 99 | 94 |
| DD-5 | 5′-3′ Exoribonuclease | 1e-20 | 100 | 86 |
| DD-6 | Nucleolar GTP-binding protein | 3e-44 | 98 | 98 |
| DD-8 | XIAP-associated factor 1 | 7e-68 | 99 | 94 |
| DD-9 | Nucleolar GTP-binding protein | 1e-85 | 99 | 98 |
| DD-11 | Cysteine protease | 1e-36 | 94 | 51 |
| DD-12 | WRKY transcription factor | 6e-100 | 98 | 98 |
表选项
利用NCBI网站提供的BLASTn和BLASTx程序,对16条测序结果进行核酸和氨基酸序列相似性比对,有9条找到相关的功能注释,另6条为其他植物物种的cDNA片段(未找到功能注释)。这9条大部分与甜橙中已知的基因序列具有较高的同源性,PP2A催化亚基一条,亚硫酸还原酶一条,与GTP结合蛋白相似度较高的有2条,1条与5′-3′核酸外切酶同源性较高,而DD-8和DD-11片段在外源添加酚酸的处理组中均有表达,分别与甜橙中的XIAP-相关因子和半胱氨酸蛋白酶相似度较高;DD-4和DD-12只在接种AM真菌和外源添加酚酸的处理组中表达,分别与甜橙中的GID1和WRKY转录因子具有较高的相似性。
以反转录得到的cDNA为模板,根据NCBI数据库中的同源基因序列设计了两条特异性引物进行PCR扩增得到1382 bp的特异条带(图 5),与甜橙中半胱氨酸蛋白酶基因的同源性高达90%以上,说明该基因为枳半胱氨酸蛋白酶基因。
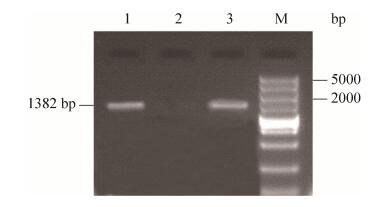 |
| 图 5 枳根系DD-11基因全长序列的扩增(Lane 1,2,3) Figure 5 DD-11 full cDNA amplified from citrus roots (Lane 1, 2, 3). |
| 图选项 |
2.3 DD-11基因的生物信息学分析 利用NCBI提供的ORF Finder工具对该核酸序列的可能读码框进行分析,该序列包含一条长度为1080 bp的完整的阅读框。利用DNAMAN软件对该基因序列进行分析,结果显示该序列编码454个氨基酸,分子式为C2210H3427N603O657S31,其理论等电点和相对分子量分别为7.81和49950.03 (表 4)。
表 4. DD-11片段氨基酸组成分析 Table 4. Amino acids composition of DD-11
| Amino acids | Numbers | Percent/% | Amino acids | Numbers | Percent/% | |
| Ala (A) | 37 | 8.1 | Leu (L) | 37 | 8.1 | |
| Arg (R) | 19 | 4.2 | Lys (K) | 24 | 5.3 | |
| Asn (N) | 18 | 4.0 | Met (M) | 11 | 2.4 | |
| Asp (D) | 18 | 4.0 | Phe (F) | 19 | 4.2 | |
| Cys (C) | 20 | 4.4 | Pro (P) | 13 | 2.9 | |
| Gln (Q) | 19 | 4.2 | Ser (S) | 42 | 9.3 | |
| Glu (E) | 23 | 5.1 | Thr (T) | 23 | 5.1 | |
| Gly (G) | 39 | 8.6 | Trp (W) | 9 | 2.0 | |
| His (H) | 11 | 2.4 | Tyr (Y) | 18 | 4.0 | |
| Ile(I) | 21 | 4.6 | Val (V) | 33 | 7.3 |
表选项
通过Protscale工具分析DD-11序列推定蛋白质的疏水性(图 6)。从图中可以看出,DD-11编码的蛋白质中疏水性最大值为3.222 (第27个氨基酸),最小值为–2.544(第159个氨基酸),在350–400区域的氨基酸具有较强的疏水性。
 |
| 图 6 DD-11序列推定编码蛋白质疏水性分析 Figure 6 Prediction of hydrophobicity regions of DD-11 hypothetic protein. |
| 图选项 |
通过SignalP-4.1软件分析可知,该蛋白为细胞外分泌蛋白,且在第36个氨基酸处C值最大,S值陡峭,Y值最高峰,预测为信号肽剪切位点(图 7)。
 |
| 图 7 DD-11氨基酸序列信号肽结构预测 Figure 7 The signal peptide analysis of DD-11 amino acids. |
| 图选项 |
本研究通过对DD-11蛋白进行磷酸化分析发现,该蛋白有22个S、14个T及7个Y可能成为蛋白激酶磷酸化位点(图 8)。
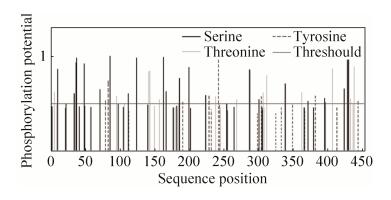 |
| 图 8 DD-11蛋白磷酸化位点分析 Figure 8 Protein phosphorylation site analysis of DD-11. |
| 图选项 |
通过PredictProtein服务器对DD-11蛋白质的二级结构进行了分析,该蛋白含有α螺旋22%、无规则卷曲58%、延伸链20%,不含有β折叠结构。然后通过SWISS-MODEL在线工具,输入柑橘DD-11基因氨基酸序列对其进行同源建模,并通过RasMol软件得到其三级结构(图 9)。
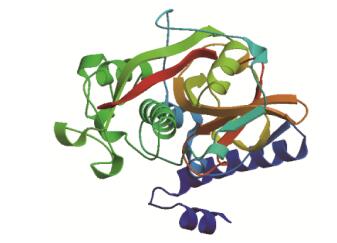 |
| 图 9 DD-11蛋白的三级结构 Figure 9 3D structure of DD-11 protein. |
| 图选项 |
3 讨论 AM真菌与寄主植物的识别有三个阶段,在早期阶段,植物分泌信号物质,诱导AM真菌菌丝分枝,与此同时,AM真菌也产生信号识别物质。而酚酸类物质作为一种信号物质目前已成为研究热点[22-23]。
植物与AM真菌相互识别后,AM真菌菌丝侵入宿主植物皮层细胞,诱导植物细胞膜以及细胞器结构的改变,植物单细胞基因大量表达,细胞活性增强,促进共生体的形成[24-25]。
DD-1与甜橙中的丝氨酸苏氨酸磷酸化酶(PP2A)催化亚基相似度较高,调节真核细胞中大部分的磷酸化酶,继而影响细胞内的信号通路。在ABA信号传导途径研究中发现PP2A既是该信号识别相关基因,同时也证明了其在菌根共生的过程中具有重要作用[26-27]。
DD-6与DD-9和GTP结合蛋白(G蛋白)相关,广泛存在于生物界,是细胞信息传导过程极为重要的开关分子,能够调控信号传导通路[28]。
前人研究结果表明,G蛋白信号传导通路还可以调控病原菌信号的传导、根瘤因子METNODR基因的表达等生物学功能[29-30],而AM形成的过程本身就是信号识别的复杂过程,说明其在共生体形成过程中也是不可或缺的。DD-4与赤霉素受体(GID1)序列相似,在赤霉素信号途径中发挥了重要的作用。研究发现GA-GID1-DELLA信号元件通过对环境因子及内源信号的识别来调节共生体的形成[31]。
DD-12与WRKY转录因子相似性较高,在水杨酸等外界因素的诱导下作用于共生体形成前期,同时还能诱导产生Ca2+信号,促进菌丝的蔓延,继而形成丛枝结构[32]。DD-11与甜橙中的半胱氨酸蛋白酶序列具有较高的相似性,广泛参与植物的各种生理过程,许多研究表明半胱酸蛋白酶在生物胁迫或生长激素等信号物质的影响下,既可作为转录因子调节基因表达,又可对蛋白质进行双重加工[33]。其中,PP2A是丝氨酸-苏氨酸蛋白磷酸酶(STK)的成员之一,是一类蛋白磷酸酶,在转录、翻译、分化和信号传导中起多种作用[34]。
PP2A是真核生物体内重要的磷酸酶,调节植物众多信号通路和生理过程,如PP2A可调节粗糙链孢霉(Neurospora crassa)菌丝的生长[35]以及构巢曲霉(Aspergillus nidulans)菌丝形态建成[36]。
稻瘟病菌(Magnaporthe oryzae)入侵水稻叶的方式与AM真菌侵染植物根系的过程非常相似。PP2A催化亚基失活可抑制稻瘟病菌营养菌丝生长,导致菌丝不能正常侵入寄主植物细胞[37]。PP2A在枳菌根共生过程中高效表达,说明其在AM真菌菌丝发育中可能起重要作用。研究表明,PP2A可被ABA诱导,而接种AM真菌可以增加宿主植物ABA含量,因此可以推测该基因不是直接被AM真菌诱导,而是间接通过增加酚类物质水平诱导。
有研究表明,在受到机械损伤或真菌侵染时,茉莉酸甲酯(MeJA)和脱落酸(ABA)作为信号传导途径的中间介质,能够诱导板栗、马铃薯和豆梨植物半胱氨酸蛋白酶抑制剂基因mRNA的积累,使体内半胱氨酸蛋白酶含量下降,从而起到防御作用[38]。
此外,半胱氨酸蛋白酶还参与信号传导响应外界环境中的生物和非生物胁迫,而且激素是重要的信号传导诱发因素[39]。例如马岩岩等[40]发现柑橘半胱氨酸蛋白酶基因CsCysP强烈响应ABA信号,但是被ET、SA和MeJA抑制。而本试验中半胱氨酸蛋白酶基因在只接种AM真菌的根系中不表达,而同时接种AM真菌并外源添加酚酸的根系则表达。因此,推测半胱氨酸蛋白酶可能通过正调控或者负调控参与多重信号传导途径。再者,AM真菌侵染枳根系时,可能酚类物质作为一种信号物质,在其诱导下突破植物的防御体系,进而促进了菌丝的分枝以及共生体的形成,最终导致半胱氨酸蛋白酶在枳根系的积累。而关于菌根共生体中,半胱氨酸蛋白酶积累的分子机理有待进一步深入研究。
References
| [1] | Bonfante P, Genre A. Arbuscular mycorrhizal dialogues: do you speak 'plantish' or 'fungish'?. Trends in Plant Science, 2015, 20: 150-154. DOI:10.1016/j.tplants.2014.12.002 |
| [2] | Bonfante P, Requena N. Dating in the dark: how roots respond to fungal signals to establish arbuscular mycorrhizal symbiosis. Current Opinion in Plant Biology, 2011, 14(4): 451-457. DOI:10.1016/j.pbi.2011.03.014 |
| [3] | Nagahashi G, Jr DD. The effects of hydroxy fatty acids on the hyphal branching of germinated spores of AM fungi. Fungal Biology, 2011, 15(4): 351-358. |
| [4] | Oldroyd GED. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology, 2013, 11(4): 252-263. DOI:10.1038/nrmicro2990 |
| [5] | Lanfranco L, Fiorilli V, Venice F, Bonfante P. Strigolactones cross the kingdoms: plants, fungi, and bacteria in the arbuscular mycorrhizal symbiosis. Journal of Experimental Botany, 2018, 69(9): 2175-2188. DOI:10.1093/jxb/erx432 |
| [6] | Zhang RQ, Zhao HQ, Zhu HH, Yao Q. Research progress in the biosynthesis of phenols in plants induced by arbuscular mycorrhizal fungi. Microbiology China, 2010, 37(8): 1216-1221. (in Chinese) 张瑞芹, 赵海泉, 朱红惠, 姚青. 丛枝菌根真菌诱导植物产生酚类物质的研究进展. 微生物学通报, 2010, 37(8): 1216-1221. |
| [7] | Perner H, Rohn S, Driemel G, Batt N, Schwarz D, Kroh LW, George E. Effect of nitrogen species supply and mycorrhizal colonization on organosulfur and phenolic compounds in onions. Journal of Agricultural and Food Chemistry, 2008, 56(10): 3538-3545. DOI:10.1021/jf073337u |
| [8] | 王森. 药用植物丛枝菌根真菌资源及对麦冬的接种效应.西北农林科技大学硕士论文, 2008 |
| [9] | He XL, Liu T, Zhao LL. Effects of inoculating AM fungi on physiological characters and nutritional components of Astragalus membranaceus under different N application levels. Chinese Journal of Applied Ecology, 2009, 20(9): 2118-2122. (in Chinese) 贺学礼, 刘媞, 赵丽莉. 接种丛枝菌根对不同施氮水平下黄芪生理特性和营养成分的影响. 应用生态学报, 2009, 20(9): 2118-2122. |
| [10] | He XL, Li J, Meng JJ, Zhao LL. Effects of Glomus mosseae on the growth and nutritional contents of Salvia miltiorrhiza Bge. under different P levels. Journal of Hebei University (Natural Science Edition), 2011, 31(4): 418-423. (in Chinese) 贺学礼, 李君, 孟静静, 赵丽莉. 摩西球囊霉和施P量对丹参生长和养分含量的影响. 河北大学学报(自然科学版), 2011, 31(4): 418-423. DOI:10.3969/j.issn.1000-1565.2011.04.018 |
| [11] | Zhang RQ, Zhu HH, Zhao HQ, Yao Q. Arbuscular mycorrhizal fungal inoculation increases phenolic synthesis in clover roots via hydrogen peroxide, salicylic acid and nitric oxide signaling pathways. Journal of Plant Physiology, 2013, 170(1): 74-79. DOI:10.1016/j.jplph.2012.08.022 |
| [12] | Ceccarelli N, Curadi M, Martelloni L, Sbrana C, Picciarelli P, Giovannetti M. Mycorrhizal colonization impacts on phenolic content and antioxidant properties of artichoke leaves and flower heads two years after field transplant. Plant and Soil, 2010, 335(1-2): 311-323. DOI:10.1007/s11104-010-0417-z |
| [13] | Jurkiewicz A, Ryszka P, Anielska T, Waligorski P, Bialonska D, Goralska K, Tsimilli-Michael M, Turnau K. Optimization of culture conditions of Arnica montana L.: effects of mycorrhizal fungi and competing plants. Mycorrhiza, 2010, 20(5): 293-306. DOI:10.1007/s00572-009-0280-z |
| [14] | Chen SC, Jin WJ, Liu AR, Zhang SJ, Liu DL, Wang FH, Lin XM, He CX. Arbuscular mycorrhizal fungi (AMF) increase growth and secondary metabolism in cucumber subjected to low temperature stress. Scientia Horticulturae, 2013, 160: 222-229. DOI:10.1016/j.scienta.2013.05.039 |
| [15] | Lopez-Raez JA, Charnikhova T, Fernandez I, Bouwmeester H, Pozo MJ. Arbuscular mycorrhizal symbiosis decreases strigolactone production in tomato. Journal of Plant Physiology, 2011, 168(3): 294-297. DOI:10.1016/j.jplph.2010.08.011 |
| [16] | Araim G, Saleem A, Arnason JT, Charest C. Root colonization by an arbuscular mycorrhizal (AM) fungus increases growth and secondary metabolism of purple coneflower, Echinacea purpurea (L.) Moench. Journal of Agricultural and Food Chemistry, 2009, 57(6): 2255-2258. DOI:10.1021/jf803173x |
| [17] | Toussaint JP, Smith FA, Smith SE. Arbuscular mycorrhizal fungi can induce the production of phytochemicals in sweet basil irrespective of phosphorus nutrition. Mycorrhiza, 2007, 17(4): 291-297. DOI:10.1007/s00572-006-0104-3 |
| [18] | Liu JY, Maldonado-Mendoza I, Lopez-Meyer M, Cheung F, To wn, C D, Harrison MJ. Arbuscular mycorrhizal symbiosis is accompanied by local and systemic alterations in gene expression and an increase in disease resistance in the shoots. Plant Journal, 2007, 50(3): 529-544. DOI:10.1111/j.1365-313X.2007.03069.x |
| [19] | Li JF, He XH, Li H, Wang MY. Arbuscular mycorrhizal fungi increase growth and phenolics synthesis in Poncirus trifoliata under iron deficiency. Scientia Horticulturae, 2015, 183: 87-92. DOI:10.1016/j.scienta.2014.12.015 |
| [20] | Zhang XW, Dong WT, Sun JH, Feng F, Deng YW, He ZH, Oldroyd GED, Wang ET. The receptor kinase CERK1 has dual functions in symbiosis and immunity signaling. Plant Journal, 2015, 81(2): 258-267. DOI:10.1111/tpj.2015.81.issue-2 |
| [21] | 李建福.缺铁胁迫下柑橘菌根共生体酚类物质及其关键基因研究.华侨大学硕士论文, 2015 |
| [22] | López-Ráez JA, Flors V, García JM, Pozo M.J. AM symbiosis alters phenolic acid content in tomato roots. Plant Signaling & Behavior, 2010, 5(9): 1138-1140. |
| [23] | Schaarschmidt S, Kopka J, Ludwig-Muller J, Hause B. Regulation of arbuscular mycorrhization by apoplastic invertses: a enhanced invertase activity in the leaf apoplast affects the symbiotic interaction. Plant Journal, 2007, 51(3): 390-405. DOI:10.1111/j.1365-313X.2007.03150.x |
| [24] | Akiyama K, Matsuzaki K, Hayashi H. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi. Nature, 2005, 435(7043): 824-827. DOI:10.1038/nature03608 |
| [25] | Tamasloukht M, Sejalon-Delmas N, Kluever A, Jauneau A, Roux C, Becard G. Root factors induce mitochondrial related gene expression and fungal respiration during the developmental switch from asymbiosis to presymbiosis in the arbuscular mycorrhizal fungus Gigaspora rosea. Plant Physiology, 2003, 131(3): 1468-1478. DOI:10.1104/pp.012898 |
| [26] | Cutler S R, Rodriguez PL, Finkelstein RR, Abrams SR. Abscisic acid: emergence of a core signaling network. Annual Review of Plant Biology, 2010, 61(1): 651-679. DOI:10.1146/annurev-arplant-042809-112122 |
| [27] | Charpentier M, Sun J, Wen JQ, Mysore KS, Oldroyd GED. Abscisic acid promotion of arbuscular mycorrhizal colonization requires a component of the PROTEIN PHOSPHATASE 2A complex. Plant Physiology, 2014, 166(4): 2077-2090. DOI:10.1104/pp.114.246371 |
| [28] | Chen MY, Liao JH, Li HR, Cai ZX, Guo ZJ, Wang ZS. Analysis of differentially expressed proteins in later developing stage fruitbody of Agaricus bisporus. Mycosystema, 2013, 32(5): 855-861. (in Chinese) 陈美元, 廖剑华, 李洪荣, 蔡志欣, 郭仲杰, 王泽生. 双孢蘑菇子实体发育后期差异表达蛋白质分析. 菌物学报, 2013, 32(5): 855-861. |
| [29] | Aharon S, Gelli A, Senedden WA, Blumwald E. Activation of a plant plasma membrane Ca2+ channel by TGα1, a heterotrimeric G protein α-subunit homologue. Febs Letters, 1998, 424(1-2): 17-21. DOI:10.1016/S0014-5793(98)00129-X |
| [30] | Millner PA, Groarke DA, White IR. Synthetic peptides as probes of plant cell signaling. Plant Growth Regulation, 1996, 18(1-2): 143-147. DOI:10.1007/BF00028499 |
| [31] | Liu SS, Chen J, Li SC, Zeng X, Meng ZX, Guo SX. Comparative transcriptome analysis of genes involved in GA-GID1-DELLA regulatory module in symbiotic and asymbiotic seed germination of Anoectochilus roxburghii (Wall.) Lindl. (Orchidaceae). International Journal of Molecular Sciences, 2015, 16(12): 30190-30203. DOI:10.3390/ijms161226224 |
| [32] | Gallou A, Declerck S, Cranenbrouck S. Transcriptional regulation of defence genes and involvement of the WRKY transcription factor in arbuscular mycorrhizal potato root colonization. Functional & Integrative Genomics, 2011, 12(1): 183-198. |
| [33] | Wang W, Zhao P, Zhou XM, Xiong HX, Sun MX. Genome-wide identification and characterization of cystatin family genes in rice (Oryzasativa L.). Plant Cell Reports, 2015, 34(9): 1579-1592. DOI:10.1007/s00299-015-1810-0 |
| [34] | Song FQ, Kong XS, Li JZ, Chang W. Screening the related genes in the AM fungi and Amorpha fruticosa symbiosis with the suppression subtractive hybridization technique. Scientia Silvae Sinicae, 2014, 50(11): 64-74. (in Chinese) 宋福强, 孔祥仕, 李季泽, 常伟. 基于抑制消减杂交技术筛选AM真菌与紫穗槐共生相关基因. 林业科学, 2014, 50(11): 64-74. |
| [35] | Yatzkan E, Szoor B, Feher Z, Dombradi V, Yarden O. Protein phosphatase 2A is involved in hyphal growth of Neurospora crassa. Molecular & general genetics: MGG, 1998, 259(5): 523-531. |
| [36] | Kosmidou E, Lunness P, Doonan JH. A type 2A protein phosphatase gene from Aspergillus nidulans is involved in hyphal morphogenesis. Current Genetics, 2001, 39(1): 25-34. |
| [37] | Du Y, Shi Y, Yang J, Chen XL, Xue MF, Zhou W, Peng YL. A serine/threonine-protein phosphatase PP2A catalytic subunit is essential for asexual development and plant infection in Magnaporthe oryzae. Current Genetics, 2013, 59(1): 33-41. |
| [38] | Hildmann T, Ebneth M, Pe?acortés H, Sánchez-Serrano JJ, Willmitzer L, Prat S. General roles of abscisic and jasmonic acids in gene activation as a result of mechanical wounding. Plant Cell, 1992, 4(9): 1157-1170. |
| [39] | Chen HJ, Su CT, Lin CH, Huang GJ, Lin YH. Expression of sweet potato cysteine protease SPCP2 altered developmental characteristics and stress responses in transgenic Arabidopsis plants. Journal of Plant Physiology, 2010, 167(10): 838-847. DOI:10.1016/j.jplph.2010.01.005 |
| [40] | Ma YY, Zhang J, Chen J, Zhang LY, Zhu SP, Yan ST, Zhong GY. Isolation, subcellular localization and expression analysis of a citrus cysteine protease gene, CsCysP. Acta Horticulturae Sinica, 2014, 41(4): 621-630. (in Chinese) 马岩岩, 张军, 陈娇, 张凌云, 朱世平, 闫树堂, 钟广炎. 柑橘半胱氨酸蛋白酶基因CsCysP的分离、亚细胞定位及表达分析. 园艺学报, 2014, 41(4): 621-630. |
