陈鹏1,2, 包希艳1, 董战旗1, 康涛涛1, 朱艳1, 潘敏慧1,2, 鲁成1,2


1. 西南大学家蚕基因组生物学国家重点实验室, 重庆 400715;
2. 西南大学农业部蚕桑生物学与遗传育种重点实验室, 重庆 400715
收稿日期:2018-08-29;修回日期:2018-11-29;网络出版日期:2019-02-18
基金项目:国家自然科学基金(31602009,31572466);中央高校基本科研业务费(SWU116066);现代农业产业技术体系(CARS-18)
*通信作者:鲁成, Tel:+86-23-68251812, E-mail:lucheng@swu.edu.cn.
摘要:[目的] 热休克应答(heat shock response,HSR)是机体细胞应对环境压力的一种重要防御策略,鉴定热休克蛋白在杆状病毒侵染宿主过程中的功能,并揭示其作用的分子机制,为探明宿主与病毒相互作用的分子基础提供理论依据。[方法] 通过分子克隆技术对Bmhsc70-4基因进行克隆,并利用BioEdit及GeneDoc对其进行多序列比对分析;分别通过真核表达和基于CRISPR/Cas9的基因编辑系统对Bmhsc70-4基因进行过表达和敲除;利用荧光定量PCR技术检测相应基因的表达量;通过对Caspase-9和Caspase-3/7活性的检测确定Bmhsc70-4基因对细胞凋亡的影响;通过免疫荧光验证BmHSC70-4和BmIAP的共定位情况,并进一步通过免疫共沉淀验证它们的相互作用。[结果] Bmhsc70-4基因开放阅读框为1950 bp,编码649个氨基酸,在昆虫间具有较高的保守性;BmNPV能够诱导Bmhsc70-4基因上调表达,过表达Bmhsc70-4基因能够促进BmNPV的增殖,敲除Bmhsc70-4基因能够抑制BmNPV的增殖,表明Bmhsc70-4基因的表达利于BmNPV的增殖;Bmhsc70-4基因具有抑制家蚕细胞凋亡的功能;荧光共定位显示BmHSC70-4和BmIAP共定位于细胞质中,免疫共沉淀结果表明两者可以相互作用;BmNPV侵染过程中Bmhsc70-4基因能够促进Bmiap基因的表达。[结论] Bmhsc70-4基因具有抑制家蚕细胞凋亡的功能,在BmNPV侵染家蚕细胞过程中,能够与BmIAP相互作用,并促进BmNPV复制增殖。
关键词:家蚕BmNPV热休克应答细胞凋亡Bmhsc70-4Bmiap
Gene Hsc70-4 promotes the replication and proliferation of Bombyx mori nucleopolyhedrovirus
Peng Chen1,2, Xiyan Bao1, Zhanqi Dong1, Taotao Kang1, Yan Zhu1, Minhui Pan1,2, Cheng Lu1,2


1. State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400715, China;
2. Key Laboratory of Sericultural Biology and Genetic Breeding, Ministry of Agriculture, Southwest University, Chongqing 400715, China
*Corresponding author: Lu Cheng, Tel: +86-23-68251812; E-mail:lucheng@swu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31602009, 31572466), by the Fundamental Research Funds for the Central Universities (SWU116066) and by the China Agriculture Research System (CARS-18)
Abstract: [Objective] Heat shock response is an important cellular defense strategy to environmental stresses. Identification of the function of heat shock protein in the process of baculovirus infection and revealing the molecular mechanism of its role will provide a theoretical basis for understanding the molecular basis of host-virus interaction. [Methods] Bmhsc70-4 gene was cloned by molecular cloning, and multiple sequence alignment was performed with BioEdit and GeneDoc. The Bmhsc70-4 gene was overexpressed by eukaryotic expression and knocked out by CRISPR/Cas9 gene editing system. The expression of the corresponding genes was detected by quantitative real-time PCR. The effect of Bmhsc70-4 gene on apoptosis was determined by detecting the activity of Caspase-9 and Caspase-3/7. The co-localization of BmHSC70-4 and BmIAP was verified by immunofluorescence, and their interaction was further verified by immunoprecipitation. [Results] The open reading frame of Bmhsc70-4 gene was 1950 bp, encoding 649 amino acids and it was highly conserved among insects. Bmhsc70-4 gene was up-regulated during BmNPV infection. Overexpression of Bmhsc70-4 gene could promote the proliferation of BmNPV, and knockout of Bmhsc70-4 gene inhibited the proliferation of BmNPV, indicating that the expression of Bmhsc70-4 gene was conducive to the proliferation of BmNPV. We confirmed that Bmhsc70-4 gene can inhibit the apoptosis of silkworm cells. Immunofluorescence assay showed that BmHSC70-4 and BmIAP were co-localized in the cytoplasm and immunocoprecipitation showed that they could interact with each other. Bmhsc70-4 gene could promote the expression of Bmiap gene during BmNPV infection. [Conclusion] Bmhsc70-4 gene had the function of inhibiting apoptosis of silkworm cells, and it could interact with BmIAP and promote BmNPV replication and proliferation during the process of BmNPV infecting silkworm cells.
Keywords: Bombyx moriBmNPVheat shock responseapoptosisBmhsc70-4Bmiap
杆状病毒(baculovirus)是一类双链环状DNA (80-180 kb)病毒,专门寄生于无脊椎动物,其宿主主要是鳞翅目(Lepidoptera)、双翅目(Diptera)和膜翅目(Hymenoptera)昆虫[1-2]。对于一个有效的感染过程而言,杆状病毒需要挟持并利用宿主细胞的多种结构及分子通路,如细胞凋亡、DNA损伤应答等[3-4]。研究表明,在宿主与病毒的长期“斗争”中,宿主同样能够通过一系列的免疫反应来阻滞病毒的复制增殖,如热休克应答、细胞凋亡等[5-6]。尽管目前对病毒与宿主的相互作用研究已经取得了丰硕的成果[7-8],然而相对于对病毒的了解来说,对宿主在感染病毒后的应答机制的理解仍很匮乏。
家蚕(Bombyx mori)是重要的经济昆虫,而蚕病的危害一直是制约蚕业发展的重要因素,其中尤以家蚕血液型脓病为主。作为家蚕重大病害脓病的病原,家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)属于杆状病毒的一种,长期受到研究者们的关注,且对杆状病毒的研究亦发端于家蚕脓病。随着研究的逐渐深入,已经获得了一些与BmNPV侵染相关的宿主基因,如脂肪酶(Bmlipase-1)、丝氨酸蛋白酶(serine protease)、caspase-1、BmREEPa、BmAtlastin-n等[9-12]。近期我们还发现,杆状病毒可以通过LEF-11劫持宿主的ATP酶ATAD3A以促进自身的复制增殖[13]。尽管作为参与免疫应答过程的热休克蛋白(heat shock protein,HSP)被报道参与了BmNPV侵染家蚕细胞的过程[14],然而对于功能强大的热休克蛋白来说,对其具体作用机制的解析是很必要的。先前的研究表明草地贪夜蛾(Spodoptera frugiperda)的热休克蛋白hsc70基因(Heat shock cognate 70)在苜蓿银纹夜蛾核型多角体病毒(Autographa californica multicapsid nucleopolyhedrovirus, AcMNPV)感染后表达量会上调[15-16],家蚕hsc70基因的表达在感染BmNPV后也会增强[14],说明hsc70基因可能参与了NPV感染宿主的过程。同时,最近有研究表明家蚕hsc70-4基因(Heat shock cognate 70-4)也参与了BmNPV的侵染过程[17],但其作用机制并不清楚。
本研究以家蚕热休克蛋白HSC70-4为研究对象,探究其在BmNPV侵染家蚕细胞过程中的功能及调控机制,可望为探明宿主与病毒相互作用的分子基础提供一定的理论依据。
1 材料和方法 1.1 材料 家蚕卵巢细胞系(BmN-SWU1)和重组BmNPV病毒(v39Kprm-EGFP)均由本实验室构建和保存。
1.2 基因序列分析 使用NCBI(National Center for Biotechnology Information)在线BLAST程序比对,并从数据库中下载相应的蛋白质序列。利用BioEdit软件进行多序列比对,并将结果通过GeneDoc软件输出。
1.3 细胞培养和转染 在27 ℃条件下,用含10% (V/V)胎牛血清的TC-100昆虫培养基恒温培养家蚕卵巢细胞系BmN-SWU1。细胞转染试剂为tremeGENE HP DNA Transfection Reagent(Roche),细胞转染操作按说明书进行。
1.4 载体构建 依据已知的序列信息设计目的基因的相应引物,其中用于构建过表达载体的引物添加相应标签序列(表 1)。pIZ/V5-His载体用于构建基因过表达质粒,本小组前期构建的CRISPR/Cas9转基因敲除载体[18]用于构建基因敲除质粒。
表 1. 本试验所用引物 Table 1. Primers used in this study
| Primer names | Primer sequences (5′→3′) |
| pIZ/V5-HA-Bmhsc70-4-F | CCGCTCGAGATGTACCCATACGATGTTCCAGATTACGCTGCAAAAGCACCCGC |
| pIZ/V5-HA-Bmhsc70-4-R | CTAGTCTAGATTAAGCGTAATCTGGAACATCGTATGGGTAATCGACCTCCTCGATGGT |
| pIZ/V5-Flag-Bmiap-F | CGCGGATCCATGGACTACAAAGACGATGACGACAAGGAGTTGACGAAAGTTGCTA |
| pIZ/V5-Flag-Bmiap-R | CCGCTCGAGTCACTTGTCGTCATCGTCTTTGTAGTCCGAGAAGTAGAGCCGCACCGCA |
| Knockdown-Bmhsc70-4-F | AAGTGAAACTGCCGAAGCTTATCT |
| Knockdown-Bmhsc70-4-R | AAACAGATAAGCTTCGGCAGTTTC |
| Bmiap-qRT-PCR-F | CCTTAGTGACTCCTGCTTTACGAA |
| Bmiap-qRT-PCR-R | TAGAAACTTGCAAATGGCTTGTG |
| Bmhsc70-4-qRT-PCR-F | GGCTTACGAAAATGAAGGAAACT |
| Bmhsc70-4-qRT-PCR-R | GCATCTTTTGTGGCTTGTCTTT |
| vp39-qRT-PCR-F | CTAATGCCCGTGGGTATGG |
| vp39-qRT-PCR-R | TTGATGAGGTGGCTGTTGC |
| sw22934-qRT-PCR-F | TTCGTACTGGCTCTTCTCGT |
| sw22934-qRT-PCR-R | CAAAGTTGATAGCAATTCCCT |
表选项
1.5 紫外诱导细胞凋亡 将转染目的质粒的细胞培养48 h后,吸除培养基,在紫外灯(8 W)下15 cm处照射4 min,添加培养基,继续培养24 h,用于后续分析。
1.6 Caspase活性检测 Caspase活性检测利用Caspase-Glo9和Caspase-Glo3/7试剂盒(Promega)进行,每孔加100 μL Caspase-Glo9或3/7工作液,每个样品重复3次,37 ℃避光孵育1 h,然后使用多荧光酶标仪检测Caspase-9和3/7的活性。
1.7 免疫荧光检测 在室温条件下用PBS轻洗目标细胞2次(5 min/次),然后添加4%多聚甲醛静置固定15 min;用PBST同上轻洗5次(6 min/次);用0.1% TritonX-100孵育10 min;用PBST轻洗(同上)后,加入封闭液(10%羊血清加3% BSA)于37 ℃封闭1 h;加入1:500稀释的一抗(HA抗体或FLAG抗体,Sigma)于37 ℃恒温孵育1 h;用PBST轻摇清洗5次(6 min/次);加入1:1000稀释的二抗(碧云天)于37 ℃恒温孵育1 h;加入DAPI染色液(碧云天)于室温染色10 min;用PBST轻洗5次(6 min/次);将细胞爬片挑起,把细胞面铺在载玻片的甘油上并封片,在共聚焦显微镜(Olympus)下观察。
1.8 免疫共沉淀及Western blotting 取共转目的质粒48 h后的细胞,将培养基倒掉,用PBS清洗2遍;加入1 mL IP裂解液置于冰上裂解3-5 min;将裂解中的细胞转移至1.5 mL的离心管(预冷)中裂解30 min;4 ℃冷冻离心15 min,14000×g;将上清分为3份:(1)取80 μL作为总蛋白样品,加入20 μL 5×SDS-PAGE蛋白上样缓冲液沸水浴10 min,(2)取400 μL,加入3 μL小鼠IgG作为对照,(3)剩余上清加入3 μL FLAG鼠抗作为实验组,冰浴孵育过夜;取70 μL protein (A+G)用1 mL IP裂解液洗1次,4 ℃离心5 min,3000×g;将对照组及实验组样品分别加到对应的protein (A+G)中,冰浴孵育3-5 h;用IP裂解液清洗3次(500 μL/次),于4 ℃离心5 min,3000×g,弃废液;在样品中加入40 μL的IP裂解液和10 μL的蛋白上样缓冲液,沸水浴10 min,用于下一步分析。
将蛋白样品加到样品孔中并进行SDS-PAGE,浓缩胶和分离胶的浓度分别为5%和12%;电泳结束后进行转膜,恒流200 mA,根据蛋白分子量确定转膜时间;然后,将PVDF膜放到蛋白封闭液中,室温孵育3 h;把PVDF膜放到相应比例的一抗稀释液中,4 ℃孵育过夜;室温,用1×TBST缓冲液轻洗4-5次(8-10 min/次),把PVDF膜放入相应比例的二抗稀释液中,孵育1 h;重复上步清洗步骤,加入ECL显色液进行显色成像。
1.9 荧光定量PCR (qRT-PCR) 本研究所用试剂为iTaqTM Universal SYBR? Green Supermix(Bio-Rad),按说明书进行操作。qRT-PCR反应程序如下:95 ℃ 4 min;95 ℃ 15 s,60 ℃ 31 s,40个循环;溶解曲线反应条件为95 ℃ 15 s;60 ℃ 20 s;95 ℃ 15 s。将家蚕真核翻译起始因子4A (家蚕芯片探针号:sw22934)作为内参基因,引物信息见表 1。
2 结果和分析 2.1 Bmhsc70-4基因序列分析 通过基因克隆获得了Bmhsc70-4基因的cDNA序列,其开放阅读框(open reading frame,ORF)为1950 bp,共编码649个氨基酸,预测其蛋白分子量约为71 kDa。分别利用家蚕、黑腹果蝇(Drosophila melanogaster)、斜纹夜蛾(Spodoptera litura)和蜜蜂(Apis mellifera)的HSC70-4同源蛋白序列进行比对分析,结果显示Bmhsc70-4基因在昆虫中具有较高的保守性(图 1)。
 |
| 图 1 不同昆虫间HSC70-4蛋白序列的比对 Figure 1 Multiple sequence alignment of HSC70-4 proteins among different insects. Bm: Bombyx mori (NP_001036892.1); Dm: Drosophila melanogaster (AGB95967.1); Sl: Spodoptera litura (ADK55518.1); Am: Apis mellifera (XP_001650298.2). |
| 图选项 |
2.2 Bmhsc70-4基因对BmNPV增殖的影响 为了探究Bmhsc70-4基因与BmNPV增殖之间的关系,我们首先对BmNPV侵染家蚕BmN-SWU1细胞后Bmhsc70-4基因的表达特征进行分析。结果显示,随着BmNPV的增殖,Bmhsc70-4基因的表达量逐渐升高(图 2-A)。为进一步探究Bmhsc70-4基因在BmNPV增殖过程中的功能,我们利用BmNPV侵染分别过表达或敲除Bmhsc70-4基因(图 2-B)后的BmN-SWU1细胞,并对杆状病毒Vp39基因的表达情况进行检测。结果显示过表达Bmhsc70-4基因能够导致Vp39基因上调表达,敲除Bmhsc70-4基因后,能够使Vp39基因下调表达(图 2-C、2-D),表明Bmhsc70-4基因能够促进BmNPV的增殖。
 |
| 图 2 Bmhsc70-4基因对BmNPV增殖的影响 Figure 2 Effect of Bmhsc70-4 gene on BmNPV proliferation. Statistically significant differences: ** P < 0.01. A: Expression analysis of Bmhsc70-4 gene during BmNPV infection. B: DNA sequencing analysis of the CRISPR/Cas9 target sites. WT: wild-type; M: mutation. C: Effect of overexpression of Bmhsc70-4 gene on BmNPV proliferation. D: Effect of knockdown of Bmhsc70-4 gene on BmNPV proliferation. |
| 图选项 |
2.3 Bmhsc70-4基因对家蚕细胞凋亡的影响 细胞凋亡是昆虫重要的先天免疫应答反应,研究表明热休克蛋白参与了细胞凋亡的调控[19-20]。为了验证Bmhsc70-4基因在家蚕细胞中的凋亡功能,分别在BmN-SWU1细胞中过表达或敲除Bmhsc70-4基因后,对Caspase-9和Caspase-3/7的活性进行了检测。结果表明,过表达Bmhsc70-4基因后,经紫外线诱导BmN-SWU1细胞,发现Caspase-9和Caspase-3/7的活性与对照相比均显著降低;敲除Bmhsc70-4基因后Caspase-9和Caspase-3/7的活性均显著升高(图 3),说明Bmhsc70-4基因在家蚕细胞中具有抗凋亡功能。
 |
| 图 3 过表达和敲除Bmhsc70-4基因对Caspase活性的影响 Figure 3 Effects of overexpression and knockdown of Bmhsc70-4 gene on caspase activity. Statistically significant differences: ** P < 0.01. A: Effect of overexpression of Bmhsc70-4 gene on caspase-9 activity. B: Effect of overexpression of Bmhsc70-4 gene on caspase-3/7 activity. C: Effect of knockdown of Bmhsc70-4 gene on caspase-9 activity. D: Effect of knockdown of Bmhsc70-4 gene on caspase-3/7 activity. |
| 图选项 |
2.4 BmHSC70-4和BmIAP蛋白的相互作用鉴定 研究表明家蚕凋亡抑制基因(Bombyx mori inhibitor apoptosis, Bmiap)在家蚕细胞中具有明确的抗凋亡作用[21],为了验证其与BmHSC70-4抗凋亡作用之间的关系,成功构建并获得了Bmhsc70-4基因(融合HA标签)和Bmiap基因(融合FLAG标签)的过表达质粒,进而转染家蚕细胞BmN-SWU1,感染BmNPV 48 h后进行免疫荧光分析。荧光共定位结果显示BmHSC70-4蛋白能够与BmIAP蛋白共定位于细胞质中(图 4-A)。为了进一步明确BmHSC70-4蛋白和BmIAP蛋白之间的关系,我们将以上两个过表达质粒共转BmN-SWU1细胞,并于感染BmNPV 48 h后进行免疫共沉淀实验。结果显示用HA和FLAG抗体都能够检测到相应蛋白条带(图 4-B),表明BmHSC70-4和BmIAP之间存在相互作用。
 |
| 图 4 免疫荧光和免疫共沉淀分析BmHSC70-4和BmIAP的相互作用 Figure 4 Immunofluorescence (A) and co-immunoprecipitation (B) analysis of the interaction between BmHSC70-4 and BmIAP. |
| 图选项 |
2.5 Bmhsc70-4基因对Bmiap基因的调控分析 为了进一步分析在BmNPV侵染家蚕细胞的过程中Bmhsc70-4基因对Bmiap基因的调控作用,分别在BmN-SWU1细胞中过表达或敲除Bmhsc70-4基因,然后检测Bmiap基因的表达情况。结果显示,在没有BmNPV侵染的情况下,无论是过表达还是敲除Bmhsc70-4基因,对Bmiap基因的表达均没有显著影响(图 5-A、5-B);而在BmNPV侵染的条件下,过表达Bmhsc70-4基因后,Bmiap基因显著上调表达(图 5-A),而敲除Bmhsc70-4基因后,Bmiap基因的表达显著下调(图 5-B),表明在BmNPV侵染过程中Bmhsc70-4基因能够促进Bmiap基因的表达。
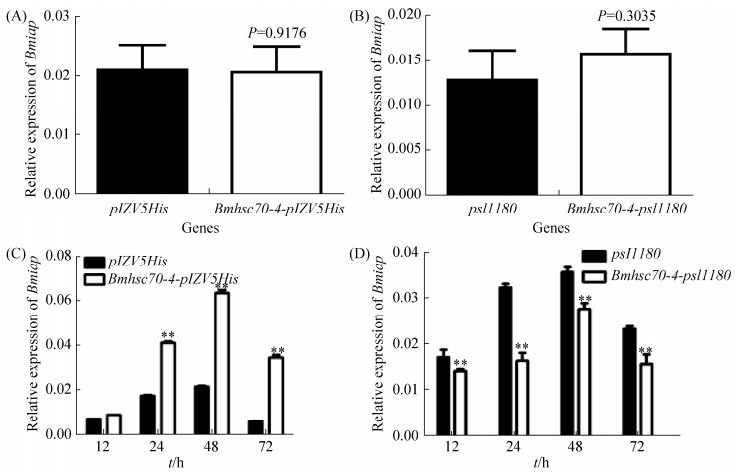 |
| 图 5 Bmiap基因的相对表达量分析 Figure 5 Analysis of the relative expression profiles of Bmiap gene. Statistically significant differences: **P < 0.01. A: Effect of overexpression of Bmhsc70-4 on Bmiap gene expression without BmNPV infection. B: Effect of knockdown of Bmhsc70-4 on Bmiap gene expression without BmNPV infection. C: Effect of overexpression of Bmhsc70-4 on Bmiap gene expression with BmNPV infection. D: Effect of knockdown of Bmhsc70-4 on Bmiap gene expression with BmNPV infection. |
| 图选项 |
3 讨论 杆状病毒与宿主相互作用的分子机制研究具有重要的科学意义和应用价值,尤其是对害虫的防治及经济昆虫抗病毒品种的培育。热休克应答(heat shock response,HSR)作为一种标志性的机体细胞应对环境压力的防御策略,可以有效维持蛋白质稳态[22]。在杆状病毒侵染宿主细胞时,会诱导热休克蛋白的高量表达,然而这种来自于宿主的应激反应是利于宿主细胞对病毒入侵的抑制,还是利于病毒本身的增殖,仍需要深入的研究。
本研究中我们以家蚕的热休克蛋白HSC70-4为研究对象,发现家蚕BmN-SWU1细胞感染BmNPV后,表达量显著升高,表明BmNPV能够诱导Bmhsc70-4基因的表达。同时,当我们过表达Bmhsc70-4基因后,能够促进BmNPV的增殖,而敲除Bmhsc70-4基因则会抑制BmNPV的增殖,表明Bmhsc70-4基因的表达利于BmNPV增殖,Bmhsc70-4参与的应激反应可能已被病毒利用。我们的结果进一步证实了病毒可能把热休克应答作为一种感染宿主细胞的重要策略[23]。
同热休克应答一样,细胞凋亡也可以被认为是宿主细胞受到病毒侵染后的一种应激反应,而研究表明热休克蛋白参与了细胞凋亡过程[20]。本研究中我们的结果显示敲除Bmhsc70-4能够诱导家蚕细胞发生凋亡,而过表达Bmhsc70-4基因能够抑制紫外诱导的细胞凋亡,表明Bmhsc70-4基因具有抑制细胞凋亡的作用。该结果与Kong等发现的热应激蛋白家族成员Hsp70能够抑制H2O2诱导的细胞凋亡一致[24]。Didelot等发现HSP90β能够与c-IAP1结合以防止c-IAP1的自身泛素化和降解[25],Zhang等发现HSP72能够通过与XIAP的结合抑制细胞凋亡[26]。为探究Bmhsc70-4基因抑制细胞凋亡的机制,我们检测了其与凋亡抑制基因Bmiap之间的关系。结果显示BmHSC70-4能够与BmIAP结合,且Bmhsc70-4基因对Bmiap基因的表达具有促进作用。我们推测在BmNPV增殖复制过程中,BmHSC70-4蛋白可以通过与BmIAP蛋白结合使其不被泛素化降解,进而抑制宿主细胞发生凋亡,为BmNPV的复制增殖提供条件。同时,我们还发现BmHSC70-4和BmIAP能够共定位于细胞质中,我们推测BmHSC70-4在细胞质中翻译为蛋白,进而调控宿主细胞线粒体凋亡通路或者和杆状病毒表达蛋白直接相互作用,从而促进病毒增殖复制,但BmHSC70-4是如何被BmNPV利用的仍需进一步研究。
References
| [1] | van Oers MM, Vlak JM. Baculovirus genomics. Current Drug Targets, 2007, 8(10): 1051-1068. DOI:10.2174/138945007782151333 |
| [2] | Rohrmann GF. Baculovirus Molecular Biology. 3rd edition. Bethesda (MD): National Center for Biotechnology Information (US), 2013. |
| [3] | Clem RJ. Baculoviruses and apoptosis: a diversity of genes and responses. Current Drug Targets, 2007, 8(10): 1069-1074. DOI:10.2174/138945007782151405 |
| [4] | Huang N, Wu W, Yang K, Passarelli AL, Rohrmann GF, Clem RJ. Baculovirus infection induces a DNA damage response that is required for efficient viral replication. Journal of Virology, 2011, 85(23): 12547-12556. DOI:10.1128/JVI.05766-11 |
| [5] | Salem TZ, Zhang FR, Xie Y, Thiem SM. Comprehensive analysis of host gene expression in Autographa californica nucleopolyhedrovirus-infected Spodoptera frugiperda cells. Virology, 2011, 412(1): 167-178. DOI:10.1016/j.virol.2011.01.006 |
| [6] | Xue J, Qiao N, Zhang W, Cheng RL, Zhang XQ, Bao YY, Xu YP, Gu LZ, Han JD, Zhang CX. Dynamic interactions between Bombyx mori nucleopolyhedrovirus and its host cells revealed by transcriptome analysis. Journal of Virology, 2012, 86(13): 7345-7359. DOI:10.1128/JVI.07217-12 |
| [7] | Ramage H, Cherry S. Virus-host interactions: From unbiased genetic screens to function. Annual Review of Virology, 2015, 2(1): 497-524. DOI:10.1146/annurev-virology-100114-055238 |
| [8] | Nguyen Q, Nielsen LK, Reid S. Genome scale transcriptomics of baculovirus-insect interactions. Viruses, 2013, 5(11): 2721-2747. DOI:10.3390/v5112721 |
| [9] | Ponnuvel KM, Nakazawa H, Furukawa S, Asaoka A, Ishibashi J, Tanaka H, Yamakawa M. A lipase isolated from the silkworm Bombyx mori shows antiviral activity against nucleopolyhedrovirus. Journal of Virology, 2003, 77(19): 10725-10729. DOI:10.1128/JVI.77.19.10725-10729.2003 |
| [10] | Qin L, Xia H, Shi H, Zhou Y, Chen L, Yao Q, Liu X, Feng F, Yuan Y, Chen K. Comparative proteomic analysis reveals that caspase-1 and serine protease may be involved in silkworm resistance to Bombyx mori nuclear polyhedrosis virus. Journal of Proteomics, 2012, 75(12): 3630-3638. DOI:10.1016/j.jprot.2012.04.015 |
| [11] | Dong XL, Liu TH, Wang W, Pan CX, Wu YF, Du GY, Chen P, Lu C, Pan MH. BmREEPa is a novel gene that facilitates BmNPV entry into silkworm cells. PLoS One, 2015, 10(12): e0144575. DOI:10.1371/journal.pone.0144575 |
| [12] | Liu TH, Dong XL, Pan CX, Du GY, Wu YF, Yang JG, Chen P, Lu C, Pan MH. A newly discovered member of the Atlastin family, BmAtlastin-n, has an antiviral effect against BmNPV in Bombyx mori. Scientific Reports, 2016, 6: 28946. DOI:10.1038/srep28946 |
| [13] | Dong ZQ, Hu N, Dong FF, Chen TT, Jiang YM, Chen P, Lu C, Pan MH. Baculovirus LEF-11 hijack host ATPase ATAD3A to promote virus multiplication in Bombyx mori cells. Scientific Reports, 2017, 7: 46187. DOI:10.1038/srep46187 |
| [14] | Sagisaka A, Fujita K, Nakamura Y, Ishibashi J, Noda H, Imanishi S, Mita K, Yamakawa M, Tanaka H. Genome-wide analysis of host gene expression in the silkworm cells infected with Bombyx mori nucleopolyhedrovirus. Virus Research, 2010, 147(2): 166-175. DOI:10.1016/j.virusres.2009.10.015 |
| [15] | Nobiron I, O'Reilly DR, Olszewski JA. Autographa californica nucleopolyhedrovirus infection of Spodoptera frugiperda cells: a global analysis of host gene regulation during infection, using a differential display approach. The Journal of General Virology, 2003, 84(Pt 11): 3029-3039. |
| [16] | Lyupina YV, Zatsepina OG, Timokhova AV, Orlova OV, Kostyuchenko MV, Beljelarskaya SN, Evgen'ev MB, Mikhailov VS. New insights into the induction of the heat shock proteins in baculovirus infected insect cells. Virology, 2011, 421(1): 34-41. DOI:10.1016/j.virol.2011.09.010 |
| [17] | Iwanaga M, Shibano Y, Ohsawa T, Fujita T, Katsuma S, Kawasaki H. Involvement of HSC70-4 and other inducible HSPs in Bombyx mori nucleopolyhedrovirus infection. Virus Research, 2014, 179: 113-118. DOI:10.1016/j.virusres.2013.10.028 |
| [18] | Dong ZQ, Chen TT, Zhang J, Hu N, Cao MY, Dong FF, Jiang YM, Chen P, Lu C, Pan MH. Establishment of a highly efficient virus-inducible CRISPR/Cas9 system in insect cells. Antiviral Research, 2016, 130: 50-57. DOI:10.1016/j.antiviral.2016.03.009 |
| [19] | Everett H, McFadden G. Apoptosis: an innate immune response to virus infection. Trends Microbiology, 1999, 7(4): 160-165. DOI:10.1016/S0966-842X(99)01487-0 |
| [20] | Kennedy D, J?ger R, Mosser DD, Samali A. Regulation of apoptosis by heat shock proteins. IUBMB Life, 2014, 66(5): 327-338. DOI:10.1002/iub.v66.5 |
| [21] | Hamajima R, Iwamoto A, Tomizaki M, Suganuma I, Kitaguchi K, Kobayashi M, Yamada H, Ikeda M. Functional analysis of inhibitor of apoptosis 1 of the silkworm Bombyx mori. Insect Biochemistry and Molecular Biology, 2016, 79: 97-107. DOI:10.1016/j.ibmb.2016.10.012 |
| [22] | Fujimoto M, Nakai A. The heat shock factor family and adaptation to proteotoxic stress. The FEBS Journal, 2010, 277(20): 4112-4125. DOI:10.1111/j.1742-4658.2010.07827.x |
| [23] | Monteiro F, Carinhas N, Carrondo MJ, Bernal V, Alves PM. Toward system-level understanding of baculovirus-host cell interactions: from molecular fundamental studies to large-scale proteomics approaches. Frontiers in Microbiology, 2012, 3: 391. |
| [24] | Kong F, Wang H, Guo J, Peng M, Ji H, Yang H, Liu B, Wang J, Zhang X, Li S. Hsp70 suppresses apoptosis of BRL cells by regulating the expression of Bcl-2, cytochrome C, and caspase 8/3. In Vitro Cellular & Developmental Biology. Animal, 2016, 52(5): 568-575. |
| [25] | Didelot C, Lanneau D, Brunet M, Bouchot A, Cartier J, Jacquel A, Ducoroy P, Cathelin S, Decologne N, Chiosis G, Dubrez-Daloz L, Solary E, Garrido C. Interaction of heat-shock protein 90β isoform (HSP90β) with cellular inhibitor of apoptosis 1 (c-IAP1) is required for cell differentiation. Cell Death and Differentiation, 2008, 15(5): 859-866. DOI:10.1038/cdd.2008.5 |
| [26] | Zhang B, Rong R, Li H, Peng X, Xiong L, Wang Y, Yu X, Mao H. Heat shock protein 72 suppresses apoptosis by increasing the stability of X-linked inhibitor of apoptosis protein in renal ischemia/reperfusion injury. Molecular Medicine Reports, 2015, 11(3): 1793-1799. DOI:10.3892/mmr.2014.2939 |
