张浩1, 滑紫微1, 牛秋红1, 惠丰立1, 董维亮2, 周杰2, 陈兆进3, 李娜1


1. 南阳师范学院生命科学与技术学院, 河南 南阳 473061;
2. 南京工业大学生物与制药工程学院, 江苏 南京 211816;
3. 南阳师范学院农业工程学院, 河南南阳 473061
收稿日期:2019-12-06;修回日期:2020-02-05;网络出版日期:2020-06-17
基金项目:河南省能源微生物资源可持续利用创新型科技团队;河南省高等学校重点科研项目(20A180020);南阳师范学院高层次人才科研启动费资助项目(2019ZX015,2019ZX013)
*通信作者:李娜,Tel/Fax:+86-377-63513726;E-mail:382052070@qq.com.
摘要:[目的] 分离并鉴定精噁唑禾草灵高效降解菌株,为开发高效降解菌剂,强化精噁唑禾草灵原位修复,保证黄瓜产品安全提供菌株资源和理论依据。[方法] 利用富集培养的方法分离降解菌株,并通过形态学、生理生化特征和16S rRNA基因进化分析进行鉴定;HPLC/MS鉴定菌株降解精噁唑禾草灵的中间产物,采用鸟枪法建库克隆降解过程中关键的水解酶基因,并进行异源表达,利用Michaelis-Menten双倒数曲线图测定酶动力学参数;通过正交试验确定菌株液态发酵参数,并通过对黄瓜灌根接种的方式,研究降解菌株对黄瓜根际土壤中精噁唑禾草灵的降解以及甘露醇对降解效率的强化作用。[结果] Rhodococcus sp.DSB-1在24 h内能将100 mg/L精噁唑禾草灵完全转化为精噁唑禾草灵酸,降解最适温度和pH分别为30℃和8.0。克隆得到一个精噁唑禾草灵水解酶基因,命名为pepE。水解酶PepE对精噁唑禾草灵的Km为28.2 μmol/L,kcat/Km为11.0 L/(μmol·s)。在发酵温度30℃、通气量1:0.4、搅拌速度200 r/min、培养时间48 h条件下,液态发酵所得菌剂对精噁唑禾草灵的降解效率最高。投加至黄瓜根际的菌株DSB-1可以在黄瓜根系定殖,12 d内完全降解黄瓜根际环境中10 mg/kg的精噁唑禾草灵。此外还发现添加甘露醇可强化菌株的修复能力,降解效率相对于未添加的处理提高14.8%。[结论] 菌株DSB-1具有原位修复精噁唑禾草灵污染土壤的潜力。
关键词:精噁唑禾草灵微生物降解水解酶基因pepE定殖强化修复
Isolation, identification and application of a fenoxaprop ethyl-degrading strain Rhodococcus sp. DSB-1
Hao Zhang1, Ziwei Hua1, Qiuhong Niu1, Fengli Hui1, Weiliang Dong2, Jie Zhou2, Zhaojin Chen3, Na Li1


1. School of Life Science and Technology, Nanyang Normal University, Nanyang 473061, Henan Province, China;
2. College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816, Jiangsu Province, China;
3. School of Agricultural Engineering, Nanyang Normal University, Nanyang 473061, Henan Province, China
Received: 6 December 2019; Revised: 5 February 2020; Published online: 17 June 2020
*Corresponding author: Na Li, Tel/Fax: +86-377-63513726, E-mail: 382052070@qq.com.
Foundation item: Supported by the Innovation Scientists and Technicians Troop Construction Projects (Sustainable Utilization of Energy Microbial Resources) of Henan Province, by the Key Scientific Research Projects of Institutions of Higher Learning in Henan Province (20A180020) and by the High-Qualified Talents Scientific Research Startup Foundation of Nanyang Normal University (2019ZX015, 2019ZX013)
Abstract: [Objective] The purpose of this study is to isolate and identify the high-efficient degradation strains of fenoxaprop ethyl, providing strain resources and theoretical basis for the development of degradation agents, enhancing the in-situ bioremediation of fenoxaprop ethyl residue contaminated soil, and ensuring the safety of cucumber products. [Methods] The degradation strain was isolated by enrichment culture method and identified by morphology, physiological, biochemical characteristics and 16S rRNA gene evolution analysis. Intermediate products during fenoxaprop ethyl degradation were analyzed by HPLC/MS. The key hydrolase gene was cloned by shotgun method, and heterologously expressed. Michaelis-Menten double reciprocal curve and orthogonal tests were used to determine the enzyme kinetic and liquid fermentation parameters of the degradation strain. Through the irrigation of degradation strain, the fenoxaprop ethyl degradation in cucumber rhizosphere soil and the enhancement effect of mannitol on degradation efficiency were studied. [Results] Rhodococcus sp. DSB-1 was able to transform 100 mg/L fenoxaprop ethyl to fenoxaprop acid as sole carbon source within 24 h. The optimum degradation temperature and pH were 30 ℃ and 8.0, respectively. A fenoxaprop ethyl hydrolase gene named pepE was cloned from the genome of strain DSB-1 by shotgun method. The Km and kcat/Km of the hydrolase PepE towards fenoxaprop ethyl were 28.2 μmol/L and 11.0 L/(μmol·s). The degradation agent acquired possessed the highest degradation efficiency towards fenoxaprop ethyl under the fermentation conditions: temperature of 30 ℃, ventilation rate of 1:0.4, stirring speed of 200 r/min and culture time of 48 h. Strain DSB-1 could colonize on the cucumber root surface, and completely degraded 10 mg/kg fenoxaprop ethyl residue in cucumber rhizosphere soil within 12 d. Addition of mannitol could improve the degradation efficiency by 14.8% compared with the non-added treatment. [Conclusion] Strain DSB-1 could be potentially applied in bioremediation of fenoxaprop ethyl contaminated soil.
Keywords: fenoxaprop-ethylbacterial biodegradationhydrolase gene pepEcolonizationenhanced bioremediation
精噁唑禾草灵(fenoxaprop ethyl,FE)是芳氧基苯氧基丙酸酯类除草剂的代表品种之一,主要用于双子叶作物田中防除单子叶杂草[1–2],属于内吸型除草剂,年销售额达到3亿美元,其作用机理是抑制脂肪酸合成的关键酶乙酰辅酶A羧化酶的活性,进而阻碍植物脂肪酸的合成,达到除草效果[3]。精噁唑禾草灵在我国的使用较为广泛,但由于长期施用,加之操作不当,导致其在环境中的残留(> 0.05 mg/kg),对生态环境以及敏感作物安全均会产生不良的影响[4–7]。
微生物降解被认为是有机污染物在自然环境中的主要降解方式。目前为止,关于FE微生物降解的研究相对较少,并且局限于降解菌株的分离鉴定、降解特性和代谢途径等。Gennari等分离得到的混合菌群能以15 mg/L FE为碳源和氮源,并鉴定出精噁唑禾草灵酸(FA)以及6-氯- 2, 3-二氢苯并恶唑-2-酮(CDHB)为其代谢产物[8];Pseudomonas fluorescens能显著去除环境中的FE,FA、CDHB和2-(4-羟基苯氧基)-丙酸(HPP)是其转化FE过程中的代谢产物[9];Alcaligenes sp. H可以利用50 mg/L FE为碳源生长,并能生成最少5种中间产物[10]。Hou等分离得到的菌株Rhodococcus sp. T1在24 h内将100 mg/L FE降解94%,并克隆到FE水解酶基因feh[11];Dong等分离的Acinetobacter sp. DL-2在120 h内将50 mg/L FE降解95.2%,并克隆到FE水解酶基因afeH[12]。虽然有不少****研究FE的微生物降解,但降解菌剂的制备、降解产物对农作物的药害、污染土壤的原位修复以及提高菌株在土壤中的存活能力等方面仍缺少实验数据,尚需进一步研究。
本研究以实验室分离得到的一株FE高效降解菌株Rhodococcus sp. DSB-1为材料,研究其降解特性,通过高效液相色谱-质谱(HPLC/MS)鉴定菌株降解的代谢产物为精噁唑禾草灵酸,其对黄瓜的药害显著减轻,并利用鸟枪法克隆得到FE水解酶基因pepE,并实现其在Escherichia coli BL21中的高效表达,研究其酶学特性;通过正交试验,研究菌株DSB-1液态发酵的最佳参数,并验证灌根方式投加菌剂至黄瓜根际,可增强菌株DSB-1在黄瓜根系的定殖,提高其存活能力,快速降解根际土壤中的FE。此外,菌株DSB-1能利用甘露醇为碳源进行快速生长,甘露醇与菌剂混施至黄瓜根际,可增强菌株DSB-1在黄瓜根际的修复效果。本研究可为FE残留污染土壤原位修复,保证黄瓜产品安全提供菌株资源和理论依据。
1 材料和方法 1.1 材料与试剂 LB培养基(g/L):10.0蛋白胨,5.0酵母粉,5.0 NaCl。MSM基础盐培养基(g/L):1.0 NH4NO3,0.5 NaCl,1.5 K2HPO4,0.5 KH2PO4,0.2 MgSO4·7H2O。液体培养基添加1.5%琼脂粉制成固体培养基。精噁唑禾草灵(FE)购自百灵威科技有限公司,甘露醇与有机试剂购自南阳聚朋生物科技有限公司,分子生物学试剂购自TaKaRa公司,PCR引物合成及测序由南京金斯瑞生物科技有限公司完成。
1.2 降解菌株的筛选与分类地位的鉴定 从长期施用FE的农田土壤采集样品,称取10 g土壤样品接种至含100 mg/L FE的100 mL MSM中,30 ℃、180 r/min恒温摇床中培养5 d,以5%的比例转接富集液至含100 mg/L FE的100 mL MSM中,重复操作3次。将具有降解效果的富集液稀释至10–4–10–6,涂布于添加有100 mg/L FE的MSM固体培养基上,30 ℃培养3–5 d,挑选出能形成透明圈的菌株,划线纯化。LB液体培养基扩大培养后,接种至含100 mg/L FE的MSM中验证其降解效果。
FE的测定采用高效液相色谱法(HPLC):盐酸酸化反应后的培养液至pH 2.0–3.0,等体积二氯甲烷萃取,静置分层,吸取下层有机溶液,无水硫酸钠去除水分,风干后,加入等量甲醇复溶,经0.22 μm的有机相滤器过滤后,用于HPLC检测。液相色谱仪器型号为RID-10A,SHIMADZU,色谱柱为C18反相色谱柱(250 mm×4.6 mm×5 μm),流动相为甲醇:水:乙酸(80:20:0.5,V/V/V),柱温40 ℃,流速1.0 mL/min,进样量20 μL,检测波长为239 nm。
挑选出具有FE降解效果的菌株,根据《常见细菌系统鉴定手册》[13]和《Bergey’s Manual of Determinative Bacteriology》[14]对菌株的形态与生理生化特性进行分析和鉴定。提取目的菌株基因组DNA[15],利用细菌16S rRNA基因通用引物以及TaKaRa Premix Taq?扩增降解菌株的16S rRNA基因,DNA凝胶纯化回收试剂盒对扩增产物进行回收,TA克隆后进行测序。通过原核生物鉴定库(http://www.ezbiocloud.net/)对菌株16S rRNA基因序列进行在线比对分析,并将相关序列导入MEGA 6.0软件,Clustal W进行基因序列比对[16],邻接法构建降解菌株的16S rRNA基因的系统进化树[17]。
1.3 菌株对精噁唑禾草灵的降解特性及甘露醇的促进作用
1.3.1 降解菌悬液的制备: 挑取单菌落接种至100 mL LB液体培养,30 ℃、180 r/min培养至对数后期,5000 r/min离心5 min收集菌体,无菌水洗涤3次,重悬,将OD600调至1.5备用。
1.3.2 温度、pH、精噁唑禾草灵初始浓度对菌株降解的影响: 在FE终浓度100 mg/L的无机盐培养基中,按5%的比例接入菌悬液,分别置于15、20、25、30、37、42 ℃,200 r/min摇床培养24 h,测定FE的浓度;在培养基初始pH分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0,FE终浓度100 mg/L的无机盐培养基中,按5%的比例接入菌悬液,30 ℃、200 r/min摇床培养24 h,测定FE的浓度;在初始FE终浓度分别为10、25、50、100、200 mg/L的无机盐培养基中,按5%的比例接入菌悬液,30 ℃、200 r/min摇床培养24 h,测定FE浓度。
1.3.3 甘露醇强化菌株降解精噁唑禾草灵: 无机盐培养基中添加FE至终浓度100 mg/L,设置添加甘露醇和未添加处理,浓度为1.0 mmol/L,按5%比例接入菌悬液,30 ℃、200 r/min摇床培养,每4 h取1次样,取至24 h,测定FE的浓度,稀释平板法测定培养基中降解菌株的数量,绘制FE降解和菌株生长曲线。
1.4 菌株降解精噁唑禾草灵代谢产物的鉴定及代谢途径预测 对1.3.3中定时取样的样品进行HPLC检测,选取中间代谢产物积累较多的样品,进行HPLC/MS分析。HPLC/MS型号为Agilient LC-MS 1100 instrument。质谱检测器为ESI离子源,m/z扫描范围100–700,离子源喷射电压4.5 kV,毛细管温度250 ℃,夹套气(N2)流量1.5 L/min,辅助气氮气流速10 L/min,样品采用负离子模式检测。
1.5 精噁唑禾草灵水解酶基因pepE的克隆与表达
1.5.1 水解酶基因pepE的克隆: 用限制性内切酶Sau3AⅠ酶切降解菌株基因组DNA,置于37 ℃水浴锅中反应适当时间,加入10×Loading Buffer,65 ℃水浴10 min,终止酶反应。琼脂糖凝胶电泳检测酶切效果,回收2–4 kb的DNA片段并纯化,酶联至BamHⅠ/BAP酶切的载体pUC118上,转化到E. coli DH5α中,涂布至添加有FE的LB平板上,挑取形成水解圈的单菌落,接种至含有氨苄青霉素(Amp,100 mg/L)的LB液体中,37 ℃摇床培养至对数生长期。按照5%的比例转接至含100 mg/L FE的无机盐培养基中,检测FE的浓度。另取2 mL有降解功能的菌悬液,提取质粒并测序,测序结果在NCBI数据库中进行在线比对与分析,并用Snapgene软件预测其ORF。
1.5.2 水解酶PepE的表达及纯化: 根据推断的FE水解酶基因序列设计引物,以菌株基因组DNA为模板进行PCR扩增,利用限制性内切酶EcoRⅠ和NdeⅠ对扩增产物进行双酶切,与同样双酶切的表达载体pET29a进行酶连,构建重组表达载体pET29a-pepE,转化至E. coli DH5α中,涂布至含有卡那霉素(Km,50 mg/L)的LB培养基上,37 ℃培养12–16 h,挑取单菌落至LB试管中,培养至对数期,提取质粒进行测序。选择插入片段序列正确的重组质粒转化至E. coli Rosseta (DE3)中,涂布于含有Km的LB培养基上,挑取单菌落至液体LB试管中,培养至对数期,提取质粒进行测序。将含有正确插入序列的表达菌株接至LB试管中培养,37 ℃、180 r/min培养至对数期。吸取1 mL菌液转接至100 mL含有Km的LB液体培养基中,培养至OD600为0.6–0.8,加入30 μL IPTG (1 mol/L),16 ℃培养16 h。12000 r/min离心2 min,收集菌体,并用Tris-HCl缓冲液(20 mmol/L,pH 8.0)洗涤菌体2次,再用Tris-HCl缓冲液重悬菌体,冰浴条件下利用超声破碎仪破碎细胞,4 ℃、12000 r/min离心20 min,取上清,即为水解酶PepE粗酶液,利用Ni-NTA Resin纯化,参照说明书。
1.5.3 水解酶PepE的酶学特性: 取适量PepE酶液加至4 mL含100 mg/L FE的缓冲液中,55 ℃反应30 min,加入等体积的二氯甲烷振荡混匀,终止反应。用HPLC检测FE的含量。
将适量的PepE酶液加至测活体系中,将反应液放置于不同温度条件下(5、10、15、20、25、30、35、40、45、50、55、60、65、70 ℃),反应30 min后测定反应体系中FE的含量。将适量的酶液分别放置于5、10、15、20、25、30、35、40、45、50、55、60、65、70 ℃条件下,处理30 min,加至酶活测定体系中测定其酶活力,以未经热处理的酶液为对照(100%),研究温度对PepE活力和稳定性的影响。
将适量的PepE酶液加入不同pH值的缓冲液体系中测定酶活力,缓冲液为:pH 3.0–6.0为柠檬酸缓冲液,pH 5.0–9.0为磷酸缓冲液,pH 8.0–10.6为甘氨酸-氢氧化钠缓冲液,缓冲液浓度均为20 mmol/L,55 ℃下反应30 min。将适量的酶液分别置于不同的缓冲液中,4 ℃放置24 h,加至酶活测定体系中测定其酶活力,以未经热处理的酶液为对照(100%),研究pH对PepE活力和稳定性的影响。
向酶活测定体系中加入1 mmol/L不同的金属离子(Cu2+、Ca2+、Fe3+、Co2+、Zn2+、Ba2+、Mg2+、Mn2+和Ni2+),以不添加金属离子的反应体系为对照,55 ℃反应30 min,测定反应体系中的精噁唑禾草灵残余量以确定其相对酶活力,研究金属离子对PepE活力的影响。
1.5.4 水解酶PepE的动力学参数: 酶反应体系:在含有100 mg/L FE的3 mL甘氨酸-氢氧化钠缓冲液(20 mmol/L,pH 9.0)中,加入适量纯化蛋白PepE,55 ℃反应5 min,酶促反应液经过预处理后,HPLC检测底物的降解。酶活单位定义为每分钟消耗1 μmol FE所需的酶量即为一个单位,计算PepE水解FE的酶活。测定不同底物浓度下的酶促反应速率,根据不同FE浓度和反应初速率作Michaelis-Menten双倒数曲线图,计算PepE对FE的Km、kcat以及kcat/Km。
1.6 菌株DSB-1在黄瓜根系的定殖
1.6.1 菌株DSB-1的GFP标记: 选择带有GFP绿色荧光蛋白基因的质粒pLYC2 (本实验室保藏),通过电转化的方法,将其导入降解菌株中,挑取发出绿色荧光的单菌落,对菌株进行单独培养、验证,命名为DSB-1-gfp,并用15%的甘油保藏菌种。菌悬液的制备如1.4.1所述。
1.6.2 黄瓜种子的消毒与萌发: 将种子浸泡在10% H2O2中10 min,进行表面消毒,用蒸馏水洗涤,置于无菌水中,吸胀7 h,再将种子平铺置于无菌湿润的滤纸上,黑暗催芽3 d后待用。
1.6.3 菌株DSB-1-gfp在黄瓜根系的定殖: 每个盆钵装土450 g,种植3颗黄瓜幼苗,每颗幼苗灌根接种DSB-1-gfp菌悬液5 mL,置于人工气候培养箱中,以25 ℃、16 h光照和22 ℃、8 h黑暗为一周期,培养15 d后,取出黄瓜根系,用无菌水轻轻冲洗,将根系切成0.5 cm小段,在激光共聚焦显微镜(CLSM,Leica TCS SP3)下观察菌株在黄瓜根表的定殖情况。
1.7 菌株DSB-1-gfp液态发酵参数优化 将菌株DSB-1-gfp在LB培养基上活化,接种至含200 mL LB培养基的1000 mL摇瓶中,培养至对数期,准备接种发酵罐(上海顾信生物科技有限公司,GS-F2005F2050)。发酵罐50 L,投料量35 L,发酵培养基为LB液体培养基(g/L):Tryptone 10.0,Yeast extract 5.0,NaCl 5.0。投料完毕后121 ℃灭菌20 min,冷却至30 ℃后,将上述培养好的摇瓶菌种按5%的接种量接至发酵罐中。发酵罐温度设置25、30、35 ℃,通气量为1:0.4、1:0.5、1:0.6,搅拌速度为150、180、200 r/min,培养时间为24、48、72 h,发酵完成后各取1 L发酵液,无菌水清洗并重悬,接种至含100 mg/L FE的MSM液体培养基中,反应5 h,测定反应后FE的浓度。利用四因素三水平正交试验,以降解率为指标,确定最佳发酵参数。
1.8 菌株DSB-1-gfp及甘露醇强化黄瓜根际精噁唑禾草灵降解的研究 对土壤设置以下不同处理:(1)对照;(2) 10 mg/kg FE;(3)甘露醇;(4) 10 mg/kg FE+DSB-1-gfp菌悬液;(5) 10 mg/kg FE+甘露醇+ DSB-1-gfp菌悬液。挑选萌发良好的黄瓜种子种植于上述不同处理的土壤中,并向(4)处理中的每颗黄瓜幼苗根部灌根接种5 mL的菌悬液,(5)处理中的幼苗灌根接种5 mL菌悬液,菌悬液中同时添加终浓度为0.1 mmol/L甘露醇,对照组接种等量的无菌水。在接种3、6、9、12、15 d时,取出幼苗,收集根际土,测定FE的浓度,利用稀释涂平板法计算不同根际土壤中菌株DSB-1-gfp的数量,对茎叶长度、鲜重、根系长度和鲜重进行测量并记录。
黄瓜根际FE的提取与测定:将5.0 g根际土加入10 mL萃取液(PBS:甲醇=8:2),150 r/min摇床振荡1 h,8000 r/min离心10 min,收集上清液,沉淀用10 mL萃取液继续重悬,振荡,离心,重复3次,合并上清液,调节pH至2.5,萃取液放至通风橱风干,用1 mL甲醇溶解,并用0.22 μm的尼龙膜过滤,进行高效液相色谱(HPLC)检测。通过外标法制作FE的标准曲线,比较样品目的峰与标准品之间的峰面积,定量检测FE的浓度。
1.9 数据处理 采用SPSS 17.0进行数据统计分析,用Microsoft Excel 2010软件绘图。
2 结果和分析 2.1 精噁唑禾草灵降解菌株的筛选与分类地位的鉴定 将具有降解效果的富集液进行梯度稀释,取10–3–10–6梯度的稀释液涂布于含100 mg/L FE的LB平板上,30 ℃培养3–5 d,根据菌体周围透明圈的产生(图 1-C),挑选出疑似具有降解效果的菌株进行验证,结果表明该菌株在24 h内能完全降解FE,并生成新的中间产物(图 1-A,1-B)。通过平板划线的方法进行纯化,命名为DSB-1。
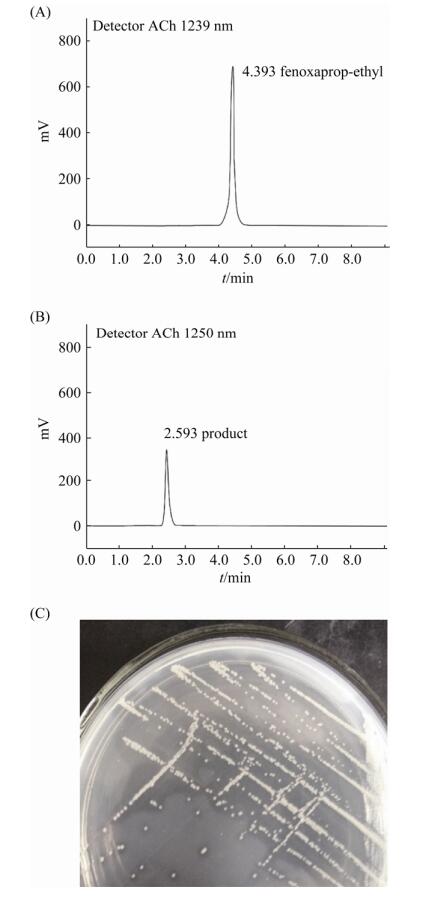 |
| 图 1 菌株DSB-1降解精噁唑禾草灵的HPLC图及其在平板上形成的透明圈 Figure 1 HPLC spectrums of FE degradation by strain DSB-1 and the transparent zone formed on the plate. A: FE; B: FE+DSB-1; C: Transparent zone formed on MSM medium. |
| 图选项 |
生理生化实验结果表明,菌株DSB-1为革兰氏阳性菌,杆状,无鞭毛,在LB平板上形成的菌落呈乳白色,突起,不透明。甲基红试验、吲哚试验、酯酶试验以及淀粉水解呈阴性,VP试验、明胶水解以及H2S生成试验呈阳性。以菌株DSB-1的总DNA为模板,扩增得到总长为1477 bp的16S rRNA基因序列,EzTaxon数据库比对结果表明,15477T[18]和Rhodococcus degradans CCM 4446T[19]的同源相似度最高,为99.86%,与Rhodococcus baikonurensis GTC 1041T[20]的16S rRNA基因序列菌株DSB-1与Rhodococcus qingshengii JCM相似度为99.63%。通过Neighbor-Joining法构建菌株DSB-1与红球菌属内模式菌株的系统进化树(图 2)表明,菌株DSB-1位于红球菌属进化树内部。故根据形态、生理生化和16S rRNA基因系统进化分析,将菌株DSB-1初步鉴定为红球菌属,命名为Rhodococcus sp. DSB-1。
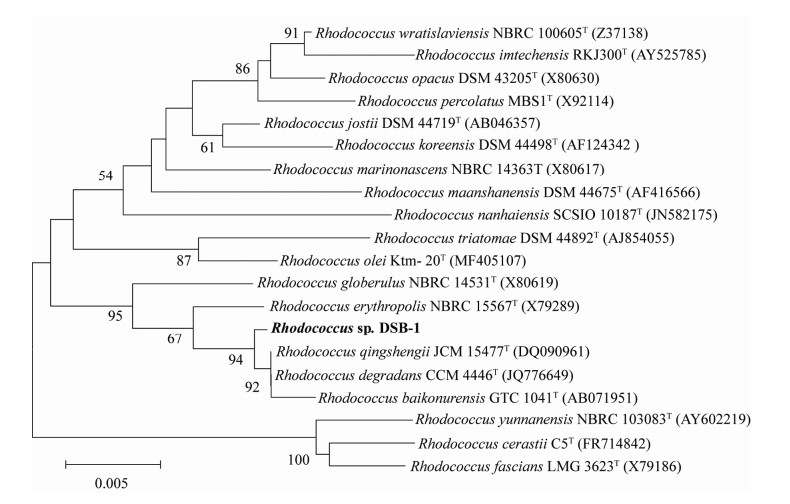 |
| 图 2 基于16S rRNA基因构建的菌株DSB-1的系统发育树 Figure 2 Neighbor-joining tree of strain DSB-1 based on 16S rRNA gene. Numbers at branch points are bootstrap values (based on 1000 replications), only values > 50% are shown. Bar, 0.005 substitutions per nucleotide position. GenBank accession number is showed in bracket. |
| 图选项 |
2.2 菌株DSB-1对精噁唑禾草灵的降解特性 不同温度、pH和初始浓度下的降解实验结果表明(图 3),菌株DSB-1在30 ℃时对FE的降解速度最快,20–42 ℃内均能够有效地降解FE (降解率 > 65%)。菌株DSB-1在pH 7.0时对FE的降解最快,pH 5.0–10.0表现出良好的降解能力(降解率 > 65%)。FE的初始浓度对菌株DSB-1降解效率有明显的影响,当浓度低于100 mg/L,菌株DSB-1可以完全降解FE,当浓度达到200 mg/L,菌株的降解率为67.2%。
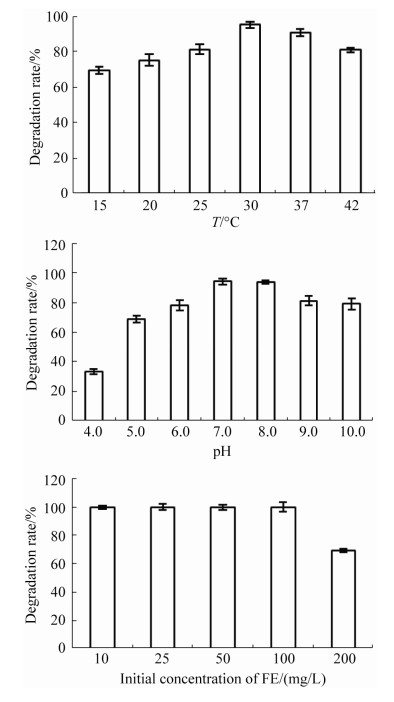 |
| 图 3 温度、pH和初始浓度对菌株DSB-1精噁唑禾草灵降解活性的影响 Figure 3 Effect of temperature, pH and initial FE concentration on the activity of FE degradation by strain DSB-1. |
| 图选项 |
2.3 甘露醇强化菌株DSB-1降解精噁唑禾草灵及其代谢产物鉴定 由图 4-A可知,菌株DSB-1可在24 h内将100 mg/L FE完全降解。利用稀释平板法对培养液中菌株DSB-1进行计数,结果表明接种初期,培养液中菌株的数量为3.56×107 CFU/mL,24 h后数量增长到9.70×107 CFU/mL,即菌株可以利用FE为碳源生长。而另外添加1.0 mmol/L甘露醇可以促进菌株DSB-1对FE的降解,培养后16 h即可完全降解底物,降解率提高了12.3%。通过平板计数发现菌株DSB-1数量相较于未添加甘露醇的处理有所升高,在12、16、20、24 h时的菌株数量为8.56×107、9.54×107、10.12×107、10.54×107 CFU/mL,分别提高了3.13%、6.00%、6.53%、8.66%。初步判定菌株DSB-1利用甘露醇作为营养物质生长,提高菌株数量,进一步促进FE的降解。
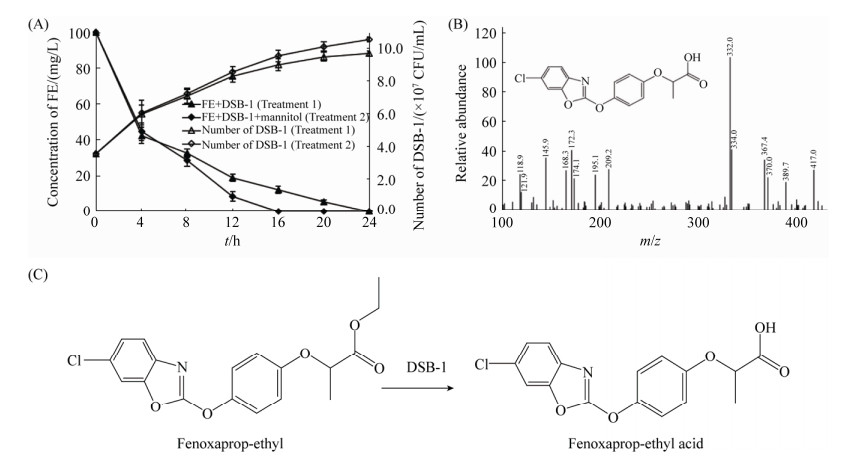 |
| 图 4 菌株DSB-1对精噁唑禾草灵的降解曲线及推测的代谢途径 Figure 4 Degradation curves of FE by DSB-1 and the metabolic pathway. A: Enhancement of FE degradation by mannitol, DSB-1 and its growth curves; B: Mass spectra of the metabolite of FE; C: The metabolic pathway of FE by DSB-1. |
| 图选项 |
HPLC结果显示(图 1),未接种DSB-1的对照组中,FE的保留时间为4.393 min,接种后原药峰消失,出现了一新的代谢产物峰,保留时间为2.593 min。收集产物进行HPLC/MS分析发现,其m/z为332.0,结合FE的化学结构式,推测该产物为精噁唑禾草灵酸(图 4-B)。菌株DSB-1使FE的酯键断裂,形成相应的酸(图 4-C)。
2.4 精噁唑禾草灵水解酶基因pepE的克隆与表达 将阳性克隆子进行测序,利用Snapgene软件对序列分析可知,其中一个ORF命名为pepE,通过在NCBI数据库上对比,该基因长度1140 bp,编码379个氨基酸,发现其在氨基酸水平上与已报道的Rhodococcus sp. T1中FE水解酶Feh的相似性达到100%[11],与Rhodococcus sp. JPL-2中FE水解酶Feh相似性为78.04%[21],推测该基因也为菌株DSB-1降解FE的基因。
构建的重组质粒pET29a-pepE在E. coli BL21中经IPTG诱导表达后的融合蛋白的C端带有6个组氨酸(His)残基组成的His标签,因此可以通过Ni-NTA亲和层析柱进行纯化。纯化后的融合蛋白PepE-6His经SDS-PAGE检测,大小约为40 kDa左右(图 5)。根据FE的浓度和测定的反应速率作Michaelis-Menten双倒数曲线图,计算出PepE对底物FE的Km为28.2 μmol/L,Vmax为417.3 μmol/min,kcat为310.7/s,kcat/Km为11.0 L/(μmol·s)。在1.5.4条件下,对FE的酶活为351.9 U/(mg·min)。
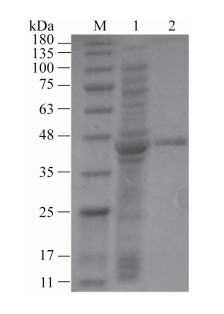 |
| 图 5 融合蛋白His6-PepE的SDS-PAGE图谱 Figure 5 SDS-PAGE of the fusion protein His6-PepE. Lane M: protein molecular weight marker; lane 1: crude extract of E. coli BL21 harboring pET29a-pepE; lane 2: purified His6-PepE. |
| 图选项 |
2.5 精噁唑禾草灵水解酶PepE的酶学特性 结果如表 1和图 6所示,水解酶PepE在50 ℃活性最高,25–60 ℃时仍有60%以上的活性,低于15 ℃或者高于65 ℃,酶活性低于30%。PepE在50 ℃以下稳定性良好,可保留50%以上的活性,60 ℃处理酶活性急剧下降,70 ℃已经检测不到酶活力。该酶在pH 7.0–10.6能保持60%以上的活性,最适pH为9.0,pH 6.0时酶活力降至35.8%,pH 5.0时活性低于20%。PepE在碱性条件下非常稳定,pH 7.0–10.6酶活力均高于90%,酸性条件下稳定性差,pH 6.0时酶活力为70.8%,pH 5.0时仅为40.9%。添加所测的各种离子对PepE的活性均有一定的抑制作用,其中Fe3+的抑制力较弱,残留酶活性仍有60.4%,而Cu2+、Ca2+、Zn2+、Mg2+、Mn2+和Ni2+抑制作用较强,残留酶的活性低于35%。
表 1. 金属离子对PepE酶活力的影响 Table 1. Effect of metal ions on PepE activity
| Metal ion | Relative activity/% |
| Free | 100.0±2.2 |
| Ca2+ | 33.9±1.9 |
| Cu2+ | 31.9±2.8 |
| Ni2+ | 19.1±2.3 |
| Mg2+ | 22.2±3.9 |
| Ba2+ | 40.2±3.9 |
| Mn2+ | 34.9±3.3 |
| Zn2+ | 15.8±2.4 |
| Co2+ | 42.6±2.0 |
| Fe3+ | 60.4±5.1 |
表选项
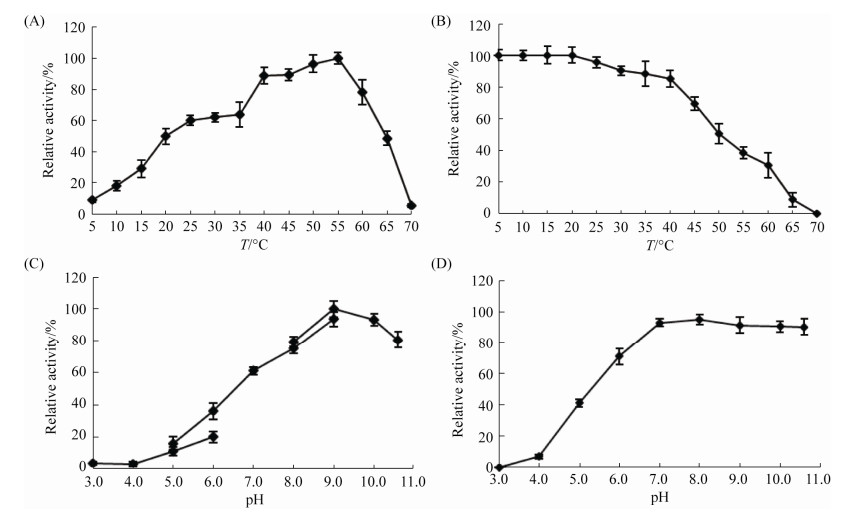 |
| 图 6 温度和pH对PepE酶活力与稳定性的影响 Figure 6 Effects of pH and temperature on enzyme activity and stability of PepE. A: Determination of the optimal temperature; B: Determination of the thermal stability; C: Determination of the optimal pH; D: Determination of the pH stability. |
| 图选项 |
2.6 菌株DSB-1的GFP标记及其在黄瓜根系的定殖 将质粒pLYC2导入菌株DSB-1中,构建可在蓝光激发条件下稳定发出绿色荧光的重组菌株,并利用gfp基因设计引物进行PCR验证,结果如图 7-C所示,野生型菌株无法扩增出gfp片段,而重组菌株可扩增得到目的片段,经测序验证序列正确,表明菌株DSB-1的GFP标记成功,可用于后续实验。菌株DSB-1-gfp在黄瓜根系定殖的结果如图 7-A和7-B所示,在接种菌株15 d后,其在黄瓜根系仍有良好的定殖能力。
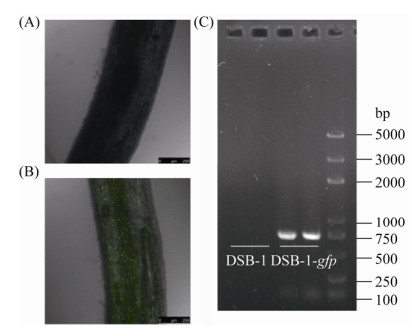 |
| 图 7 菌株DSB-1-gfp在黄瓜根系定殖的激光共聚焦图片 Figure 7 Confocal laser scanning microscope images of DSB-1-gfp colonizing the cucumber roots. A: cucumber treated without DSB-1-gfp; B: cucumber treated with DSB-1-gfp; C: PCR verification of gfp gene. |
| 图选项 |
2.7 液态发酵参数的优化 菌株DSB-1可高效降解FE,还可定殖于黄瓜根系,提高其在土壤环境中的生存能力,因此,开发高效的FE微生物降解菌剂是十分必要的。设计四因素三水平正交试验,探索菌株DSB-1-gfp液态发酵的最佳参数,即因子A:发酵温度(25、30、35 ℃),因子B:搅拌速度(150、180、200 r/min),因子C:通气量(1:0.4、1:0.5、1:0.6),因子D:培养时间(24、48、72 h)。取不同处理的发酵液1 L,离心,等量无菌水清洗并重悬,按5%的比例接种至FE终浓度为100 mg/L的MSM液体培养基中,30 ℃、200 r/min培养5 h,测定FE的降解率。FE降解率越高,参数组合下液态发酵效果越好。本试验中30 ℃是因子A的最佳水平,200 r/min是因子B的最佳水平,1:0.4是因子C的最佳水平,48 h是因子D的最佳水平,该组合的降解率为75.33%,高于其他8种组合。因此,菌株DSB-1-gfp液态发酵的最佳方案为发酵温度30 ℃,通气量1:0.4,搅拌速度200 r/min,培养时间48 h。后续FE污染土壤原位修复所需的菌悬液以此方案进行。
2.8 菌株DSB-1-gfp对黄瓜根际土壤中精噁唑禾草灵的降解及甘露醇的强化作用 菌株DSB-1-gfp在黄瓜根际土壤中的浓度变化如图 8-A所示,添加FE与菌悬液处理中,菌株的初始浓度为3.72×107 CFU/g,随着时间的延长,菌株的浓度逐渐下降,培养后15 d,浓度为1.29×103 CFU/g。另外添加甘露醇的处理样品中,菌株的浓度随时间变化的趋势与未添加甘露醇一致,但同一时间菌株浓度高于未添加处理,培养后15 d,浓度仍可达到1.70×104 CFU/g。
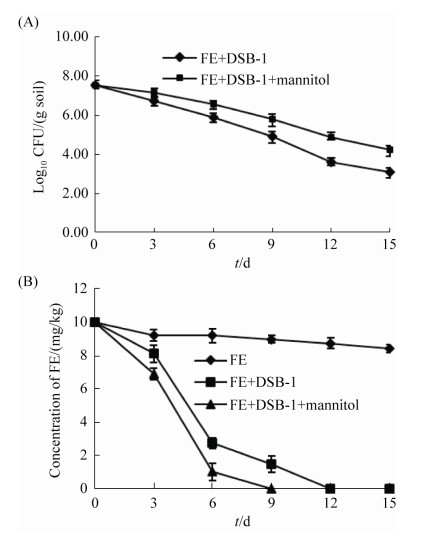 |
| 图 8 黄瓜根际土壤中菌株数量及精噁唑禾草灵的浓度 Figure 8 The population of DSB-1 and concentration of FE in cucumber rhizosphere soil. A: the population of DSB-1 in cucumber rhizosphere soil; B: concentration of FE in cucumber rhizosphere soil. |
| 图选项 |
黄瓜根际土壤中FE的变化趋势如图 8-B所示,添加降解菌株能显著提高根际环境中FE的降解,未接种的处理,15 d FE的降解效率仅为15.9%,而接种的处理样品,9 d后FE的降解率达到85.2%,12 d后已无法检测到FE的存在,添加甘露醇可显著促进根际环境中FE的降解,9 d后FE完全降解,同比之下,降解率提高14.8%。与此同时,对在不同处理下敏感作物黄瓜的生长状况进行测定,结果如表 2所示,仅添加菌株DSB-1-gfp与甘露醇的处理对黄瓜生长没有显著影响,培养15 d后,FE的处理会显著抑制黄瓜的生长,与对照相比,各项生长指标的差异均达到显著水平。添加菌株DSB-1以及菌株甘露醇混合液对黄瓜的生长有恢复作用,与受到药害的黄瓜相比,各项生长指标均存在显著差异,与对照样品相比无显著差异,表明菌株DSB-1接种至黄瓜根际土壤,能够改善黄瓜根际微环境,减轻FE对黄瓜生长的抑制。
表 2. 黄瓜在不同处理下的生长状况(15 d) Table 2. The growth of cucumber under different treatments (15 d)
| Treatment | Leaf area/cm2 | Root length/cm | Fresh seedling weight/g | Fresh root weight/g |
| Control | 18.11±0.38b | 12.13±0.21b | 0.94±0.02b | 0.71±0.02b |
| 10 mg/kg FE | 9.38±0.27a | 6.18±0.03a | 0.47±0.04a | 0.31±0.04a |
| DSB-1-gfp | 17.61±0.23b | 11.55±0.11b | 0.85±0.05b | 0.67±0.05b |
| 0.1 mmol/L mannitol | 17.83±0.36b | 11.91±0.18b | 0.84±0.04b | 0.68±0.03b |
| 10 mg/kg FE+DSB-1-gfp | 17.87±0.58b | 11.38±0.10b | 0.89±0.07b | 0.70±0.06b |
| 10 mg/kg FE+DSB-1-gfp+0.1 mmol/L mannitol | 17.88±0.83b | 11.20±0.14b | 0.84±0.06b | 0.71±0.05b |
| The lowercase letters affixed to the data indicate significant differences (P < 0.05); FE: fenoxaprop ethyl. | ||||
表选项
3 讨论 微生物降解是目前去除环境中FE的主要方式,本研究从农田土壤中分离得到一株高效的降解菌株DSB-1,经鉴定,其属于Rhodococcus sp.。目前已有不少关于Rhodococcus属降解其他环境污染物的报道[22–24],并且Rhodococcus属的菌株在土壤中种类和数量多,代谢类型复杂多样,环境适应能力强[25],可为FE污染土壤的修复提供理想的菌株资源。
目前关于FE降解菌株的报道中,多数菌株的降解效率较弱。Pseudomonas fluorescens的一系列菌株,对低浓度(3.256 mg/L)的FE的降解效率为82%–96%[9];Acinetobacter sp. MEPE-0128[26]与Acinetobacter sp. DL-2[12]在5 d内对50 mg/L FE的降解率分别为80%和95.2%;Alcaligenes sp. H[10]以及Pseudomonas azotoformans QDZ-1[27]在5 d内对100 mg/L FE的降解率分别为45.8%和90.8%;菌株Rhodococcus sp. JPL-2在54 h内对100 mg/L FE的降解率为94.5%[28];Rhodococcus sp. T1的降解效率较高,24 h对100 mg/L FE的降解率为94%[11],但不能完全转化FE。降解特性方面,Acinetobacter sp. DL-2在温度为25–42 ℃时对50 mg/L FE降解率较高,维持在65%以上,而在20 ℃的降解率只有48.5%,并且24 h内对25–200 mg/L FE的降解率很低(10%左右)[12];Acinetobacter sp. MEPE-0128在20 ℃时对50 mg/L FE的降解率只有50%左右,当FE浓度在75 mg/L以上,降解效率显著下降,24 h的降解率约为20%[26];Rhodococcus sp. JPL-2适合降解的温度和pH范围为20–37 ℃、pH 5.0–8.0,范围外条件下的降解率较低[28];Rhodococcus sp. T1最适降解温度为30 ℃,pH为8.0[11]。本实验分离得到的菌株DSB-1在24 h内即可完全降解100 mg/L FE,pH 7.0–8.0的降解率超过93%,20–42 ℃、pH 5.0–10.0对100 mg/L FE保持较高的降解效率(> 65%),最适条件下,FE浓度达到200 mg/L,菌株的降解率可达67.2%。从生态安全和降解特性角度出发,本菌株具有较好的应用前景,可为后续污染土壤的修复提供有力保障。
在代谢途径方面,酯键水解生成相应的酸是芳氧基苯氧基丙酸酯类除草剂微生物降解的关键步骤。Alcaligenes sp. H[10]、Pseudomonas azotoformans QDZ-1[27]、Rhodococcus sp. T1[11]以及Acinetobacter sp. DL-2[12]均能将FE转化为精噁唑禾草灵酸,但不能继续降解,本研究分离得到的菌株DSB-1面临同样的问题。结构复杂的污染物可能需要多种微生物共同作用才能完全矿化。关于FE微生物降解的菌株仍需进一步分离与鉴定。
在降解基因与酶学特性研究方面,Hou等从Rhodococcus sp. T1中克隆得到FE水解酶基因feh,但并未对其编码的水解酶进行研究[11];Nie等从菌株Pseudomonas azotoformans QDZ-1克隆得到氰氟草酯水解酶基因chbH,其表达的水解酶ChbH同样能够水解FE,其酶活为3.95 U/(mg·min)[27];Dong等从菌株Acinetobacter sp. DL-2克隆得到新的FE水解酶基因afeH,在大肠杆菌中表达纯化的酶对FE的酶活为216.39 U/(mg·min),最适反应温度和pH分别为50 ℃和pH 9.0,pH 8.0–10.0仍有60%以上的活性,将AfeH放置在pH 3.0–10.6的缓冲液中,随后进行酶活测定,发现仍有50%以上的活性。25–60 ℃AfeH可保持60%以上活性,而将酶进行40 ℃以下热处理,仍有高于50%的活性,当温度高于50 ℃,活性显著下降[12];Chen等从菌株Sphingopyxis sp. OB-3中克隆得到酯酶基因broH,Li等从菌株Sphingobium quisquiliarum DC-2中克隆得到酰胺酶基因cmeH,其表达的酯酶BroH与CmeH均能水解FE,但并未研究其对FE的降解特性[29–30];娄旭等从Rhodococcus sp. JPL-2中克隆得到FE水解酶基因,表达后的水解酶Feh对FE的酶活力高达1080 U/(mg·min),其最适温度和pH分别为35 ℃和pH 7.5,pH 5.0–8.0仍有60%以上的活性,Feh放置在pH 5.0–8.0稳定,仍有50%以上的活性。25–50 ℃时,FeH可保持60%以上活性,而将酶进行50 ℃以下热处理,仍有高于50%的活性,当温度高于50 ℃,活性降至30%以下[28]。本实验中PepE对FE的酶活达到351.9 U/(mg·min),是目前一系列FE水解酶中活性仅次于菌株Rhodococcus sp. JPL-2中FE水解酶,但该酶的pH稳定性不如PepE,pH 10.0时活性仅有30%左右,而PepE仍有90.3%的活性,表明PepE适合碱性环境中精噁唑禾草灵的修复。
将携带gfp基因的载体导入菌株DSB-1中,成功获得在蓝色光激发下释放绿色荧光的菌株,可以定性研究其在黄瓜根系的定殖。通过激光共聚焦显微镜观察发现,菌株DSB-1能在黄瓜的根系表面定殖,定殖部位主要在分生区、伸长区和成熟区,无法进入根系的内部,这与之前根际有益菌的定殖一致[31–32]。FE是内吸型除草剂,菌株DSB-1在根系定殖,增强菌株在土壤中的存活能力,一方面可以有效地防止除草剂的吸入,另一方面也能通过降解FE,从根本上解除对作物的药害。因此,较强的定殖能力表明菌株在原位修复FE污染土壤方面有着巨大潜力。
根际是土壤与植物进行物质能量交换最剧烈的,植物、土壤与微生物相互作用的区域,也是营养物质和有害物质从无机环境进入生命系统参与食物链物质循环的瓶颈和必经通道,有害物质在作物体内过度累积会达到致死的程度。因此,根际环境的修复和改造理应成为关注的重点。目前有报道关于根际降解甲苯、毒死蜱和氯嘧磺隆的降解[33–35],尚未有菌株在作物根际降解FE的相关研究。本研究立足黄瓜根际环境,分离得到的菌株Rhodococcus sp. DSB-1能将FE转化为精噁唑禾草灵酸,代谢产物对黄瓜毒性显著降低(表 2),并且能在黄瓜根系定殖,提高存活能力。鉴于此优势,对菌株进行液态发酵,确定最佳参数,为后续土壤原位修复提供菌种资源。甘露醇是菌株DSB-1可利用进行生长的物质之一,菌株利用甘露醇进行生长,提高自身生物量,即可提高菌株对FE的降解效率(图 8-B),可为后续强化污染物微生物原位修复提供实验数据和操作方式。
References
| [1] | Chen XX, Yu S, Han LJ, Sun SJ, Zhi YN, Li WM. Residues and dissipation of the herbicide fenoxaprop-P-ethyl and its metabolite in wheat and soil. Bulletin of Environmental Contamination and Toxicology, 2011, 87(1): 50-53. |
| [2] | Cocker KM, Moss SR, Coleman JOD. Multiple mechanisms of resistance to fenoxaprop-p-ethyl in United Kingdom and other European populations of herbicide-resistant Alopecurus myosuroides (Black-Grass). Pesticide Biochemistry and Physiology, 1999, 65(3): 169-180. |
| [3] | Pornprom T, Mahatamnuchoke P, Usui K. The role of altered acetyl-CoA carboxylase in conferring resistance to fenoxaprop-P-ethyl in Chinese sprangletop (Leptochloa chinensis (L.) Nees). Pest Management Science, 2006, 62(11): 1109-1115. |
| [4] | Rajkhowa DJ, Deka NC, Borah N, Barua IC. Effect of herbicides with or without paddy weeder on weeds in transplanted summer rice (Oryza sativa). Indian Journal of Agronomy, 2007, 52(2): 107-110. |
| [5] | 蔡喜运. 环糊精和腐殖酸对手性除草剂禾草灵的水生毒理和生物有效性影响研究. 浙江大学博士学位论文, 2006. |
| [6] | Betancourt M, Reséndiz A, Fierro ECYR. Effect of two insecticides and two herbicides on the porcine sperm motility patterns using computer-assisted semen analysis (CASA) in vitro. Reproductive Toxicology, 2006, 22(3): 508-512. |
| [7] | Palut D, Kostka G, Wiadrowska B, Bańkowski R. Effect of diclofop on the activity of some drug-metabolizing enzymes in the liver of male Wistar rats. Roczniki Państwowego Zak?adu Higieny, 2002, 53(1): 1-9. |
| [8] | Gennari M, Vincenti M, Nègre M, Ambrosoli R. Microbial metabolism of fenoxaprop-ethyl. Pest Management Science, 1995, 44(3): 299-303. DOI:10.1002/ps.2780440314 |
| [9] | Hoagland RE, Zablotowicz RM. Biotransformations of fenoxaprop-ethyl by fluorescent Pseudomonas strains. Journal of Agricultural and Food Chemistry, 1998, 46(11): 4759-4765. DOI:10.1021/jf980637q |
| [10] | Song LY, Zhao YC, Hua RM. Separation of fenoxaprop-p-ethyl biodegradation products by HPTLC. JPC-Journal of Planar Chromatography-Modern TLC, 2005, 18(101): 85-88. DOI:10.1556/JPC.18.2005.1.15 |
| [11] | Hou Y, Tao J, Shen WJ, Liu J, Li JQ, Li YF, Cao H, Cui ZL. Isolation of the fenoxaprop-ethyl (FE)-degrading bacterium R hodococcus sp. T 1, and cloning of FE hydrolase gene feh. FEMS Microbiology Letters, 2011, 323(2): 196-203. |
| [12] | Dong WL, Jiang S, Shi KW, Wang F, Li SH, Zhou J, Huang F, Wang YC, Zheng YX, Hou Y, Huang Y, Cui ZL. Biodegradation of fenoxaprop-p-ethyl (FE) by Acinetobacter sp. strain DL-2 and cloning of FE hydrolase gene afeH. Bioresource Technology, 2015, 186: 114-121. |
| [13] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京:科学出版社, 2001. |
| [14] | Gebreyohannes G, Koonawootrittriron S, Elzo MA, Suwanasopee T. Variance components and genetic parameters for milk production and lactation pattern in an ethiopian multibreed dairy cattle population. Asian-Australasian Journal of Animal Sciences (AJAS), 2013, 26(9): 1237-1246. DOI:10.5713/ajas.2013.13040 |
| [15] | Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Research, 1988, 16(3): 1215-1215. DOI:10.1093/nar/16.3.1215 |
| [16] | Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG. Clustal W and clustal X version 2.0. Bioinformatics, 2007, 23(21): 2947-2948. |
| [17] | Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [18] | Xu JL, He J, Wang ZC, Wang K, Li WJ, Tang SK, Li SP. Rhodococcus qingshengii sp. nov., a carbendazim-degrading bacterium. International Journal of Systematic and Evolutionary Microbiology, 2007, 27(12): 2754-2757. |
| [19] | ?vec P, ?ernohlávková J, Busse HJ, Vojtková H, Pant??ek R, Cnockaert M, Ma?laňová I, Králová S, Vandamme P, Sedlá?ek I. Classification of strain CCM 4446T as Rhodococcus degradans sp. nov.. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12): 4381-4287. |
| [20] | Li Y, Kawamura Y, Fujiwara N, Naka T, Liu HS, Huang XX, Kobayashi K, Ezaki T. Rothia aeria sp. nov.. isolated from air in the Russian space laboratory Mir. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(3): 827-835. |
| [21] | Liu HM, Lou X, Ge ZJ, Yang F, Chen DB, Zhu JC, Xu JH, Li SP, Hong Q. Isolation of an aryloxyphenoxy propanoate (AOPP) herbicide-degrading strain Rhodococcus ruber JPL-2 and the cloning of a novel carboxylesterase gene (feh). Brazilian Journal of Microbiology, 2015. |
| [22] | Xu JL, Gu XY, Shen B, Wang ZC, Wang K, Li SP. Isolation and characterization of a carbendazim-degrading Rhodococcus sp. djl-6. Current Microbiology, 2006, 53(1): 72-76. |
| [23] | Rehfuss M, Urban J. Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources. Systematic and Applied Microbiology, 2005, 28(8): 695-701. DOI:10.1016/j.syapm.2005.05.011 |
| [24] | Kitagawa W, Kimura N, Kamagata Y. A novel p-Nitrophenol degradation gene cluster from a Gram-positive bacterium, Rhodococcus opacus SAO101. Journal of Bacteriology, 2004, 186(15): 4894-4901. DOI:10.1128/JB.186.15.4894-4902.2004 |
| [25] | Shao ZQ, Seffens W, Mulbry W, Behki RM. Cloning and expression of the s-triazine hydrolase gene (trzA) from Rhodococcus corallinus and development of Rhodococcus recombinant strains capable of dealkylating and dechlorinating the herbicide atrazine. Journal of Bacteriology, 1995, 177(20): 5748-5755. DOI:10.1128/JB.177.20.5748-5755.1995 |
| [26] | 陶健. 精噁唑禾草灵降解菌MEPE-0128的分离鉴定及水解酶的分离纯化. 南京农业大学硕士学位论文, 2011. |
| [27] | Nie ZJ, Hang BJ, Cai S, Xie XT, He J, Li SP. Degradation of cyhalofop-butyl (CyB) by Pseudomonas azotoformans strain QDZ-1 and cloning of a novel gene encoding CyB-hydrolyzing esterase. Journal of Agricultural and Food Chemistry, 2011, 59(11): 6040-6046. DOI:10.1021/jf200397t |
| [28] | 娄旭. 精恶唑禾草灵降解菌的分离、降解特性研究及其水解酶基因feh的克隆与表达. 南京农业大学硕士学位论文, 2012. |
| [29] | Li Y, Chen Q, Wang CH, Cai S, He J, Huang X, Li SP. Degradation of acetochlor by consortium of two bacterial strains and cloning of a novel amidase gene involved in acetochlor-degrading pathway. Bioresource Technology, 2013, 148: 628-631. DOI:10.1016/j.biortech.2013.09.038 |
| [30] | Chen K, Liu Y, Mao DM, Liu XM, Li SP, Jiang JD. An essential esterase (BroH) for the mineralization of bromoxynil octanoate by a natural consortium of Sphingopyxis sp. strain OB-3 and Comamonas sp. strain 7D-2. Journal of Agricultural and Food Chemistry, 2013, 61(47): 11550-11559. DOI:10.1021/jf4037062 |
| [31] | Walker R, Rossall S, Asher MJC. Colonization of the developing rhizosphere of sugar beet seedlings by potential biocontrol agents applied as seed treatments. Journal of Applied Microbiology, 2002, 92(2): 228-237. |
| [32] | Liu XM, Zhao HX, Chen SF. Colonization of maize and rice plants by strain Bacillus megaterium C4. Current Microbiology, 2006, 52(3): 186-190. |
| [33] | Zhang H, Chen F, Zhao HZ, Lu JS, Zhao MJ, Hong Q, Huang X. Colonization on cucumber root and enhancement of chlorimuron-ethyl degradation in the rhizosphere by Hansschlegelia zhihuaiae S113 and root exudates. Journal of Agricultural and Food Chemistry, 2018, 66(18): 4584-4591. DOI:10.1021/acs.jafc.8b00041 |
| [34] | Feng FY, Ge J, Li YS, Cheng JJ, Zhong JF, Yu XY. Isolation, colonization, and chlorpyrifos degradation mediation of the endophytic bacterium Sphingomonas strain HJY in Chinese Chives (Allium tuberosum). Journal of Agricultural and Food Chemistry, 2017, 65(6): 1131-1138. DOI:10.1021/acs.jafc.6b05283 |
| [35] | Barac T, Taghavi S, Borremans B, Provoost A, Oeyen L, Colpaert JV, Vangronsveld J, van der Lelie D. Engineered endophytic bacteria improve phytoremediation of water-soluble, volatile, organic pollutants. Nature Biotechnology, 2004, 22(5): 583-588. DOI:10.1038/nbt960 |
