周磊2#, 李育森1,2#, 黄仙德2, 施军1, 陈伟源2, 韩耀全1, 匡天旭2, 何安尤1


1. 广西壮族自治区水产科学研究院, 广西水产遗传育种与健康养殖重点实验室, 广西 南宁 530021;
2. 华南农业大学海洋学院, 广东广州 510642
收稿日期:2019-12-14;修回日期:2020-02-18;网络出版日期:2020-06-16
基金项目:广西科技重大专项课题(桂科AA17204095-8)
*通信作者:何安尤, Tel:+86-771-5316524;E-mail:heanyou2000@aliyun.com.
#共同第一作者。
摘要:[目的] 为了解洪潮江水库浮游细菌群落组成、空间分布及其与环境因子的相互作用关系。[方法] 基于16S rRNA基因高通量测序技术,对洪潮江水库浮游细菌群落结构与多样性进行了分析,同步对水体的理化指标进行检测。[结果] 洪潮江水库共注释浮游细菌28门79纲168目243科325属85种。优势门为变形菌门、放线菌门、蓝细菌门、疣微菌门、拟杆菌门、浮霉菌门,分别占比21.95%、21.30%、17.98%、12.27%、11.72%、9.51%。基于Bray-Curtis距离的PCoA分析表明,洪潮江水库9个采样点可以被分为3组,细菌群落呈现沿上下游梯度变化的趋势。perMANOVA检验显示,各组差异显著,但是各组的多样性指数没有显著性差异。Mantel分析表明,透明度、浊度、总磷、亚硝酸盐氮、硝酸盐氮、叶绿素a、pH、溶解氧、氧化还原电位、比电导、总溶解固体以及营养状态会显著影响浮游细菌群落结构。[结论] 洪潮江水库浮游细菌空间分布特征是自然环境理化因子和农业活动综合作用的结果。研究结果对了解浮游细菌群落空间格局及其对人类活动的响应,以及水库管理具有科学参考价值。
关键词:洪潮江水库高通量测序浮游细菌环境因子空间分布
Spatial distribution of bacterioplankton community in Hongchaojiang Reservoir and its relationship with environmental factors
Lei Zhou2#, Yusen Li1,2#, Xiande Huang2, Jun Shi1, Weiyuan Chen2, Yaoquan Han1, Tianxu Kuang2, Anyou He1


1. Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture, Guangxi Academy of Fisheries Science, Nanning 530021, Guangxi Province, China;
2. College of Marine Sciences, South China Agricultural University, Guangzhou 510642, Guangdong Province, China
Received: 14 December 2019; Revised: 18 February 2020; Published online: 16 June 2020
*Corresponding author: Anyou He , Tel: +86-591-87640197; E-mail: heanyou2000@aliyun.com.
Foundation item: Supported by the Major Special Project of Science and Technology in Guangxi (AA17204095-8)
#Those authors contributed equally to this work.
Abstract: [Objective] To elucidate the composition, spatial distribution and interaction between phytoplankton community and environmental factors in Hongchaojiang Reservoir. [Methods] The community structure and diversity of planktonic bacteria in Hongchaojiang Reservoir were analyzed based on the 16S rRNA gene high-throughput sequencing technology. The physical and chemical variables of the water were detected simultaneously. [Results] A total of 28 phyla, 79 classes, 168 order, 243 families, 325 genera and 85 species were identified. Proteobacteria, Actinobacteria, Cyanobacteria, Verrucomicrobia, Bacteroidetes and Planctomycetes accounted for 21.95%, 21.30%, 17.98%, 12.27%, 11.72% and 9.51%, respectively. The PCoA analysis based on bray-curtis distance showed that the nine sampling sites in Hongchaojiang Reservoir could be divided into three groups, with the bacterial community displaying a gradient change along the upstream and downstream. The perMANOVA test indicated significant differences among the groups. However, there was no significant difference of the diversity index among the groups. Mantel analysis further confirmed that the transparency (Trans), turbidity (Turb), total phosphorus (TP), nitrite nitrogen (NO2N), nitrate nitrogen (NO3N), chlorophyll a (Chlo), pH, dissolved oxygen (DO), oxidation reduction potential (ORP), specific conductivity (SPC), total dissolved solids (TDS), nutritional status (TLI) would affect the planktonic bacteria community structure significantly. [Conclusion] The spatial distribution of bacterioplankton in Hongchaojiang Reservoir is influenced by the combined effects of physical and chemical factors and agricultural activities. These results provided scientific references for understanding the spatial pattern of the plankton-bacterial community and its response to human activities as well as reservoir management.
Keywords: Hongchaojiang Reservoirhigh-throughput sequencingbacterioplankton communityenvironmental factorsspatial distribution
浮游细菌是指水体中营浮游生活的原核生物类群,尽管绝大多数的浮游细菌个体大小只有0.2–2.0 μm,但是它们在水生生态系统生物地球化学循环中具有极其重要的作用[1-2]。作为生态系统中的初级生产者,浮游细菌(例如蓝细菌)通过光合作用合成有机物。生态系统的正常运行离不开稳定的微生物群落结构。在水体中,微生物能够分解有机质,并将其转化为无机营养盐,过量的营养盐转化会导致水体富营养化,造成水华暴发,破坏水域系统的稳态。由于水体的微生物结构相对简单且空间分布结构较为松散,所以浮游微生物对水体环境变化极为敏感。也正因如此,人们将水体浮游微生物当作水体理化性质和水生态的重要环境指示物[3-5]。
洪潮江水库又名星岛湖,坐落在南流江下游的一条主要支流洪潮江上,坝址位于广西北海市合浦县星岛湖镇。控制集雨面积402 km2,总库容7.14亿m3。是一座以灌溉为主,兼顾发电、防洪、旅游等综合利用的大(二)型水利枢纽工程。洪潮江水库是北海市主城区、合浦县以及钦州市钦南区那思镇的规划饮用水水源地。近年来,由于放火烧山造成库区沿岸严重水土流失,非法采矿造成水土流失,无证无序过度捕捞、单一树种(速生桉)种植,库区投饵网箱养鱼造成水体富营养化污染水体,畜禽养殖场产生的污水污染物直排污染水体等问题,洪潮江水库正面临一定的环境压力,严重威胁水库水生态环境安全。目前相关****对洪潮江水库氮磷时空分布[6]、浮游生物[7]以及富营养化[8-9]进行了分析与评价,发现工农业污染正加速水库水质的富营养化进程。然而,作为水体生态系统中重要的组成部分,目前尚未有关于洪潮江水库浮游细菌的相关报道。
全面了解水生态系统中浮游细菌群落多样性、分布特征及其对环境因子的响应,对于管理和维护水域生态环境具有深远的意义。因此,本研究基于16S rRNA基因高通量测序技术,对洪潮江水库浮游细菌群落组成、多样性、空间分布特征及其影响因素进行了分析,以期为保护洪潮江水库水生态环境提供科学参考。
1 材料和方法 1.1 水体样本采集和理化指标测定 于2019年4月在洪潮江水库设置9个采样点,分布于整个库区(图 1),其中S1和S3为上游站点(US),S2、S4、S6位于水库中游(MS),S5、S7、S8、S9位于水库下游(DS)。使用采水器采集表层(0.6 m)水样2 L,其中500 mL水样经0.22 μm微孔滤膜过滤,液氮速冻运输后置于–80 ℃冰箱用于DNA提取,其他水样用于理化指标测定。参照标准方法[10-11],测定水样总氮(TN)、铵氮(NH3N)、总磷(TP)、高锰酸盐指数(CODMn)以及叶绿素a含量(Chlo)、总硬度(TH)、亚硝酸盐氮(NO2N)、硝酸盐氮(NO3N)、总有机碳(TOC)等理化指标。透明度(Trans)采用塞氏盘,浊度(Turb)采用浊度计,水温(WT)、pH、溶解氧(DO)、氧化还原电位(ORP)、比电导(SPC)、总溶解固体(TDS)、盐度(Salinity)采用YSI proplus现场测定。采用综合营养状态指数法进行水质评价[12-13]。
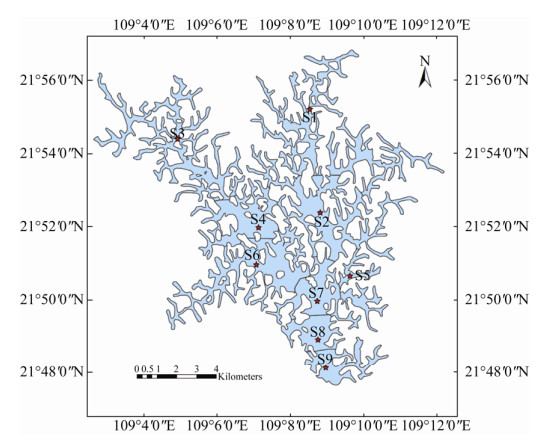 |
| 图 1 洪潮江水库采样点示意图 Figure 1 Sampling sites in Hongchaojiang Reservoir. |
| 图选项 |
1.2 高通量测序 从样本中提取基因组DNA后,用带有barcode的特异引物扩增16S rRNA的V3+V4区。引物序列341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT。后对PCR扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,利用广州基迪奥生物科技有限公司Hiseq2500 PE250上机测序。
1.3 统计分析 测序得到raw reads之后,使用FASTP (https://github.com/OpenGene/fastp)对低质量reads进行过滤,然后运用FLASH进行组装和QIIME再过滤,以保证利用最有效数据聚类成OTU。使用UPARSE流程以97%相似性将优化序列划分可操作分类单元(OTU,operational taxonomic units),采用RDP classifier贝叶斯算法对照Silva数据库以80%置信度对OTU代表序列进行物种分类注释。为避免各样品生物量的差异,按最小样本序列数进行样本序列抽平处理,得到标准化数据进行后续统计分析。基于OTU进行稀释性曲线分析,计算覆盖度(Coverage)、Chao1丰富度指数和Shannon-Weiner多样性指数。采用单因素方差分析进行不同分组细菌多样性指数显著性检验,利用R语言“Vegan”软件包做基于Bray-Curtis距离的PCoA分析,通过Person相关分析和Mantel分析研究环境因子与细菌群落的关系。
2 结果和分析 2.1 水体理化性质 洪潮江水库春季9个采样点的水体理化指标见表 1。各站点透明度(Trans)总体表现出上游低而下游高的趋势,在S1站点最低,S5站点最高,分别为0.5 m和1.3 m;浊度(Turb)在S1站点最高,S9站点最低,分别为22.7 NTU和5.04 NTU;总磷(TP)和叶绿素a (Chlo)含量上游高而下游低,总磷最高值为S1 (0.038 mg/L),最低值为S9 (0.01 mg/L),叶绿素a最高值为S3 (43.046 mg/m3),最低值为S6 (8.4294 mg/m3);其他指标未见明显规律。采用综合营养状态指数法(TLI)进行水质评价发现,除上游S1、S3站点的TLI > 50,为轻度富营养外,其他站点均为中营养型[30≤TLI(∑)≤50],主要是由于S1、S3的透明度(Trans)较低,而叶绿素a(Chlo)含量较高所致。各站点TLI均值为46.14,总体营养状态处于中营养化状态。
表 1. 洪潮江各采样点水体理化因子 Table 1. Physicochemical factors of water samples in the Hongchaojiang Reservoir
| Samples | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 |
| Trans/m | 0.5 | 0.75 | 0.6 | 0.6 | 1.45 | 0.7 | 1.2 | 1.2 | 1.3 |
| Turb/NTU | 22.7 | 11.6 | 21.6 | 17.1 | 5.79 | 21.3 | 7.46 | 6.39 | 5.04 |
| TP/(mg/L) | 0.038 | 0.014 | 0.07 | 0.03 | 0.02 | 0.02 | 0.01 | 0.021 | 0.01 |
| TH/(mg/L) | 9.22 | 13.3 | 17.4 | 10.5 | 11 | 10 | 9.42 | 9.22 | 11.1 |
| TN/(mg/L) | 0.79 | 0.84 | 0.86 | 0.81 | 0.8 | 0.83 | 0.91 | 0.85 | 0.79 |
| NO2N/(mg/L) | 0.021 | 0.025 | 0.05 | 0.032 | 0.019 | 0.029 | 0.019 | 0.018 | 0.015 |
| NO3N/(mg/L) | 0.385 | 0.548 | 0.598 | 0.594 | 0.56 | 0.543 | 0.545 | 0.583 | 0.55 |
| NH3N/(mg/L) | 0.12 | 0.104 | 0.192 | 0.157 | 0.168 | 0.147 | 0.115 | 0.131 | 0.136 |
| CODMn/(mg/L) | 2.95 | 3.79 | 3.03 | 2.78 | 1.94 | 2.77 | 2.53 | 2.36 | 2.4 |
| Chlo/(mg/m3) | 39.3254 | 25.2497 | 43.046 | 18.0858 | 20.9164 | 8.4294 | 15.3548 | 11.2681 | 8.6198 |
| WT/℃ | 27.1 | 28.2 | 27.8 | 27.6 | 28.4 | 28 | 27.1 | 26.3 | 26.1 |
| pH | 7.97 | 8.41 | 9.18 | 8.96 | 8.61 | 8.91 | 8.39 | 8.48 | 8.82 |
| DO/(mg/L) | 8.45 | 9.49 | 9.053 | 9.7 | 9.88 | 10.1 | 9.2 | 10.01 | 9.82 |
| ORP/mV | 238.6 | 112.8 | 51.6 | 78.9 | 85.3 | 98.6 | 106.8 | 119.8 | 98.8 |
| SPC/(μS/cm) | 42.7 | 43.6 | 68.2 | 46.1 | 39 | 44.5 | 40.4 | 40.5 | 39.5 |
| TDS/(g/L) | 27.3 | 27.95 | 44.2 | 29.9 | 25.35 | 29.25 | 26 | 26 | 26 |
| Salinity/% | 0.002 | 0.002 | 0.003 | 0.002 | 0.002 | 0.002 | 0.002 | 0.002 | 0.002 |
| TOC/(mg/L) | 3.068 | 2.898 | 2.939 | 4.3055 | 2.61 | 2.7185 | 2.001 | 2.266 | 2.328 |
| TLI | 54.62156 | 46.98365 | 57.57332 | 48.91343 | 44.25194 | 42.66739 | 40.52824 | 42.40992 | 37.27673 |
表选项
2.2 细菌种类组成与多样性 对洪潮江水库水体样品获得的数据进行处理,得到有效序列总计936565条,每个样品的序列为77970–133598,稀疏曲线表明9个样品的曲线趋向平坦,说明测序深度合理,能反映水体的细菌种类组成。
所得2036个OTU,经物种注释,隶属于28门79纲168目243科325属85种,大部分OTU未能注释到种水平。在门水平,优势门为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes),分别占比21.95%、21.30%、17.98%、12.27%、11.72%、9.51%,合计94.73%。其余门占比均小于2%。各门的分布如图 2所示。
 |
| 图 2 洪潮江水库各站点水体中细菌门的组成 Figure 2 Bacterial taxa composition (phylum level) in water of Hongchaojiang Reservoir. |
| 图选项 |
洪潮江水库浮游细菌的多样性指数见表 2,由表 2可知全部样品的覆盖率指数大于99%,表明测序结果有较好的代表性。方差分析表明,各指数在不同区域的差异不显著(P > 0.05)。
表 2. 浮游细菌群落的多样性指数 Table 2. Diversity index of the bacterioplankton community
| Group | Site | Sobs index | Shannon index | Simpson index | Chao index | Ace index | Goods_coverage index |
| US | S1 | 1203 | 6.741929 | 0.972995 | 1550.357 | 1632.688 | 0.995387 |
| US | S3 | 1107 | 6.649586 | 0.970162 | 1470.951 | 1456.885 | 0.995864 |
| MS | S2 | 1008 | 6.576111 | 0.971958 | 1333.19 | 1357.475 | 0.996162 |
| MS | S4 | 1169 | 7.200611 | 0.985372 | 1537.765 | 1545.107 | 0.995738 |
| MS | S6 | 1123 | 6.749084 | 0.977504 | 1635.468 | 1527.97 | 0.995415 |
| DS | S5 | 1072 | 6.83987 | 0.979151 | 1391.444 | 1375.152 | 0.996251 |
| DS | S7 | 1115 | 6.567637 | 0.972896 | 1488.5 | 1493.219 | 0.995724 |
| DS | S8 | 1066 | 6.668293 | 0.976147 | 1408.366 | 1397.403 | 0.996149 |
| DS | S9 | 1090 | 6.883389 | 0.979686 | 1403.636 | 1412.684 | 0.996148 |
表选项
2.3 群落结构 基于Bray-Curtis距离的PCoA分析表明,洪潮江水库9个采样点可以被分为3组,分别是上游的US组(S1,S3),中游的MS组(S2,S4,S6),以及下游的DS组(S5,S7,S8,S9)。第一轴解释了43.49%的群落变异,第二轴解释了23.86%的群落变异,排序图能反映大部分的群落变异信息。第一轴主要呈现洪潮江浮游细菌群落沿上下游变化的趋势(图 3)。perMANOVA检验显示,各组差异显著(F=4.6213;R2=0.6064;P=0.0010)。对三组样本差异的细菌进行统计分析,发现US与MS差异细菌有疣微菌门(Verrucomicrobia)和Patescibacteria门,疣微菌门(Verrucomicrobia)与Patescibacteria门在MS组均显著高于US组;US与DS差异细菌有蓝细菌门(Cyanobacteria)和疣微菌门(Verrucomicrobia),其中蓝细菌门(Cyanobacteria)在DS组中显著低于US组,而疣微菌门(Verrucomicrobia)在DS组中显著高于US组;DS与MS差异细菌有浮霉菌门(Planctomycetes),其在DS组中显著低于MS组(图 4)。
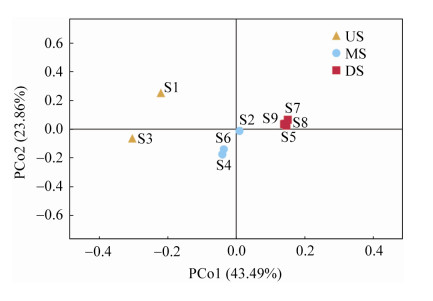 |
| 图 3 浮游细菌群落结构的主坐标分析 Figure 3 PCoA analysis of bacterioplankton community structure. |
| 图选项 |
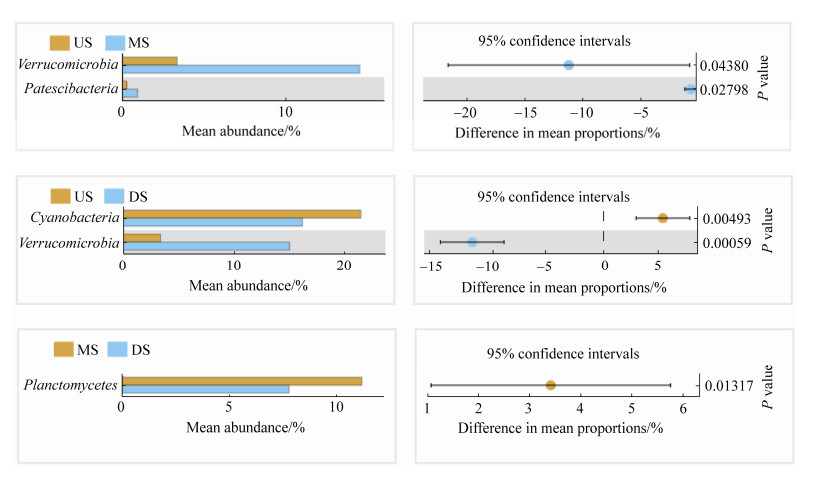 |
| 图 4 各组样品中细菌 Figure 4 Analysis of bacterial differences at phylum level between each group. |
| 图选项 |
2.4 浮游细菌群落结构及功能与环境因子关联分析 Mantel分析表明,透明度(Trans)、浊度(Turb)、总磷(TP)、亚硝酸盐氮(NO2N)、硝酸盐氮(NO3N)、叶绿素a (Chlo)、pH、溶解氧(DO)、氧化还原电位(ORP)、比电导(SPC)、总溶解固体(TDS)、综合营养状态指数(TLI)会显著影响浮游细菌群落结构(图 5,P < 0.05)。
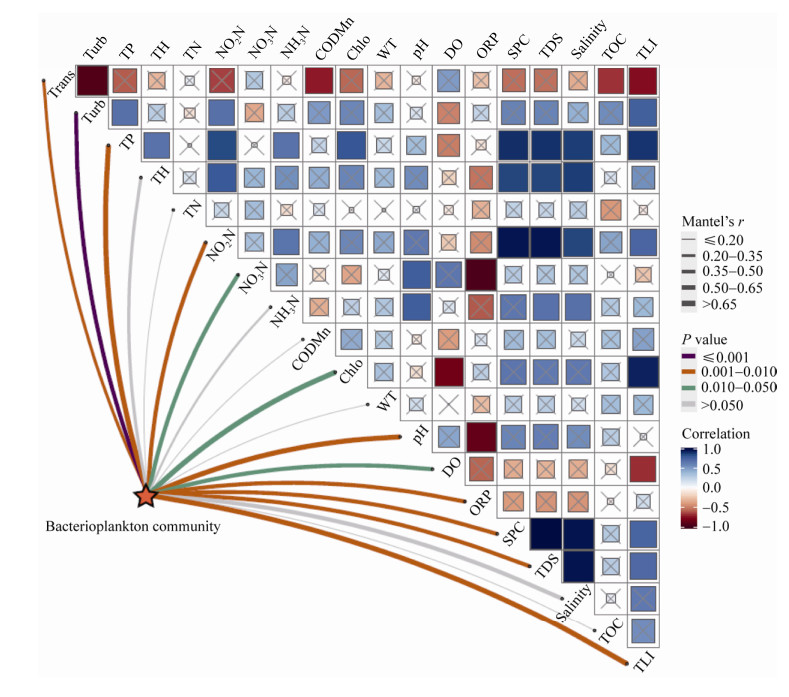 |
| 图 5 环境因子相关性及环境与群落关系的mantel分析 Figure 5 Correlation of environmental factors and mantel analysis of relationship between environment and bacterioplankton community. |
| 图选项 |
为进一步了解浮游细菌群落响应环境的特征,对各细菌门与环境因子进行相关性分析。结果显示,变形菌门(Proteobacteria)与溶解氧(DO)呈显著的负相关;放线菌门(Actinobacteria)与TOC呈显著负相关;蓝细菌门(Cyanobacteria)与浊度(Turb)和总磷(TP)呈显著正相关;疣微菌门(Verrucomicrobia)与浊度(Turb)、总磷(TP)、叶绿素a(Chlo)呈显著正相关,与溶解氧(DO)呈显著负相关;拟杆菌门(Bacteroidetes)与亚硝酸盐氮(NO2N)、铵氮(NH3N)、pH、比电导(SPC)、总溶解固体(TDS)呈显著正相关,与氧化还原电位(ORP)呈显著负相关。详见图 6。
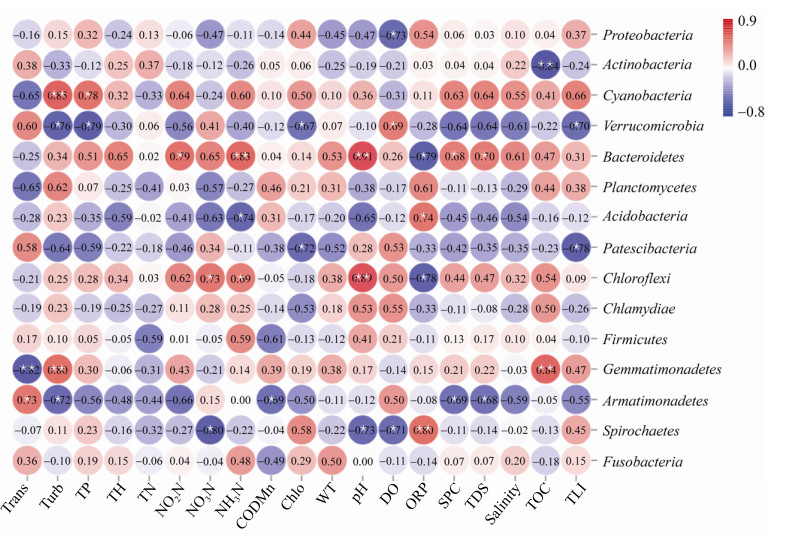 |
| 图 6 细菌门与环境的相关性(丰度排名≤ 15) Figure 6 Relationship between bacteria and environment factors at phylum level (Abundance ranking≤15). Blue represents negative correlation, while red represents positive correlation. *represents significant correlation (P < 0.05) and ** represents extremely significant correlation (P < 0.01). |
| 图选项 |
3 讨论 为了解洪潮江水库水质状况,采用综合营养状态指数法进行评价,发现水库TLI均值为46.14,处于中营养化状态,与张益峰等[9]基于浮游植物的评估结果(生物量为1.47 mg/L,其中中营养型范围1–3 mg/L)基本一致。2004年以后随着经济快速发展,造成大量氮、磷营养盐排入水体,库区富营养化严重,地表水环境质量标准由Ⅱ类以上下降到Ⅲ类、Ⅳ类[8]。放火烧山种植速生桉和非法采矿等活动造成的水土流失极其严重,以及生活废水、养殖污水直排入库等为主要原因[7]。该结果表明洪潮江水库近年的一系列管理措施取得了一定的效果,如投饵养殖的取缔,以及以鲢鳙为主体的“净水渔业”的实施,使库区水质能得到一定的恢复。洪潮江水库浮游细菌主要由变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)组成,分别占比21.95%、21.30%、17.98%、12.27%、11.72%、9.51%。与丹江口水库[14]和三峡水库[15]优势菌门组成类似,也符合典型湖泊、河流等淡水水体中浮游细菌群落组成的规律[16]。由此可知,淡水生境可能拥有相似的优势菌门组成。但是洪潮江水库第一优势菌门为变形菌门(Proteobacteria),而丹江口水库和三峡水库第一优势菌门为放线菌门(Actinobacteria)。而在太湖等富营养化较高甚至出现蓝藻水华的水域,蓝细菌门(Cyanobacteria)往往成为优势菌门[17]。变形菌门的部分种类通过固氮和脱氮作用在全球氮平衡中发挥重要作用[18]。放线菌门的某些物种利用葡萄糖,并具有异养硝化作用,在营养和能量循环中起着关键作用[19]。从蓝细菌门的相对丰度来看,洪潮江水库累积的工农业污染使得该水体正处在富营养化进程之中。这些类群的细菌的生态功能可能是其在淡水生境中广泛分布的原因。蓝细菌门种类由于可引起蓝藻水华而受到广泛关注,其会对饮用水安全造成重大威胁,同时也可能引起其他病原微生物暴发,对库区的养殖活动造成影响。因此对于水库管理而言,应定期监测蓝细菌门细菌的丰度变化。
PCoA分析表明,洪潮江水库9个采样站点的浮游细菌可以划分为3个组,第一组2个站点位于水库上游库汊区,第二组3个站点位于水库中游,第三组4个站点位于水库下游。浮游细菌群落结构空间分布呈现上下游梯度格局。造成这一空间分布的原因可能与水质的理化因子和农业活动有关。上游库汊区(S1,S3)营养状态受网箱养殖、围汊养鸭等生产活动的影响,大量氮、磷营养盐排入水体,呈现富营养化[6-7, 9],使得上游与其他区域显著区分(图 3)。而下游区域(S5,S7,S8,S9)为净水渔业示范区,通过投放鲢、鳙鱼进行不投饵的生态养殖,大量研究表明鲢鳙具有调控水体细菌尤其是蓝藻的能力[20-22],使得下游与中游的细菌群落组成进一步分化。统计分析发现造成上游与下游差异细菌主要是蓝细菌门(Cyanobacteria)和疣微菌门(Verrucomicrobia),其中蓝细菌门(Cyanobacteria)在下游的相对丰度显著低于上游,而疣微菌门(Verrucomicrobia)在下游的相对丰度显著高于上游。蓝细菌作为富营养化的指示物种,其分布特征说明净水渔业的实施产生了一定的效果。值得注意的是,对三个区域的多样性指数进行比较发现各指数均不存在显著性差异。表明各区域之间发生了一定程度的物种替代使得物种多样性水平未发生改变而群落结构呈现显著的变化。
微生物对水环境因子的变化非常敏感,水体中浮游细菌群落受到复杂的生物和非生物过程影响,比如溶解氧、pH、温度、水体营养状态、叶绿素a、浮游生物相互作用等[23-24]。自然环境理化因子和工农业活动综合作用是造成洪潮江水库浮游细菌空间分布特征的主要原因,工农业活动会通过促进自然环境理化因子的改变,进而影响浮游细菌的生长与分布。Mantel分析显示洪潮江水库浮游细菌群落分布主要与透明度(Trans)、浊度(Turb)、总磷(TP)、亚硝酸盐氮(NO2N)、硝酸盐氮(NO3N)、叶绿素a (Chlo)、pH、溶解氧(DO)、氧化还原电位(ORP)、比电导(SPC)、总溶解固体(TDS)、营养状态(TLI)等环境因子显著相关,表明浮游细菌群落组成由于受多种环境因子的共同影响而呈现不同的变化。总磷(TP)、亚硝酸盐氮(NO2N)、硝酸盐氮(NO3N)、叶绿素a (Chlo)、透明度(Trans)、浊度(Turb)及营养状态指数(TLI)是水体营养状态的综合反映。已有大量研究表明水体营养状态是影响浮游细菌群落的主导因子[24-26]。溶解氧是影响水体细菌生存和繁殖的重要指标之一,因而成为影响洪潮江水库浮游细菌的主要环境因子之一。肖汉玉等[27]在乐安江,Spietz等[28]在胡德运河也发现了溶解氧在塑造水体细菌群落中的重要作用。本研究中pH会显著影响洪潮江水库浮游细菌群落,其与拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)呈显著正相关,与螺旋体门(Spirochaetes)呈显著负相关。除了直接影响外,pH还与亚硝酸盐氮(NO2N)、硝酸盐氮(NO3N)以及氧化还原电位(ORP)呈现显著的相关性,表明其会通过这些环境因子间接对细菌群落产生影响。阴星望[29]在丹江口水库亦发现类似的现象:pH是影响丹江口库区浮游细菌群落组成的重要因素,其中拟杆菌门(Bacteroidetes)与pH呈显著性正相关。在相关的研究中,细菌群落的组成变化更多由温度驱动[30-31],温度可影响细菌生长。然而本研究中未发现浮游细菌空间分布受水温的影响,可能是本研究仅牵涉一个季节,各站点温度差异较小。因此为更全面了解浮游细菌群落动态及其影响因素,还有待对洪潮江水库浮游细菌的季节、年度变化进行持续研究。
References
| [1] | Garcia SL, Salka I, Grossart HP, Warnecke F. Depth-discrete profiles of bacterial communities reveal pronounced spatio-temporal dynamics related to lake stratification. Environmental Microbiology Reports, 2013, 5(4): 549-555. |
| [2] | Xu Q, Jia KL, Li WB, Wang LM, Zhao SN, Yu RX, Yang JH. Characteristics of the summer phytoplankton community structure in Dalinor Lake. Journal of Hydroecology, 2016, 37(6): 14-22. (in Chinese) 徐琼, 贾克力, 李文宝, 王利明, 赵胜男, 于瑞雪, 杨久辉. 达里诺尔湖夏季浮游植物群落结构及分布特征. 水生态学杂志, 2016, 37(6): 14-22. |
| [3] | Fortunato CS, Eiler A, Herfort L, Needoba JA, Peterson TD, Crump BC. Determining indicator taxa across spatial and seasonal gradients in the Columbia River coastal margin. The ISME Journal, 2013, 7(10): 1899-1911. |
| [4] | Paerl HW, Dyble J, Moisander PH, Noble RT, Piehler MF, Pinckney JL, Steppe TF, Twomey L, Valdes LM. Microbial indicators of aquatic ecosystem change:current applications to eutrophication studies. FEMS Microbiology Ecology, 2003, 46(3): 233-246. |
| [5] | Sun MY, Dafforn KA, Brown MV, Johnston EL. Bacterial communities are sensitive indicators of contaminant stress. Marine Pollution Bulletin, 2012, 64(5): 1029-1038. |
| [6] | Wang XH, Huang CM, Qin QR, Li QH. Spatiotemporal distribution and eutrophication of nitrogen and phosphorus in Hongchaojiang reservoir, Beibu Gulf, China. Hunan Agricultural Sciences, 2010(24): 24-25, 29. (in Chinese) 王晓辉, 黄翠梅, 覃秋荣, 李秋华. 北部湾地区洪潮江水库氮磷时空分布及富营养成因研究. 湖南农业科学, 2010(24): 24-25, 29. |
| [7] | He AY, Han YQ, Lei JJ. Phytoplankton survey in cage culture area of Hongchaojiang reservoir. Guangxi Aquatic Science and Technology, 2012, 41(3): 6-14. (in Chinese) 何安尤, 韩耀全, 雷建军. 洪潮江水库网箱养殖区浮游植物调查. 广西水产科技, 2012, 41(3): 6-14. |
| [8] | Wang XH. Analysis on the cause of eutrophication in Hongchaojiang Reservoir. China Water Transport, 2013(8): 122-123. (in Chinese) 王晓辉. 洪潮江水库富营养成因分析. 中国水运(下半月), 2013(8): 122-123. |
| [9] | Zhang YF, Ye Q, Chen X, Wei CY, Yang MW. The evaluation and analysis of flood tide river eutrophication status. Popular Science & Technology, 2014, 16(8): 57-59. (in Chinese) 张益峰, 叶权, 陈旭, 韦昌用, 杨明伟. 洪潮江水库富营养化状态评价与分析. 大众科技, 2014, 16(8): 57-59. |
| [10] | 金相灿, 刘鸿亮, 屠清瑛. 中国湖泊富营养化. 北京:中国环境科学出版社, 1990. |
| [11] | Sun W, Xia CY, Xu MY, Guo J, Sun GP. Application of modified water quality indices as indicators to assess the spatial and temporal trends of water quality in the Dongjiang River. Ecological Indicators, 2016, 66: 306-312. |
| [12] | Wang MC, Liu XQ, Zhang JH. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. (in Chinese) 王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49. |
| [13] | 郭成久, 洪梅, 闫滨. 基于综合营养状态指数法的石佛寺水库水质富营养化评价. 沈阳农业大学学报, 2016, 47(1): 119-123. |
| [14] | Chen ZJ, Ding CY, Zhu JY, Li B, Huang J, Du ZM, Wang Y, Li YY. Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir. China Environmental Science, 2017, 37(1): 336-344. (in Chinese) 陈兆进, 丁传雨, 朱静亚, 李冰, 黄进, 杜宗明, 王亚, 李玉英. 丹江口水库枯水期浮游细菌群落组成及影响因素研究. 中国环境科学, 2017, 37(1): 336-344. |
| [15] | Luo F, Lu LH, Li Z, Fu C, Yan B. Composition and functions of planktonic microbial communities based on metagenomic approach:a case study in Chongqing urban section of the Three Gorges Reservoir. Ecology and Environmental Monitoring of Three Gorges, 2019, 4(3): 1-10. (in Chinese) 罗芳, 鲁伦慧, 李哲, 付川, 闫彬. 基于宏基因组学的三峡库区重庆主城段水体浮游微生物群落的组成和功能分析. 三峡生态环境监测, 2019, 4(3): 1-10. |
| [16] | Wu XB, Ye F, Jiang Y, Wu SJ, Liu H, Wang C, Zhang W, Wang Y. Bacterioplankton community structure in the mainstream of Yangtze River and driving factors. Resources and Environment in the Yangtze Basin, 2019, 28(7): 1652-1662. (in Chinese) 吴晓冰, 叶飞, 姜毅, 吴胜军, 刘鸿, 王川, 张炜, 王雨. 长江干流浮游细菌群落结构及影响因素. 长江流域资源与环境, 2019, 28(7): 1652-1662. |
| [17] | Xu C, Zhang JY, Zhu BC, Song T, Huang J, Wu W. Extensive profiling of a bacterial community during Summer in Meiliang Bay, Lake Taihu. Environmental Monitoring and Forewarning, 2015, 7(1): 37-40. (in Chinese) 徐超, 张军毅, 朱冰川, 宋挺, 黄君, 吴蔚. 夏季太湖梅梁湾水体中细菌的群落结构. 环境监控与预警, 2015, 7(1): 37-40. |
| [18] | Liu ZH, Huang SB, Sun GP, Xu ZC, Xu MY. Phylogenetic diversity, composition and distribution of bacterioplankton community in the Dongjiang River, China. FEMS Microbiology Ecology, 2012, 80(1): 30-44. |
| [19] | Elifantz H, Malmstrom RR, Cottrell MT, Kirchman DL. Assimilation of polysaccharides and glucose by major bacterial groups in the Delaware Estuary. Applied and Environmental Microbiology, 2005, 71(12): 7799-7805. |
| [20] | Zhang X, Xie P, Hao L, Guo NC, Gong YG, Hu XL, Chen J, Liang GD. Effects of the phytoplanktivorous silver carp (Hypophthalmichthys molitrixon) on plankton and the hepatotoxic microcystins in an enclosure experiment in a eutrophic lake, Lake Shichahai in Beijing. Aquaculture, 2006, 257(1/4): 173-186. |
| [21] | Guo LG, Wang Q, Xie P, Tao M, Zhang J, Niu Y, Ma ZM. A non-classical biomanipulation experiment in Gonghu Bay of Lake Taihu:control of Microcystis blooms using silver and bighead carp. Aquaculture Research, 2015, 46(9): 2211-2224. |
| [22] | 徐跑. 蠡湖净水渔业研究与示范. 上海:上海科学技术出版社, 2017. |
| [23] | Souffreau C, van der Gucht K, van Gremberghe I, Kosten S, Lacerot G, Lob o LM, de Moraes Huszar VL, Roland F, Jeppesen E, Vyverman W, de Meester L. Environmental rather than spatial factors structure bacterioplankton communities in shallow lakes along a >6000 km latitudinal gradient in South America. Environmental Microbiology, 2015, 17(7): 2336-2351. |
| [24] | Kong ZY, Kou WB, Ma YT, Yu HT, Ge G, Wu L. Seasonal dynamics of the bacterioplankton community in a large, shallow, highly dynamic freshwater lake. Canadian Journal of Microbiology, 2018, 64(11): 786-797. |
| [25] | Haukka K, Kolmonen E, Hyder R, Hietala J, Vakkilainen K, Kairesalo T, Haario H, Sivonen K. Effect of nutrient loading on bacterioplankton community composition in lake mesocosms. Microbial Ecology, 2006, 51(2): 137-146. |
| [26] | Teira E, Martínez-García S, Calvo-Díaz A, Morán XAG. Effects of inorganic and organic nutrient inputs on bacterioplankton community composition along a latitudinal transect in the Atlantic Ocean. Aquatic Microbial Ecology, 2010, 60(3): 299-313. |
| [27] | Xiao HY, Wang P, Liu JZ, Li CQ, Li Y, Zhao J. Characteristics of bacterial community in Le'an River in winter based on high-throughput sequencing. Acta Microbiologica Sinica, 2019, 59(1): 181-194. (in Chinese) 肖汉玉, 王鹏, 刘君政, 李传琼, 李燕, 赵君. 基于高通量测序的乐安江冬季细菌群落特征分析. 微生物学报, 2019, 59(1): 181-194. |
| [28] | Spietz RL, Williams CM, Rocap G, Horner-Devine MC. A dissolved oxygen threshold for shifts in bacterial community structure in a seasonally hypoxic Estuary. PLoS One, 2015, 10(8): e0135731. |
| [29] | 阴星望. 丹江口水库微生物群落特征及其与水质的关系研究. 南阳师范学院硕士学位论文, 2019. |
| [30] | Sunagawa S, Coelho LP, Chaffron S, Kultima JR, Labadie K, Salazar G, Djahanschiri B, Zeller G, Mende DR, Alberti A, Cornejo-Castillo FM, Costea PI, Cruaud C, d'Ovidio F, Engelen S, Ferrera I, Gasol JM, Guidi L, Hildebrand F, Kokoszka F, Lepoivre C, Lima-Mendez G, Poulain J, Poulos BT, Royo-Llonch M, Sarmento H, Vieira-Silva S, Dimier C, Picheral M, Searson S, Kandels-Lewis S, Bowler C, de Vargas C, Gorsky G, Grimsley N, Hingamp P, Iudicone D, Jaillon O, Not F, Ogata H, Pesant S, Speich S, Stemmann L, Sullivan MB, Weissenbach J, Wincker P, Karsenti E, Raes J, Acinas SG, Bork1 P. Structure and function of the global ocean microbiome. Science, 2015, 348(6237): 1261359. |
| [31] | Ma LL, Mao GN, Liu J, Gao GH, Zou CL, Bartlam MG, Wang YY. Spatial-temporal changes of bacterioplankton community along an exhorheic river. Frontiers in Microbiology, 2016, 7: 250. |
