闫敏1#, 秦诗洁1#, 崔永亮2, 涂卫国2, 沈甜1, 刘含1, 张芳1, 余秀梅1


1. 四川农业大学资源学院, 四川成都 611130;
2. 四川省自然资源科学研究院, 四川成都 610041
收稿日期:2020-01-06;修回日期:2020-03-19;网络出版日期:2020-04-08
基金项目:四川省重点研发项目(2017SZ0087);国家自然科学基金(31872696);四川省重大科技专项课题(2017NZDZX0003)
*通信作者:余秀梅, Tel:+86-28-86290982;E-mail:yuxiumeicool@163.com.
#并列第一作者
摘要:[目的] 探究镉吸附细菌是否能够高效固定土壤有效镉(Cd),为土壤有效Cd的微生物固定提供理论依据。[方法] 利用含Cd2+牛肉膏蛋白胨液体培养基对细菌进行Cd的耐受性测试筛选出镉抗性强的菌株;通过16S rRNA基因相似性及系统进化分析鉴定耐镉细菌,将菌细胞加入含CdCl2溶液中进行Cd2+吸附效率测定;通过土培模拟实验,测定土壤pH、碱解氮、有效磷、速效钾、有机质、CEC、有效Cd及微生物数量来分析镉吸附细菌对镉污染土壤的影响。[结果] 从德阳鱼腥草根际土壤中分离获得的57株细菌对Cd2+表现出不同程度的抗性,并从中筛选出3株耐Cd优势细菌普罗威登斯菌属(Providencia)DY8、芽孢杆菌属(Bacillus)DY3和芽孢杆菌属(Bacillus)DY1-4。其对溶液中的Cd2+表现出较好的吸附作用,吸附效率随着Cd2+浓度升高而降低。DY8、DY3、DY1-4能使镉污染土壤中有效Cd含量分别降低72.11%、68.55%、62.32%,同时显著提高镉污染土壤中碱解氮、有效磷的含量。[结论] Cd污染农田土壤中含有丰富的耐Cd微生物资源,Cd吸附细菌能降低土壤中有效Cd的含量,且能有效改善土壤养分条件。
关键词:农田土壤细菌镉吸附镉固定
Isolation of cadmium-adsorbing bacteria for soil cadmium fixation
Yan Min1#, Qin Shijie1#, Cui Yongliang2, Tu Weiguo2, Shen Tian1, Liu Han1, Zhang Fang1, Yu Xiumei1


1. College of Resources, Sichuan Agricultural University, Chengdu 611130, Sichuan Province, China;
2. Sichuan Natural Resources Research Institute, Chengdu 610041, Sichuan Province, China
Received: 6 January 2020; Revised: 19 March 2020; Published online: 8 April 2020
*Corresponding author: Xiumei Yu. Tel: +86-28-86290982; E-mail: yuxiumeicool@163.com.
Foundation item: Supported by Key R & D Project of Sichuan Province (2017SZ0087), by the National Natural Science Foundation of China (31872696), and by the Major Science and Technology Special Project of Sichuan Province (2017NZDZX0003)
#Those authors contributed equally to this work
Abstract: [Objective] To study Cd-adsorbing bacteria for fixing soil Cd. [Methods] Tolerance of microbe against Cd was measured in the beef extract peptone liquid medium containing Cd2+ to select cadmium-resistant strains. The cadmium-tolerant bacteria were identified by 16S rRNA gene similarity and phylogenetic analysis, The adsorption efficiency of bacteria for Cd2+ was determined by adding bacteria cells into the solution containing CdCl2. Soil culture simulation experiment was performed to analyze the effects of cadmium adsorption bacteria on cadmium-contaminated soil by determining soil pH, alkali-hydrolyzed nitrogen, available phosphorus, available potassium, organic matter, CEC, available Cd and the number of microorganisms. [Results] Total of 57 bacteria strains isolated from the rhizosphere soil of Houttuynia cordata at Deyang showed different degrees of resistance to Cd2+. Three dominant Cd-resistant bacteria strains were Providencia DY8, Bacillus DY3 and Bacillus dy1-4. They showed good adsorption efficiency to Cd2+ in liquid. The adsorption efficiency of Cd2+ decreased with the Cd2+ concentration increasing. DY8, DY3 and DY1-4 reduced the effective Cd content in cadmium-contaminated soil by 72.11%, 68.55% and 62.32%, respectively, and significantly increased the alkali-dissolved nitrogen and available phosphorus in cadmium-contaminated soil. [Conclusion] The Cd-contaminated farmland soil contains rich resources of Cd-resistant microorganisms. Cd-absorbing bacteria can reduce the content of effective Cd in soil and improve soil nutrient conditions.
Keywords: farmland soilbacteriacadmium adsorptioncadmium fixation
镉(Cd)是毒性极强的重金属之一,也是痕量金属中可移动性、生物活性最强的元素。土壤镉(Cd)污染具有隐蔽性、累积性、长期性、滞后性、不可逆且难以被土著生物降解等特点,不仅会恶化土壤生态系统,影响作物的质量及产量,还可通过食物链在人体内富集并对人体健康造成严重威胁[1-3]。Cd并非人体必需的微量元素,但其可通过呼吸道和消化道进入人体,对人体造成极大伤害。研究表明,Cd会与某些蛋白质分子结合生成镉蛋白质,影响人体对营养物质的消化吸收[4];Cd还可以通过一系列的生化反应降低机体清除自由基的能力,引起氧化损伤,引发细胞毒性和导致癌变[5]。土壤中的Cd会使土壤环境质量恶化,减少土壤中的细菌特别是固氮菌的数量、影响土壤酶活性。植物体内的Cd浓度过高会干扰植物根系的生长、损坏叶绿体结构导致植物无法正常进行光合作用等。
土壤Cd污染形势严峻,引起国内外****的广泛关注。目前土壤Cd污染修复有化学、物理和生物3种修复方式[6]。其中,生物修复中的微生物修复是指与重金属有较强亲合力的微生物,可通过生物吸附、生物转化、生物累积、胞外沉淀和外排作用等途径降低土壤重金属的毒性[6-7]。据研究报道,枯草芽孢杆菌可使花生籽粒Cd积累量降低25.37%[8];光合细菌、乳酸菌和枯草芽孢杆菌可使菠菜植株Cd含量下降14.5%[9];啤酒酵母对镉有很好的吸附作用,在最适条件下吸附率可达到92.2%[10];经过固化的阿里希氏菌具有极强的Cd2+的去除能力且储存稳定可长期使用[11]。此外,巨大芽孢杆菌、恶臭假单胞菌、地衣芽孢杆菌以及某些藻类,产生的胞外聚合物能够与Cd2+形成络合物,进而有效降低植物对土壤中Cd的吸收[12-14],还有****从砷和镉污染的农田土壤中分离出了苯酚杆菌属新种[15]。利用微生物修复技术修复Cd污染土壤,可以改善土壤环境,且成本低、能耗地、不产生二次污染,故具有广阔的应用和发展前景。
因此,本研究主要从重金属污染严重地区的鱼腥草根际土壤中分离筛选出具有Cd抗性且能高效吸附Cd的细菌资源,并通过室内模拟实验研究Cd吸附细菌对农田土壤Cd的固定效果,为农田土壤Cd污染的微生物钝化修复提供理论依据和可利用的菌株资源。
1 材料和方法 1.1 材料
1.1.1 菌株、供试土壤及培养基: 菌株DY1-4、DY8、DY3分离自四川德阳地区鱼腥草根际土壤并保存,土壤总镉含量为0.31–1.26 mg/kg,有效镉含量为0.15–0.46 mg/kg,pH为5.90–6.80。Cd钝化室内模拟试验的土壤采集自德阳地区含Cd的农田土壤,土壤总镉含量为1.26 mg/kg,有效镉含量为0.46 mg/kg,pH为5.20,新鲜采集的土壤样品置于无菌袋中带回学校实验室进行实验。
牛肉膏蛋白胨培养基(g/L):牛肉膏5.0,蛋白胨10.0,NaCl 5.0,琼脂粉20,蒸馏水1 L,pH 7.0,1×105 Pa灭菌30 min;牛肉膏蛋白胨液体培养基:牛肉膏蛋白胨培养基不加琼脂,1×105 Pa灭菌30 min。
1.1.2 主要仪器: 立式高压蒸汽灭菌锅LDZF75LⅢ (上海申安医疗器械厂);双层恒温摇床HY150S (武汉汇诚生物技术有限公司);分光光度计V-1100D (上海美谱达仪器有限公司);离心机Centrifuge5148R (艾本德中国有限公司);火焰光度计FP6410 (上海精科仪器有限公司);PCR仪、凝胶成像系统、聚丙烯酰胺凝胶电泳仪(Bio-Rad公司);ICP-AES (美国热电公司)。
1.2 耐镉细菌的分离与纯化 称取10 g供试土样,无菌操作下将其放入装有适量玻璃珠和90 mL无菌水的三角瓶中,160 r/min、28 ℃振荡30 min后分别稀释到10–3、10–4、10–5。各吸取0.1 mL上清液涂布在牛肉膏培养基平板上,28 ℃恒温箱中培养48 h后统计其数量,挑选出具有不同形态特征的单菌落,在牛肉膏平板上进行划线纯化并用革兰氏染色进行染色镜检,直至获得纯化菌株后保种放入4 ℃冰箱中保存备用。
1.3 细菌的镉耐受性测试 筛选出的菌株接种于液体牛肉膏培养基中,恒温摇床160 r/min、28 ℃培养24 h;按1%比例接种新鲜菌液于不同Cd2+浓度牛肉膏培养基中,培养基Cd2+浓度分别为50、100、150、200、250、300、350、400、450、500、550、600、650、700 mg/L,每个浓度处理重复3次;160 r/min、28 ℃摇床培养48 h,用可见分光光度计测定OD600值,以普通液体牛肉膏培养基作参比,根据测定菌株的生长状况来初步判断细菌的Cd耐受性[16]。
1.4 耐镉细菌的镉吸附效率测试 将菌株接种于普通牛肉膏蛋白胨平板上培养24 h后收集菌细胞,用磷酸盐盐水反复清洗离心后制备成菌悬液。再将菌液按1%的比例分别接种在含Cd2+浓度为20、50、100、200 mg/L的无菌水中,每个处理3次重复,160 r/min、28 ℃培养8 h,离心收集上清液,稀释过滤后ICP-AES测定上清液中残留Cd2+的浓度,据此计算菌株Cd2+的吸附效率[17]。
1.5 镉耐受细菌的分子鉴定 使用Sangon Biotech细菌基因组DNA快速抽提试剂盒提取细菌总DNA保存于–20 ℃冰箱备用。菌株16S rRNA的PCR扩增[18]引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系(30 μL):2×PCR Mix 15 μL;27F (10 pmol) 0.15 μL;1492R (10 pmol) 0.15 μL;DNA模板(50 ng/mL) 1 μL;ddH2O补足至30 μL。PCR扩增程序为:94 ℃ 3 min;94℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,35个循环数;72 ℃ 8 min。16S rRNA扩增片段长度在1.5 kb左右,扩增产物用1%琼脂糖凝胶电泳检测,合格后送生工生物工程(上海)股份有限公司测序。测序结果在GenBank中进行BLAST分析,并用MEGA7.0邻接法(Neighbour-Joining)构建16S rRNA系统进化树,确定Cd耐受细菌的相似性与系统进化地位。
1.6 镉吸附细菌固定土壤镉的功能验证 采集Cd污染农田土壤,晾干磨细后分装到灭菌的塑料花盆中(1 kg/盆),分别加入3株Cd吸附细菌的新鲜培养液(浓度约为108 CFU/mL) 200 mL充分混匀,以使土壤菌细胞含量约为0.2亿cell/g。同时分别施加等量无菌水(CK1)和牛肉膏蛋白胨液体培养基(CK2)作为对照,每处理3次重复。25 ℃光照实验室放置10 d后,用新鲜土样测定土壤微生物数量,用20目和100目的风干土样测定土壤有效Cd含量和土壤理化性质。
土壤有效Cd测定:取4.00 g 20目风干土样,加入40 mL DTPA浸提剂,振荡2 h后过滤,用ICP-MS测定有效Cd含量[19]。
土壤微生物数量的测定:同1.2.1中菌株分离方法,取0.1 mL浓度为10–5的稀释液进行平板培养,根据培养的菌落数计算土壤中的活菌数量。
土壤理化性质测定:土壤理化性质主要测定土壤pH、碱解氮、有效磷、速效钾、有机质含量及阳离子交换量。土壤pH采用电位测定法,碱解氮采用水解扩散法,有效磷采用碳酸氢钠浸取-钼锑抗比色法,速效钾采用醋酸铵浸提-原子吸收火焰光度法;土壤有机质采用重铬酸钾外加热容量法;阳离子交换量采用EDTA-铵盐法测定[20]。
2 结果和分析 2.1 镉耐受细菌的分离与筛选 本研究采用稀释涂布平板法从四川广汉鱼腥草根际土壤中分离纯化细菌,根据细菌菌落形态的大小、形状、颜色等特征挑选出不同菌落特征的菌株57株,分离纯化后利用含Cd2+培养基进行筛选。菌株存活率随培养基含Cd2+浓度升高不断降低,超过40%的菌株在Cd2+为50 mg/L的培养液中难以存活(图 1),当培养基Cd2+浓度达到150 mg/L,菌株存活率仅为19.30%,当培养基中Cd2+浓度在300–550 mg/L时,有7株菌株存活,培养基Cd2+浓度升高到650 mg/L时,仅剩3株细菌存活。根据镉耐受性实验筛选出不同Cd2+浓度下抗逆性较好的3株菌株DY1-4、DY8以及DY3。
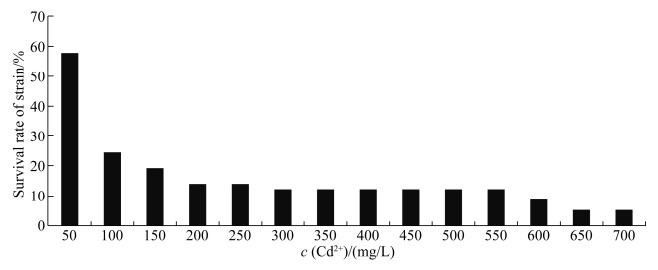 |
| 图 1 不同Cd2+浓度下土壤细菌存活率 Figure 1 Soil bacterial survival rate under different Cd2+ concentrations. |
| 图选项 |
DY1-4、DY8、DY3三株优势菌株在不同Cd2+浓度培养基中生长趋势大致相同(图 2),菌液OD600随培养基中Cd2+浓度增加而下降。DY1-4、DY8、DY3的最低抑制浓度(minimum inhibitory concentration,MIC)分别为350、350、500 mg/L,最低致死浓度(minimum lethal concentration,MLC)分别为1420、960、840 mg/L。当培养基Cd2+浓度为50 mg/L时,DY1-4、DY8、DY3的OD600值均大于0.5,表明长势较好;培养基Cd2+浓度在50–200 mg/L时,尽管Cd2+浓度不断增加,但菌株生长受Cd2+浓度影响较小,OD值下降速度较为缓慢;Cd2+浓度达到350 mg/L时,DY8、DY3生长状况均受到明显抑制;DY1-4在培养液Cd2+浓度达到500 mg/L时生长受到明显抑制。3株细菌均可在高Cd2+含量环境中生长,据实验结果初步判断DY1-4对Cd2+的耐受性高于DY8、DY3。
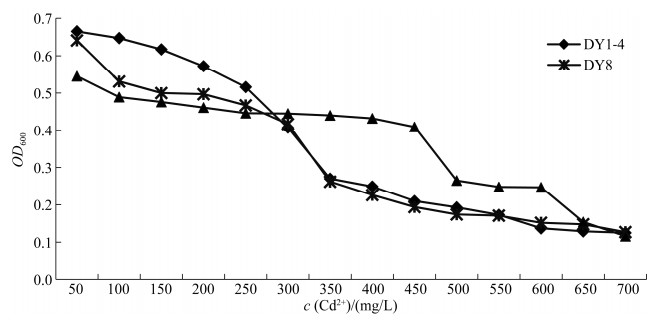 |
| 图 2 不同Cd2+浓度下镉耐受细菌DY1-4、DY8、DY3生长曲线 Figure 2 Growth curve of cadmium-tolerant bacteria DY1-4, DY8, DY3 under different Cd2+ concentrations. |
| 图选项 |
2.2 镉耐受细菌的镉吸附性效率分析 同一菌株在不同Cd2+浓度溶液中吸附能力差异明显(图 3),随Cd2+浓度升高,3株菌株的Cd2+吸附效率不断下降,3株细菌Cd2+吸附率均表现为20 mg/L > 50 mg/L > 100 mg/L > 200 mg/L。在Cd2+浓度为20 mg/L时,3种菌株对Cd2+的去除率达到100%;Cd2+浓度达到200 mg/L时,吸附效率下降到较低水平,该浓度下DY1-4的吸附效果最好吸附率为27.5%;当Cd2+溶液浓度分别为100 mg/L和200 mg/L时,DY1-4、DY8对同一浓度Cd2+吸附能力差异不显著。说明在一定初始浓度范围内,离子与菌株细胞间的物质传递能力随Cd2+初始浓度增加而增强,Cd2+易被细菌钝化。但培养液中的Cd2+达到一定浓度时,处于饱和状态的菌体表面富集基团和内部吸附位点无法进一步吸收Cd2+。对菌株而言高浓度的Cd2+有一定抑制性,能改变菌体细胞的结构、成分,使菌株富集、代谢能力下降。DY1-4、DY8、DY3在相同Cd2+浓度溶液中的Cd2+吸附率有显著差异,菌株DY1-4整体表现更为稳定,预估3种菌株处理污染土壤中Cd2+含量低于20 mg/kg时可能有较明显的效果。
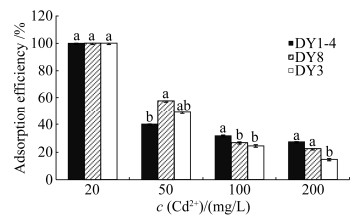 |
| 图 3 镉耐受细菌在不同浓度Cd2+溶液的Cd2+吸附性效率 Figure 3 Cd2+ adsorption efficiency of cadmium- tolerant bacteria in different concentrations of Cd2+ solution; The different letters indicated significant difference (P < 0.05). |
| 图选项 |
2.3 镉耐受细菌的分子鉴定 对筛选出的3株Cd2+耐受细菌和12株普罗威登斯菌属(Providencia sp.)以及30株芽孢杆菌属(Bacillus sp.)的标准菌株进行16S rRNA系统发育树构建,以此确定优势菌株属以及属以上分类单位的亲缘关系[21],结果如图 4所示。
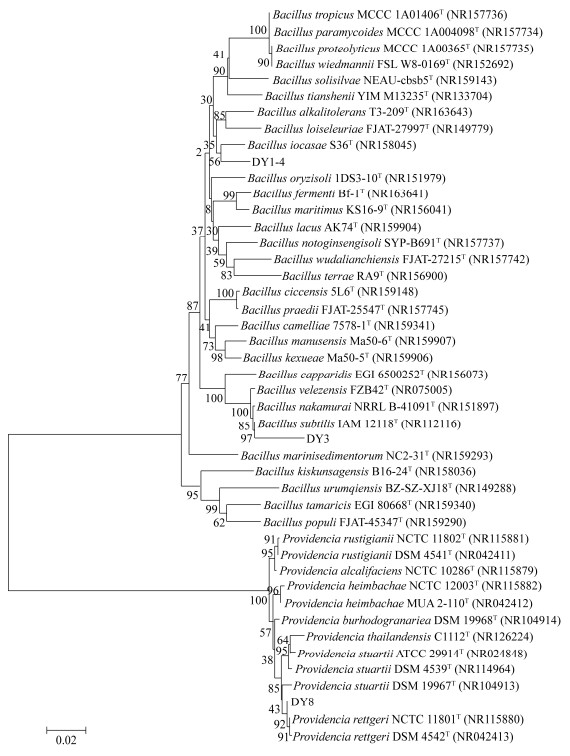 |
| 图 4 镉吸附细菌16S rRNA基因的系统发育树 Figure 4 Phylogenetic tree of cadmium-adsorbing bacterial 16S rRNA gene. T: standard strain. The numbers at each branch points is the percentage supported by bootstrap; Bar 0.02 at the bottom is the sequence divergence; Those in parentheses are the accession numbers in GenBank. |
| 图选项 |
本研究中获得的3株Cd2+耐受性细菌的16S rRNA基因序列与普罗威登斯菌属(Providencia sp.)和芽孢杆菌属(Bacillus sp.)高度同源(97%–100%)。其中菌株DY3和菌株DY1-4属于芽孢杆菌属(Bacillus sp.),DY1-4菌株与菌株Bacillus iocasae S36T遗传距离最近,说明其可能是碘化芽孢杆菌(Bacillus iocasae);DY3菌株与标准菌株Bacillus subtilis IAM12118T遗传距离最近,亲缘性高,以此鉴定为枯草芽孢杆菌(Bacillus subtilis)。菌株DY8独立存在于另一个普罗威登斯菌属(Providencia sp.)的小分支上,与标准菌株Providencia rettgeri NCTC11801T的遗传距离最近,以此鉴定为雷氏普罗威登斯菌(Providencia rettgeri)。
2.4 镉吸附细菌对土壤镉的钝化功能验证
2.4.1 镉吸附细菌对土壤有效Cd2+的影响: 两组对照与三组施加菌剂的实验组之间土壤有效Cd差异显著(P < 0.05),实验组DY3和DY8之间无显著差异(P > 0.05) (图 5)。与CK1、CK2相比,施加DY14、DY8、DY3菌剂对土壤有效Cd有明显的固定作用,使土壤中有效Cd分别降低了62.32%、72.11%、68.55%,推测是3株Cd吸附细菌不仅能直接降低土壤中Cd的生物活性,还可以通过影响土壤pH值等间接降低土壤中有效Cd含量。
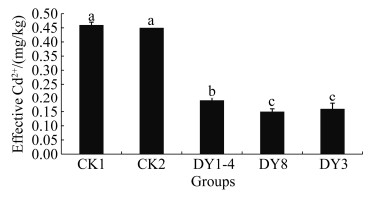 |
| 图 5 镉吸附细菌对土壤有效Cd的影响 Figure 5 Effect of cadmium adsorption bacteria on soil effective Cd. The different letters indicated significant difference (P < 0.05). |
| 图选项 |
2.4.2 镉吸附细菌对土壤有效理化性质和细菌数量的影响: 5组实验处理下土壤pH值、碱解氮、有效磷、速效钾差异有统计学意义(表 1),2组对照所有指标均无显著差异,表明在土壤中加入培养液对研究涉及指标的影响可以忽略不计。2组CK的土壤pH值均显著高于施加菌剂的实验处理,但DY14、DY8、DY3两两之间pH无显著差异,表明施加菌剂增加了土壤酸性。菌株DY14、DY8、DY3处理下土壤有机质、CEC及速效钾均有所增加但不显著,说明这3株细菌解钾等功能还有待探索。施加Cd吸附细菌处理下的土壤碱解氮、有效磷均显著高于CK1、CK2,施加DY14、DY8、DY3菌剂的土壤碱解氮含量分别提高了19.39%、22.23%、21.41%,速效磷含量分别提升4.75%、6.43%、4.54%,这与研究发现的具有促进磷酸盐溶解能力的Bacillus subtilis SJ-101Cd吸附细菌[22]相似。其原因可能是土壤中Cd对耐镉细菌产生一定作用,使其分泌较多酸性物质而使土壤pH降低,此外菌株通过调节pH或产生硫化氢沉淀Cd或与环境中Cd络合、螯合,减少土壤中NH4+、PO43-与Cd的络合,从而减少了土壤中有效Cd含量,提高土壤有效氮、有效磷含量,有效改善了土壤肥力。施入菌剂的土壤中微生物数量较CK1、CK2组少且差异显著,说明往土壤中接入大量的Cd吸附细菌明显抑制了土壤土著微生物的生长。
表 1. 镉吸附细菌对土壤理化性质的影响 Table 1. Effects of three strains on effective physicochemical properties of soil
| Groups | CK1 | CK2 | DY3 | DY1-4 | DY8 |
| pH | 5.24±0.08a | 5.15±0.09a | 4.71±0.29b | 4.58±0.39b | 4.67±0.16b |
| SOM/%) | 2.31±0.04a | 2.34±0.11a | 2.43±0.06a | 2.41±0.04a | 2.45±0.06a |
| CEC/(cmol/kg) | 17.94±1.92a | 18.96±0.59a | 20.09±0.98a | 20.29±0.77a | 20.53±0.74a |
| AN/(mg/kg) | 96.06±3.08b | 97.86±1.23b | 117.02±1.95a | 115.04±1.82a | 117.82±1.24a |
| AP/(mg/kg) | 118.78±1.45b | 119.74±1.50b | 124.22±2.42a | 124.47±4.01a | 126.48±2.01a |
| AK/(mg/kg) | 86.14±2.93a | 86.92±1.63a | 89.22±0.98a | 89.34±1.31a | 90.70±1.58a |
| Number of bacteria/(1×107 CFU/g) | 5.43±1.02a | 4.56±0.92b | 3.33±.70c | 3.27±0.94c | 4.03±0.89bc |
| The different letters indicated significant difference (P < 0.05). | |||||
表选项
3 讨论 具备重金属耐受性菌株的筛选是研究微生物修复的重要环节,当前从重金属污染土壤中分离筛选菌株是最有效的途径之一。林晓燕等[23]从重金属镉污染稻田土壤中筛选出的菌株LCd1和LCd2在液体培养基中分别可耐受80 mg/L和50 mg/L的Cd2+;链霉菌Streptomyces sp. strain Cd TB01[24]可耐受50 mg/L的Cd2+;周丽英等[25]从镉污染土壤中分离获得了在镉处理浓度超过300 mg/L时受到抑制但依旧能够生长的菌株;来自有色金属矿区植物根际土壤中的耐镉菌株BS1、BS2、BS3[26]对Cd2+的最低抑制浓度分别为300、100、80 mg/L。本研究从Cd含量为0.31–1.26 mg/kg的鱼腥草根际土壤中筛选出的菌株DY1-4 (Bacillus iocasae)、DY8 (Providencia rettgeri)、DY3 (Bacillus subtilis)对Cd2+的最低抑制浓度可达到500 mg/L,其中DY1-4的Cd2+致死浓度(MLC)超过了1000 mg/L,充分说明农田镉污染土壤中存在丰富的耐镉微生物资源。
芽孢杆菌属细菌是国内外研究人员筛选研究耐重金属Cd等的重要土壤微生物菌种资源之一。赵光等[27]发现凝结芽孢杆菌ZG49对于重金属污染土壤中Cd、Pb有明显的钝化作用;夏娟娟等[28]筛选得到镉耐性芽孢杆菌JL-4并证明其具有Cd钝化能力;此外Manikandan等[29]将在超富集植物大叶合欢根际分离筛选的芽孢杆菌属应用于大叶合欢植物修复的结果显示效果良好,芽孢杆菌属不仅具有显著的重金属积累能力,同时具有较高的还原酶活性。可见芽胞杆菌属细菌在重金属污染微生物修复中具有重要作用。本文筛选出的碘化芽孢杆菌DY1-4、枯草芽孢杆菌DY3以及雷氏普罗威登斯菌DY8在溶液Cd2+浓度为20 mg/L时对Cd2+的去除率均达到100%,尽管随着溶液Cd2+浓度增加3株细菌的Cd2+的去除效率不断降低,但在Cd2+浓度高达200 mg/L的溶液中,菌株对Cd2+的去除率仍在14%以上。由此推测这3株细菌应用于非重度Cd污染土壤中会有较好的效果。
本文筛选出的3株细菌中DY8在不同浓度Cd2+溶液中生长曲线最为稳定,DY1-4的Cd耐受性最高,而菌株的镉吸附性测试表明DY1-4的吸附能力最优且相对稳定,DY8次之,一定程度上可以说明菌株对镉的耐受性与其镉吸附效率呈正相关。3株细菌对降低土壤有效Cd含量方面也表现出显著效果,土培模拟实验结果表明,室内理想条件下DY8、DY3、DY1-4分别使土壤中有效Cd减少了0.30、0.29、0.26 mg/kg。同时3株镉吸附细菌对改善土壤理化性质方面也体现出积极作用,相较于CK2施加菌剂使土壤中碱解氮平均提高了19.17%,有效磷含量平均提高了5.32 mg/kg,土壤肥力得到有效提升。本研究筛选出的3株菌株对重金属Cd抗逆性较好,具有极其重要的研究价值与应用潜能可作为较好的试验材料之一应用于重金属镉污染的微生物修复,为Cd污染土壤的微生物固定修复提供了可利用的菌株资源。但在实际应用过程中使用实验室常规培养基制作菌剂成本略高,所以挖掘合适的载体和介质,以及如何使得施加到土壤中的菌株最大限度地发挥其对金属的固定作用值得进一步探究。
References
| [1] | Sun LJ, Qin Q, Song K, Qiao HX, Xue Y. The remediation and safety utilization techniques for Cd contaminated farmland soil:a review. Ecology and Environment Sciences, 2018, 27(7): 1377-1386. (in Chinese) 孙丽娟, 秦秦, 宋科, 乔红霞, 薛永. 镉污染农田土壤修复技术及安全利用方法研究进展. 生态环境学报, 2018, 27(7): 1377-1386. |
| [2] | Wang KJ, Han X, Zhang XZ, Yu HY. Study on effects of passivation material on the frxation of Cd in cd-contaminated soil. Journal of Nuclear Agricultural Sciences, 2020, 34(2): 433-441. (in Chinese) 王科积, 韩熙, 张锡洲, 余海英. 钝化材料复配对镉污染土壤中镉的固定效果. 核农学报, 2020, 34(2): 433-441. |
| [3] | Liu ML, Jiang M, Li B, Chen JJ, Zu YQ, Zhan FD. Research advances on the immobilization remediation of farmland soil cadmium pollution. Journal of Yunnan Agricultural University (Natural Science), 2018, 33(2): 350-359. (in Chinese) 刘梦丽, 蒋明, 李博, 陈建军, 祖艳群, 湛方栋. 农田土壤镉污染钝化修复研究进展. 云南农业大学学报(自然科学), 2018, 33(2): 350-359. |
| [4] | Xiao QT, Wang JY, Zheng XY, Rong H, Zhang GJ, Wang LH, Xie HL, Li Y, Chen S, Lin RY, Lin WX. Analysis of the differently expressed proteins in rice roots in response to cadmium stress. Acta Ecologica Sinica, 2015, 35(24): 8276-8283. (in Chinese) 肖清铁, 王经源, 郑新宇, 戎红, 张国君, 王良华, 谢惠玲, 李艺, 陈珊, 林瑞余, 林文雄. 水稻根系响应镉胁迫的蛋白质差异表达. 生态学报, 2015, 35(24): 8276-8283. |
| [5] | Yang HZ, Liu N, Li YQ, Wei XX, Wang L. Effects of cadmium on glutathione contents and activities of glutathione related enzymes in gill and hepatopancreas of Anodonta woodiana. Journal of Agro-Environment Science, 2015, 34(1): 15-21. (in Chinese) 杨惠珍, 刘娜, 李涌泉, 卫晓溪, 王兰. 镉对背角无齿蚌主要组织谷胱甘肽含量和相关酶活性的影响. 农业环境科学学报, 2015, 34(1): 15-21. |
| [6] | Tang XQ, Miao X. Progress of remediation on soil polluted by cadmium. Environmental Engineering, 2013, 31(S1): 747-750. (in Chinese) 唐秋香, 缪新. 土壤镉污染的现状及修复研究进展. 环境工程, 2013, 31(S1): 747-750. |
| [7] | Li JR, Xu YM, Lin DS, Liang XF, Sun YB, Wang L. In situ immobilization remediation of heavy metals in contaminated soils:a review. Ecology and Environment Sciences, 2014, 23(4): 721-728. (in Chinese) 李剑睿, 徐应明, 林大松, 梁学峰, 孙约兵, 王林. 农田重金属污染原位钝化修复研究进展. 生态环境学报, 2014, 23(4): 721-728. |
| [8] | Zhang X, Fan ZX, Guo DF, Wang LX. Effects of microorganisms on the growth of spinach under Cd stress. Tianjin Agricultural Sciences, 2011, 17(1): 81-83, 87. (in Chinese) 张欣, 范仲学, 郭笃发, 王丽香. 3种微生物制剂对轻度镉污染土壤中菠菜生长的影响. 天津农业科学, 2011, 17(1): 81-83, 87. |
| [9] | Ji HW, Wang XM, Pang HW, Li BW, Zhang PP, Hao JT. Effect of Bacillus subtilis and Bacillus megaterium on soil available Cd. Journal of Soil and Water Conservation, 2015, 29(3): 325-329. (in Chinese) 纪宏伟, 王小敏, 庞宏伟, 李博文, 张培培, 郝佳腾. 枯草芽孢杆菌与巨大芽孢杆菌对土壤有效态Cd的影响研究. 水土保持学报, 2015, 29(3): 325-329. |
| [10] | Liu ZY, Liu C. Approach on the characteristics of absorbing the cadmium with waste brewer's yeast. Liquor Making, 2008, 35(5): 67-69. (in Chinese) 刘振扬, 刘超. 废啤酒酵母吸附镉离子的特性探讨. 酿酒, 2008, 35(5): 67-69. |
| [11] | Shi XY, Zhou GT, Liao SJ, Shan SP, Wang GJ, Guo ZH. Immobilization of cadmium by immobilized Alishewanella sp. WH16-1 with alginate-lotus seed pods in pot experiments of Cd-contaminated paddy soil. Journal of Hazardous Materials, 2018, 357: 431-439. DOI:10.1016/j.jhazmat.2018.06.027 |
| [12] | Pramanik K, Mitra S, Sarkar A, Maiti TK. Alleviation of phytotoxic effects of cadmium on rice seedlings by cadmium resistant PGPR strain Enterobacter aerogenes MCC 3092. Journal of Hazardous Materials, 2018, 351: 317-329. DOI:10.1016/j.jhazmat.2018.03.009 |
| [13] | Li H, Luo N, Li YW, Cai QY, Li HY, Mo CH, Wong MH. Cadmium in rice:transport mechanisms, influencing factors, and minimizing measures. Environmental Pollution, 2017, 224: 622-630. DOI:10.1016/j.envpol.2017.01.087 |
| [14] | Li Y, Pang HD, He LY, Wang Q, Sheng XF. Cd immobilization and reduced tissue Cd accumulation of rice (Oryza sativa wuyun-23) in the presence of heavy metal-resistant bacteria. Ecotoxicology and Environmental Safety, 2017, 138: 56-63. DOI:10.1016/j.ecoenv.2016.12.024 |
| [15] | Li XX, Yu Y, Choi L, Song YL, Wu MH, Wang GJ, Li MS. Phenylobacterium soli sp. nov., isolated from arsenic and cadmium contaminated farmland soil. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(5): 1398-1403. DOI:10.1099/ijsem.0.003325 |
| [16] | Wang HP, Xie XH, Liu JS. Isolation, identification and characteristics of a Zn-resisting bacterium, Sphingomonas sp. DX-T3-03. Microbiology China, 2010, 37(10): 1495-1500. (in Chinese) 王慧萍, 谢学辉, 柳建设. 抗锌细菌Sphingomonas sp. DX-T3-03分离、鉴定及性质. 微生物学通报, 2010, 37(10): 1495-1500. |
| [17] | Farhan SN, Khadom AA. Biosorption of heavy metals from aqueous solutions by Saccharomyces Cerevisiae. International Journal of Industrial Chemistry, 2015, 6(2): 119-130. DOI:10.1007/s40090-015-0038-8 |
| [18] | Sun LN, Zhang YF, He LY, Chen ZJ, Wang QY, Qian M, Sheng XF. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland. Bioresource Technology, 2010, 101(2): 501-509. DOI:10.1016/j.biortech.2009.08.011 |
| [19] | Liu YL, Qiu ZM, Zhou P, Tong YD, Jiang YM, Zhang XQ, Liu TH. Determination of available microelements in soil by inductively coupled plasma mass spectrometry. Journal of Analytical Science, 2012, 28(6): 862-864. (in Chinese) 刘永林, 邱祖民, 周萍, 童迎东, 姜玉梅, 章效强, 刘廷华. 电感耦合等离子体质谱法测定土壤中有效态微量元素. 分析科学学报, 2012, 28(6): 862-864. |
| [20] | 鲍士旦. 土壤农化分析. 第3版. 北京: 中国农业出版社, 2000. |
| [21] | Bao WY, Jiang JW, Zhou Y, Wu YF, Liang ZQ. Screening and genomic analysis of a lignocellulose degrading bacterium. Acta Microbiologica Sinica, 2016, 56(5): 765-777. (in Chinese) 鲍文英, 江经纬, 周云, 吴玉峰, 梁志清. 一株木质纤维素降解菌的筛选及其全基因组分析. 微生物学报, 2016, 56(5): 765-777. |
| [22] | Zaidi S, Usmani S, Singh BR, Musarrat J. Significance of Bacillus subtilis strain SJ-101 as a bioinoculant for concurrent plant growth promotion and nickel accumulation in Brassica juncea. Chemosphere, 2006, 64(6): 991-997. DOI:10.1016/j.chemosphere.2005.12.057 |
| [23] | Lin XY, Mou RX, Cao ZY, Zhu ZW, Chen MX. Isolation and cadmium adsorption mechanisms of cadmium-resistant bacteria strains. Journal of Agro-Environment Science, 2015, 34(9): 1700-1706. (in Chinese) 林晓燕, 牟仁祥, 曹赵云, 朱智伟, 陈铭学. 耐镉细菌菌株的分离及其吸附镉机理研究. 农业环境科学学报, 2015, 34(9): 1700-1706. |
| [24] | Zhou G, Yang H, Pan H, Wang C, Fu FH, Lu XY, Tian Y. Isolation, identification and characteristics of a cadmium tolerant Streptomyces strain. Acta Scientiae Circumstantiae, 2017, 37(6): 2076-2084. (in Chinese) 周赓, 杨辉, 潘虎, 王翀, 付复华, 卢向阳, 田云. 一株耐镉链霉菌的筛选、鉴定与基本特性分析. 环境科学学报, 2017, 37(6): 2076-2084. |
| [25] | Zhou LY, Ye RJ, Lin ST, Liu J, Xiao QT, Lin SL, Li Y, Lin WX, Lin RY. Screening and identification of cadmium-tolerant bacteria from rhizosphere soils under rice. Chinese Journal of Eco-Agriculture, 2012, 20(5): 597-603. (in Chinese) 周丽英, 叶仁杰, 林淑婷, 刘杰, 肖清铁, 林素兰, 李艺, 林文雄, 林瑞余. 水稻根际耐镉细菌的筛选与鉴定. 中国生态农业学报, 2012, 20(5): 597-603. |
| [26] | Wang CJ, Xiong ZT, Xu ZR, Liu RX. Isolation, identification and adsorption characteristics of Cd-resistant rhizobacteria in a nonferrous metal mine. Journal of Ecology and Rural Environment, 2018, 34(5): 448-455. (in Chinese) 汪婵娟, 熊治廷, 徐仲瑞, 刘荣相. 有色金属矿区植物根际耐镉菌的分离鉴定与镉吸附特性. 生态与农村环境学报, 2018, 34(5): 448-455. |
| [27] | Zhao G. Study on isolation, identification and characteristics of acid-producing bacteria promoting plants to absorb heavy metals from soil. Journal of Anhui Agricultural Sciences, 2010, 38(18): 9696-9698. (in Chinese) 赵光. 促进植物吸收土壤重金属的产酸菌的筛选鉴定及特性研究. 安徽农业科学, 2010, 38(18): 9696-9698. |
| [28] | 夏娟娟.植物促生内生细菌的筛选及其强化油菜富集土壤铅镉重金属的研究.南京农业大学硕士学位论文, 2006. |
| [29] | Manikandan M, Gopal J, Kumaran RS, Kannan V, Chun S. Purification and characterization of a highly active chromate reductase from endophytic Bacillus sp. DGV19 of Albizzia lebbeck (L.) Benth. actively involved in phytoremediation of tannery effluent-contaminated sites. Preparative Biochemistry & Biotechnology, 2016, 46(2): 192-199. |
