冯艳茹1, 高亚君1, 杭小红1, 何勇强1,2, 姜伯乐1,2


1. 广西大学生命科学与技术学院, 广西 南宁 530004;
2. 亚热带农业生物资源保护与利用国家重点实验室, 广西 南宁 530004
收稿日期:2020-02-14;修回日期:2020-03-13;网络出版日期:2020-04-30
基金项目:广西自然科学基金(2014GXNSFFA118005,2018GXNSFAA281147)
*通信作者:姜伯乐, Tel:+86-771-3239255;E-mail:jbl1971@gxu.edu.cn.
摘要:[目的] 植物病原细菌通过Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)将Ⅲ型效应物(type Ⅲ secreted effectors,T3SEs)分泌转运到宿主细胞的不同位点上,进而行使不同的致病功能。本研究旨在确定Xcc 8004 Ⅲ型效应物中分子量最大的蛋白XopXccR1在植物中的亚细胞定位。[方法] 利用生物信息学方法分析XopXccR1的跨膜信息。通过同源重组方法将XopXccR1全长、N端(1–1220 aa)和C端(1221–2030 aa)分别克隆到植物表达载体pCAMBIA-2300-35S::EGFP上,利用根癌农杆菌介导的瞬时表达浸染本生烟,通过激光共聚焦显微镜观察亚细胞定位结果。[结果] XopXccR1全长和N端定位在本生烟细胞膜上,而C端定位在细胞质中。[结论] XopXccR1的N端与C端可能分别存在定位信号,N端信号主导全长蛋白的最终定位。
关键词:十字花科黑腐病菌Ⅲ型效应物XopXccR1亚细胞定位
Subcellular localization of a type Ⅲ secreted effector XopXccR1 of Xanthomonas campestris pv. campestris in plant cells
Yanru Feng1, Yajun Gao1, Xiaohong Hang1, Yongqiang He1,2, Bole Jiang1,2


1. College of Life Sciences and Technology, Guangxi University, Nanning 530004, Guangxi Zhuang Autonomous Region, China;
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530004, Guangxi Zhuang Autonomous Region, China
Received: 14 February 2020; Revised: 13 March 2020; Published online: 30 April 2020
*Corresponding author: Bole Jiang, Tel: +86-771-3239255; E-mail: jbl1971@gxu.edu.cn.
Foundation item: Supported by the Guangxi Natural Science Foundation of China (2014GXNSFFA118005, 2018GXNSFAA281147)
Abstract: [Objective] Plant pathogenic bacteria can directly deliver the secreted type Ⅲ effectors (T3SEs) into different sites of host cells through the type Ⅲ secretion system (T3SS), thereby exercising various pathogenic functions. The purpose of this study was to determine the subcellular localization of the largest T3SE protein XopXccR1 of Xcc 8004 in plants. [Methods] The bioinformatics methods were used to analyze the putative transmembrane region of XopXccR1. To obtain the transient expression Agrobacterium strains, the full-length XopXccR1 without stop codon, the N-terminus (1-1220 aa), and the C-terminus (1221-2030 aa) were ligated to the plant expression vector pCAMBIA-2300-35S::EGFP respectively by homologous recombination. Utilizing Agrobacterium-mediated transient expression to infect Nicotiana benthamiana, the results of subcellular localization were then observed with a laser confocal microscope. [Results] The full-length and the N-terminus of XopXccR1 are mainly localized in the cell membrane of N. benthamiana, while the C-terminus of XopXccR1 in the cytoplasm. [Conclusion] XopXccR1 N-and C-terminus might both have the targeting signals. The targeting signals in the N-terminus of XopXccR1 mainly contributes the final sub-localization of XopXccR1.
Keywords: Xanthomonas campestris pv. campestrisT3SEsXopXccR1subcellular localization
十字花科黑腐病菌(Xanthomonas campestris pv. campestris,Xcc)是一类重要的病原细菌,主要通过伤口和水孔侵染十字花科植物引起黑腐病,形成“V”字形黑腐病斑[1]。作为研究病原细菌与植物互作的模式菌株之一,Xcc含有多种致病因子,如胞外多糖、胞外酶、植物毒素以及Ⅲ型效应物(type Ⅲ secreted effectors,T3SEs)等,其中Ⅲ型效应物是最重要的一类致病因子[2-4]。Xcc通过Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)将Ⅲ型效应物直接分泌并转运到植物体内,进而抑制植物的防御反应,为病原菌在寄主体内的侵染和繁殖提供有益的环境[5]。面对威胁,植物也进化出了不同的防御机制,主要包括2个层次的免疫反应,即病原菌相关分子模式/微生物相关分子模式(pathogen/microbe associated molecular patterns,PAMPs/MAMPs)引发的免疫反应(PAMPs triggered immunity,PTI)和效应物引发的免疫反应(effector triggered immunity,ETI)[6]。PTI基于胞外跨膜受体(PRRs)识别并诱发防御反应,包括细胞内各种离子交换、活性氧(reactive oxygen species,ROS)暴发、MAPK (mitogen-activated protein kinase)激活、病程相关基因(pathogenesis- related genes,PRs)表达以及胼胝质沉积(callose deposition)等[7];ETI基于植物抗性蛋白对效应物的特异识别(基因对基因),诱发更为强烈的防御反应,如超敏反应(hypersensitive response,HR),造成侵染部位的细胞死亡,导致局部抗性,限制病原菌的生长、繁殖和扩张[5]。
亚细胞定位在效应物与植物靶标互作关系的研究中具有广泛的应用,通过效应物在植物中的定位信息可以在一定程度上指示效应物与植物靶标之间可能存在的互作关系。基因瞬时表达是一种替代转基因等稳定表达但周期长的方法,其中根癌农杆菌介导的烟草叶片侵染法因其操作简单、转化效率高而被广泛应用[8]。随着对效应物与植物靶标互作关系研究的深入,越来越多的效应物在植物中的定位已经明确。分布在植物细胞不同部位的效应物蛋白具有不同或相似的功能和靶标蛋白。来自Pseudomonas syringae的AvrPto和AvrPtoB定位在质膜上,靶定多种激酶[9-11]。P. syringae的效应物蛋白HopI1定位于叶绿体中,抑制水杨酸(SA)积累和相关的植物防御反应[12]。在细胞质中也存在很多效应物蛋白,如Xcc 8004中的AvrAC,P. syringae中的HopM1、HopF2、AvrB以及HopAI1等[13]。同样定位在细胞核的效应物蛋白也有不少,主要是来自黄单胞菌属和罗尔斯通氏菌(Ralstonia solanacearum)的转录激活类(transcription activator-like,TAL)效应物[14],这类效应物具有典型的结构特征,包括N端的分泌信号区、中部的串联34肽重复区(tetratricopeptide repeat,TPR)以及C端的核定位信号(nuclear localization signals,NLSs)和酸性转录激活结构域(acidic activation domain,AD)[15]。此外来自黄单胞菌的XopD是一个半胱氨酸蛋白酶,其自身完整的HLH (helix-loop-helix)结构域是靶定细胞核以及非特异DNA结合所必需的[16-18]。
在Xcc 8004已鉴定的Ⅲ型效应物中,XopXccR1效应物蛋白分子量最大,全长6096 bp,编码2031个氨基酸。由于效应物功能的冗余性,大多数效应物对致病力的贡献并不显著,然而xopXccR1这个大的效应物蛋白编码基因在单独突变后,致病力显著降低,且可以完全回补[19]。这么大的一个效应物蛋白如何发挥致病作用目前还不清楚,它是否会存在着与其他效应物蛋白不同的致病策略也不得而知。因此,本研究利用根癌农杆菌介导的本生烟侵染瞬时表达技术,期望通过对效应物蛋白XopXccR1在植物细胞中的定位来初步探究其如何发挥致病功能。
1 材料和方法 1.1 材料
1.1.1 植物材料: 本生烟(Nicotiana benthamiana),4–5周倒四倒三叶,培养条件:25 ℃恒温、16 h光照/8 h黑暗,相对湿度75%。
1.1.2 菌株、质粒和培养条件: 本研究所用菌株和质粒见表 1。Xcc培养温度为28 ℃,培养基为NYG (Nutrient Yeast Glycerol)[20],大肠杆菌(Escherichia coli) DH5α培养温度为37 ℃,培养基为LB (Lysogeny Broth),根癌农杆菌(Agrobacterium tumefaciens) GV3101培养温度为28 ℃,培养基为YEB (Yeast Extract Broth)。菌株培养使用的抗生素浓度如下:利福平(Rifampicin,Rif) 50 μg/mL,卡那霉素(Kanamycin,Kan) 25 μg/mL。
表 1. 本研究所用的菌株和质粒 Table 1. Bacterial strains and plasmids used in this study
| Strainsand plasmids | Relevantcharacteristicsa | Sourcereference |
| Strains | ||
| Xcc8004 | Wildtype strain, Rifr | Thislab |
| E.coli DH5α | Transformreceptor | Thislab |
| AgrobacteriumGV3101 | Transgenicexpression, Rifr | Thislab |
| Plasmids | ||
| pCAMBIA2300-35S::EGFP | Plantexpression vector, Kanr | Thislabb |
| P2300-35S::XopXccR1-EGFP | XopXccR1transient expression plasmid, Kanr | Thisstudy |
| P2300-35S::XopXccR1N1-1220aa-EGFP | XopXccR1N1-1220transient expression plasmid, Kanr | Thisstudy |
| P2300-35S::XopXccR1C1221-2030aa-EGFP | XopXccR1C1221-2030transient expression plasmid, Kanr | Thisstudy |
| a: Rif=Rifampicin, Kan=Kanamycin. b: Provided by Professor Xianwei Fan of State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources. | ||
表选项
1.1.3 引物与试剂: 主要试剂:2×phanta Max Master Mix,CloneExpress II One Step Cloning Kit购买于Vazyme公司(中国南京),限制性内切酶购买于Promega公司(中国北京),DNA片段回收试剂盒购买于TaKaRa公司(中国大连),质粒提取试剂盒购买于Genstar公司(中国北京),2-吗啉-乙磺酸[2-(4-Morpholino)-ethanesulfonic acid,MES]和乙酰丁香酮(Acetosyringone,AS)购买于Solaribo公司(中国北京)。根据Xcc 8004菌株的核苷酸序列,按照试验需要设计的引物见表 2。
表 2. 本研究所用的引物 Table 2. Primers used in this study
| Primers | Primerssequence (5′→3′)a |
| XopXccR1-FB | AACACGGGTACCCGGGGATCCCTGGAGCCTGCAGAACCAGCGACGGCTTCACCGCAGAGTAGGCCT |
| XopXccR1-RX | GCTCACCATGTCGACTCTAGATTACTCCTGGCCCGACGTGATCTGGCTGCCGGCGAC |
| XopXccR1N1-1220aa-FB | AACACGGGTACCCGGGGATCCCTGGAGCCTGCAGAACCAGCGACGGCTTCACCGCAGAGTAGGCCT |
| XopXccR1N1-1220aa-RX | GCTCACCATGTCGACTCTAGAGGGTGCGACGGGCTGTCTT |
| XopXccR1C1221-2030aa-FB | AACACGGGTACCCGGGGATCCAACGCCGCGCCAGACGCAG |
| XopXccR1C1221-2030aa-RX | GCTCACCATGTCGACTCTAGATTACTCCTGGCCCGACGTGATCTGGCTGCCGGCGAC |
| M13F | CCCAGTCACGACGTTGTAAAACG |
| M13R | CAGGAAACAGCTATGAC |
| a: Added restriction sites are underlined. | |
表选项
1.2 生物信息学分析 通过KEGG:Kyoto Encyyclopedia of Genes and Genomes网站(http://www.kegg.jp/kegg/)获取基因序列。通过在线软件TMpred (http://www.ch.embnet.org/software/TMPRED_form.html)预测基因的跨膜螺旋。
1.3 Xcc 8004总DNA提取 取过夜培养、OD600=1左右的Xcc 8004菌液1.5 mL于EP管中,12000 r/min离心1 min。弃上清,加入400 μL裂解液(20 mmol/L NaAc,40 mmol/L Tris-Ac,1% SDS,1 mmol/L EDTA),涡旋振荡,完全混匀后加入200 μL 5 mol/L NaCl,来回颠倒混匀至出现白色絮状成团,12000 r/min离心10 min。取上清于一干净EP管中,加入等体积氯仿颠倒混匀,12000 r/min离心5 min。用移液器小心吸取上清于新的EP管中,加入等体积异丙醇,12000 r/min离心10 min。弃上清,用75%乙醇反复洗涤2次,小心吸弃上清,室温晾干后加入50 μL ddH2O溶解沉淀,–20 ℃备用。
1.4 同源重组 通过ClonExpress技术获得重组表达载体,只需要将5′端和3′端分别带有和线性化载体两末端一致的序列(15–20 bp)的PCR产物与经线性化处理的载体在37 ℃反应30 min即可完成连接反应。植物双元表达载体pCAMBIA-2300-35S::EGFP经BamH I和Xba I双酶切线性化并胶回收纯化,经琼脂糖凝胶电泳检测正确。目的外源片段以Xcc 8004总DNA为模板,XopXccR1F/R、XopXccR1N1-1220F/R和XopXccR1C1221-2030F/R为引物,用高保真酶2×phanta Max Master Mix扩增得到,经1.0%琼脂糖凝胶电泳检测大小正确。然后用DNA凝胶回收试剂盒将获得的外源目的片段进行胶回收纯化并电泳检测。将获得的外源目的片段和线性化载体按照CloneExpress II One Step Cloning Kit说明书进行37 ℃连接30 min,常规转化E. coli DH5α,然后涂布Kan抗性平板,筛选单菌落进行菌体PCR验证,验证正确的转化子用质粒提取试剂盒抽提质粒DNA并送奥科生物公司(中国武汉)测序。
1.5 重组载体转入根癌农杆菌及鉴定 通过电转化方法将测序正确的重组质粒和空载体分别转入根癌农杆菌GV3101中,涂布Rif+Kan抗性平板并置于30 ℃培养,2 d后挑选单菌落进行菌体PCR验证,验证正确的转化子可用于根癌农杆菌瞬时表达侵染实验。
1.6 根癌农杆菌介导的瞬时表达转化本生烟 将转入不同质粒的根癌农杆菌GV3101接种到含有适宜抗生素的YEB培养基中,28 ℃、200 r/min振荡培养至OD600为1.0左右,4000 r/min离心10 min,使用渗透缓冲液(infiltration medium) (10 mmol/L MES/KOH,pH=5.7,10 mmol/L MgCl2,150 μmol/L AS)重悬沉淀,洗涤2次,然后用渗透缓冲液重悬沉淀,调整OD600=1.0,28 ℃、100 r/min避光振荡培养2 h。
选用25 ℃、16 h光照/8 h黑暗条件下生长4–5周的本生烟,在侵染前避光2 h,使气孔开放,然后用去掉针头的一次性注射器在烟草的倒三叶、倒四叶背面进行压渗接种,使整个叶片被侵染液浸润。扶正植株后在黑暗条件下培养2 d。
1.7 转化烟草的激光扫描共聚焦显微镜的观察 48 h后剪下侵染的烟草叶片,在无菌水中小心撕取下表皮,制作水浸玻片,指甲油封片后进行激光共聚焦成像(LEICA-TCS-SP8MP多光子激光共聚焦显微镜,德国),激发光波长为488 nm,发射光波长为501–528 nm。
2 结果和分析 2.1 生物信息学分析显示XopXccR1可能是膜蛋白 XopXccR1是Xcc 8004中已鉴定的Ⅲ型效应物中分子量最大的蛋白[19]。根据KEGG网站信息显示,XopXccR1编码基因XC_3160全长6096 bp,编码2031个氨基酸。利用在线软件TMPred (http://www.ch.embnet.org/software/TMPRED_form. html)预测XopXccR1的跨膜螺旋,结果显示存在3个潜在的跨膜区(图 1),即膜外跨向膜内(o-i)的114–133 aa和1276–1296 aa以及膜内跨向膜外(i-o)的1225–1159 aa区域(表 3)。在线软件的预测结果表明XopXccR1效应物蛋白很可能是一个膜蛋白。
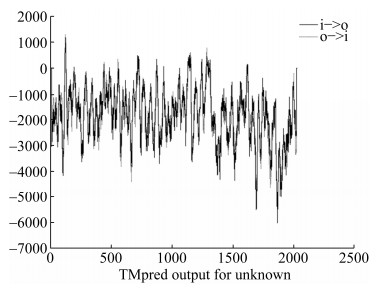 |
| 图 1 XopXccR1的跨膜螺旋预测 Figure 1 Prediction of trans-membrane helices for XopXccR1. |
| 图选项 |
表 3. 预测的跨膜位点 Table 3. Predicted transmembrane sites
| Area | Length | Score | Orientation |
| 114–133 | 20 | 1291 | o-i |
| 1125–1159 | 35 | 504 | i-o |
| 1276–1296 | 21 | 776 | o-i |
表选项
2.2 效应物蛋白亚细胞定位表达载体的构建与验证 由于XopXccR1分子量太大,经检索发现其编码基因没有合适的限制性内切酶酶切位点可用,无法通过一般的酶切连接来构建重组质粒,因此本研究通过ClonExpress技术来获得重组质粒。ClonExpress技术是一种简单、快速并且高效的DNA无缝克隆技术,可将插入片段定向克隆至任意载体的任意位点。鉴于同源重组对引物要求的特殊性,在设计引物时,分别在插入片段的正/反向PCR引物的5′端引入了线性化载体的末端序列,使得PCR产物的5′端和3′端分别带有和线性化载体两末端一致的序列(15–20 bp)。以Xcc 8004总DNA为模板,XopXccR1F/R、XopXccR1N1-1220F/R和XopXccR1C1221-2030F/R为引物,用高保真酶分别扩增得到含有载体pCAMBIA-2300-35S::EGFP酶切位点附近15 bp碱基的外源片段,产物经1.0%琼脂糖凝胶电泳证实,符合要求,分别得到长度为6135 bp、3702 bp和2475 bp的DNA片段(图 2)。将经BamH I/Xba I双酶切得到的线性化载体pCAMBIA-2300-35S::EGFP和已获得的外源DNA片段进行胶回收纯化,然后连接并转化E. coli DH5α。所得的转化子经菌体PCR验证,验证正确的转化子培养后提质粒并送公司测序,测序正确的XopXccR1亚细胞定位表达重组质粒分别命名为P2300-35S::XopXccR1-EGFP、P2300-35S::XopXccR1N1-1220aa-EGFP和P2300-35S:: XopXccR1C1221-2030aa-EGFP。
 |
| 图 2 xopXccR1、xopXccR1N1-1220aa和xopXccR1C1221-2030aa基因克隆电泳结果 Figure 2 Electrophoresis results of xopXccR1, xopXccR1N1-1220aa and xopXccR1C1221-2030aa cloning. M: GeneRuler 1 kb DNA ladder; lane 1: xopXccR1; lane 2: xopXccR1C1221-2030aa; lane 3: xopXccR1N1-1220aa. |
| 图选项 |
2.3 根癌农杆菌的转化和验证 分别将测序正确的P2300-35S::XopXccR1- EGFP、P2300-35S::XopXccR1N1-1220aa-EGFP和P2300-35S::XopXccR1C1221-2030aa-EGFP质粒通过电转化分别转入根癌农杆菌GV3101中,在含Rif+Kan抗生素的YEB固体培养基上筛选出阳性克隆,经菌体PCR验证正确后,分别获得EGFP融合蛋白菌株GV3101/XopXccR1-EGFP、GV3101/ XopXccR1N1-1220aa和GV3101/XopXccR1C1221-2030aa (图 3)。
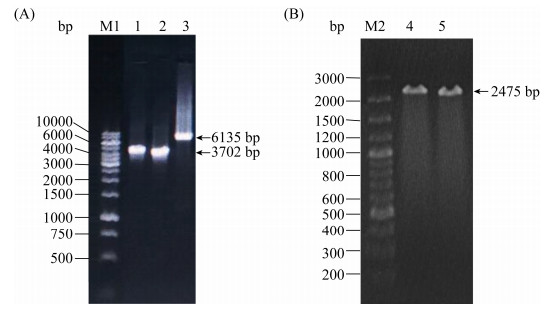 |
| 图 3 农杆菌转化子PCR验证 Figure 3 PCR verification of Agrobacterium transformants. M1: GeneRuler 1 kb DNA ladder; lane 1–2: GV3101/XopXccR1N1-1220aa; lane 3: GV3101/XopXccR1-EGFP; M2: GeneRuler 100 bp Plus DNA ladder; lane 4–5: GV3101/XopXccR1C1221-2030aa. |
| 图选项 |
2.4 XopXccR1全长定位与分段蛋白定位 采用农杆菌介导的瞬时表达方法,将重组农杆菌侵染本生烟叶片,避光48 h后在激光共聚焦显微镜下观察,激发光波长为488 nm,发射光波长为501–528 nm。通过激光共聚焦显微镜观察发现:作为对照(CK)的空载体pCAMBIA-2300- 35S::EGFP弥散分布于整个本生烟表皮细胞中(图 4-A),而XopXccR1-EGFP融合蛋白的荧光分布在本生烟细胞膜上,表明全长XopXccR1定位于本生烟细胞膜上(图 4-B)。推测XopXccR1在植物中的潜在靶定部位为细胞膜。
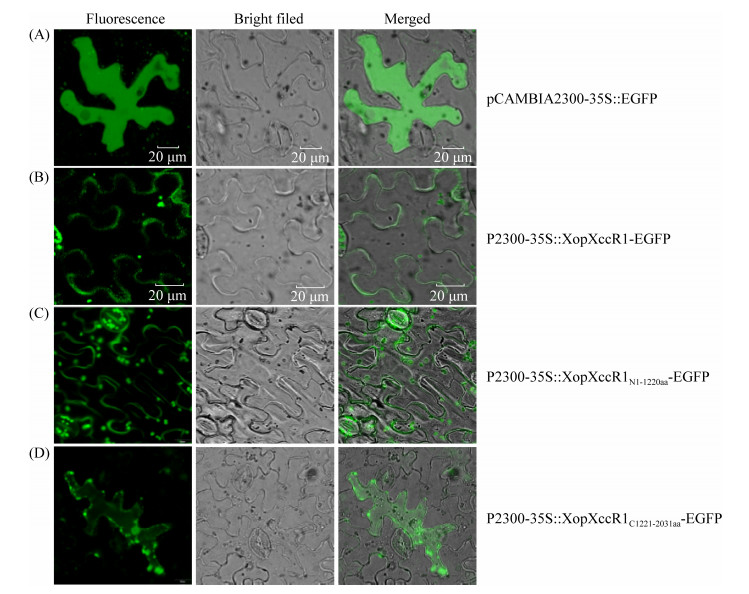 |
| 图 4 XopXccR1全长及N端、C端在本生烟中的亚细胞定位 Figure 4 Subcellular localization of full-length, N-terminal and C-terminal of XopXccR1 in N. benthamiana. A: CK, pCAMBIA-2300-35S::EGFP; B: P2300-35S::XopXccR1-EGFP; C: P2300-35S::XopXccR1N1-1220aa-EGFP; D: P2300-35S::XopXccR1C1221-2030aa-EGFP. |
| 图选项 |
有趣的是,当XopXccR1被分为XopXccR1N1-1220和XopXccR1C1221-2030两部分时,定位结果发生了改变。XopXccR1N1-1220aa-EGFP融合蛋白荧光分布在本生烟细胞膜上(图 4-C),与全长XopXccR1- EGFP融合蛋白定位一致,而XopXccR1C1221-2030aa- EGFP融合蛋白荧光弥散于本生烟细胞质中(图 4-D)。C端的细胞质定位表明XopXccR1在经Ⅲ型分泌系统分泌出去后发生了某种结构上的变化,使得效应物XopXccR1的N端和C端呈现出不同的定位结果。根据生物信息学对效应物XopXccR1的跨膜螺旋分析,其存在的3个潜在跨膜螺旋有2个分布在1220 aa附近,这个结果与定位结果具有一定的吻合度。但是具体的信号位点还需要进一步研究。
3 结论和讨论 在Xcc 8004中已鉴定的Ⅲ型效应物中,XopXccR1不仅是分子量最大的,约216 kDa,还是单一效应物蛋白对致病力有显著贡献的效应物[19]。本研究聚焦于其在植物细胞中的定位,从而初步探究XopXccR1与寄主或/和非寄主植物之间可能存在的互作关系。利用生物信息学方法对XopXccR1进行了初步的预测分析,XopXccR1没有核定位信号,跨膜螺旋分析发现其可能存在3个跨膜螺旋,包括2个由膜外跨向膜内的区域114–133 aa和1276–1296 aa以及膜内跨向膜外的1225–1159 aa区域,提示其可能是一个膜蛋白。通过农杆菌介导的瞬时表达侵染试验,我们发现全长XopXccR1定位在烟草细胞膜上。分段定位结果却有点出乎意料,N端XopXccR1N1-1220aa与全长效应物蛋白的定位结果一致,位于细胞膜,而C端XopXccR1C1221-2030aa定位在细胞质中,这样的结果引起了我们的思考,XopXccR1这个大的效应物蛋白可能存在着多个不同的植物亚细胞定位信号,至少N端和C端分别含有定位信号;且N端信号对XopXccR1效应物蛋白的最终定位更加重要。xopXccR1基因全长可以完全回补致病力[19],其N-端和C-端部分定位结果不同,那N-端和C-端单独是否能够回补致病力,值得进一步研究。
根据亚细胞定位结果,我们对XopXccR1进行了不同的生物信息学分析,通过同源性分析以及保守结构域的搜寻,我们发现XopXccR1效应物蛋白在第155到第615个氨基酸之间存在着一个AvrE保守结构域,这个结构域注释为AvrE superfamily,同时XopXccR1及其同源蛋白HopR1与假单胞菌中的效应物蛋白AvrE具有一定的同源性。来自假单胞菌的AvrE也是一个大的效应物蛋白,而且是AvrE superfamily的创始成员[21]。Xin等[22]的研究发现AvrE效应物蛋白定位于细胞质膜以及质膜相关的囊泡类结构上,且与拟南芥中的抗菌免疫相关基因NHL13互作。有趣的是,AvrE蛋白自身存在2个互作区域,即N端AvrE-N (1–995 aa)和C端AvrE–C (990–1795 aa)。而且定位结果显示,全长AvrE定位在细胞边缘,N端定位与全长一致,C端定位在细胞质中,通过N端和C端共表达发现N端能够牵制C端融合蛋白的定位,即N端存在质膜定位信号,引导AvrE定位于质膜及质膜相关的囊泡结构上。在本研究中,XopXccR1的定位结果与AvrE的定位结果高度相似,且两者具有一定的同源性,也许XopXccR1具有与AvrE相似的功能,当然这个问题还需要进一步的研究。本研究通过定位来揭示Ⅲ型效应物蛋白与植物之间的关系,为进一步研究大的效应物蛋白的作用机理奠定了基础,同时也有助于其他大效应物蛋白的研究。
References
| [1] | Williams PH. Black rot:a continuing threat to world crucifers. Plant Disease, 1980, 64(8): 736-742. DOI:10.1094/PD-64-736 |
| [2] | Katzen F, Ferreiro DU, Oddo CG, Ielmini MV, Becker A, Pühler A, Ielpi L. Xanthomonas campestris pv. campestris gum mutants:effects on xanthan biosynthesis and plant virulence. Journal of Bacteriology, 1998, 180(7): 1607-1617. DOI:10.1128/JB.180.7.1607-1617.1998 |
| [3] | Kao CC, Barlow E, Sequeira L. Extracellular polysaccharide is required for wild-type virulence of Pseudomonas solanacearum. Journal of Bacteriology, 1992, 174(3): 1068-1071. DOI:10.1128/JB.174.3.1068-1071.1992 |
| [4] | Rudolph K. Infection of the plant by Xanthomonas//Swings JG, Civerolo EL. Xanthomonas. Netherlands: Springer, 1993: 193-264. |
| [5] | Jones JDG, Dangl JL. The plant immune system. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [6] | Dodds PN, Rathjen JP. Plant immunity:towards an integrated view of plant-pathogen interactions. Nature Reviews Genetics, 2010, 11(8): 539-548. DOI:10.1038/nrg2812 |
| [7] | Segonzac C, Zipfel C. Activation of plant pattern-recognition receptors by bacteria. Current Opinion in Microbiology, 2011, 14(1): 54-61. DOI:10.1016/j.mib.2010.12.005 |
| [8] | Yang YN, Li RG, Qi M. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves. The Plant Journal, 2000, 22(6): 543-551. DOI:10.1046/j.1365-313x.2000.00760.x |
| [9] | Xing WM, Zou Y, Liu Q, Liu JN, Luo X, Huang QQ, Chen S, Zhu LH, Bi RC, Hao Q, Wu JW, Zhou JM, Chai JJ. The structural basis for activation of plant immunity by bacterial effector protein AvrPto. Nature, 2007, 449(7159): 243-247. DOI:10.1038/nature06109 |
| [10] | Van Der Hoorn RAL, Kamoun S. From guard to decoy:A new model for perception of plant pathogen effectors. The Plant Cell, 2008, 20(8): 2009-2017. DOI:10.1105/tpc.108.060194 |
| [11] | Cheng W, Munkvold KR, Gao HS, Mathieu J, Schwizer S, Wang S, Yan YB, Wang JJ, Martin GB, Chai JJ. Structural analysis of Pseudomonas syringae AvrPtoB bound to host BAK1 reveals two similar kinase-interacting domains in a type Ⅲ effector. Cell Host and Microbe, 2011, 10(6): 616-626. DOI:10.1016/j.chom.2011.10.013 |
| [12] | Jelenska J, Yao N, Vinatzer BA, Wright CM, Brodsky JL, Greenberg JT. A J domain virulence effector of Pseudomonas syringae remodels host chloroplasts and suppresses defenses. Current Biology, 2007, 17(6): 499-508. DOI:10.1016/j.cub.2007.02.028 |
| [13] | Deslandes L, Rivas S. Catch me if you can:bacterial effectors and plant targets. Trends in Plant Science, 2012, 17(11): 644-655. DOI:10.1016/j.tplants.2012.06.011 |
| [14] | Scholze H, Boch J. TAL effectors are remote controls for gene activation. Current Opinion in Microbiology, 2011, 14(1): 47-53. DOI:10.1016/j.mib.2010.12.001 |
| [15] | Boch J, Scholze H, Schornack S, Landgraf A, Hahn S, Kay S, Lahaye T, Nickstadt A, Bonas U. Breaking the code of DNA binding specificity of TAL-type Ⅲ effectors. Science, 2009, 326(5959): 1509-1512. DOI:10.1126/science.1178811 |
| [16] | Hotson A, Chosed R, Shu HJ, Orth K, Mudgett MB. Xanthomonas type Ⅲ effector XopD targets SUMO-conjugated proteins in planta. Molecular Microbiology, 2003, 50(2): 377-389. DOI:10.1046/j.1365-2958.2003.03730.x |
| [17] | Kim JG, Taylor KW, Hotson A, Keegan M, Schmelz EA, Mudgett MB. XopD SUMO protease affects host transcription, promotes pathogen growth, and delays symptom development in Xanthomonas-infected tomato leaves. The Plant Cell, 2008, 20(7): 1915-1929. DOI:10.1105/tpc.108.058529 |
| [18] | Canonne J, Marino D, Jauneau A, Pouzet C, Brière C, Roby D, Rivas S. The Xanthomonas type Ⅲ effector XopD targets the Arabidopsis transcription factor MYB30 to suppress plant defense. The Plant Cell, 2011, 23(9): 3498-3511. DOI:10.1105/tpc.111.088815 |
| [19] | Jiang W, Jiang BL, Xu RQ, Huang JD, Wei HY, Jiang GF, Cen WJ, Liu J, Ge YY, Li GH, Su LL, Hang XH, Tang DJ, Lu GT, Feng JX, He YQ, Tang JL. Identification of six type Ⅲ effector genes with the PIP box in Xanthomonas campestris pv. campestris and five of them contribute individually to full pathogenicity. Molecular Plant-Microbe Interactions, 2009, 22(11): 1401-1411. DOI:10.1094/MPMI-22-11-1401 |
| [20] | Daniels MJ, Barber CE, Turner PC, Sawczyc MK, Byrde RJW, Fielding AH. Cloning of genes involved in pathogenicity of Xanthomonas campestris pv. campestris using the broad host range cosmid pLAFR1. The EMBO Journal, 1984, 3(13): 3323-3328. DOI:10.1002/j.1460-2075.1984.tb02298.x |
| [21] | Degrave A, Siamer S, Boureau T, Barny MA. The AvrE superfamily:ancestral type Ⅲ effectors involved in suppression of pathogen-associated molecular pattern-triggered immunity. Molecular Plant Pathology, 2015, 16(8): 899-905. DOI:10.1111/mpp.12237 |
| [22] | Xin XF, Nomura K, Ding XH, Chen XJ, Wang K, Aung K, Uribe F, Rosa B, Yao J, Chen J, He SY. Pseudomonas syringae effector avirulence protein E localizes to the host plasma membrane and down-regulates the expression of the NONRACE-SPECIFIC DISEASE RESISTANCE1/HARPIN-INDUCED1-LIKE13 gene required for antibacterial immunity in Arabidopsis. Plant Physiology, 2015, 169(1): 793-802. |
