崔佳丽1, 游金坤2, 李洁实2

 , 乔腾生3, 董训赞3
, 乔腾生3, 董训赞3 1. 云南省药物研究所, 云南昆明 650111;
2. 中华全国供销合作总社昆明食用菌研究所, 云南 昆明 650223;
3. 昆明理工大学生命科学与技术学院, 云南 昆明 650500
收稿日期:2020-01-16;修回日期:2020-03-17;网络出版日期:2020-04-15
基金项目:云南省基础研究计划(2017FD038)
*通信作者:李洁实, E-mail:kyougen@163.com.
摘要:[目的] 研究核桃壳提取液(walnut shell extracts,WSE)对单针藻Monoraphidium sp.QLZ-3生长和油脂积累的影响。[方法] 向BG-11培养基中添加不同量的WSE(培养基中保留有BG-11中全部营养成分)。[结果] 结果显示,当BG-11培养基中的WSE含量为40%时,单针藻的生物量产率及油脂产率达到(534.70±4.07)mg/(L·d)和(296.35±15.36)mg/(L·d),相比对照组分别提高了的14.82%和33.50%,蛋白质和碳水化合物含量分别有不同程度的上调和下调。与对照组相比,微藻中谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)含量与活性均上调。此外,WSE作用下,微藻对多酚的移除达到84.37%,同时上调了核酮糖1,5-二磷酸羧化酶基因(ribulose 1,5-bisphosphate carboxylase/oxygenase,rbcL)和乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,accD)基因的表达量。[结论] 研究表明,WSE联合BG-11可以提高微藻的生物量产率和油脂产率,降低微藻培养的原料成本,为核桃壳的资源化利用及微藻的工业化生产提供了一定的技术支撑。
关键词:核桃壳提取液Monoraphidium sp.QLZ-3活性氧生物量产率油脂产率
Production of lipid from walnut shell extracts by Monoraphidium sp. QLZ-3
Jiali Cui1, Jinkun You2, Jieshi Li2

 , Tengsheng Qiao3, Xunzan Dong3
, Tengsheng Qiao3, Xunzan Dong3 1. Yunnan Pharmaceutical Research Institute, Kunming 650111, Yunnan Province, China;
2. All-China Federation of Supply and Marketing Cooperatives Kunming Institute of Edible Fungi, Kunming 650223, Yunnan Province, China;
3. Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, Yunnan Province, China
Received: 16 January 2020; Revised: 17 March 2020; Published online: 15 April 2020
*Corresponding author: Jieshi Li, E-mail:kyougen@163.com.
Foundation item: Supported by the Basic Research Program of Yunnan Province (2017FD038)
Abstract: [Objective] The effects of walnut shell extracts (WSE) on the growth and lipid accumulation of Monoraphidium sp. QLZ-3 were explored. [Methods] Different volumes of WSE were added to BG-11 medium (all nutrients in BG-11 were retained in the medium). [Results] The biomass and lipid productivity reached (534.7±4.07) mg/(L·d) and (296.4±15.36) mg/(L·d) with addition of 40% WSE in the culture medium, increasing 14.82% and 33.50%, respectively, with upregulation of protein and downregulation of carbohydrate. [Conclusion] Exogenous WSE could enhance the biomass and lipid productivities in microalgae.
Keywords: walnut shell extractsMonoraphidium sp. QLZ-3reactive oxygen speciesbiomass productivitylipids productivity
作为以动植物油脂等为原料制备而成的生物柴油是一种清洁的替代能源[1]。利用微藻制备生物柴油具有多方面的优势,受到越来越多各方面****的关注[2]。然而,由于生产成本较高及微藻生物量和油脂产率相对较低等因素,制约了微藻生物柴油工业化生产的发展进程[3]。研究指出,利用废水等培养微藻可以有效降低利用微藻制备生物柴油过程中的生产成本[4]。
核桃壳是核桃产品加工过程中产生的废弃物,可用于制作活性炭、提取色素等,但是大部分核桃壳却直接焚烧,不仅浪费了资源,还会污染环境[5-6]。有研究表明,核桃壳中含有包括多酚在内大量的营养物质,多酚具有较强的抗氧化性[7]。研究指出,抗氧化剂可以通过调节藻细胞内抗氧化酶的活性,从而促进微藻积累油脂[8]。Nayak等[9]研究说明,利用生活废水培养微藻的过程中,微藻的生物量相对较低,仅为0.54 g/L。然而,联合核桃壳提取液(walnut shell extracts,WSE)与BG-11用于培养微藻鲜有报到,研究WSE对BG-11中微藻生长和油脂积累的影响,有利于了解废水联合BG-11作用下微藻的生长和油脂积累的相关机制。
核酮糖1, 5-二磷酸羧化酶(ribulose 1, 5-bisphosphate carboxylase/oxygenase,rbcL)与CO2的固定有关[10]。乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,accD)催化乙酰辅酶A,是微藻油脂合成过程中的限速酶[11]。研究WSE对BG-11中微藻rbcL和accD基因的影响,有利于了解废水联合BG-11作用下微藻油脂合成的分子机制。
本文以单针藻Monoraphidium sp. QLZ-3为对象,研究了WSE对微藻生物量产率和油脂产率的影响,同时对微藻细胞内的蛋白质和碳水化合物进行了检测。此外,研究了微藻对WSE中多酚的移除、相关抗氧化酶活性及与油脂合成相关酶基因的表达量。联合WSE和BG-11用于微藻的培养,为提高微藻的生物量产率和油脂产率,降低微藻培养的原料成本,以及对核桃壳环境友好的资源化利用提供一定的指导依据。
1 材料和方法 1.1 培养基的制备 以单针藻Monoraphidium sp. QLZ-3为研究对象(本实验室筛选、保存)[12]。称取适量的核桃硬壳(云南省林业科学院提供)与10倍质量的蒸馏水混合,在95 ℃条件下提取4 h,得到褐色的WSE,经8层纱布过滤后,添加NaNO3 (1.16 g/L),调整pH至6.8–7.0 (WSE中的成分如表 1所示)[13]。以BG-11培养基为基础培养基作为对照组,向BG-11培养基中添加不同量的WSE作为实验组(培养基中保留有BG-11中全部营养成分,且添加体积比分别为10%、20%、30%、40%和50%的WSE)。将上述培养基在121 ℃的条件下灭菌20 min后,分装至光生物反应器(? 0.06 m×h 0.51 m)中,接入单针藻Monoraphidium sp. QLZ-3 (初始接种量为0.4 g/L),通入12%的CO2,气体流速为0.5 L/min,光照强度6500 lux,培养温度为25±1 ℃,每组设置3个平行。
表 1. WSE中主要成分含量 Table 1. Compositions of WSE medium
| Parameter | Value/(Units) |
| B | 43.36 μg/L |
| Na | 12.77 mg/L |
| Mg | 1.36 mg/L |
| Al | 32.45 μg/L |
| K | 24.80 mg/L |
| Ca | 1.25 mg/L |
| Cr | 3.00 μg/L |
| Mn | 117.05 μg/L |
| Cu | 1.13 mg/L |
| Zn | 18.21 μg/L |
| Hg | 0.024 μg/L |
| Pb | 0.14 μg/L |
| N | 56.70 mg/L |
| P | 7.20 mg/L |
| COD | 3210 mg/L |
| Polyphenols | 65.87 mg/L |
表选项
1.2 生物量、油脂含量的测定[14] 生物量:每天取10 mL (V)藻液,3500 r/min离心10 min,去上清,冷冻干燥后,称取藻粉重量(w1)。微藻生物量按照公式(1)计算。
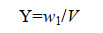 | 公式(1) |
油脂含量:准确称取0.3–0.5 g (m1)冷冻干燥干藻粉,添加2倍质量的石英砂研磨40 min。添加3 mL氯仿甲醇溶液(2:1,V/V),在25 ℃、150 r/min条件下振荡提取30 min后,离心(5000 r/min,10 min),取上清。将上述提取操作重复3次,合并3次上清液,置于预先干燥称重的离心管(m2)中,在40 ℃的恒温箱中干燥至恒重(m3),油脂含量(%)按照公式(2)计算。
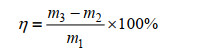 | 公式(2) |
1.3 蛋白质和碳水化合物含量的测定[15] 蛋白质:将微藻冻干后,取10 mg的干藻粉放入1.5 mL的离心管中,加入200 μL的NaOH溶液(1 mol/L),在80 ℃的条件下水浴10 min,加入800 μL的蒸馏水,在12000×g的条件下离心30 min,取上清。重复上述提取步骤2次,合并3次上清液,以牛血清蛋白建立标准曲线,利用考马斯亮蓝法测定蛋白质的浓度。
1.4 rbcL和accD酶基因表达分析 使用Primer5.0设计引物,由生工生物工程(上海)股份有限公司合成18S和rbcL和accD酶基因的上下游扩增引物(表 2),进行荧光定量PCR。
表 2. 酶基因荧光定量引物 Table 2. Gene-specific primers used for qRT-PCR
| Primer | Primer sequence (5′→3′) | Annealing temperature/℃ |
| 18S F | GGGAGTATGGTCGCAAGG | 57 |
| 18S R | GACTATTTAGCAGGCTGAGGT | |
| rbcL F | GTACCTGCCCAACCTCACCG | 57 |
| rbcL R | GCACCAGCATGGACACCACC | |
| accD F | GGGCGTGATGGAGTTTG | 61 |
| accD R | AGGTTGGCCTCGTTCTG |
表选项
Trizol法提取不同浓度WSE处理下单针藻Monoraphidium sp. QLZ-3内的RNA,利用逆转录试剂盒(TaKaRa)将RNA逆转录合成cDNA,以其为模板,进行RT-PCR扩增,检测不同浓度WSE处理下单针藻rbcL和accD基因表达的变化。通过ABI 7500荧光定量仪对rbcL和accD基因的表达进行定量,RT-PCR的数据结果用2–ΔΔCT的方法处理分析。以18S基因作为内标以调节RNA的用量和循环数,使内标基因在诱导条件下的表达丰度一致,最终得到基因表达量之间的倍数关系。
1.5 化学需氧量(chemical oxygen demand,COD)、总磷(total phosphorus,TP)、总氮(total nitrogen,TN)及多酚含量测定 培养基中的COD、TP及TN使用COD多参数光度计(HANNA HI83399型)检测[16]。
WSE中总多酚含量采用Folin-Ciocalteu法测定[15]:称取干燥至恒重的没食子酸10.0 mg,加入到蒸馏水中定容至100 mL。分别取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和0.9 mL没食子酸溶液于10 mL的比色管中,加入Folin-Ciocalteu试剂0.5 mL,1 min后,加入碳酸钠溶液1.5 mL (200 g/L),用蒸馏水定容至刻度线处,混匀,40 ℃保温2 h后,迅速冷却。在760 nm处测定吸光度,建立标准曲线。取新鲜藻液2 mL,室温下8000×g离心5 min,取上清液1 mL,根据上述方法测定并代入标准曲线计算样品中多酚含量。
1.6 细胞内活性氧(reactive oxygen species,ROS)及酶活性测定 将收集的样品按照Che等[15]的方法使用活性氧检测试剂盒(上海碧云天生物技术有限公司)测定细胞内ROS的含量。
单针藻Monoraphidium sp. QLZ-3中谷胱甘肽(Glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)的活性使用试剂盒(碧云天)进行测定[17]。
1.7 脂肪酸组成分析 将2 mL 3%的硫酸-甲醇(体积比)溶液加入到烘干的油脂中,70 ℃回流2 h后,加入2 mL正己烷振荡提取4 h,取正己烷相进行气相色谱-质谱(GC-MS)分析[12]。
1.8 统计分析 本文全部实验均设置3组平行,利用ANOVA (SPSS19.0)一步法分析实验数据,*P < 0.05表示差异显著,**P < 0.01表示差异极显著。
2 结果和讨论 2.1 WSE对微藻生物量和油脂含量的影响 不同含量的WSE对单针藻Monoraphidium sp. QLZ-3生长的影响如图 1-A所示。在培养过程中,随着WSE含量的不断提高,微藻的生物量逐渐增加,当WSE的含量达到40%时,微藻的生物量达到(3.74±0.03) g/L,是对照组的1.15倍(P < 0.01)。同时,微藻的油脂含量达到最高,为(55.42±2.45)%,生物量产率和油脂产率分别为(534.70±4.07) mg/(L·d)和(296.41±15.36) mg/(L·d),分别相比对照组提高了14.82% (P < 0.01)和33.51% (P < 0.01)。相关研究结果显示,单独使用WSE培养微藻时,其生物量为1.18 g/L,生物量产率和油脂产率为130.18 mg/(L·d)和97.52 mg/(L·d)[13],分别为本实验结果的31.55%、24.34%和32.90%。Cheah等[18]研究指出,当BG-11中含有5%的棕榈油废水时,可以促进小球藻ESP-31的生长,生物量为3.46 g/L,但其油脂含量仅为17.6%,继续提高棕榈油废水的含量,微藻的生长受到抑制,这与本实验结果一致。当BG-11中WSE的含量增加至50%时,单针藻Monoraphidium sp. QLZ-3的生物量开始降低,油脂含量、生物量产率和油脂产率均有所下降。相关研究表明,微藻中油脂含量的增加与细胞内碳水化合物和蛋白质等大分子之间的相互转化有关[14]。结果表明,向BG-11中添加适宜浓度的WSE可以促进单针藻Monoraphidium sp. QLZ-3的生长和油脂的积累。
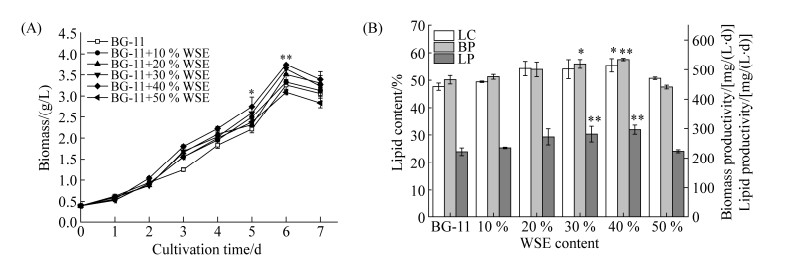 |
| 图 1 不同含量的WSE对微藻生长(A)和油脂含量(B)的影响 Figure 1 Effect of different WSE content on microalgae growth (A) and lipid content (B). LC: lipid content; BP: biomass productivity; LP: lipid productivity. Significance is indicated as asterisks. *: P < 0.05; **: P < 0.01. |
| 图选项 |
研究指出,BG-11培养基的制备成本为¥85.54/t[19]。此外,WSE的制备成本为¥25.05/t (天然气价格为¥2.4/t,水价格为¥3.45/t),实验组中培养基的制备成本为¥95.56/t。在WSE的作用下,微藻生物量和油脂的原料成本分别为¥25.55/kg和¥46.39/kg,相比对照组分别降低了2.93%和14.31% (P < 0.01)。结果表明,WSE联合BG-11用于微藻的培养可以降低微藻生物柴油制备的原料成本。
2.2 WSE对单针藻Monoraphidium sp. QLZ-3蛋白质、碳水化合物含量及COD、TP、TN移除率的影响 如图 2-A所示,实验组中单针藻Monoraphidium sp. QLZ-3细胞内的蛋白质的含量逐渐增加,第5天时最高,达到(22.42±0.30)%,为对照组的1.15倍(P < 0.05)。添加40% WSE的实验组中,蛋白质的含量与对照组变化趋势相同,第5天时达到峰值,然后逐步下降。而与对照组相比,实验组中碳水化合物含量则下调(图 2-B)。这可能是由于在诱导条件下,促进了细胞内部分与油脂合成相关酶的活性提高,从而提高了微藻中蛋白质含量和油脂积累[15, 17]。本实验结果显示,适宜浓度的WSE可以调节单针藻Monoraphidium sp. QLZ-3中蛋白质和碳水化合物的含量,促进微藻的生长和油脂的积累。
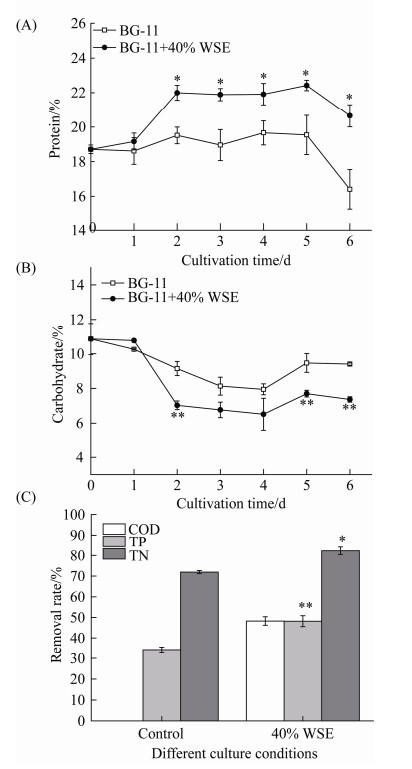 |
| 图 2 WSE对微藻中蛋白质(A)、碳水化合物含量(B)及COD、TP、TN移除率(C)的影响 Figure 2 Effect of WSE on content of protein, carbohydrate and the removal rate of COD, TP and TN in microalgae. Significance is indicated as asterisks. *: P < 0.05; **: P < 0.01. |
| 图选项 |
图 2-C表明,在微藻的生长过程中,添加40%的WSE对TN和TP的移除效果显著高于对照组,其中COD的最大移除率为(48.28±2.05)%,TN为(48.21±2.68)%,TP的最大去除率为(82.27±1.82)%。实验结果表明,培养基中营养物质的移除与细胞生长有关。相关研究显示,废水中氮的消耗量有利于单针藻Monoraphidium ssp. SDEC-17细胞的生长,而废水中的磷则是合成代谢产物的重要元素[20]。此外,利用棕榈油厂废水培养微藻时,废水中的TN和TP可以被微藻有效利用,进而促进细胞生长和脂质调节[18]。
2.3 WSE中多酚含量的变化 有研究指出,多酚具有较强的抗氧化性,可以作为一种微量元素被细胞吸收利用,从而减缓细胞的氧化损伤[7, 21]。抗氧化剂可以调节微藻细胞中的油脂合成途径,从而促进微藻油脂的合成[8]。如图 3所示,40%的WSE作用下,单针藻Monoraphidium sp. QLZ-3对多酚的移除率逐渐增加,培养至第6天时,其移除率达到(84.37±0.15)%。结果显示,40%的WSE促进了微藻的生长和油脂的积累(图 1-B),同时,WSE中的多酚被单针藻Monoraphidium sp. QLZ-3移除。前人研究指出,多酚可以阻碍细胞中油脂分子与自由基的结合,进而减少由于脂质氧化引起的细胞损伤,达到促进油脂的积累的目的[22]。抗氧化剂促进微藻的生长和油脂的积累,与抗氧化酶的活性及油脂合成相关酶基因的表达有关[8]。
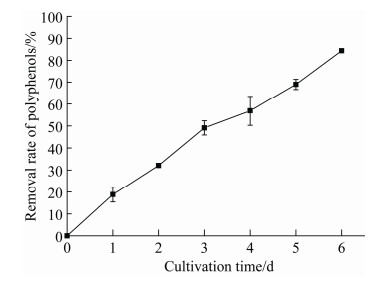 |
| 图 3 微藻对WSE中多酚的移除 Figure 3 The removal of polyphenols in WSE by microalgae. |
| 图选项 |
2.4 WSE对单针藻Monoraphidium sp. QLZ-3中ROS、GSH含量及SOD活性的影响 如图 4-A所示,在培养过程中,对照组中ROS的含量逐渐增加,而添加40% WSE的实验组中,ROS的含量先增加,第3天时达到最高,后逐渐降低,最终与对照组中ROS含量基本一致。这可能是由于WSE中的重金属导致了氧化胁迫,促进了藻细胞内ROS的迸发,ROS的增加可以促进藻细胞中次级代谢产物的积累,从而油脂含量提高[17]。相关研究指出,机体响应胁迫会启动自身的抗氧化系统,体内抗氧化物质的含量或活性提高,用于淬灭过高的ROS,降低胁迫条件对机体的损伤[23]。此外,抗氧化剂可以调控藻细胞内的抗氧化体系,淬灭过高的ROS,降低胁迫条件对机体的损伤[17]。WSE中的多酚作为一种抗氧化剂,可能参与了胁迫条件下藻细胞中抗氧化体系的调控。
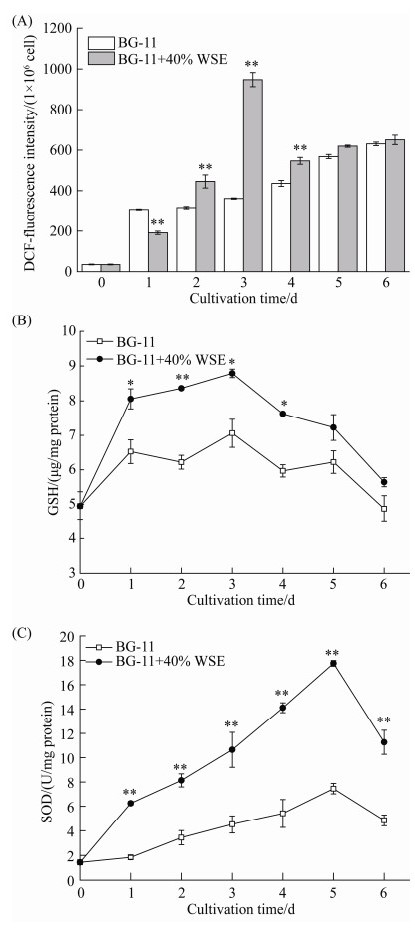 |
| 图 4 WSE对微藻中ROS含量(A)、GSH含量(B)和SOD活性(C)的影响 Figure 4 Effect of WSE on ROS, GSH content and SOD activity in microalgae. Significance is indicated as asterisks. *: P < 0.05; **: P < 0.01. |
| 图选项 |
在微藻的培养过程中,GSH含量先增加后减少,第3天时,含量达到最高(图 4-B)。图 4-B表明,外源添加WSE显著促进了藻细胞中GSH含量的增加,第2天时最高,为对照组的1.34倍(P < 0.01)。研究指出,GSH具有较强的抗氧化性,在非生物胁迫条件下,GSH含量的增加有助于降低细胞内ROS的含量,减少细胞的氧化损伤,促进油脂的积累[16]。这与本实验结果相一致,WSE促进了单针藻Monoraphidium sp. QLZ-3中GSH的增加(图 4-B),从而促进了油脂的积累(图 1-A)。
SOD是生物体系中抗氧化酶系的重要组成成员,广泛分布在微生物、植物和动物体内[24]。在WSE作用下,藻细胞中SOD的活性逐渐增加,第5天时,SOD活性最高,为(17.75±0.24) U/mg蛋白,是对照组的2.38倍(图 4-C,P < 0.01)。图 3表明,在培养过程中,多酚的移除率逐渐增加,与此同时细胞内SOD的活性逐渐增加。Zhao等[17]研究指出,外源叔丁基对甲酚(butylated hydroxytoluene,BHT)作用下,促进了雨生红球藻Haematococcus pluvialis中SOD活性的提高,减少了细胞的氧化损伤,进而增加了细胞中油脂的积累。本实验中也得到相似的结果,WSE中多酚的消耗上调了单针藻Monoraphidium sp. QLZ-3中SOD的活性,增加了细胞的抗氧化能力,有利于减少由于脂质氧化引起的细胞氧化损伤,促进微藻油脂的积累。
2.5 WSE对微藻中rbcL和accD基因表达量的影响 上述结果表明,WSE的添加会引起单针藻Monoraphidium sp. QLZ-3内ROS的变化,WSE中的多酚作为一种抗氧化剂,通过参与细胞内的抗氧化体系调节,淬灭过高的ROS,减缓细胞的氧化损伤,维持氧代谢的平衡,促进油脂含量的增加。研究指出,抗氧化剂可以通过调节油脂合成相关途径,进而促进微藻中油脂的积累[8]。
WSE对单针藻Monoraphidium sp. QLZ-3细胞内rbcL和accD基因表达量的影响,以及外源添加WSE对微藻中rbcL基因相对表达量的影响见图 5。在WSE的作用下,单针藻Monoraphidium sp. QLZ-3细胞内rbcL基因的相对表达量均出现不同程度的上调。与对照组相比,在培养的1–3 d,rbcL基因的相对表达量从(1.55±0.23)倍增加至(2.14±0.16)倍,随后开始下降,到第6天时下降至(1.77±0.21)倍。rbcL基因与CO2的固定有关,其表达量的上调,可以加快光合作用固碳[10]。图 5表明,WSE作用下微藻中rbcL基因表达量上调,可以提高微藻的光合作用速率,促进微藻对CO2的吸收,为微藻的生长提供更多的碳骨架,进而促进了微藻的生物量和油脂的积累(图 1-A和B)。相关研究表明,缺氮条件可以促进小球藻chlorella vulgaris var L3中rbcL基因表达量的上调,油脂含量增加了25%[10]。本实验结果显示,外源添加40%的WSE上调了rbcL基因表达量,提高了CO2的固定效率,促进了微藻的生长及油脂的积累。
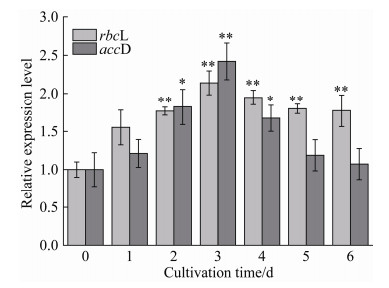 |
| 图 5 WSE对微藻中rbcL和accD基因表达量的影响 Figure 5 Effect of WSE on expression of rbcL and accD genes in microalgae. Significance is indicated as asterisks. *: P < 0.05; **: P < 0.01. |
| 图选项 |
乙酰辅酶A羧化酶主要催化依赖ATP的乙酰辅酶A (acetyl coenzyme A)转化为丙二酰辅酶A,是微藻油脂合成过程中的限速酶[25]。在WSE的作用下,单针藻Monoraphidium sp. QLZ-3中,accD基因相对表达量的变化如图 5所示,在单针藻Monoraphidium sp. QLZ-3培养的前3天,藻细胞内accD的活性逐渐增强,第3天时达到对照组的(2.42±0.24)倍,而后逐渐下降。前人研究指出,由ACCase催化生成的丙二酰辅酶A,可以有效抑制脂肪酸的氧化[25]。本实验研究结果显示,向BG-11中加入适宜浓度的WSE,可以提高单针藻Monoraphidium sp. QLZ-3中accD的相对表达量,促进微藻油脂的积累。
2.6 外源WSE对单针藻脂肪酸的组成影响 表 3显示了在WSE作用下单针藻Monoraphidium sp. QLZ-3中脂肪酸组成的变化。与对照组相比,40%的WSE作用下,微藻中的C16:0和C18:3含量分别减少了24.80% (P < 0.01)和23.24% (P < 0.01),而C18:1和C18:2的含量则分别增加了174.25% (P < 0.01)和39.82% (P < 0.01)。从而使得实验组中SFA含量下调,MUFA上调,PUFA含量保持不变。40%的WSE作用下的实验组中DU值为(112.91±6.76),相比对照组提高了9.76%,可作为生产生物柴油的原料[26]。此外,LCSF用来计算生物柴油的CFPP,CFPP值越低,生物柴油的低温流动性能越好。由于各国所处的环境不同,对CFPP值也有不同的规定。虽然欧洲柴油标准并未对生物柴油的CFPP值提出具体的要求,但我国(GB/T25199-2010)规定其值不高于–5 ℃到12 ℃。本实验结果表明,WSE联合BG-11培养微藻得到的脂肪酸,符合生产生物柴油的标准。
表 3. 不同培养条件对单针藻Monoraphidium sp. QLZ-3中脂肪酸的组成的影响 Table 3. Effects of different culture conditions on the composition of fatty acids in Monoraphidium sp. QLZ-3
| Fatty acid | Cultivation conditions | |
| BG11/(% Total fatty acids) | 40%WSE/(% Total fatty acids) | |
| C14:0 | 0.66±0.021 | 0.48±0.011** |
| C15:0 | 0.43±0.05 | 0.12±0.014** |
| C16:0 | 39.59±2.72 | 29.77±0.92** |
| C16:1 | 0.8±0.19 | 0.32±0.013** |
| C17:0 | 0.49±0.11 | 0.31±0.021** |
| C18:0 | 2.56±0.10 | 1.41±0.12** |
| C18:1 | 6.33±0.35 | 17.36±1.79** |
| C18:2 | 19.81±2.22 | 27.52±1.44** |
| C18:3 | 24.79±0.98 | 19.03±0.64** |
| C20:0 | 0.17±0.14 | 0.087±0.016** |
| C20:1 | 0.1±0.14 | 1.06±0.30** |
| C20:2 | Nd | 0.19±0.078 |
| C20:3 | 3.23±0.31 | 0.019±0.026** |
| C22:0 | 0.097±0.14 | 0.46±0.078** |
| C22:1 | Nd | 0.61±0.21 |
| C22:2 | Nd | Nd |
| C24:0 | Nd | 0.46±0.08 |
| C24:1 | Nd | 0.047±0.067 |
| SFA | 44.01±1.28 | 33.09±1.26** |
| MUFA | 7.23±0.68 | 19.39±2.38** |
| PUFA | 47.82±3.51 | 46.76±2.19 |
| DU | 102.87±2.70 | 112.91±6.76 |
| LCSF | 5.56±1.07 | 5.37±0.45 |
| CEPP | –16.31±0.02 | –16.31±0.01 |
| Significance is indicated as asterisks (*: P < 0.05; **: P < 0.01). SFA: saturated fatty acid; MUFA: monounsaturated fatty acid; PUFA: polyunsaturated fatty acid; DU: degree of unsaturation; LCSF: long chain saturation factor; CFPP: cold filter plugging poin. | ||
表选项
3 结论 本文研究了不同浓度的WSE对BG-11中单针藻Monoraphidium sp. QLZ-3生长和油脂积累的影响。40%的WSE上调了rbcL和accD基因的表达量,加快了CO2的固定和多酚的移除,同时上调了GSH和SOD的活性,提高了单针藻Monoraphidium sp. QLZ-3的生物量产率和油脂产率。综上,WSE联合BG-11培养微藻,为微藻的工业化培养和核桃壳的综合利用提供了新的思路。
References
| [1] | Dong XZ, Che RQ, Zhao YT, Li Tao, Xu JW, Zhao P, Yu XY. Effects of fulvic acid on lipid accumulation and genes (me、pepc、accD) expression of Monoraphidium sp. FXY-10. China Oils and Fats, 2018, 43(7): 108-112. (in Chinese) 董训赞, 车绕琼, 赵永腾, 李涛, 徐军伟, 赵鹏, 余旭亚. 黄腐酸对单针藻Monoraphidium sp. FXY-10油脂积累及me、pepc、accD基因表达量的影响. 中国油脂, 2018, 43(7): 108-112. |
| [2] | Dong XZ, Che RQ, Zhao YT, Zhao P, Xu JW, Li T, Yu XY. Effects of fulvic acid on lipid accumulation of Monoraphidium sp. FXY-10. Oceanologia et Limnologia Sinica, 2018, 49(4): 815-820. (in Chinese) 董训赞, 车绕琼, 赵永腾, 赵鹏, 徐军伟, 李涛, 余旭亚. 黄腐酸对Monoraphidium sp. FXY-10油脂合成的影响. 海洋与湖沼, 2018, 49(4): 815-820. |
| [3] | Hoh D, Watson S, Kan E. Algal biofilm reactors for integrated wastewater treatment and biofuel production:a review. Chemical Engineering Journal, 2016, 287: 466-473. DOI:10.1016/j.cej.2015.11.062 |
| [4] | Cheah WY, Show PL, Juan JC, Chang JS, Ling TC. Enhancing biomass and lipid productions of microalgae in palm oil mill effluent using carbon and nutrient supplementation. Energy Conversion and Management, 2018, 164: 188-197. DOI:10.1016/j.enconman.2018.02.094 |
| [5] | Feng Z, Fang XP. Comprehensive utilization ways of by-products from walnut processing. China Oils and Fats, 2018, 43(9): 71-74, 87. (in Chinese) 冯贞, 方晓璞. 核桃加工副产物综合利用途径. 中国油脂, 2018, 43(9): 71-74, 87. |
| [6] | Zhang SJ, Xing BL, Huang GX, Jia JB, Xu B, Zhang XM, Zhang CX. A study on adsorption of Cr(Ⅵ) by hydrothermal carbon from walnut shell. Chemical Industry and Engineering Progress, 2016, 35(3): 950-956. (in Chinese) 张双杰, 邢宝林, 黄光许, 贾建波, 徐冰, 张效铭, 张传祥. 核桃壳水热炭对六价铬的吸附特性. 化工进展, 2016, 35(3): 950-956. |
| [7] | Ouyang H, Hou K, Peng WX, Liu ZL, Deng HP. Antioxidant and xanthine oxidase inhibitory activities of total polyphenols from onion. Saudi Journal of Biological Sciences, 2018, 25(7): 1509-1513. DOI:10.1016/j.sjbs.2017.08.005 |
| [8] | Zhao YT, Wang HP, Han BY, Yu XY. Coupling of abiotic stresses and phytohormones for the production of lipids and high-value by-products by microalgae:a review. Bioresource Technology, 2019, 274: 549-556. DOI:10.1016/j.biortech.2018.12.030 |
| [9] | Nayak M, Karemore A, Sen R. Performance evaluation of microalgae for concomitant wastewater bioremediation, CO2 biofixation and lipid biosynthesis for biodiesel application. Algal Research, 2016, 16: 216-223. DOI:10.1016/j.algal.2016.03.020 |
| [10] | Ikaran Z, Suárez-Alvarez S, Urreta I, Casta?ón S. The effect of nitrogen limitation on the physiology and metabolism of Chlorella vulgaris var L3. Algal Research, 2015, 10: 134-144. DOI:10.1016/j.algal.2015.04.023 |
| [11] | Singh P, Kumari S, Guldhe A, Singh G, Bux F. ACCase and rbcL gene expression as a function of nutrient and metal stress for enhancing lipid productivity in Chlorella sorokiniana. Energy Conversion and Management, 2017, 148: 809-819. DOI:10.1016/j.enconman.2017.06.054 |
| [12] | Zhao YT, Li DF, Ding K, Che RQ, Xu JW, Zhao P, Li T, Ma HX, Yu XY. Production of biomass and lipids by the oleaginous microalgae Monoraphidium sp. QLY-1 through heterotrophic cultivation and photo-chemical modulator induction. Bioresource Technology, 2016, 211: 669-676. DOI:10.1016/j.biortech.2016.03.160 |
| [13] | Dong XZ, Han BY, Zhao YT, Ding W, Yu XY. Enhancing biomass, lipid production, and nutrient utilization of the microalga Monoraphidium sp. QLZ-3 in walnut shell extracts supplemented with carbon dioxide. Bioresource Technology, 2019, 287: 121419. DOI:10.1016/j.biortech.2019.121419 |
| [14] | Zhao YT, Li DF, Xu JW, Zhao P, Li T, Ma HX, Yu XY. Melatonin enhances lipid production in Monoraphidium sp. QLY-1 under nitrogen deficiency conditions via a multi-level mechanism. Bioresource Technology, 2018, 259: 46-53. DOI:10.1016/j.biortech.2018.03.014 |
| [15] | Che RQ, Huang L, Xu JW, Zhao P, Li T, Ma HX, Yu XY. Effect of fulvic acid induction on the physiology, metabolism, and lipid biosynthesis-related gene transcription of Monoraphidium sp. FXY-10. Bioresource Technology, 2017, 227: 324-334. DOI:10.1016/j.biortech.2016.12.017 |
| [16] | Dong XZ, Zhao YT, Yu XY. Research on the biofuels production of Monoraphidium sp. FXY-10 by combined melatonin and molasses wastewater. Chemical Industry and Engineering Progress, 2019, 38(5): 2421-2428. (in Chinese) 董训赞, 赵永腾, 余旭亚. 褪黑素诱导糖蜜废醪液培养单针藻Monoraphidium sp. FXY-10产生物燃料. 化工进展, 2019, 38(5): 2421-2428. |
| [17] | Zhao YT, Yue CC, Ding W, Li T, Xu JW, Zhao P, Ma HX, Yu XY. Butylated hydroxytoluene induces astaxanthin and lipid production in Haematococcus pluvialis under high-light and nitrogen-deficiency conditions. Bioresource Technology, 2018, 266: 315-321. DOI:10.1016/j.biortech.2018.06.111 |
| [18] | Cheah WY, Show PL, Juan JC, Chang JS, Ling TC. Microalgae cultivation in palm oil mill effluent (POME) for lipid production and pollutants removal. Energy Conversion and Management, 2018, 174: 430-438. DOI:10.1016/j.enconman.2018.08.057 |
| [19] | Pei HY, Jiang LQ, Hou QJ, Yu Z. Toward facilitating microalgae cope with effluent from anaerobic digestion of kitchen waste:the art of agricultural phytohormones. Biotechnology for Biofuels, 2017, 10(1): 76. |
| [20] | Mondal M, Ghosh A, Tiwari ON, Gayen K, Das P, Mandal MK, Halder G. Influence of carbon sources and light intensity on biomass and lipid production of Chlorella sorokiniana BTA 9031 isolated from coalfield under various nutritional modes. Energy Conversion and Management, 2017, 145: 247-254. DOI:10.1016/j.enconman.2017.05.001 |
| [21] | Lu YZ, Du Y, Qin XY, Wu HT, Huang YJ, Cheng Y, Wei Y. Comprehensive evaluation of effective polyphenols in apple leaves and their combinatory antioxidant and neuroprotective activities. Industrial Crops and Products, 2019, 129: 242-252. DOI:10.1016/j.indcrop.2018.12.013 |
| [22] | Paz-Yépez C, Peinado I, Heredia A, Andrés A. Lipids digestibility and polyphenols release under in vitro digestion of dark, milk and white chocolate. Journal of Functional Foods, 2019, 52: 196-203. DOI:10.1016/j.jff.2018.10.028 |
| [23] | Shi HT, Wang X, Tan DX, Reiter RJ, Chan ZL. Comparative physiological and proteomic analyses reveal the actions of melatonin in the reduction of oxidative stress in Bermuda grass (Cynodon dactylon (L). Pers.). Journal of Pineal Research, 2015, 59(1): 120-131. DOI:10.1111/jpi.12246 |
| [24] | Xu HX. Research progress on comprehensive utilization of superoxide dismutase. Horticulture & Seed, 2014(8): 59-62. (in Chinese) 徐颢溪. 超氧化物歧化酶综合利用研究进展. 园艺与种苗, 2014(8): 59-62. |
| [25] | Mei LK, Wei QQ, Zhang HB, Zhou JP. Research progress in acetyl-CoA carboxylase inhibitors. Journal of China Pharmaceutical University, 2019, 50(3): 253-264. (in Chinese) 梅连阔, 魏强强, 张惠斌, 周金培. 乙酰辅酶A羧化酶抑制剂的研究进展. 中国药科大学学报, 2019, 50(3): 253-264. |
| [26] | Yu XY, Zhao P, He CA, Li JJ, Tang XH, Zhou JP, Huang ZX. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresource Technology, 2012, 121: 256-262. DOI:10.1016/j.biortech.2012.07.002 |
