李健, 李肖鹤, 后文, 郑沈, 朱向东


江西农业大学生物科学与工程学院, 江西 南昌 330045
收稿日期:2019-04-16;修回日期:2019-07-12;网络出版日期:2019-07-24
基金项目:国家自然科学基金项目(21366012);江西省教育厅科技计划项目(GJJ170286)
*通信作者:朱向东, E-mail:zhuxdau@jxau.edu.cn.
摘要:[目的] 从积年垃圾堆积点土壤中筛选具有高效抑菌能力的广谱拮抗菌株并研究其抑菌特性,寻找乡镇垃圾堆积点污染治理的新思路。[方法] 采用平板稀释法和管碟法从乡镇积年垃圾堆积点的土壤中分离拮抗真菌,并通过形态观察、生理生化特性及分子生物学鉴定分析对拮抗菌株进行鉴定。通过测定抑菌活性物质的极性,选择合适的有机试剂对拮抗真菌的发酵菌体甲醇浸提物及发酵液进行萃取,并利用TLC-Bioautography法对发酵液及发酵菌体中的抑菌活性组分进行分析。使用23种指示菌测定拮抗真菌DAZ-2的发酵菌体乙酸乙酯粗提物的抑菌广谱,测定粗提物在高温、酸碱、紫外和自然光条件下抑菌能力,以及对大肠杆菌和白色念珠球菌的最小抑菌浓度。[结果] 分离得到一株传代稳定的广谱拮抗真菌DAZ-2,经过形态观察、生理生化特性测定及ITS序列分析,菌株鉴定为Aspergillus fumigatus。通过极性测定,选择乙酸乙酯对烟曲霉DAZ-2发酵菌体甲醇浸提物及发酵液进行萃取,TLC-Bioautography法分析表明两者中的抑菌活性物质不是同一组分,且存在多组分物质共同作用产生抑菌效果的可能性;菌体浸提物乙酸乙酯萃取部分(200μg/mL)对11种指示菌具有抑菌效果,对大肠杆菌和白色念珠球菌的MIC为7.50μg/mL和15μg/mL,且对高温、酸碱、紫外、自然光照都具有较强的稳定性。[结论] 分离得到一株高效抑菌且传代稳定的广谱拮抗菌株烟曲霉DAZ-2,有希望为微生物药物的开发和乡镇垃圾堆积点污染治理提供科学依据。
关键词:烟曲霉抑菌活性生物防治
Isolation, identification and antibacterial characteristics of broad-spectrum antagonistic strains in soils of garbage accumulation
Jian Li, Xiaohe Li, Wen Hou, Shen Zheng, Xiangdong Zhu


College of Biological Science and Engineering, Jiangxi Agriculture University, Nanchang 330045, Jiangxi, China
Received: 16 April 2019; Revised: 12 July 2019; Published online: 24 July 2019
*Corresponding author: Zhu Xiangdong, E-mail:zhuxdau@jxau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (21366012) and by the Jiangxi Provincial Department of Education Science and Technology Plan Project (GJJ170286)
Abstract: [Objective] A broad-spectrum antagonistic strain with high antibacterial ability was screened from the garbage heap soil and its antibacterial properties were studied for pollution control of township garbage accumulation sites. [Methods] Antagonistic fungi were isolated from the soil of garbage accumulation sites in townships by plate dilution method and cylinder-plate method, and the antagonistic strains were identified by morphological observation, physiological and biochemical characteristics and molecular biological identification. Suitable organic reagents were selected to extract mycelia and fermentation broth of antagonistic fungi, by measuring the polarity of antibacterial active substances. The TLC-Bioautography method was used to analyze the bacteriostatic active components in the fermentation broth and mycelia. Determination of antibacterial spectrum of ethyl acetate extract of mycelium used 23 indicator bacteria. The high-temperature tolerance, acid-base tolerance, ultraviolet stability, natural light stability of the crude extract and the minimum inhibitory concentration against Escherichia coli and Candida albicans were determined. [Results] A passaging stable broad-spectrum antagonistic fungus DAZ-2 was isolated and identified as Aspergillus fumigatus by morphological observation, physiological and biochemical characteristics, and ITS sequence analysis. Selecting ethyl acetate reagent to extract methanol extract and fermentation broth of Aspergillus fumigatus DAZ-2 fermentation mycelium. The TLC-Bioautography method showed that the antibacterial active substances in the two were not the same component, and the multi-component substances cooperated to produce a bacteriostatic effect. The crude ethyl acetate extract of fermenting mycelium (200 μg/mL) has antibacterial effect on 11 indicator bacteria, and the MIC of Escherichia coli and Candida albicans is 7.50 and 15 μg/mL, and the antibacterial ability was stable, tolerated to temperature, light, ultraviolet, acid, and alkali. [Conclusion] A wide-spectrum antagonistic strain, Aspergillus fumigatus DAZ-2 with high antibacterial activity and stable passage was isolated, which is expected to provide a scientific basis for the development of microbial drugs and the pollution control of garbage accumulation sites in villages.
Keywords: Aspergillus fumigatusantibacterial activitybiocontrol
随着过去数十年的开发,普通陆地环境中新型抗生素的分离获取越来越困难,于是对特殊环境微生物的研究已成为当前微生物药学研究的主要领域之一[1]。近年来各国科研人员加大了对海洋、极地、热泉、火山、洞穴、沙漠、盐碱地、红树林等特殊生态环境[2-5]中的微生物药物的研发,分离得到了许多微生物新属或新种[6],并从中获得了一些结构新颖的活性物质[7]。垃圾堆积点这种人为创造的普通陆地环境中特殊环境也许可以为拮抗菌株的筛选及微生物药物的开发研究提供帮助。
垃圾的分类处理及资源化利用是环境治理的一个重要发展方向。垃圾的大量聚积、腐败变质和抗生素的泛滥使用为微生物提供了充足的营养及适合的生长、变异的环境,因此垃圾堆积点便渐渐成为了理想的微生物资源库。近年来的报道显示,相继有科研人员从垃圾污染环境中分离获得了具有应用价值的微生物资源,例如:解磷菌、固氮菌及解钾菌[8];餐厨垃圾中胶原蛋白和几丁质原位降解菌株[9];除臭微生物菌群[10-12];纤维素降解菌株[13-14]等等。但针对垃圾堆积点土壤进行抗菌微生物的筛选鉴定及特性研究,目前国内外还未见报道,相对较为冷门。人为干涉带来了大量的外来菌种,环境中抗生素的污染[15]加剧了微生物的变异与竞争,使从垃圾堆积点土壤中筛选获得高效抑菌的生防菌株的可能性相较于普通陆地土壤环境大大提升。因此,垃圾堆积点土壤的抗菌微生物资源开发具有较好的应用价值和发展前景。
本研究使用23种指示菌,从江西省吉安市周边乡镇积年垃圾堆积点土壤中筛选到一株烟曲霉(Aspergillus fumigatus)DAZ-2。实验结果表明,DAZ-2是一株高效抑菌且传代稳定的广谱拮抗菌株,菌体浸提物乙酸乙酯萃取部分对热处理、酸碱、自然光和紫外拥有较强的稳定性,具有一定的生防潜力和开发成微生物药物的价值,希望能够为乡镇中生活垃圾长期堆积造成的环境污染治理提供些许帮助。
1 材料和方法 1.1 材料
1.1.1 培养基: 拮抗真菌的筛选采用马丁氏培养基;真菌的培养采用PDA培养基;发酵液及种子液采用PDB培养基;细菌培养采用牛肉膏蛋白胨培养基;菌落形态观测采用查氏培养基和高氏一号培养基[16]。
1.1.2 供试指示菌: 包括大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、苏云金芽孢杆菌(Bacillus thuringiensis)、枯草芽孢杆菌(Bacillus subtilis)、水稻黄单胞菌(Xanthomonas oryzae)、地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、恶臭假单胞菌(Pseudomonas putida)、黑曲霉(Aspergillus niger)、意大利青霉(Penicillium italicum)、桔青霉(Fungi Imperficti)、指状青霉(Penicillium digitatum)、啤酒酵母(Saccharomyces cerevisiae)、西瓜枯萎病菌(Fusarium oxysporum f. sp. niveum)、黄瓜枯萎病菌(Fusarium oxysporum f. sp. cucumebrium Owen)、棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)、烟草黑胫病菌(Phytophthora parasiticavar. nicotianae)、葡萄座腔病菌(Botryosphaeria dothidea)、稻瘟病菌(Magnaporthe oryzae)、水稻纹枯病菌(Thanatephorus cucumeris)、白色念珠球菌(Candida albicans)、链隔孢菌(Alternaria nees)、辣椒疫霉菌(Phytophthora capsici)共23种指示菌,以上菌株由江西农业大学生物科学与工程学院实验室保藏、提供。
1.1.3 土壤样品: 于江西省吉安市周边乡镇内不同环境类型(山坳,池塘,树林,草地等)的积年垃圾堆积点,使用五点采样法采得土壤样品多份。
1.2 拮抗菌株的筛选
1.2.1 菌株的分离、纯化和保藏: 将土壤样品配制成0.1 g/mL的土壤悬浮液,无菌条件下使用稀释平板法[17]借助马丁氏培养基对土壤中的真菌进行分离。28 ℃下恒温倒置培养,对菌株的菌落形态进行观察、归类,选择代表性菌株单菌落进行挑取,用划线法反复纯化菌株,并根据分离时间以DAZ-1、DAZ-2、DAZ-3的顺序依次对纯化菌株进行命名。将获得的纯化菌株甘油低温保藏。
1.2.2 抑菌活性测定: 无菌条件下用PDA培养基将甘油保藏的纯化菌株活化,切块放入PDB培养基中,28 ℃下150 r/min摇床培养3 d,制备成种子液。按2%的接种量将种子液接入发酵(PDB)培养基。相同条件下摇床培养7 d后,5000 r/min低温离心20 min,分离上清液和菌体备用。
取离心后获得的上清液用0.22 μm的微孔滤膜过滤处理,视为发酵液。将大肠杆菌、苏云金芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球菌和水稻黄单胞菌5种细菌指示菌制成菌悬液,菌悬液OD600值为0.8-1[18]。利用管碟法[19]测定发酵液的抑菌活性。每个带菌平板中放置4个牛津杯,其中3个牛津杯中加入200 μL发酵液,以等量无菌蒸馏水为空白对照。带菌平板28 ℃下恒温培养24 h,以抑菌圈直径的大小表示抑菌效果的强弱,记录数据并拍照,每个处理设置3个平行,筛选具有抑菌效果的拮抗菌株。
离心后获得的菌体混悬于无菌蒸馏水,5000 r/min低温离心20 min,反复处理3次,洗净菌体表面残留发酵液,40 ℃烘干。处理好的发酵菌体用3倍体积的甲醇试剂浸提,过夜后用布氏漏斗抽滤,反复浸提3次。将浸提后的甲醇溶剂减压浓缩至浸膏,获得发酵菌体甲醇浸提物。用蒸馏水溶解,稀释浓度至1 mg/mL,无菌蒸馏水为空白对照,使用管碟法对菌体甲醇浸提物进行抑菌活性测定。
1.3 拮抗菌株的鉴定
1.3.1 形态学鉴定: 将甘油保藏的拮抗菌株活化后,分别接种至PDA培养基、查氏培养基、高氏一号培养基和牛肉膏蛋白胨培养基中,28 ℃恒温培养3 d,观察菌株的菌落形态、基内菌丝及气生菌丝颜色、是否产生色素等[20]形态学特征。同时利用插片法[21],使用光学显微镜对拮抗菌株进行显微观察,记录数据并拍照。
1.3.2 生理生化鉴定: 将甘油保藏的拮抗菌株活化,28 ℃恒温培养4 d,达到稳定期后,对菌株的耐盐性、耐酸性、淀粉酶、过氧化氢酶、甲基红和碳源利用能力等生理生化特征进行测定[22]。
1.3.3 ITS序列分析鉴定: 挑取菌体经过变性处理,离心取上清液为模板,利用通用引物ITS1(5′-T CCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCT CCGCTTATTGATATGC-3′)进行ITS序列的PCR扩增。PCR反应条件为:98 ℃预变性2 min;98 ℃变性10 s,54 ℃退火10 s,72 ℃延伸10 s,35个循环;72 ℃延伸5 min。PCR扩增产物用1%琼脂糖凝胶电泳进行检测后切胶回收,送至湖南擎科生物有限公司进行测序。将获得序列提交至GenBank,并在NCBI数据库中进行BLAST序列分析比对,采用MEGA5.1软件中的Neighbor- Joining法[23]构建系统发育树,然后结合形态学分析和生理生化特性测定确定拮抗菌株的种属地位。
1.4 拮抗菌株DAZ-2的抑菌特性研究
1.4.1 抑菌活性物质的极性测试: 取拮抗菌株DAZ-2的发酵菌体甲醇浸提物(用水溶解)及发酵液各5份,分别用等体积的石油醚、氯仿、乙酸乙酯和正丁醇试剂充分萃取。静置4 h后用分液漏斗分离水相和有机相,反复萃取3次。分装萃取后的水相备用。将不同试剂萃取获得的有机相减压浓缩至浸膏,用少量甲醇完全溶解,获得发酵菌体甲醇浸提物及发酵液的不同有机溶剂的萃取组分,分别加入蒸馏水稀释浓度至200 μg/mL。参照1.2.2方法,以大肠杆菌为指示菌,未经有机溶剂萃取的发酵菌体甲醇浸提物(200 μg/mL)及发酵液为对照,通过管碟法,测定不同有机溶剂粗提物及对应有机溶剂3次萃取后的水相的抑菌活性,选择合适的活性物质萃取剂。
1.4.2 TLC-Bioautography法[24]: 将获得的发酵菌体甲醇浸提物及发酵液的乙酸乙酯萃取部分减压浓缩至浸膏,甲醇溶解稀释至200 μg/mL,用毛细管分别点样于GF254硅胶板上。设置A、B、C、D、E共5个处理组。其中A处理组点样在硅胶板中央,不用展开剂展开。B、C、D、E处理组用展开剂(氯仿:甲醇=7:3)展开。在无菌条件下使用琼脂覆盖法[20]将牛肉膏蛋白胨培养基和指示菌均匀涂布在处理后的硅胶板上。A、B处理组硅胶板上涂布指示菌为大肠杆菌,C、D、E处理组硅胶板上涂布指示菌分别为金黄色葡萄球菌、苏云金芽孢杆菌和枯草芽孢杆菌。37 ℃恒温培养过夜,由A处理组硅胶板上有无抑菌圈出现,判断发酵菌体甲醇浸提物及发酵液的乙酸乙酯粗提物中的抑菌活性组分可否通过Bioautography法进行活性追踪;比较B、C、D、E处理组硅胶板上,发酵菌体甲醇浸提物及发酵液的乙酸乙酯粗提物TLC展开部分中无细菌生长或细菌生长较少部位的Rf值,判断二者中的抑菌活性物质是否为同一组分。
1.5 抑菌谱实验 取适量发酵菌体甲醇浸提物(用水溶解),乙酸乙酯充分萃取,有机相减压浓缩至浸膏,少量甲醇溶解,加入蒸馏水稀释至200 μg/mL,0.22 μm的微孔滤膜过滤,获得待测药液简称为发酵菌体乙酸乙酯粗提物,分装备用,使用23种指示菌测试其抑菌谱。
参照1.2.2方法,通过管碟法测定发酵菌体甲醇浸提物乙酸乙酯萃取组分对黑曲霉、意大利青霉、桔青霉、指状青霉、啤酒酵母、白色念珠球菌6种真菌指示菌和大肠杆菌、苏云金芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球菌、地衣芽孢杆菌、解淀粉芽孢杆菌、恶臭假单胞菌、水稻黄单孢菌8种细菌指示菌的抑菌效果。与加入待测药液中等量甲醇溶解的无菌蒸馏水为空白对照,各处理重复3次,观察抑菌圈大小并记录拍照。
通过菌丝生长速率法[25]测定发酵菌体乙酸乙酯粗提物对西瓜枯萎病菌、黄瓜枯萎病菌、棉花枯萎病菌、烟草黑胫病菌、葡萄座腔病菌、稻瘟病菌、水稻纹枯病菌、链隔孢菌、辣椒疫霉菌9种病原指示菌的抑菌效果。将处理好的200 μg/mL的粗提物溶液按1:20的比例和PDA培养基混匀,制成带药平板。无菌条件下在平板中央接入病原指示菌的菌饼(d=6 mm),空白对照的平板中加入与待测药液等量甲醇溶解的无菌蒸馏水。各处理重复3次,28 ℃恒温培养4 d,用十字交叉法[26]测量对照平板及带药平板上的菌落直径,记录并拍照,计算发酵菌体乙酸乙酯粗提物对病原指示菌的菌落生长抑制率。
用公式(1-2)[27]计算菌丝生长抑制率(%)。
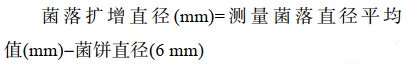 | 公式(1) |
 | 公式(2) |
1.7 菌体浸提物乙酸乙酯萃取部分的抑菌活性稳定性测试 取适量拮抗菌株DAZ-2菌体浸提物乙酸乙酯萃取部分,少量甲醇完全溶解,加入蒸馏水将浓度稀释至200 μg/mL,视为待测药液。待经过不同处理后,0.22 μm微孔滤膜过滤除菌,用于抑菌活性稳定性测试[28]。
1.7.1 热稳定性: 取适量待测药液,于40、60、80、100 ℃温度下,分别水浴加热处理30、60、90、120、180 min,以及121 ℃下处理20 min。冷却至室温,以大肠杆菌为指示菌,室温下保藏相同时间的待测药液为对照组,参照1.2.2方法,通过管碟法测试菌体浸提物乙酸乙酯萃取部分抑菌活性的热稳定性。
1.7.2 酸碱稳定性: 配置1 mol/L的HCL和NaOH溶液,并用pH计测定待测药液的原始pH值。然后取适量待测药液分装,分别将pH值改变至1.0-13.0,以大肠杆菌为指示菌,原始pH值的待测药液为对照组,参照1.2.2方法,通过管碟法测试菌体浸提物乙酸乙酯萃取部分抑菌活性的酸碱稳定性。
1.7.3 光稳定性: 取适量待测药液,分装至50 mL无菌锥形瓶中,用封口膜封紧瓶口防止染菌。A处理组放置在无遮挡的阳台处,自然光照处理6、12、18、24 h;B处理组放置在36 W紫外灯管下方30 cm处,分别处理20、30、40、50、60 min。处理时间结束的待测药液于无菌条件下分装,放置在黑暗条件下保藏。待处理完毕后,以黑暗中保藏24 h和60 min的待测药液为对照组,大肠杆菌为指示菌,参照1.2.2方法,通过管碟法测试菌体浸提物乙酸乙酯萃取部分对自然光照和紫外光照的稳定性。
1.8 数据处理 利用Excel 2007进行数据的处理,借助DPS 7.5软件采用最小显著差数法(LSD)分析拮抗菌株DAZ-2的活性代谢产物对于不同指示菌的抑制效果,将显著性水平设定为α=0.05,并利用Origin8.5软件作图。
2 结果和分析 2.1 拮抗菌株的筛选 借助马丁氏琼脂培养基,从积年垃圾堆积点土样中分离获得纯化真菌226株,经过5种细菌指示菌对纯化菌株发酵产物的拮抗筛选,获得有抑菌效果的拮抗菌株67株,占分离纯化菌株总数的29.65%。其中菌株DAZ-2的抑菌效果最为明显(表 1),发酵液对5种细菌指示菌全部具有抑制效果。发酵菌体的甲醇浸提物能够溶解在水和甲醇溶液中,但相同浓度下,无菌蒸馏水溶解后抑菌活性更强。而用水溶解并稀释至1 mg/mL时,对5种细菌指示菌的抑菌圈直径全部超过20 mm。因此选定拮抗菌株DAZ-2进行后续试验。
表 1. 拮抗菌株DAZ-2的抑菌活性初测 Table 1. Preliminary determination of antibacterial activity of antagonistic strain DAZ-2
| Indicator bacteria | Inhibition zone diameter/mm | |
| Fermentation liquid | Mycelium extract | |
| Escherichia coli | 24.15±0.03 | 22.48±0.06 |
| Staphylococcus aureus | 18.25±0.04 | 23.43±0.05 |
| Xanthomonas oryzae | 23.65±0.06 | 22.55±0.06 |
| Bacillus subtilis | 20.28±0.12 | 20.37±0.03 |
| Bacillus thuringiensis | 23.01±0.03 | 24.53±0.05 |
| The data are mean±SD. Tests were conducted in triplicate and results varied as indicated by standard deviation. The same as below. | ||
表选项
2.2 拮抗菌株的鉴定
2.2.1 形态学鉴定: 菌株DAZ-2在PDA培养基上培养3 d后,菌落向培养基表面隆起,疏松、干燥、呈绒毛状,边缘为白色,中间为烟绿色,培养基为浅绿色,有大量孢子产生(图 1)。显微观察发现菌丝分隔,孢子为球形,顶囊为倒烧瓶状,分生孢子梗为圆筒形(图 1)。在不同鉴别培养基上均能生长,但生长较差,无色素产生(表 2)。
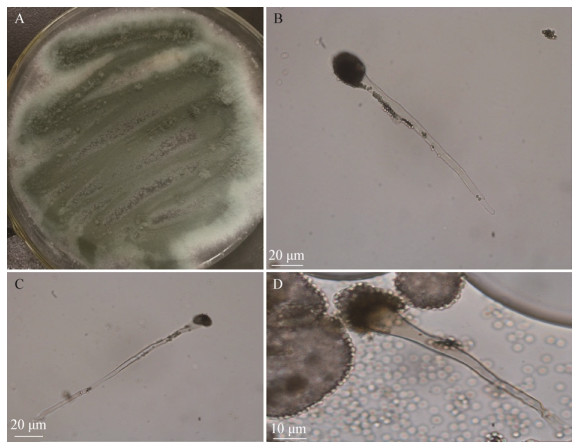 |
| 图 1 菌株DAZ-2的形态学观察 Figure 1 Morphological observation of strain DAZ-2. A: Observation of colony morphology; B, C, D: microscopic observation. |
| 图选项 |
表 2. 菌株DAZ-2在不同鉴别培养基上的培养特征 Table 2. Culture characteristics of strain DAZ-2 on different identification media
| Medium | Colony morphology | Aerial mycelium | Substrate mycelium | Soluble pigment | Growth |
| Gause’s synthetic agar | Flat | White | White | None | General |
| Beef extract peptone | Fluffy | Gray | White | None | General |
| Czapek’s agar | Flat | Light gray | Yellow brown | None | General |
| Potato dextrose agar | Fluffy | Smoke green | White | Light green | Well |
表选项
2.2.2 生理生化特性测定: 拮抗菌株DAZ-2具有一定的耐盐性和耐酸性,能够产过氧化氢酶和淀粉酶,具有使明胶液化等能力,不能够利用阿拉伯糖和鼠李糖为唯一碳源,部分生理生化特征如表 3。
表 3. 菌株DAZ-2的生理生化特性 Table 3. Physiological and biochemical characteristics of strain DAZ-2
| Item | Result |
| Growth in (NaCl 1.0%-3.0%) | + |
| Growth in (pH 5.0-8.0) | + |
| Gelatin liquefaction | + |
| Oxidase | + |
| Starch hydrolysis | + |
| Tween 80 | + |
| Methyl red | + |
| L-Gum sugar | - |
| L-rhamnose | - |
| D-mannitol | + |
| D-fructose | + |
| D-xylose | + |
| Sucrose | + |
| D-glucose | + |
| ‘+’, ‘-’indicated intensity of reaction; ‘-’ indicated negative reaction. | |
表选项
2.2.3 分子生物学鉴定: 将拮抗菌株DAZ-2的ITS rDNA测序结果提交至GenBank中,获得登入号MK054270。获得序列在NCBI数据库中进行BLAST比对,并利用MEGA5.1软件构建系统发育树(图 2)。结果显示,拮抗菌株DAZ-2与菌株Aspergillus fumigatus isolate LF5(JF815069.1)和Aspergillus fumigatus isolate 15-F(GU244530.1)位于同一分枝,亲缘关系最近,相似度达到100%。结合显微观察、培养特征及生理生化特性的分析比对,故将此拮抗菌株DAZ-2鉴定为烟曲霉(Aspergillus fumigatus DAZ-2)。
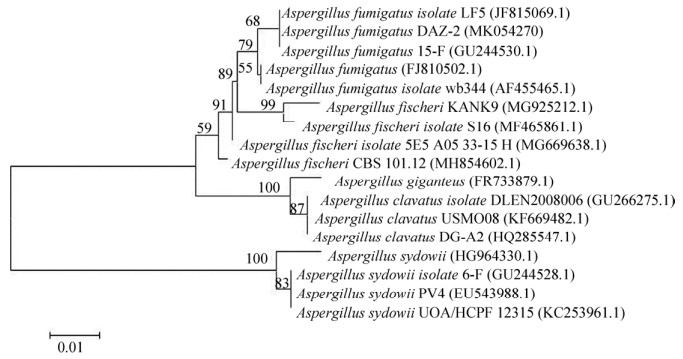 |
| 图 2 邻接法分析菌株DAZ-2的ITS rDNA序列构建的系统发育树 Figure 2 Neighbour-Joining (NJ) tree based on fungal ITS rDNA sequences of strain DAZ-2. 0.01 was sequence divergence. |
| 图选项 |
2.3 烟曲霉DAZ-2的抑菌特性研究
2.3.1 抑菌活性物质的极性测试: 根据相似相溶原理,用不同极性的有机试剂对烟曲霉DAZ-2的发酵菌体甲醇浸提物及发酵液进行反复萃取后,分装有机相,浓缩至浸膏后用水溶解。通过管碟法用大肠杆菌作指示菌,测试不同有机溶剂萃取组分(200 μg/mL)及被其萃取后的水相抑菌能力。数据显示(表 4),石油醚萃取部分没有抑菌活性,氯仿和乙酸乙酯萃取部分有都具抑菌活性,且被等量氯仿3次萃取后的发酵液抑菌能力消失,表明活性组分转移到氯仿层。且氯仿萃取获得的粗提物稀释至200 μg/mL后,抑菌效果小于相同浓度的乙酸乙酯粗提物。发酵菌体甲醇浸提物及发酵液经过正丁醇萃取后的水相没有抑菌能力,但是有机相中活性物质的抑菌能力较弱,存在正丁醇溶剂对抑菌活性物质具有负面影响的可能性。由此,选择乙酸乙酯对菌株DAZ-2中次生代谢产物进行萃取,获得发酵液及发酵菌体两者的乙酸乙酯粗提物,分装备用待后续实验。
表 4. 抗菌活性物质的极性测定 Table 4. Polarity determination of antibacterial active substances (Escherichia coli)
| Extracting agent | Fermentation liquid/mm | Mycelium extract/mm | ||||
| Organic phase | Water component | Organic phase | Water component | |||
| Petroleum ether | 0d | 22.98±0.02b | 0d | 18.93±0.04b | ||
| Chloroform | 24.28±0.06b | 0c | 29.85±0.02b | 14.63±0.03c | ||
| Ethyl acetate | 28.25±0.01a | 0c | 32.01±0.06a | 0d | ||
| N-butanol | 12.03±0.02c | 0c | 11.43±0.06c | 0d | ||
| CK | 0d | 24.43±0.03a | 0d | 22.50±0.07a | ||
| Different lowercase letters in the same column showed significant difference at 0.05 levels. The same as below. | ||||||
表选项
2.3.2 TLC-Bioautography法: 使用琼脂覆盖法,将牛肉膏蛋白胨培养基及细菌指示菌均匀涂布在硅胶板上,37 ℃下培养过夜后,A(点样在硅胶板中央且未用展开剂处理)硅胶板上,有清晰可见的抑菌圈形成(图 3中a、b点),证明发酵菌体甲醇浸提物和发酵液的乙酸乙酯粗提物中都有抑菌活性物质存在,并可通过Bioautography法在硅胶板上进行活性追踪。B、C、D、E不同处理的硅胶板上都出现了清晰可见的细菌不生长部位(图 3中c、d、e、f点),但是都只出现在发酵菌体乙酸乙酯粗提物的TLC展开后区域,发酵液乙酸乙酯粗提物TLC展开区域全部无抑菌圈形成(展开剂氯仿:甲醇=7:3)。结合极性测试和TLC结果进行分析,判断烟曲霉DAZ-2的发酵菌体甲醇浸提物和发酵液中具有抑菌活性的组分可能存在不同,且发酵液中可能为多组分物质共同作用进而产生抑菌效果。故挑选抑菌活性物质分离难度较低的发酵菌体甲醇浸提物的乙酸乙酯萃取部分进行后续实验,并将其简称为菌体浸提物乙酸乙酯萃取部分。
 |
| 图 3 TLC-Bioautography法检测 Figure 3 TLC-Bioautography assay. a: Bioautography of crude extract of ethyl acetate from Mycelium extract (Escherichia coli); b: Bioautography of crude extract of ethyl acetate in fermentation broth (Escherichia coli); c: Crude extract of ethyl acetate from Mycelium extract TLC (chloroform: methanol=7:3)-bioautography results (Staphylococcus aureus); d: Crude extract of ethyl acetate from Mycelium extract TLC (chloroform: methanol=7:3)-bioautography results(Bacillus thuringiensis); e: Crude extract of ethyl acetate from Mycelium extract TLC (chloroform: methanol=7:3)-bioautography results (Bacillus subtilis); f: Crude extract of ethyl acetate from Mycelium extract TLC (chloroform: methanol=7:3)-bioautography results (Escherichia coli). |
| 图选项 |
2.4 烟曲霉DAZ-2菌体浸提物乙酸乙酯萃取部分的抑菌谱试验 用23种指示菌测试菌体浸提物乙酸乙酯萃取部分的抑菌谱,发现粗提物(200 μg/mL)只对其中11种指示菌存在抑菌效果。管碟法(表 5)结果显示,其对大肠杆菌、金黄色葡萄球菌和白色念珠球菌的抑菌效果较为突出(图 4);菌丝生长速率法(表 6)结果显示,粗提物只对测试中的3种病原指示菌存在抑制作用,且抑制效果较弱。拮抗菌株烟曲霉DAZ-2的分离来源为乡镇垃圾堆积点土壤,可能受土壤环境中生活垃圾较多且和植物病原菌接触较少的影响,故对大肠杆菌等指示菌抑制效果较为明显,对病原指示菌拮抗效果较差。
表 5. 管碟法测试菌株DAZ-2菌体浸提物乙酸乙酯萃取部分的抑菌谱 Table 5. Antibacterial spectrum of mycelium crude ethyl acetate extract from strain DAZ-2 by cylinder-plate method
| Indicator bacteria | Inhibition zone/mm |
| Escherichia coli | 32.75±0.01 |
| Staphylococcus aureus | 27.25±0.06 |
| Pseudomonas putida | 18.73±0.04 |
| Bacillus amyloliquefaciens | 0 |
| Bacillus licheniformis | 0 |
| Xanthomonas oryzae | 20.08±0.03 |
| Bacillus subtilis | 14.45±0.02 |
| Fungi Imperficti | 0 |
| Candida albicans | 27.68±0.01 |
| Saccharomyces cerevisiae | 19.28±0.02 |
| Penicillium digitatum | 0 |
| Penicillium italicum | 0 |
| Aspergillus niger | 0 |
| Bacillus thuringiensis | 15.38±0.03 |
表选项
 |
| 图 4 菌株DAZ-2菌体浸提物乙酸乙酯萃取部分(200 μg/mL)对大肠杆菌、金黄色葡萄球菌、白色念珠球菌的抑菌效果 Figure 4 Bacteriostatic effect of mycelium crude ethyl acetate extract (200 μg/mL) from strain DAZ-2 on Escherichia coli (A), Staphylococcus aureus (B) and Candida albicans (C). |
| 图选项 |
表 6. 菌丝生长速率法测试菌株DAZ-2菌体浸提物乙酸乙酯萃取部分的抑菌谱 Table 6. Antibacterial spectrum of mycelium crude ethyl acetate extract from strain DAZ-2 by mycelium growth rate method
| Test fungus | Inhibition ratio/% |
| Fusarium oxysporum f. sp. niveum | 52.70 |
| Phytophthora capsici | 0 |
| Alternaria Nees | 0 |
| Thanatephorus cucumeris | 30.12 |
| Magnaporthe oryzae | 0 |
| Fusarium oxysporum f. sp. cucumebrium Owen | 0 |
| Fusarium oxysporum f. sp. vasinfectum | 12.16 |
| Phytophthora parasiticavar nicotianae | 0 |
| Botryosphaeria dothidea | 0 |
表选项
2.5 烟曲霉DAZ-2菌体浸提物乙酸乙酯萃取部分对大肠杆菌和白色念珠球菌的MIC测定 选择大肠杆菌和白色念珠球菌为指示菌,由表 7可知,发酵菌体乙酸乙酯粗提物对大肠杆菌的MIC为7.5 μg/mL,对白色念珠球菌的MIC为15 μg/mL,抑制效果较为高效,具有开发成微生物药物的潜力和价值。
表 7. 菌体浸提物乙酸乙酯萃取部分对大肠杆菌和白色念珠球菌的最小抑菌浓度 Table 7. MIC of mycelium crude ethyl acetate extract against Escherichia coli and Candida albicans
| Crude ethyl acetate extract/(μg/mL) | Inhibition zone/mm | |
| Escherichia coli | Candida albicans | |
| 75.0 | 24.20±0.06a | 23.15±0.04a |
| 37.5 | 21.15±0.02b | 19.45±0.06b |
| 27.5 | 17.45±0.04c | 14.28±0.01c |
| 15.0 | 13.65±0.03d | 12.20±0.01d |
| 7.5 | 11.80±0.01e | 0e |
| 5.0 | 0f | 0e |
| Different lowercase letters in the same column showed significant difference at 0.05 levels. | ||
表选项
2.6 菌体浸提物乙酸乙酯萃取部分抑菌活性的稳定性测试
2.6.1 热稳定性: 待测药液的抑菌圈直径随着温度的升高和处理时间的延长而减小(图 5),但是即使是100 ℃处理180 min后,抑菌圈直径也保持在20 mm以上。121 ℃处理20 min后,虽然粗提物的抑菌活性相较于原始对照组下降了41.52 %,却也没有消失,故从整体数据可以判断,烟曲霉DAZ-2菌体浸提物乙酸乙酯萃取部分(200 μg/mL)对大肠杆菌抑菌活性具有一定的热稳定性。
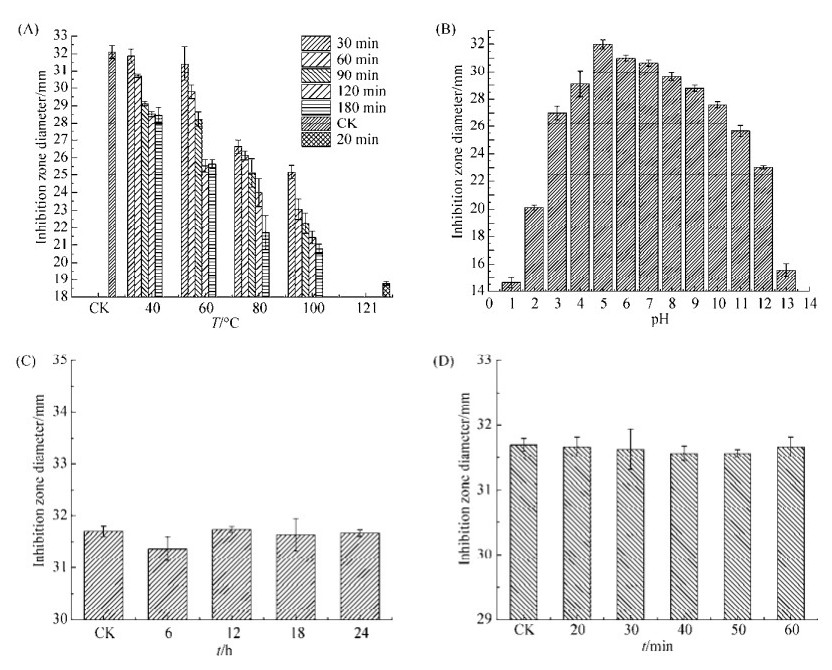 |
| 图 5 菌株DAZ-2菌体浸提物乙酸乙酯萃取部分对大肠杆菌的抑菌活性稳定性测试 Figure 5 Stability test of antibacterial activity of crude ethyl acetate extract from strain DAZ-2 fermenting mycelium extract against Escherichia coli. Effect of temperature (A), pH (B), natural light (C) and ultraviolet irradiation (D) on antibacterial activity. Tests were conducted in triplicate and results varied as indicated by standard deviation. |
| 图选项 |
2.6.2 酸碱稳定性: 部分拮抗菌株对指示菌的抑制效果可能是通过产生酸性次生代谢产物如乙酸、乳酸及其他有机酸造成的。通过pH计测定,发现烟曲霉DAZ-2菌体浸提物乙酸乙酯萃取部分(200 μg/mL)的pH值为5.07,借助NaOH (1 mol/L)溶液将待测药液的pH值调节至中性后,抑菌圈直径只减少了4.19%,故可以初步排除烟曲霉DAZ-2产生酸性物质导致抑菌效果的可能性。将原始pH的待测药液视为pH=5的处理组,并以其为对照,通过实验数据(图 5)可知,pH值的改变对粗提物对大肠杆菌的抑菌效果影响较大,pH值为1或13时,抑菌圈直径只有原始对照组的45.73%和48.67%,故对抑菌活性物质进行分离或处理实验时,应注意减少pH值的改变,尽量保持弱酸性环境。
2.6.3 光照稳定性: 待测药抑菌能力的光照稳定性包括对自然光及紫外光的耐受性,由数据可知(图 5),自然光光照处理24 h和紫外光照处理60 min后,待测药液对大肠杆菌的抑菌效果较黑暗环境下保藏相同时间的待测药液没有显著性的差异,可以初步判断菌体浸提物乙酸乙酯萃取部分中的抑菌活性物质具有较好的光照稳定性。
3 讨论 垃圾的减容化、减量化和资源化是未来环境保护的重要发展方向。对垃圾中的微生物资源进行开发,筛选获得对垃圾处理具有应用价值的微生物目前已成为国内外研究的热点[29-30]。但从垃圾及其污染的环境中进行抗菌微生物筛选的研究还未见报道。本文从江西省吉安市周边乡镇内不同环境类型(山坳,池塘,树林,草地等)的积年垃圾堆积点土壤中发现一株高效抑菌且传代稳定的烟曲霉(Aspergillus fumigatu) DAZ-2及大量抑菌活性较弱的拮抗菌株,证明了垃圾堆积点土壤具有一定的抗菌微生物筛选潜力和价值。垃圾中微生物资源的开发方向不应该仅局限于垃圾污染的治理[31],抗菌微生物的筛选对乡镇垃圾堆积点环境污染治理具有价值的同时,也能够为新型微生物药物的开发提供帮助。希望能通过相关研究,找到未来垃圾中微生物资源利用新的发展方向。
自青霉素的发现和应用以来,微生物药物开始在人类的历史舞台上扮演重要角色。而随着抗生素在工业、农业及医疗等行业的广泛利用,导致新型微生物药物的需求不断增长[32],抗菌微生物的筛选也越来越受到重视。报道显示,高艳侠等[33]从尼罗罗非鱼肠道中筛选到一株对罗非鱼源无乳链球菌等9种病原菌具有拮抗功能的益生菌,其中对鰤鱼诺卡氏菌的平均抑菌圈直径达28.3 mm;张丽等[34]从印度楝树的叶片中分离得到一株内生放线菌,发酵液乙酸乙酯萃取物对稻瘟病菌的抑菌圈直径可达24.2 mm,但对光非常敏感,暴露在光线下会逐渐失去活性;李生樟等[35]从空心菜根际土壤中筛选得到一株可以抑制多种植物病原黄单胞菌的贝莱斯芽孢杆菌,其无菌发酵液的活性物质耐高温和蛋白酶降解,但不耐强酸强碱;刘琴等[36]从黄瓜中分离得到一株对黄瓜枯萎病的EC50为0.2107 mg/L的链霉菌;李娟等[37]从蒜头果中分离得到一株植物内生真菌烟曲霉,发现它对6种人体致病细菌(蜡样芽孢杆菌、副溶血性弧菌、无乳链球菌、福氏志贺氏菌、金黄色葡萄球菌、藤黄微球菌)均有抑菌活性,其中对副溶血性弧菌、藤黄微球菌最低抑制浓度达到6.25 mg/mL。实验数据表明,本实验筛选获得的烟曲霉(Aspergillus fumigatu) DAZ-2发酵菌体浸提物的乙酸乙酯萃取部分(200 μg/mL)对11种指示菌具有抑制效果。其中对大肠杆菌和白色念珠球菌的抑菌圈直径达到32.75 mm和27.68 mm,最小抑菌浓度分别达到7.50 μg/mL和15 μg/mL,具有较好的开发成微生物药物的价值和潜力,也证明了垃圾污染环境中抗菌微生物筛选的可行性。
经过薄层层析和生物自显影实验测定,可以判断烟曲霉DAZ-2所产生的抑菌活性组分不止一种。挑选经过多次前期处理后,获得的发酵菌体浸提物乙酸乙酯萃取部分进行抑菌特性试验测定,能有效降低代谢产物中无抑菌活性组分对实验结果的干扰。实验结果表明,抑菌活性物质易溶于氯仿、乙酸乙酯、甲醇及水中,且对高温、酸碱、紫外照射、自然光照射都存在较好的稳定性。121 ℃处理20 min、pH由1-13的改变和紫外及自然光的长时间照射都不会使抑菌活性完全消失。该实验结果与朱晓飞等[27]的报道不一致,可以初步排除抑菌活性物质为多肽类物质的可能性。据报道显示,朱双双等[38]从黄花蒿内分离得到一株内生烟曲霉SPS-02,并从其乙酸乙酯萃取物中分离得到4个单体化合物,其中化合物1(胶霉毒素)对白色念珠球菌具有较好的抑制作用和抑菌稳定性,还具有较强的抗肿瘤和免疫抑制的活性,与本文的前期研究结果相似。接下来将参照相关报道,进一步对活性物质进行分离,并对活性物质的抑菌机理进行更深入的研究。
References
| [1] | Wilson ZE, Brimble MA. Molecules derived from the extremes of life. Natural Product Reports, 2009, 26(1): 44-71. |
| [2] | Combie J, Albert FG, van Tran K, Cabrera J, Correira HJ, Guo YH, Lindermuth J, Rauert N, Galbraith W, Selitrennikoff CP. Extremophilic organisms as an unexplored source of antifungal compounds. The Journal of Antibiotics, 2001, 54(1): 56-65. |
| [3] | Trischman JA, Tapiolas DM, Jensen PR, Dwight R, Fenical W, McKee TC, Ireland CM, Stout TJ, Clardy J. Salinamides A and B:anti-inflammatory depsipeptides from a marine streptomycete. Journal of the American Chemical Society, 1994, 116(2): 757-758. |
| [4] | Hamedi J, Mohammadipanah F, Von Jan M, P?tter G, Schumann P, Spr?er C, Klenk HP, Kroppenstedt RM. Nocardiopsis sinuspersici sp. nov., isolated from sandy rhizospheric soil. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(10): 2346-2352. |
| [5] | Hozzein WN, Goodfellow M. Nocardiopsis arabia sp. nov., a halotolerant actinomycete isolated from a sand-dune soil. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(11): 2520-2524. |
| [6] | Chen YG, Chen J, Chen QH, Tang SK, Zhang YQ, He JW, Li WJ, Liu YQ. Yaniella soli sp. nov., a new actinobacterium isolated from non-saline forest soil in China. Antonie van Leeuwenhoek, 2010, 98(3): 395-401. |
| [7] | Cheng M, Wu CY, Zhuang W. Progress in separation and extraction of marine bioactive substances. Journal of Fujian Fisheries, 2002(2): 39-45. (in Chinese) 呈玫, 吴成业, 庄宛. 海洋生物活性物质的分离提取技术进展. 福建水产, 2002(2): 39-45. |
| [8] | Guo XY, Cui Y, Ren LH. Interaction effects of azotobacteria, p-releasing and k-releasing bacteria in food waste-recycling wastewater. Environmental Engineering, 2017, 35(4): 36-39. (in Chinese) 郭新愿, 崔月, 任连海. 餐厨废水中解磷菌、固氮菌及解钾菌的互作效应研究. 环境工程, 2017, 35(4): 36-39. |
| [9] | Li Y, Wang LX, Ge MJ, Yin JX, Chen MN. Screening and identification of collagen and chitin in situ degradation strains in kitchen waste. Jiangsu Agricultural Sciences, 2018, 46(8): 304-307. (in Chinese) 李芸, 王李忻, 葛梦娇, 尹军霞, 陈梦娜. 餐厨垃圾中胶原蛋白和几丁质原位降解菌株的筛选与鉴定. 江苏农业科学, 2018, 46(8): 304-307. |
| [10] | Xu LJ, Wang Z, Wu YB, Chen W, Xu J, He YL. Screening of deodorizing microorganisms from municipal solid waste. Acta Agriculturae Jiangxi, 2016, 28(7): 87-91. (in Chinese) 许丽娟, 王震, 吴迎奔, 陈薇, 许隽, 贺月林. 城市生活垃圾除臭微生物菌群的筛选. 江西农业学报, 2016, 28(7): 87-91. |
| [11] | Zeng S, Li NH, He K, Hu ZQ. Screening, combination of microbial deodorant for garbage & optimization of its culture conditions. Journal of Microbiology, 2015, 35(2): 72-77. (in Chinese) 曾苏, 李南华, 贺琨, 胡子全. 垃圾微生物除臭剂的筛选、复配及其培养条件的优化. 微生物学杂志, 2015, 35(2): 72-77. |
| [12] | 唐微微.景区生态厕所除臭复合菌剂的研制及应用.四川师范大学硕士学位论文, 2013. |
| [13] | Liu GH, Liu B, Che JM, Wang JP, Chen QQ, Yao YF, Liu QY. Screening of a Bacillus amyloliquefaciens strain and its probiotic characteristics. Journal of Agricultural Biotechnology, 2018, 26(6): 1043-1055. (in Chinese) 刘国红, 刘波, 车建美, 王阶平, 陈倩倩, 姚运法, 刘琴英. 一株解淀粉芽胞杆菌的筛选及其益生特性研究. 农业生物技术学报, 2018, 26(6): 1043-1055. |
| [14] | Mudita IM, Wirawan IW, Wibawa AAPP, Partama IBG. Degradation of lignocellulosic substrates by bacteria isolated from waste landfill. International Journal of Agriculture Innovations & Research, 2014, 3(2): 555-558. |
| [15] | Wang LH, Xi H, Huang XH, Sun JZ, Xie B. Characteristics of antibiotic resistance genes in municipal solid waste landfill. Chinese Journal of Applied and Environmental Biology, 2019, 25(2): 333-338. (in Chinese) 王柳红, 奚慧, 黄兴华, 孙金昭, 谢冰. 城市垃圾填埋场抗生素抗性基因的污染特征. 应用与环境生物学报, 2019, 25(2): 333-338. |
| [16] | Yang BS, Miao CP, Zhang JH, Jiang GY, Yang D, Yu H. Population distribution and antimicrobial activities of endophytes in Toddalia asiatica. Acta Microbiologica Sinica, 2014, 54(3): 276-284. (in Chinese) 杨本寿, 苗翠苹, 张建华, 姜国银, 杨德, 虞泓. 飞龙斩血内生菌种群分布及抑菌活性检测. 微生物学报, 2014, 54(3): 276-284. |
| [17] | Boubetra D, Sabaou N, Zitouni A, Bijani C, Lebrihi A, Mathieu F. Taxonomy and chemical characterization of new antibiotics produced by Saccharothrix SA198 isolated from a Saharan soil. Microbiological Research, 2013, 168(4): 223-230. |
| [18] | Zhao LF, Xu YJ, Hou YT, Zou YH, Li YN, Yang ZH, Li XY, Zhang MY. Screening and inhibition of antagonistic endophytic bacteria isolated from soybean (Glycine max) nodules against Alternaria longipes. Chinese Journal of Applied Ecology, 2016, 27(5): 1560-1568. (in Chinese) 赵龙飞, 徐亚军, 侯怡婷, 邹艳慧, 李亚楠, 杨志华, 李小雨, 张梦瑶. 烟草赤星病菌拮抗性大豆根瘤内生菌的筛选及抑制作用. 应用生态学报, 2016, 27(5): 1560-1568. |
| [19] | Liu J, Fang X. The influence factors and control methods of titer determination for erythromycin ethylsuccinate by cylinder-plate method. Journal of Pharmaceutical Research, 2013, 32(12): 705-707. (in Chinese) 刘晋, 房霞. 管碟法测定琥乙红霉素效价的影响因素分析及控制方法. 药学研究, 2013, 32(12): 705-707. |
| [20] | Guo Q, Wu YL, Huang GL, Cai HN, Ni H, Xiao AF, Hu Y. Screening and identification of Naringin enzyme producing fungus for Debittering Pomelo juice. Food Science, 2008, 29(2): 225-228. (in Chinese) 郭倩, 邬应龙, 黄高凌, 蔡慧农, 倪辉, 肖安风, 胡阳. 柚苷酶产生真菌的复筛及菌种初步鉴定. 食品科学, 2008, 29(2): 225-228. |
| [21] | Cai XZ. Insertion method to observe the effect of actinomycetes. Experiment Teaching and Apparatus, 1995(2): 28. (in Chinese) 蔡信之. 插片法观察放线菌霉菌效果好. 实验教学与仪器, 1995(2): 28. |
| [22] | 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979. |
| [23] | Mei XL, Zhao QY, Tan SY, Xu YC, Shen B, Shen QR. Screening, identification, and biocontrol effect of antagonistic bacteria against Phytophthora capsici. Chinese Journal of Applied Ecology, 2010, 21(10): 2652-2658. (in Chinese) 梅新兰, 赵青云, 谭石勇, 徐阳春, 沈标, 沈其荣. 辣椒疫病拮抗菌株筛选、鉴定及其防效. 应用生态学报, 2010, 21(10): 2652-2658. |
| [24] | Annegowda HV, Tan PY, Mordi MN, Ramanathan S, Hamdan MR, Sulaiman MH, Mansor SM. TLC-bioautography-guided isolation, HPTLC and GC-MS-assisted analysis of bioactives of Piper betle leaf extract obtained from various extraction techniques:In vitro evaluation of phenolic content, antioxidant and antimicrobial activities. Food Analytical Methods, 2013, 6(3): 715-726. DOI:10.1007/s12161-012-9470-y |
| [25] | Fang X, Xu WF, Niu N, Ou T, Wang F, Zuo WD, Xie J. Screening, identification and optimization of fermentation conditions of an antagonistic endophytic bacterium from mulberry. Acta Microbiologica Sinica, 2018, 58(12): 2147-2160. (in Chinese) 方翔, 徐伟芳, 牛娜, 欧婷, 王飞, 左伟东, 谢洁. 一株桑树内生拮抗菌的分离、鉴定及发酵条件优化. 微生物学报, 2018, 58(12): 2147-2160. |
| [26] | Song HY, Han LR, Feng JT, Zhang X. Screening of 94 strains of soil actinomycetes with antifungal activity. Acta Agriculturae Boreali-Occidentalis Sinica, 2010, 19(12): 172-176. (in Chinese) 宋洪允, 韩立荣, 冯俊涛, 张兴. 94株土壤放线菌抑菌活性的初步筛选. 西北农业学报, 2010, 19(12): 172-176. |
| [27] | Zhu XF, Zhang XX, Niu YC, Hu YS, Yan YC, Wang HS. Isolation and identification of a Bacillus amyloliquefaciens YB-3 against Rhizoctonia solani. Acta Microbiologica Sinica, 2011, 51(8): 1128-1133. (in Chinese) 朱晓飞, 张晓霞, 牛永春, 胡元森, 闫艳春, 王海胜. 一株抗水稻纹枯病菌的解淀粉芽胞杆菌分离与鉴定. 微生物学报, 2011, 51(8): 1128-1133. |
| [28] | Wang Q, Hu CJ, Ke FG, Huang SL, Li QQ. Characterization of a bacterial biocontrol strain 1404 and its efficacy in controlling postharvest citrus anthracnose. Acta Microbiologica Sinica, 2010, 50(9): 1208-1217. (in Chinese) 汪茜, 胡春锦, 柯仿钢, 黄思良, 黎起秦. 生防菌株1404的鉴定及其对采后柑橘炭疽病的防治效果. 微生物学报, 2010, 50(9): 1208-1217. |
| [29] | Gill SS, Jana AM, Shrivastav A. Aerobic bacterial degradation of kitchen waste:a review. Journal of Microbiology, Biotechnology and Food Sciences, 2014, 3(6): 477-483. |
| [30] | Kaur M, Arora S. Isolation and screening of cellulose degrading bacteria in kitchen waste and detecting their degrading potential. Journal of Mechanical & Civil Engineering, 2012, 1(2): 33-35. |
| [31] | Wan WJ, Zhang YB, Nie ZY, Mao YJ, Xu J, Yu Y. The screening and identification of thermostable decomposition bacteria in kitchen waste and the relative application. Food & Machinery, 2019, 35(6): 54-58, 68. (in Chinese) 万文娟, 张赟彬, 聂志妍, 毛彦佳, 许静, 喻莹. 耐高温餐厨垃圾分解细菌的筛选、鉴定及应用. 食品与机械, 2019, 35(6): 54-58, 68. |
| [32] | Read AF, Woods RJ. Antibiotic resistance management. Evolution, Medicine, and Public Health, 2014, 2014(1): 147. |
| [33] | Gao YX, Zhang DF, Ke XL, Liu ZG, Yi MM, Wang M, Han XQ, Lu MX. Selection and characterization of intestinal Bacillus strain antagonistic against pathogenic Streptococcus agalactiae of tilapia. Acta Microbiologica Sinica, 2019, 59(5): 926-938. (in Chinese) 高艳侠, 张德锋, 可小丽, 刘志刚, 衣萌萌, 王淼, 韩雪晴, 卢迈新. 罗非鱼源无乳链球菌肠道拮抗芽孢杆菌的筛选及其生物学特性. 微生物学报, 2019, 59(5): 926-938. |
| [34] | Zhang L, Ji MS, Yu ZG. Antifungal activities and stability of metabolites from Streptomyces rochei YL-2 against Pyricularia oryzae. Journal of Shenyang Agricultural University, 2014, 45(2): 143-146. (in Chinese) 张丽, 纪明山, 于志国. 娄彻氏链霉菌YL-2代谢产物对稻瘟病菌的抑制活性及其稳定性. 沈阳农业大学学报, 2014, 45(2): 143-146. |
| [35] | Li SZ, Chen Y, Yang RH, Zhang CP, Liu Z, Li YL, Chen T, Chen GY, Zou LF. Isolation and identification of a Bacillus velezensis strain against plant pathogenic Xanthomonas spp. Acta Microbiologica Sinica, 2019, 59(10): 1969-1983. (in Chinese) 李生樟, 陈颖, 杨瑞环, 张翠萍, 刘昭, 李逸朗, 陈涛, 陈功友, 邹丽芳. 一株拮抗黄单胞菌的贝莱斯芽孢杆菌的分离和鉴定. 微生物学报, 2019, 59(10): 1969-1983. |
| [36] | Liu Q, Xu J, Liu HA, Ji MX, Li CM, Han GJ, Qi JH, Sun J. Isolation and antagonistic activity of endophytic actinomycete SR-1102 to Fusarium oxysporum f. sp. cucumebrium of cucumber. Journal of Yangzhou University (Agricultural and Life Science Edition), 2015, 36(2): 83-88. (in Chinese) 刘琴, 徐健, 刘怀阿, 吉沐祥, 李传明, 韩光杰, 祁建杭, 孙俊. 黄瓜内生放线菌SR-1102分离及对枯萎病菌拮抗活性. 扬州大学学报(农业与生命科学版), 2015, 36(2): 83-88. |
| [37] | Li J, Chen ZH, Hua M, Yuan XL, Yu H, Wang Y. Antibacterial activity of Aspergillus fumigatus from Malania oleifera Chun et lee. Journal of West China Forestry Science, 2018, 47(4): 89-94. (in Chinese) 李娟, 陈中华, 华梅, 原晓龙, 虞泓, 王毅. 蒜头果中植物内生真菌烟曲霉的抗菌活性研究. 西部林业科学, 2018, 47(4): 89-94. |
| [38] | Zhu SS, Tang YF, Ruan CF, Zhang HW. Identification and secondary metabolites of an endophytic fungus sps-02 from Artemisia annua L. Natural Product Research and Development, 2016, 28(4): 519-524. (in Chinese) 朱双双, 汤逸飞, 阮川芬, 章华伟. 黄花蒿内生真菌SPS-02的鉴定和次生代谢产物研究. 天然产物研究与开发, 2016, 28(4): 519-524. |
