赵一全#, 张慧#, 张晓昱

 , 谢尚县
, 谢尚县

华中科技大学生命科学与技术学院, 环境资源微生物技术研究所, 湖北武汉 430074
收稿日期:2020-09-03;修回日期:2020-11-09;网络出版日期:2020-11-18
基金项目:国家自然科学基金(31970098)
作者简介:谢尚县, 教授, 博士生导师, 华中卓越****、楚天****、黄鹤英才、中国菌物学会海洋与淡水菌物学专业委员会委员、湖北省微生物学会常务理事。现任华中科技大学生命科学与技术学院环境资源微生物技术研究所所长。华中科技大学2009年学士, 美国德州农工大学2016年博士。始终致力于生物质的生物降解与转化和基于合成生物学的绿色生物制造等领域的微生物学与合成生物学理论与技术体系研究。并基于系统合成生物学的创新理性设计, 构建木质素到生物能源、生物材料、生物医药等高值物质的多元转化平台。近五年来, 以第一作者和通讯作者在Advanced Science, Green Chemistry等国际期刊上发表论文十余篇, 申请美国/国际专利2项。主持国家自然科学基金面上项目、华中科技大学自主创新基金等项目。受邀担任Microbial Biotechnology、Biotechnology and Applied Biochemistry等期刊特邀编辑以及Microbial Biotechnology、Journal of Renewable Materials等国际期刊的学术编委.
*通信作者: Tel:+86-27-87792108;E-mail:zhangxiaoyu@hust.edu.cn(张晓昱);
E-mail:shangxian_xie@hust.edu.cn(谢尚县).
#共同第一作者。
摘要:木质纤维素是地球上最丰富的可再生资源。我国每年产生约9亿吨农业秸秆,因得不到有效利用,不仅造成资源浪费,也产生了诸多严峻的环境问题。缺少木质素的高效降解和资源化利用技术是限制木质纤维素产业化的主要瓶颈之一。虽然木质素的降解与转化多年来一直都受到关注,但是由于木质素结构的复杂性及异质性,使其高效利用受限。近年来,微生物具有的“生物漏斗”式转化特性为木质素的高值转化和利用提供了新方向。本文就生物质利用研究以来,微生物在木质素解聚与转化方面的研究历程与最新进展进行了简要的回顾与总结,并初步讨论了目前木质素高值转化面临的机遇与挑战。
关键词:木质素生物解聚多元生物转化
Microbial depolymerization and valorization of lignin
Yiquan Zhao#, Hui Zhang#, Xiaoyu Zhang

 , Shangxian Xie
, Shangxian Xie

Institute of Environmental Microbiology & Bioresource Science, College of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, Hubei Province, China
Received: 3 September 2020; Revised: 9 November 2020; Published online: 18 November 2020
*Corresponding author: Tel: +86-27-87792108; E-mail: zhangxiaoyu@hust.edu.cn (Xiaoyu Zhang);
shangxian_xie@hust.edu.cn(Shangxian Xie).
Foundation item: Supported by the National Natural Science Foundation of China (31970098)
#Those authors contributed equally to this work.
Abstract: Lignocellulose is the most abundant renewable resource on the earth. There are about 900 million tons of agricultural straw produced annually in China. Most of them cannot be effectively used, and thus not only causes a waste of resources, but also causes many serious environmental problems. The recalcitrance of lignin is one of the main challenges restricting the industrialization of lignocellulose. Although the degradation and transformation of lignin have been studied for many years, it is still challenged to commercially valorize the lignin because of its inherent heterogeneity. In recent years, the "biological funneling" transformation characteristics of microorganisms have been widely studied and will potentially provide a new direction for the valorization of lignin. This review mainly summarizes the research processes of microbial lignin depolymerization and transformation, and discusses the current opportunities and challenges of lignin biological valorization.
Keywords: ligninbiological depolymerizationvalorization
随着人类社会的发展和科技的进步,不可再生能源尤其是化石燃料资源逐渐枯竭。同时,长期高负荷地利用化石燃料释放了大量的碳素和能量,打破了自然界碳和能量的平衡,造成了全球气候变暖、雾霾蔓延等灾难性后果,这种局面对我国的战略发展构成了严峻的挑战。一方面,我国现阶段石油供求矛盾比较突出,石油对外依存度较高。另一方面,我国每年约有9亿吨秸秆等农林废弃物产生,秸秆的焚烧成为秋冬季雾霾的主要成因之一,对我国的环境质量和人民身体健康造成了一定危害。因此,积极发展农林废弃物的清洁资源化利用技术对我国的能源、环境以及战略安全等方面都具有至关重要的意义。
木质纤维素是世界上最丰富的可再生资源,也是农林废弃物的主要成分。木质纤维素的三种主要组分在不同植物中的含量也表现出略微的差异,其中木质素(15%至25%)含量仅次于纤维素(35%至50%)和半纤维素(20%至35%)[1]。据估计,每年全球木质纤维素的产量达2×1011吨,理论上足以替代当今所需的化石能源以及其衍生化学品[2]。木质素是一种结构极其复杂的高分子聚合物,包含愈创木基丙烷结构单体(G),紫丁香基丙烷结构单体(S)和对羟基苯基丙烷结构单体(H)三种主要的结构单体(图 1)。在不同种类的木质素中,三种单体的比例也存在差异,它们通过不同类型的醚键和C-C键连接而成,其中以5-5’和β-5为代表的价键不易水解,这种高分子结构形成了木质纤维素主要的抗性屏障[3]。木质素复杂的结构和顽固的抗性限制了其自身的转化利用,因而在生物炼制早期的研究和产业化中,主要集中于开发利用由糖基单元聚合而成的纤维素和半纤维素。而木质素抗性屏障的破坏程度又对纤维素的利用具有显著的影响。因此,需要通过复杂的预处理技术破除木质素抗性屏障,使纤维素充分暴露出来便于水解和进一步的生物转化[4]。中国多部委联合公告和美国的《能源安全与独立法案》均对纤维素乙醇的生产和应用做出了指导和规划[5]。纤维素乙醇和制浆造纸等行业持续快速发展,作为副产物的木质素年产量达到近1.2亿吨[6]。随着生物炼制产业的进一步发展,全球的木质素产量将呈爆发式增长。木质素作为自然界体量最大的可再生芳香族原料,具备转化成塑料、脂质和精细化学品的巨大潜力[7]。仅仅将木质素作为预处理后的废弃物以及低质固体燃料使用,不仅不利于生物精炼的综合应用,在造成资源极大浪费的同时也会对环境造成污染[8]。
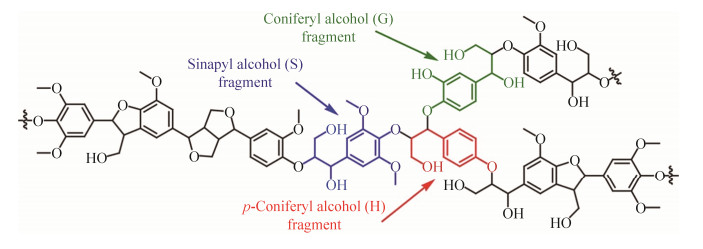 |
| 图 1 典型木质素结构示意图[9] Figure 1 Schematic diagram of a typical lignin structure[9]. |
| 图选项 |
木质素降解以及在此基础上衍生的新型能源、材料和化学品的开发一直以来都是一个世界性的难题[10]。长期以来,大量关于木质素解聚的基础研究致力于将木质素转化为化学品和燃料,但很少能应用于商业实践[8]。木质素的异质性通常会导致解聚后产生复杂的芳香族化合物,这给利用木质素生产精细化学品带来了重大的技术挑战。在自然界中,真菌主导木质素大分子的解聚过程,木质素解聚衍生的非均质物质更多的是被细菌代谢[11]。丰富的自然资源为生物法提供了解决挑战的可能。细菌多样化的分解代谢系统和日益完善的遗传操作技术成为木质素增值转化的强大工具[12-13]。越来越多的研究开始集中于筛选具备降解木质素衍生芳烃的微生物、解析芳烃化合物的代谢机制、利用代谢工程技术强化代谢能力和木质素衍生芳烃向高值化学品的定向转化等方面[14-15]。木质素资源的高值化利用将成为生物精炼一体化中关键的一部分,对提高木质纤维素生物炼制的经济性和可持续性具有重要作用。
在自然界中,木质素大分子的解聚和衍生芳烃等小分子的矿化之间有着密切的联系。在深入解析自然界木质素碳循环机制的基础上,可利用微生物进行木质素的综合高值转化。在整个转化过程中,不仅要重视芳香族化合物的代谢与转化,对于木质素解聚部分的研究仍不可忽略,更重要的是将生物炼制的预处理过程和木质素基芳烃化合物转化过程进行偶联,综合考虑上游和下游之间的衔接,这对于实现木质素的高值转化至关重要。本文将总结近年来利用微生物在去除生物质结构屏障以及木质素高值资源化利用这两个阶段的研究进展,讨论分析目前存在的挑战并展望未来的发展前景。
1 木质素的生物解聚 在自然界碳循环和长期进化的过程中,植物通过产生木质素结构抗性屏障以抵御外来入侵和降解。与此同时,自然界中的微生物则通过不断进化获得解聚和转化木质素的能力和特性,从而使得木质纤维素中的碳素得到有效释放以维持自然界重要的碳循环[16]。筛选具备解聚木质素能力的微生物进行预处理是生物法中一个重要的研究方向,经济有效的预处理方式追求从木质纤维素中分离木质素并尽可能避免对纤维素的破坏[17]。
在探究木质素生物解聚的过程中,科学家们发现木腐真菌等微生物具有高效的木质素降解系统[18-19]。其中白腐真菌主要通过产生漆酶(Laccase)、木质素过氧化物酶(Lignin peroxidase),锰过氧化物酶(Manganese peroxidase)和多功能过氧化物酶(Versatile peroxidase)等多种胞外氧化还原酶及其产生自由基的辅助酶系实现对木质素的解聚。褐腐真菌则主要利用木质素降解酶和Fenton反应产生自由基对木质素结构进行破坏修饰而优先水解木质纤维素的纤维素成分。研究表明木腐真菌主要通过两条氧化途径对木质素结构进行解聚(图 2)。苯基香豆满和松脂醇降解途径是通过氧化木质素杂环结构中的呋喃结构,从而切断Cα-Cβ键。而在β-芳基-乙醚氧化途径中,Cα-Cβ键被过氧化物酶切断,产生香兰素和苯甲基酮类物质,香兰素随后在香草酸脱氢酶作用下氧化为香草酸。经过这一系列的反应,木腐真菌实现了对木质素碳水化合物结合体、苯基丙烷、木质素侧链以及芳香环结构的裂解。两条途径的本质都是以木质素降解酶系为主导的氧化还原反应,因此木质素氧化还原酶的类型及反应特征决定了木质素结构解构特征[19-20]。利用微生物进行木质素的解聚需要考虑效率以及在解聚过程中对纤维素结构的影响。随着木质素解聚酶的降解特性和分子机制得到深入的研究[21],提升了生物法预处理的效率并拓宽了生物法的应用范围。
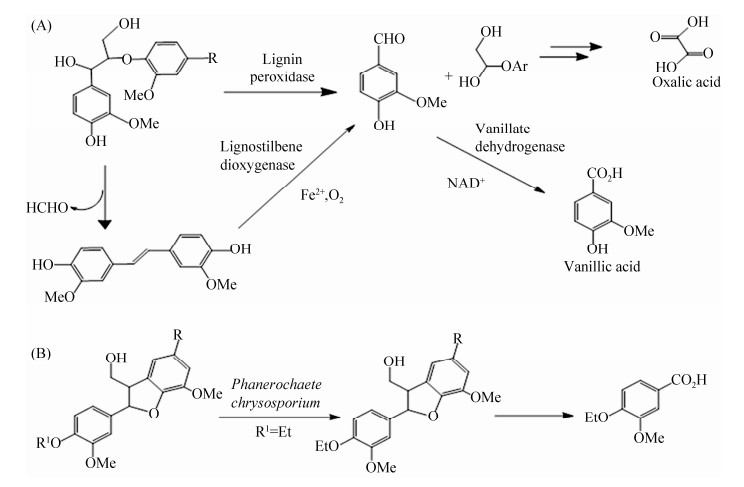 |
| 图 2 木腐真菌主要的木质素解聚途径[19] Figure 2 The main lignin depolymerization pathways of wood-rot fungi[19]. |
| 图选项 |
漆酶广泛存在于细菌、真菌、植物和昆虫中,是使用最广泛的木质素降解多铜氧化酶[22]。Ander和Eriksson等在对Sporotrichum pulverulentum进行遗传研究时,验证了缺乏漆酶的突变体无法降解木质素,证明了漆酶在木质素降解中的重要作用[23]。漆酶使用分子氧作为电子受体,催化各种酚醛底物的氧化。但漆酶作为大分子难以有效深入木质纤维素屏障结构内部,且其氧化还原电势较低,只能氧化酚醛类木质素单元。但是当有2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)或1-羟基苯并三唑(HBT)等小分子介体存在的情况下,底物的范围可以扩大到非酚类化合物[24]。锰过氧化物酶是一种含血红素的糖蛋白,最早发现于金黄色葡萄球菌中。锰过氧化物酶催化复合的Mn2+氧化为Mn3+,进而氧化大量酚类底物。Mn3+被广泛认为是可扩散的氧化剂,能够在远离锰过氧化物酶活性位点处氧化次级底物[25]。另外,白腐真菌可分泌草酸和其它有机酸,形成稳定的Mn3+螯合物,可作为酚类化合物和染料的稳定扩散氧化剂。木质素过氧化物酶最早发现于白腐真菌中,其攻击木质素聚合物具有相对非特异性,能够氧化不同的酚类芳香族化合物和各种非酚类木质素模型化合物。木质素过氧化物酶还具有高氧化还原电位,能够氧化未能被其它过氧化物酶氧化的底物。与锰过氧化物酶和木质素过氧化物酶相比,多功能过氧化物酶的作用底物更加广泛。多功能过氧化物同时具有锰过氧化物酶和木质素过氧化物酶的底物催化位点,如保守性氨基酸残基Glu、Glu和Asp组成的锰离子结合位点,以及保守性氨基酸残基Trp构成的芳香族化合物氧化位点,因此既能像锰过氧化物酶一样氧化Mn2+,又能像木质素过氧化物酶一样氧化藜芦醇等高氧化还原电位底物,同时还可以氧化一系列酚型和非酚型木质素结构化合物,形成高氧化还原电位的Mn3+或自由基,进而作用于木质素大分子[26]。木质素的生物解聚和相关酶系已经得到了系统的研究和综述[19, 27],本文主要关注生物法在预处理阶段分离木质素过程中的应用。
1.1 生物制浆 用真菌和酶介导的生物质预处理体系,在节省能源的同时可显著提高纸浆强度[28]。白腐真菌是自然界已知能够独立完全矿化木质素的一类生物。使用白腐真菌预处理木材增强了纸张的强度和韧性[29]。在不断筛选预处理效果更好的真菌的同时,真菌解聚木质素的机理研究也不断深入[30]。一系列木质素的解聚酶在纸浆改性和去除树脂类化合物中逐渐得到应用[31]。Dyer和Ragauskas利用漆酶和ABTS/HBT等介体对软木(松木)木片进行预处理,其中漆酶/HBT体系对提升脱木质素效率和纸浆产量最为有效[32]。漆酶-HBT体系同样可以减少热机械制浆(TMP)过程能量的消耗并改善纸张亮度和机械强度等性能[33]。利用代谢工程和合成生物学构建只解聚木质素而不水解纤维素的工程菌也可以实现微生物法制备高质量纸浆。漆酶的应用较为广泛,Widsten和Kandelbauer对漆酶在生物制浆等林业产品生产中应用已经进行了详细的综述[22]。除漆酶外,其他过氧化物酶也表现出应用的潜力,可以和漆酶进行协同作用,从而提升木质素的解聚效果[25]。除真菌外,具有木质素降解能力的细菌也可用于生物制浆。假单胞菌属Pseudomonas sp. PKE117因具有独特的芳香族化合物代谢特性,可以破坏愈创木脂丙烷类木质素单位并分解苯环,在软木的生物制浆中显示出更大的潜力[34]。
1.2 生物乙醇 全球的化石燃料储藏量有限且分布不均,将可再生生物质资源转化为燃料是缓解能源压力的有效方法。能源安全涉及国家战略,在近四十年时间里,生物乙醇一直是各个国家研究的热点方向[35]。最初的第一代生物乙醇主要使用玉米等淀粉含量较高的粮食作物作为主要原料,这涉及粮食的安全问题[36]。因此,使用木质纤维素作为主要原料的第二代生物乙醇得到广泛的研究和应用。相比于第一代生产工艺,在第二代生物乙醇中预处理技术是关键性的工艺步骤,如何更好的将纤维素和半纤维素暴露出来,充分地被水解酶水解释放可发酵糖,这直接关系到后续的发酵效率以及整个过程的经济性[37-38]。相比于物理方法和化学方法,生物法在环境保护和成本控制方面的潜力使其获得了持续的关注。白腐真菌因其对木质素的解聚能力被广泛应用于预处理工艺[39-40]。Stereum hirsutum、Echinodontium taxodii等白腐菌能够选择性地降解木质素而保留纤维素和半纤维[41-43]。利用Irpex lacteus对玉米秸秆进行预处理,可以将糖化效率提升到66.4%[44]。Coniophora puteana和Postia placenta等褐腐真菌也在预处理工艺中表现出很好的应用前景,与白腐真菌的作用方式不同,褐腐真菌虽然不能对木质素进行高效降解,但是在对木质素进行化学结构修饰的同时,可以降低纤维素的结晶度,导致细胞壁孔隙率显著增加,从而促进木质纤维素底物的糖化过程[45]。
纤维素乙醇和制浆造纸等行业持续产出大量副产物木质素。作为可再生芳香族原料的木质素如何转化为精细化学品将成为生物精炼一体化最为关键和最具挑战的环节。
2 木质素的未来:整合构建多功能微生物实现高值转化 目前,将木质素转化为可替代燃料的技术包括催化热解、加氢处理、碱性裂解/烷基化和气化[46]。热裂解是一种可以通过高温将木质素转化为生物油的方法。但木质素在热解过程中会产生数百种不同的化合物,导致生物油产物的组分非常复杂,其中大部分化学性质不稳定,需要通过昂贵的加氢脱氧步骤才能被用作燃料[47]。近年来通过化学催化将木质素解聚成芳香族单体化合物方面的研究取得了很多突破性的进展。Rahimi等利用甲酸在温和的条件下结合金属催化将氧化后的木质素解聚成单体化合物,其产率可达60wt%[48]。Shuai等也报道了在生物质预处理过程中添加甲醛作为保护剂,使木质素在催化加氢解聚过程中,能高效地解聚为单体[49]。值得关注的是白腐真菌及其相关木质素降解酶能够在环境友好的条件下有效解聚木质素,是获得芳香族小分子底物的重要途径。但是如前述,不管是化学还是生物方法,木质素固有的异质性使其解聚得到的芳香族单体化合物的组成仍然非常复杂,对下游的进一步产品纯化提出非常高的要求,从而极大地限制了木质素的高值转化利用[50]。随着生物技术持续突破性的发展,以及木质素高值化的迫切需求,深度挖掘与重构微生物对多元芳香族化合物定向转化途径为木质素的生物资源化利用方面迎来了新的机遇。
2.1 “生物漏斗”式的芳香族化合物利用 在自然界降解利用木质素的漫长过程中,一些微生物进化出类似“生物漏斗”式的芳香族化合物代谢功能(图 3):即通过“上游通路”(upper pathways),将木质素解聚后复杂的芳香族化合物转化为邻苯二酚或原儿茶酸等几种主要的中间体。在芳香族化合物代谢的“下游通路”(lower pathways)中,双加氧酶通过裂解芳香环中的C-C键生成开环单体,再通过β-酮己二酸(β-ketoadipate pathway)等途径将这些单体汇集到中心碳代谢中,从而实现微生物对复杂芳香族化合物的利用[51-52]。“生物漏斗”式的芳香族化合物利用方法为我们提供了一种克服现代生物炼制过程中木质素解聚芳香族产物异质性问题的生物解决方案,极大地简化下游目标产物的分离。通过与上游的木质素解聚催化相结合,该方案为木质素转化高值化学品的商业应用提供了可能。
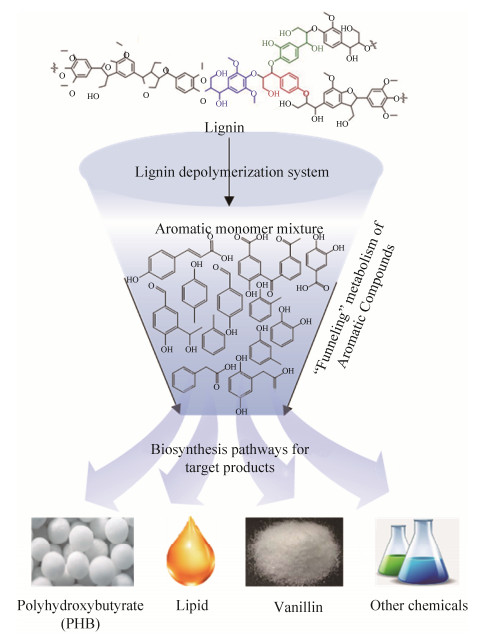 |
| 图 3 木质素解聚产物的“漏斗式”生物转化 Figure 3 Biological funneling conversion of lignin-derived aromatic compounds. |
| 图选项 |
2.2 将木质素转化为生物塑料 聚羟基脂肪酸酯(PHA)是原核生物在特定的条件下合成并可以大量贮藏的一类热塑性聚酯,无毒且不溶于水,这种生态优势使其成为可降解塑料的理想原材料之一[53]。聚β-羟基丁酸酯(PHB)是最早发现并研究最广泛的一种PHA,在包装和医药材料等领域得到应用[54]。现阶段利用微生物生产PHB的原材料占生产成本的50%,因此PHB商用的价格仍显著高于石油基塑料[55]。选择廉价的木质素作为原料生产PHB,可以有效的降低成本并提高木质纤维素生物精炼厂的可持续性。已报道的研究中,用于生产PHB的木质素来源主要有三种,即木质纤维素酶水解后的残留木质素、制浆造纸业产生的牛皮纸木质素以及通过木质纤维素原料碱预处理获得的碱性预处理液(APL)[45, 56-57]。
恶臭假单胞菌KT2440(Pseudomonas putida KT2440)同时具备一定的木质素降解能力和PHA合成能力。Linger等最早证明了这一点:P. putida KT2440在APL中培养48 h后,其干细胞中PHA积累量可达到36%[14]。Liu等利用H2SO4和NaOH的组合预处理结合分批补料发酵,将P. putida KT2440利用木质素合成PHA的产量提高到1.0 g/L[58]。而通过基因工程改造同样可以有效的提升PHA的产率。Salvachua等通过敲除PHA解聚酶基因phaZ并且同时过表达β氧化相关基因fadBA1和fadBA2,显著的提升了PHA的产率[59]。
用于木质素转化合成PHB研究比较多的另一类细菌是Ralstonia eutropha(Cupriavidus necator)。R. eutropha具有丰富的底物多样性,可利用不同的底物为原料合成多种不同的生物基化学品[60],其PHB的积累量最高可达细胞干重的90%,显著优于其它细菌[61]。Berezina等在研究R. eutropha DSM 545代谢不同种类芳香族化合物转化PHB的能力时,发现苯甲酸的浓度超过2.5 g/L时会对细胞产生毒性,通过12周的分批补料,避免底物浓度过高对发酵影响的同时将PHB产量提升到43.7 g/L[62]。因为PHB的积累需要在氮限制条件下,两阶段的发酵方法可以使细胞生长和PHB积累分开,同样能够显著提升PHB的产量[63]。利用Plackett- Burman和中心复合设计对补充剂的种类和浓度进行筛选,在添加二氧化硅纳米颗粒、ABTS和Tween 80的条件下,R. eutropha DSM 545以APL为碳源合成PHB的效率提升了10倍[64]。通过对R. eutropha H16基因组的测序和注释,为其基因工程的改造提供了基础[65]。用于改善PHB代谢工程的基因组编辑工具也得到不断开发[66-67]。将发酵过程的优化与基因工程的优化相结合,为高效转化PHB提供了更多的可能。
2.3 将木质素转化为脂质 脂质可以作为生产食品和燃料的重要原料,在已报道的研究中发现木质素基芳香族化合物可以作为微生物合成脂质的底物。产油红球菌属(Rhodococcus)具有高效芳香族化合物代谢能力,在木质素转化脂质中显示出巨大的潜力。Rhodococcus jostii RHA1被证明具有木质素降解能力[68-69]。通过对R.jostii RHA1基因组的分析,发现其具有将不同芳烃化合物代谢并转化成自身所需能量化合物的能力[70]。我们研究发现,在漆酶处理后的木质素解聚芳香族代谢中,Rhodococcus opacus PD630主要通过β-酮己二酸途径、苯乙酸分解代谢途径(Phenylacetate catabolic pathway)和尿黑酸途径(Homogentisate pathway)将木质素解聚后的芳香族单体化合物进行开环转化为乙酰辅酶A[71]。在氮限制条件下,这些芳香族化合物代谢后的产物可以被R. jostii RHA1、R. opacus PD630以及R. opacus DSM 1069等作为碳源进行脂质合成并且大量贮存在体内[72-74]。但这些微生物对于生物精炼产生的木质素残渣的利用能力比较有限,其中只有低分子量木质素被利用,而木质素大分子聚合物难以被转化利用[75]。针对这个问题,将大分子木质素解聚成低分子量芳香族化合物是关键。当外源漆酶加入培养体系中,可以促进木质素的解聚,从而使R. opacus PD630利用木质素为唯一碳源转化合成脂质的产量提升了17倍[73]。我们进一步利用合成生物学在R. opacus PD630中构建了漆酶的异源分泌表达系统,可以有效弥补R. opacus PD630中木质素解聚能力低的生化缺陷,从而显著提高了木质素到油脂的生物转化效率[71]。许多研究在红球菌中发现新的转运结合蛋白和编码基因对于脂质的催化合成以及在其油脂合成和积累过程中具有重要的作用,可为后续从木质素到油脂合成路径的优化提供重要的生物学元件[69, 76-77]。虽然近几年在木质素到油脂生物转化方面的研究有了很多突破性的进展,但是如何平衡异源蛋白表达所需的高氮和油脂积累所需的限氮条件之间的矛盾,是下一步研究需要重点解决的问题。
2.4 香兰素 香兰素(4-羟基-3-甲氧基苯甲醛)是全球生产量最大的香精化学品,在食品和化妆品等领域有广泛应用。源于石油基愈创木酚的非天然香兰素被要求在食品消费品标签中注明“合成”。利用木质素通过微生物转化合成的香兰素香气强度是石油基香兰素的1.2倍,更重要的是,与年产量40至50吨的天然香兰素一样均被美国和欧盟允许标注为“天然”。野生型的微生物将木质素分解为香兰素的能力十分有限,通过代谢工程手段优化代谢途径可以有效提高香兰素的合成效率。Sainsbury等通过敲除R. jostii RHA1野生株中编码香兰素脱氢酶的基因,可以使突变株能以麦草为唯一碳源产生香兰素[78]。虽然已有研究报道DyP型过氧化物酶可能在这个过程中起重要的作用[79],然而木质素向香兰素的转化仍需要一套完整的酶系以提升其转化效率。许多放线菌能够通过降解木质素产生阿魏酸,而Streptomyces sp. strain V-1可将阿魏酸进一步转化为香兰素[80]。Sharma等利用微生物燃料电池系统,通过H2O2介导的氧化反应成功将复杂的木质素转化为香兰素等低分子量附加值的芳族化学品[81]。
2.5 其他化合物 顺,顺-粘康酸可以作为纤维和塑料的生产原料,全球市场规模巨大,其生物合成一直备受关注[82]。恶臭假单胞菌(P. putida)、谷氨酸棒杆菌(Corynebacterium glutamicum)和分枝杆菌(Amycobacterium)都能够作为生产顺,顺-粘康酸的底盘生物[83-84]。通过构建和改造工程菌株,阻遏顺,顺-粘康酸这种代谢中间体的分解,实现了顺,顺-粘康酸的有效积累[85]。Kohlstedt等利用P. putida KT2440为底盘生物,通过模块化的设计增强其邻苯二酚的耐受性和转化效率,实现了木质素到尼龙的转化[86]。Sonoki等对P. putida KT2440和鞘氨醇单胞菌SYK-6 (Sphingomonas paucimobilis SYK-6)进行改造,实现了分别以软木木质素和硬木木质素作为碳源代谢转化顺,顺-粘康酸[87]。以木质素组分替代葡萄糖提供细菌生长所需的碳源不仅降低了成本,又实现了对木质素废弃物的高值化利用。对羟基苯甲酸酯作为一种安全的防腐剂被广泛用于食品,药品等行业。化学合成对羟基苯甲酸需要严苛的条件并伴随副产物的产生。生物法转化对羟基苯甲酸表现出一定的潜力。Jung等利用Burkholderia glumae BGR1以木质素模式化合物香豆酸为底物生产对羟基苯甲酸,通过敲除对羟基苯甲酸的分解代谢基因,从而实现目标产物的有效积累[88]。
3 挑战和展望 3.1 挑战 木质纤维素的预处理技术已经研究了近一个世纪,木质素的高值化研究在近10年内也逐渐得到越来越多的关注[89]。然而,存在的诸多局限性仍为木质素的高值转化带来了挑战。
3.1.1 木质素自身的局限: 木质素结构复杂,我们至今仍未能完全解析木质素的结构特征。已知木质素是稳定的三维生物聚合物,对生物或化学降解具有特别的抵抗力。木质素不溶于水,微生物利用高分子不溶木质素的能力较低,需要适当的解聚以将富含木质素的底物分解为可被细菌有效吸收的低分子量和水溶性物质,其异质结构也极大地限制了转化效率。虽然细菌拥有较为多样的底物代谢图谱,但仍无法将所有异质组分完全转化。此外,微生物对木质素解聚到一定程度后,即使通过添加过量的降解酶或者重复培养等方式,也难以将木质素完全降解和转化。这些局限性都导致了细菌系统对木质素进行转化产品效率低。
3.1.2 上游和下游缺乏衔接: 3现阶段木质素主要来源于生物质预处理过程。传统的造纸和制浆行业单纯的追求纸张质量,忽视了严苛的反应对木质素结构造成缩合等影响,这阻碍了其进一步的增值转化。虽然许多研究力求保证纸张质量的同时改善严苛的预处理条件,为木质素的下游转化带来更多的便利。然而,在商业制浆过程中鲜有应用。生物精炼厂在以往的加工过程中通常着重于碳水化合物的转化,忽视了对下游木质素的转化和利用。更为棘手的问题是不同的预处理技术对木质素结构和组成的修饰具有显著的差异,这使得本就复杂的木质素更加难以利用。
自然界中木质素的解聚和转化并不是完全割裂的过程,两者之间存在一定的联系:真菌主要负责木质素大分子的解聚,细菌完成异质芳烃的矿化,从而有效地维持自然界碳循环过程。而现阶段通过预处理获取的木质素,其结构反而更加复杂。生物学手段强化了微生物代谢芳香族化合物和合成目标产物的能力,但这仍属于对木质素高值转化下游阶段的强化,缺乏与上游木质素剥离以及高效解聚等预处理过程的偶联,这也极大地限制了生物精炼一体化的进程。
3.2 展望 木质素的高值转化需要将木质素的解聚、异质芳烃代谢和目标产物合成这三个步骤看作一个连贯的整体,不仅每一个步骤都需要系统的优化,三个步骤的有机整合对于真正实现木质素的高值转化至关重要。
预处理技术作为现阶段获得木质素的主要步骤,对后续高值转化步骤具有决定性的影响。原本严苛的预处理技术也逐渐倾向于温和的解聚木质素,以减少对后续转化的负作用。特别是“木质素优先”概念的出现以期将木质素增值放在生物精炼厂的最前沿,通过实施主动稳定化的分级分离方法,缓解木质素缩合的同时减少对碳水化合物结构完整性的损害[90-91]。生物法凭借独特的优势在“木质素优先”理念中具有更大的潜力。生物法预处理本身源于自然,预处理过程不会对木质素大分子结构造成缩合,更符合木质素优先概念的诉求。在后续异质芳烃代谢和目标产物合成过程中,生物法中各个阶段具有的互通性也为优化带来极大的便利。生物法将三个过程有机地整合不仅可以完成木质素的优先分离,更能够实现木质素的优先转化。木质素的高值转化仍需要从多个角度进行开发,这其中也包括利用多种不同的方法进行系统地整合[51]。
3.2.1 筛选新的功能菌株和功能基因: 筛选具有降解和转化木质素能力的微生物或复合菌系是一项漫长而又艰巨的任务,但其重要性对生物法的三个过程都不言而喻。自然界已经进化出的木质素降解转化系统仍有大部分未能得到认知和开发。已有研究集中于从堆肥[92]、污泥[93]、动物肠道[94]和森林土壤中进行筛选并成功获得了许多目标微生物,随着培养技术的不断进步,可以获取更多的目标功能微生物[95]。通过扩大筛选范围和深度同样会带来更多的发现,Numata等在海洋中筛选出能够直接将木质素转化为PHB的微生物[96]。基于宏基因组学等技术可以弥补纯化培养存在的限制,筛选并挖掘新的酶和转化途径[97]。比较基因组学等也为木质素的分解提供了新认识[98]。
3.2.2 技术优化与系统整合: 白腐真菌等微生物具备解聚与矿化木质素的能力,通过基因编辑等技术和代谢工程技术对木质素解聚过程进行调控,即可以提升木质素的解聚效率,又可以避免完全将其矿化。合成生物学可以充分利用不同微生物的优势功能,通过模块化的构建方式,集不同微生物之所长[99]。更为重要的是,将上游解聚与下游代谢途径的开发相结合,利用细菌的芳烃代谢系统将真菌解聚的木质素芳烃化合物进行代谢和转化,这不仅能够促进木质素的解聚,也可以避免已经解聚的芳烃化合物进一步再聚合[100]。将两个过程的衔接也作为重点优化的部分之一,以一体化的设计,充分发挥生物法在木质素高值转化过程中的优势和作用。
3.2.3 综合利用: 尽管生物法表现出较强的多样性,但我们仍强调利用多种方法实现优势互补。多种方法的组合不局限于预处理过程,同样可以在后续转化中应用,以更有效的解聚和利用木质素。微生物对木质素很难实现100%的转化。因此,在木质素的资源化过程中,可以利用微生物的降解与转化作用,在将木质素解聚产物转化为目标产物的同时,对木质素的大分子进行生物改性,从而利用微生物难以降解的改性后木质素制备高性能生物高分子材料(图 4)。木质素巨大的年产量需要找到相对应的需求市场。全球对于沥青的需求量巨大并仍在增加,生物改性后的木质素可以作为高性能沥青粘合剂的改性剂,以同时改善沥青粘合剂的高温和低温性能[101]。木质素基碳纤维材料也是一种优质的材料,商业应用面十分广泛,但成本较高。目前,传统木质素基碳纤维的机械性能无法与石油基碳纤维相比,而通过酶介体系统对木质素进行处理后,其中剩余的高聚体木质素虽未能被解聚,但是其结构却已被酶进行了改性,其制备的碳纤维材料性能甚至比传统商用碳纤维更优越[102]。另外,研究者利用白腐菌处理后的木质素制备了具有超高比表面积的生物碳材料,其比表面积可高达3439 m2/g,在电容型阴极电极、快速去除水中有机污染物和电催化材料都具有优异的性能[103]。因此,在利用微生物进行木质素的降解与转化时,对于不易被解聚的高分子木质素,可以结合其改性后结构特性,用于制备具有优越性能的生物材料。
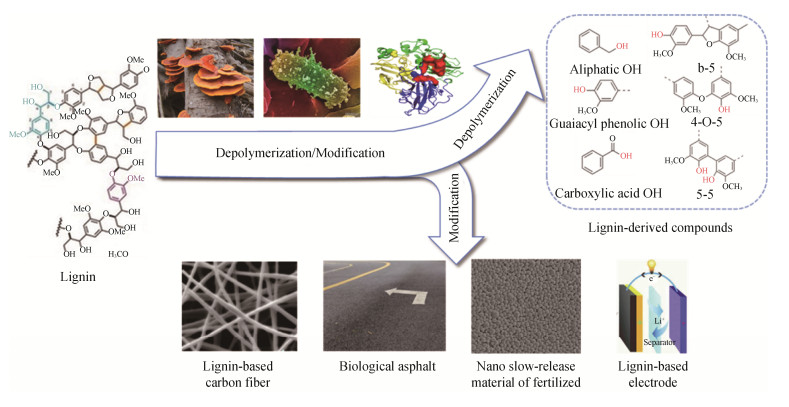 |
| 图 4 木质素的综合利用 Figure 4 Lignin valorization by integrating multiple bioprocesses. |
| 图选项 |
总而言之,木质素的高值转化仍是一个复杂的过程,需要对上游解聚和下游转化等多个环节进行一体化设计,在对单一步骤进行强化的同时,也要注重各部分的有机偶联。此外,生物法友好的解聚方案同样可以结合优化的化学解聚方法,从而促进木质素更好的解聚。而在下游转化过程中,以生物漏斗式转化方案为主,结合生物改性等方法,扩大木质素基转化产物的种类,提升木质素的利用率,从而实现木质素的综合利用。
References
| [1] | Alvira P, Negro M, Ballesteros M. Effect of endoxylanase and α-L-arabinofuranosidase supplementation on the enzymatic hydrolysis of steam exploded wheat straw. Bioresource Technology, 2011, 102(6): 4552-4558. DOI:10.1016/j.biortech.2010.12.112 |
| [2] | Xu CP, Arancon RAD, Labidi J, Luque R. Lignin depolymerisation strategies:towards valuable chemicals and fuels. Chemical Society Reviews, 2014, 43(22): 7485-7500. DOI:10.1039/C4CS00235K |
| [3] | Bugg TDH, Rahmanpour R. Enzymatic conversion of lignin into renewable chemicals. Current Opinion in Chemical Biology, 2015, 29: 10-17. DOI:10.1016/j.cbpa.2015.06.009 |
| [4] | Mosier N, Wyman C, Dale B, Elander R, Lee YY, Holtzapple M, Ladisch M. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresource Technology, 2005, 96(6): 673-686. DOI:10.1016/j.biortech.2004.06.025 |
| [5] | Cao L, Yu IKM, Liu Y, Ruan X, Tsang DCW, Hunt AJ, Ok YS, Song H, Zhang S. Lignin valorization for the production of renewable chemicals:State-of-the-art review and future prospects. Bioresource Technology, 2018, 269: 465-475. DOI:10.1016/j.biortech.2018.08.065 |
| [6] | Chen Z, Wan CX. Biological valorization strategies for converting lignin into fuels and chemicals. Renewable and Sustainable Energy Reviews, 2017, 73: 610-621. DOI:10.1016/j.rser.2017.01.166 |
| [7] | Gillet S, Aguedo M, Petitjean L, Morais ARC, da Costa Lopes AM, Lukasik RM, Anastas PT. Lignin transformations for high value applications:towards targeted modifications using green chemistry. Green Chemistry, 2017, 19(18): 4200-4233. DOI:10.1039/C7GC01479A |
| [8] | Ragauskas AJ, Beckham GT, Biddy MJ, Chandra R, Chen F, Davis MF, Davison BH, Dixon RA, Gilna P, Keller M. Lignin valorization:improving lignin processing in the biorefinery. Science, 2014, 344: 6185. |
| [9] | Shao Y, Xia Q, Dong L, Liu X, Han X, Parker SF, Cheng Y, Daemen LL, Ramirez-Cuesta AJ, Yang S, Wang Y. Selective production of arenes via direct lignin upgrading over a niobium-based catalyst. Nature Communications, 2017, 8(16104). |
| [10] | Parajuli R, Dalgaard T, J?rgensen U, Adamsen APS, Knudsen MT, Birkved M, Gylling M, Schj?rring JK. Biorefining in the prevailing energy and materials crisis:a review of sustainable pathways for biorefinery value chains and sustainability assessment methodologies. Renewable and Sustainable Energy Reviews, 2015, 43: 244-263. DOI:10.1016/j.rser.2014.11.041 |
| [11] | Kamimura N, Takahashi K, Mori K, Araki T, Fujita M, Higuchi Y, Masai E. Bacterial catabolism of lignin-derived aromatics:New findings in a recent decade:Update on bacterial lignin catabolism. Environmental Microbiology Reports, 2017, 9(6): 679-705. DOI:10.1111/1758-2229.12597 |
| [12] | de Gonzalo G, Colpa DI, Habib MH, Fraaije MW. Bacterial enzymes involved in lignin degradation. Journal of Biotechnology, 2016, 236: 110-119. DOI:10.1016/j.jbiotec.2016.08.011 |
| [13] | Brown ME, Chang MC. Exploring bacterial lignin degradation. Current Opinion in Chemical Biology, 2014, 19: 1-7. DOI:10.1016/j.cbpa.2013.11.015 |
| [14] | Linger JG, Vardon DR, Guarnieri MT, Karp EM, Hunsinger GB, Franden MA, Johnson CW, Chupka G, Strathmann TJ, Pienkos PT, Beckham GT. Lignin valorization through integrated biological funneling and chemical catalysis. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(33): 12013-12018. DOI:10.1073/pnas.1410657111 |
| [15] | Kamimura N, Sakamoto S, Mitsuda N, Masai E, Kajita S. Advances in microbial lignin degradation and its applications. Current Opinion in Biotechnology, 2019, 56: 179-186. DOI:10.1016/j.copbio.2018.11.011 |
| [16] | Nelsen MP, DiMichele WA, Peters SE, Boyce CK. Delayed fungal evolution did not cause the Paleozoic peak in coal production. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2442-2447. DOI:10.1073/pnas.1517943113 |
| [17] | Taherzadeh MJ, Karimi K. Pretreatment of lignocellulosic wastes to improve ethanol and biogas production:a review. International Journal of Molecular Sciences, 2008, 9(9): 1621-1651. DOI:10.3390/ijms9091621 |
| [18] | Martínez áT, Speranza M, Ruiz-Due?as FJ, Ferreira P, Camarero S, Guillén F, Martínez MJ, Gutiérrez Suárez A, Río Andrade JCd. Biodegradation of lignocellulosics: microbial, chemical, and enzymatic aspects of the fungal attack of lignin. 2005. |
| [19] | Bugg TD, Ahmad M, Hardiman EM, Rahmanpour R. Pathways for degradation of lignin in bacteria and fungi. Natural Product Reports, 2011, 28(12): 1883-1896. DOI:10.1039/c1np00042j |
| [20] | Ahmad M, Taylor CR, Pink D, Burton K, Eastwood D, Bending GD, Bugg TDH. Development of novel assays for lignin degradation:comparative analysis of bacterial and fungal lignin degraders. Molecular Biosystems, 2010, 6(5): 815-821. DOI:10.1039/b908966g |
| [21] | Sanchez C. Lignocellulosic residues:Biodegradation and bioconversion by fungi. Biotechnology Advances, 2009, 27(2): 185-194. DOI:10.1016/j.biotechadv.2008.11.001 |
| [22] | Widsten P, Kandelbauer A. Laccase applications in the forest products industry:a review. Enzyme and Microbial Technology, 2008, 42(4): 293-307. DOI:10.1016/j.enzmictec.2007.12.003 |
| [23] | Ander P, Eriksson K-E. The importance of phenol oxidase activity in lignin degradation by the white-rot fungus Sporotrichum pulverulentum. Archives of Microbiology, 1976, 109(1-2): 1-8. DOI:10.1007/BF00425105 |
| [24] | Leonowicz A, Cho NS, Luterek J, Wilkolazka A, Wojtas-Wasilewska M, Matuszewska A, Hofrichter M, Wesenberg D, Rogalski J. Fungal laccase:properties and activity on lignin. Journal of Basic Microbiology, 2001, 41(3-4): 185-227. DOI:10.1002/1521-4028(200107)41:3/4<185::AID-JOBM185>3.0.CO;2-T |
| [25] | Hofrichter M. Review:lignin conversion by manganese peroxidase (MnP). Enzyme and Microbial Technology, 2002, 30(4): 454-466. DOI:10.1016/S0141-0229(01)00528-2 |
| [26] | Camarero S, Sarkar S, Ruiz-Duenas FJ, Martinez MJ, Martinez AT. Description of a versatile peroxidase involved in the natural degradation of lignin that has both manganese peroxidase and lignin peroxidase substrate interaction sites. Journal of Biological Chemistry, 1999, 274(15): 10324-10330. DOI:10.1074/jbc.274.15.10324 |
| [27] | Janusz G, Pawlik A, Sulej J, Swiderska-Burek U, Jarosz-Wilkolazka A, Paszczynski A. Lignin degradation:microorganisms, enzymes involved, genomes analysis and evolution. Fems Microbiology Reviews, 2017, 41(6): 941-962. DOI:10.1093/femsre/fux049 |
| [28] | Kang KY, Jo BM, Oh JS, Mansfield SD. The effects of biopulping on chemical and energy consumption during kraft pulping of hybrid poplar. Wood and Fiber Science, 2007, 35(4): 594-600. |
| [29] | Yang QF, Zhan HY, Wang SF, Fu SY, Li KC. Modification of eucalyptus CTMP fibres with white-rot fungus Trametes hirsute-effects on fibre morphology and paper physical strengths. Bioresource Technology, 2008, 99(17): 8118-8124. DOI:10.1016/j.biortech.2008.03.029 |
| [30] | Gonzalez-Perez D, Mateljak I, Garcia-Ruiz E, Ruiz-Due?as FJ, Martinez AT, Alcalde M. Alkaline versatile peroxidase by directed evolution. Catalysis Science & Technology, 2016, 6(17): 6625-6636. |
| [31] | Mart?nez-ínigo M, Gutiérrez A, Del R?o J, Mart?nez M, Mart?nez A. Time course of fungal removal of lipophilic extractives from Eucalyptus globulus wood. Journal of Biotechnology, 2000, 84(2): 119-126. DOI:10.1016/S0168-1656(00)00345-X |
| [32] | Dyer T, Ragauskas A. Laccase:a harbinger to kraft pulping. ACS Symposium Series, 2004, 889: 339-362. |
| [33] | Petit-Conil M, Semar S, Niku-Paavola M, Sigoillor J, Asther A, Anke H, Viikari L. Potential of laccases in softwood-hardwood high-yield pulping and bleaching. Progress in Biotechnology, 2002: 193-202. |
| [34] | Yang JS, Ni JR, Yuan HL, Wang E. Biodegradation of three different wood chips by Pseudomonas sp PKE117. International Biodeterioration & Biodegradation, 2007, 60(2): 90-95. |
| [35] | Zabed H, Sahu J, Suely A, Boyce A, Faruq G. Bioethanol production from renewable sources:Current perspectives and technological progress. Renewable and Sustainable Energy Reviews, 2017, 71: 475-501. DOI:10.1016/j.rser.2016.12.076 |
| [36] | Maity SK. Opportunities, recent trends and challenges of integrated biorefinery:Part Ⅱ. Renewable and Sustainable Energy Reviews, 2015, 43: 1446-1466. DOI:10.1016/j.rser.2014.08.075 |
| [37] | Mood SH, Golfeshan AH, Tabatabaei M, Jouzani GS, Najafi GH, Gholami M, Ardjmand M. Lignocellulosic biomass to bioethanol, a comprehensive review with a focus on pretreatment. Renewable and Sustainable Energy Reviews, 2013, 27: 77-93. DOI:10.1016/j.rser.2013.06.033 |
| [38] | Vaidya A, Singh T. Pre-treatment of Pinus radiata substrates by basidiomycetes fungi to enhance enzymatic hydrolysis. Biotechnology Letters, 2012, 34(7): 1263-1267. DOI:10.1007/s10529-012-0894-7 |
| [39] | Zhang XY, Yu HB, Huang HY, Liu YX. Evaluation of biological pretreatment with white rot fungi for the, enzymatic hydrolysis of bamboo culms. International Biodeterioration & Biodegradation, 2007, 60(3): 159-164. |
| [40] | Ferraz A, Cordova AM, Machuca A. Wood biodegradation and enzyme production by Ceriporiopsis subvermispora during solid-state fermentation of Eucalyptus grandis. Enzyme and Microbial Technology, 2003, 32(1): 59-65. DOI:10.1016/S0141-0229(02)00267-3 |
| [41] | Lee JW, Kim HY, Koo BW, Choi DH, Kwon M, Choi IG. Enzymatic saccharification of biologically pretreated pinus densiflora using enzymes from brown rot fungi. Journal of Bioscience and Bioengineering, 2008, 106(2): 162-167. DOI:10.1263/jbb.106.162 |
| [42] | Ma FY, Yang N, Xu CY, Yu HB, Wu JG, Zhang XY. Combination of biological pretreatment with mild acid pretreatment for enzymatic hydrolysis and ethanol production from water hyacinth. Bioresource Technology, 2010, 101(24): 9600-9604. DOI:10.1016/j.biortech.2010.07.084 |
| [43] | Yu H, Guo G, Zhang X, Yan K, Xu C. The effect of biological pretreatment with the selective white-rot fungus Echinodontium taxodii on enzymatic hydrolysis of softwoods and hardwoods. Bioresource Technology, 2009, 100(21): 5170-5175. DOI:10.1016/j.biortech.2009.05.049 |
| [44] | Song LL, Yu HB, Ma FY, Zhang XY. Biological pretreatment under non-sterile conditions for enzymatic hydrolysis of corn stover. Bioresources, 2013, 8(3): 3802-3816. |
| [45] | Schilling JS, Tewalt JP, Duncan SM. Synergy between pretreatment lignocellulose modifications and saccharification efficiency in two brown rot fungal systems. Applied Microbiology and Biotechnology, 2009, 84(3): 465-475. |
| [46] | Wang HL, Pu YQ, Ragauskas A, Yang B. From lignin to valuable products-strategies, challenges, and prospects. Bioresource Technology, 2019, 271: 449-461. DOI:10.1016/j.biortech.2018.09.072 |
| [47] | Saraeian A, Nolte MW, Shanks BH. Deoxygenation of biomass pyrolysis vapors:Improving clarity on the fate of carbon. Renewable and Sustainable Energy Reviews, 2019, 104: 262-280. DOI:10.1016/j.rser.2019.01.037 |
| [48] | Rahimi A, Ulbrich A, Coon JJ, Stahl SS. Formic-acid-induced depolymerization of oxidized lignin to aromatics. Nature, 2014, 515(7526): 249-252. DOI:10.1038/nature13867 |
| [49] | Shuai L, Amiri MT, Questell-Santiago YM, Héroguel F, Li Y, Kim H, Meilan R, Chapple C, Ralph J, Luterbacher JS. Formaldehyde stabilization facilitates lignin monomer production during biomass depolymerization. Science, 2016, 354(6310): 329-333. DOI:10.1126/science.aaf7810 |
| [50] | Pang J, Zheng M, Li X, Sebastian J, Jiang Y, Zhao Y, Wang A, Zhang T. Unlock the compact structure of lignocellulosic biomass by mild ball milling for ethylene glycol production. ACS Sustainable Chemistry & Engineering, 2018, 7(1): 679-687. |
| [51] | Beckham GT, Johnson CW, Karp EM, Salvachúa D, Vardon DR. Opportunities and challenges in biological lignin valorization. Current Opinion in Biotechnology, 2016, 42: 40-53. DOI:10.1016/j.copbio.2016.02.030 |
| [52] | Xie SX, Ragauskas AJ, Yuan JS. Lignin conversion:opportunities and challenges for the integrated biorefinery. Industrial Biotechnology, 2016, 12(3): 161-167. DOI:10.1089/ind.2016.0007 |
| [53] | Madkour MH, Heinrich D, Alghamdi MA, Shabbaj Ⅱ, Steinbu?chel A. PHA recovery from biomass. Biomacromolecules, 2013, 14(9): 2963-2972. DOI:10.1021/bm4010244 |
| [54] | Chen GQ, Wang Y. Medical applications of biopolyesters polyhydroxyalkanoates. Chinese Journal of Polymer Science, 2013, 31(5): 719-736. DOI:10.1007/s10118-013-1280-1 |
| [55] | Aramvash A, Moazzeni Zavareh F, Gholami Banadkuki N. Comparison of different solvents for extraction of polyhydroxybutyrate from Cupriavidus necator. Engineering in Life Sciences, 2018, 18(1): 20-28. DOI:10.1002/elsc.201700102 |
| [56] | Salvachúa D, Karp EM, Nimlos CT, Vardon DR, Beckham GT. Towards lignin consolidated bioprocessing:simultaneous lignin depolymerization and product generation by bacteria. Green Chemistry, 2015, 17(11): 4951-4967. DOI:10.1039/C5GC01165E |
| [57] | Zakzeski J, Bruijnincx PCA, Jongerius AL, Weckhuysen BM. The catalytic calorization of lignin for the production of renewable chemicals. Chemical Reviews, 2010, 110(6): 3552-3599. DOI:10.1021/cr900354u |
| [58] | Liu ZH, Olson ML, Shinde S, Wang X, Hao NJ, Yoo CG, Bhagia S, Dunlap JR, Pu YQ, Kao KC, Ragauskas AJ, Jin MJ, Yuan JS. Synergistic maximization of the carbohydrate output and lignin processability by combinatorial pretreatment. Green Chemistry, 2017, 19(20): 4939-4955. DOI:10.1039/C7GC02057K |
| [59] | Salvachua D, Rydzak T, Auwae R, De Capite A, Black BA, Bouvier JT, Cleveland NS, Elmore JR, Furches A, Huenemann JD, Katahira R, Michener WE, Peterson DJ, Rohrer H, Vardon DR, Beckham GT, Guss AM. Metabolic engineering of Pseudomonas putida for increased polyhydroxyalkanoate production from lignin. Microbial Biotechnology, 2020, 13(3): 813-813. |
| [60] | Lu JN, Brigham CJ, Li S, Sinskey AJ. Ralstonia eutropha H16 as a platform for the production of biofuels, biodegradable plastics, and fine chemicals from diverse carbon resources. Biotechnology for Biofuel Production and Optimization, 2016: 325-351. |
| [61] | Brigham CJ, Zhila N, Shishatskaya E, Volova TG, Sinskey AJ. Manipulation of Ralstonia eutropha carbon storage pathways to produce useful bio-based products. Sub-Cellular Biochemistry, 2012, 64: 343-366. |
| [62] | Berezina N, Yada B, Lefebvre R. From organic pollutants to bioplastics:insights into the bioremediation of aromatic compounds by Cupriavidus necator. New Biotechnology, 2015, 32(1): 47-53. |
| [63] | Du GC, Chen J, Yu J, Lun S. Continuous production of poly-3-hydroxybutyrate by Ralstonia eutropha in a two-stage culture system. Journal of Biotechnology, 2001, 88(1): 59-65. |
| [64] | Li M, Eskridge K, Liu E, Wilkins M. Enhancement of polyhydroxybutyrate (PHB) production by 10-fold from alkaline pretreatment liquor with an oxidative enzyme-mediator-surfactant system under Plackett-Burman and central composite designs. Bioresource Technology, 2019. |
| [65] | Pohlmann A, Fricke WF, Reinecke F, Kusian B, Liesegang H, Cramm R, Eitinger T, Ewering C, P?tter M, Schwartz E. Genome sequence of the bioplastic-producing "Knallgas" bacterium Ralstonia eutropha H16. Nature Biotechnology, 2006, 24(10): 1257-1262. DOI:10.1038/nbt1244 |
| [66] | Zhang X, Lin YN, Wu Q, Wang Y, Chen GQ. Synthetic biology and genome-editing tools for improving pha metabolic engineering. Trends in Biotechnology, 2019. |
| [67] | Xiong B, Li ZK, Liu L, Zhao DD, Zhang XL, Bi CH. Genome editing of Ralstonia eutropha using an electroporation-based CRISPR-Cas9 technique. Biotechnology for Biofuels, 2018, 11(1): 172. |
| [68] | Seto M, Masai E, Ida M, Hatta T, Kimbara K, Fukuda M, Yano K. Multiple polychlorinated biphenyl transformation systems in the gram-positive bacterium Rhodococcus sp. strain RHA1. Applied and Environmental Microbiology, 1995, 61(12): 4510-4513. DOI:10.1128/AEM.61.12.4510-4513.1995 |
| [69] | Villalba MS, Alvarez HM. Identification of a novel ATP-binding cassette transporter involved in long-chain fatty acid import and its role in triacylglycerol accumulation in Rhodococcus jostii RHA1. Microbiology, 2014, 160: 1523-1532. DOI:10.1099/mic.0.078477-0 |
| [70] | Holder JW, Ulrich JC, DeBono AC, Godfrey PA, Desjardins CA, Zucker J, Zeng Q, Leach AL, Ghiviriga I, Dancel C. Comparative and functional genomics of Rhodococcus opacus PD630 for biofuels development. PLoS Genet, 2011, 7(9): e1002219. DOI:10.1371/journal.pgen.1002219 |
| [71] | Xie SX, Sun S, Lin FR, Li MZ, Pu YQ, Cheng YB, Xu B, Liu ZH, da Costa Sousa L, Dale BE. Mechanism-guided design of highly efficient protein secretion and lipid conversion for biomanufacturing and biorefining. Advanced Science, 2019, 6(13): 1801980. |
| [72] | Xie SX, Sun QN, Pu YQ, Lin FR, Sun S, Wang X, Ragauskas AJ, Yuan JS. Advanced chemical design for efficient lignin bioconversion. Acs Sustainable Chemistry & Engineering, 2017, 5(3): 2215-2223. |
| [73] | Zhao C, Xie SX, Pu YQ, Zhang R, Huang F, Ragauskas AJ, Yuan JS. Synergistic enzymatic and microbial lignin conversion. Green Chemistry, 2016, 18(5): 1306-1312. DOI:10.1039/C5GC01955A |
| [74] | Jin M, Slininger PJ, Dien BS, Waghmode S, Moser BR, Orjuela A, Sousal LdC, Balan V. Microbial lipid-based lignocellulosic biorefinery:feasibility and challenges. Trends in Biotechnology, 2015, 33(1): 43-54. DOI:10.1016/j.tibtech.2014.11.005 |
| [75] | Kosa M, Ragauskas AJ. Lignin to lipid bioconversion by oleaginous Rhodococci. Green Chemistry, 2013, 15(8): 2070-2074. DOI:10.1039/c3gc40434j |
| [76] | Hernandez MA, Comba S, Arabolaza A, Gramajo H, Alvarez HM. Overexpression of a phosphatidic acid phosphatase type 2 leads to an increase in triacylglycerol production in oleaginous Rhodococcus strains. Applied Microbiology and Biotechnology, 2015, 99(5): 2191-2207. DOI:10.1007/s00253-014-6002-2 |
| [77] | MacEachran DP, Sinskey AJ. The Rhodococcus opacus TadD protein mediates triacylglycerol metabolism by regulating intracellular NAD(P)H pools. Microbial Cell Factories, 2013, 12(104): 1475-2859. |
| [78] | Sainsbury PD, Hardiman EM, Ahmad M, Otani H, Seghezzi N, Eltis LD, Bugg TDH. Breaking down lignin to high-value chemicals:the conversion of lignocellulose to vanillin in a gene deletion mutant of Rhodococcus jostii RHA1. Acs Chemical Biology, 2013, 8(10): 2151-2156. DOI:10.1021/cb400505a |
| [79] | Sainsbury PD, Mineyeva Y, Mycroft Z, Bugg TDH. Chemical intervention in bacterial lignin degradation pathways:Development of selective inhibitors for intradiol and extradiol catechol dioxygenases. Bioorganic Chemistry, 2015, 60: 102-109. DOI:10.1016/j.bioorg.2015.05.002 |
| [80] | Yang WW, Tang HZ, Ni J, Wu QL, Hua DL, Tao F, Xu P. Characterization of two streptomyces enzymes that convert ferulic acid to vanillin. PLoS One, 2013, 8(6): e67339. DOI:10.1371/journal.pone.0067339 |
| [81] | Sharma RK, Mukhopadhyay D, Gupta P. Microbial fuel cell-mediated lignin depolymerization:a sustainable approach. Journal of Chemical Technology and Biotechnology, 2019, 94(3): 927-932. DOI:10.1002/jctb.5841 |
| [82] | Wu WH, Dutta T, Varman AM, Eudes A, Manalansan B, Loque D, Singh S. Lignin valorization:two hybrid biochemical routes for the conversion of polymeric lignin into value-added chemicals. Scientific Reports, 2017, 7: 8420. DOI:10.1038/s41598-017-07895-1 |
| [83] | Becker J, Kuhl M, Kohlstedt M, Starck S, Wittmann C. Metabolic engineering of Corynebacterium glutamicum for the production of cis, cis-muconic acid from lignin. Microbial Cell Factories, 2018, 17(1): 115. DOI:10.1186/s12934-018-0963-2 |
| [84] | Barton N, Horbal L, Starck S, Kohlstedt M, Luzhetskyy A, Wittmann C. Enabling the valorization of guaiacol-based lignin:Integrated chemical and biochemical production of cis, cis-muconic acid using metabolically engineered Amycolatopsis sp ATCC 39116. Metabolic Engineering, 2018, 45: 200-210. DOI:10.1016/j.ymben.2017.12.001 |
| [85] | Salvachua D, Johnson CW, Singer CA, Rohrer H, Peterson DJ, Black BA, Knapp A, Beckham GT. Bioprocess development for muconic acid production from aromatic compounds and lignin. Green Chemistry, 2018, 20(21): 5007-5019. DOI:10.1039/C8GC02519C |
| [86] | Kohlstedt M, Starck S, Barton N, Stolzenberger J, Selzer M, Mehlmann K, Schneider R, Pleissner D, Rinkel J, Dickschat JS, Venus J, van Duuren JBJH, Wittmann C. From lignin to nylon:Cascaded chemical and biochemical conversion using metabolically engineered Pseudomonas putida. Metabolic Engineering, 2018, 47: 279-293. DOI:10.1016/j.ymben.2018.03.003 |
| [87] | Sonoki T, Takahashi K, Sugita H, Hatamura M, Azuma Y, Sato T, Suzuki S, Kamimura N, Masai E. Glucose-free cis, cis-muconic acid production via new metabolic designs corresponding to the heterogeneity of lignin. Acs Sustainable Chemistry & Engineering, 2018, 6(1): 1256-1264. |
| [88] | Jung DH, Kim EJ, Jung E, Kazlauskas RJ, Choi KY, Kim B-G. Production of p-hydroxybenzoic acid from p-coumaric acid by Burkholderia glumae BGR1. Biotechnology and Bioengineering, 2016, 113(7): 1493-1503. DOI:10.1002/bit.25908 |
| [89] | Kirk TK, Farrell RL. Enzymatic "combustion":the microbial degradation of lignin. Annual Review of Microbiology, 1987, 41: 465-505. DOI:10.1146/annurev.mi.41.100187.002341 |
| [90] | Renders T, Van den Bosch S, Koelewijn S-F, Schutyser W, Sels B. Lignin-first biomass fractionation:the advent of active stabilisation strategies. Energy & Environmental Science, 2017, 10(7): 1551-1557. |
| [91] | Deuss PJ, Scott M, Tran F, Westwood NJ, de Vries JG, Barta K. Aromatic monomers by in situ conversion of reactive intermediates in the acid-catalyzed depolymerization of lignin. Journal of the American Chemical Society, 2015, 137(23): 7456-7467. DOI:10.1021/jacs.5b03693 |
| [92] | Wang YX, Liu Q, Yan L, Gao YM, Wang Y, Wang WD. A novel lignin degradation bacterial consortium for efficient pulping. Bioresource Technology, 2013, 139: 113-119. DOI:10.1016/j.biortech.2013.04.033 |
| [93] | Raj A, Reddy MMK, Chandra R, Purohit HJ, Kapley A. Biodegradation of kraft-lignin by Bacillus sp isolated from sludge of pulp and paper mill. Biodegradation, 2007, 18(6): 783-792. DOI:10.1007/s10532-007-9107-9 |
| [94] | Geib SM, Filley TR, Hatcher PG, Hoover K, Carlson JE, Jimenez-Gasco MdM, Nakagawa-Izumi A, Sleighter RL, Tien M. Lignin degradation in wood-feeding insects. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(35): 12932-12937. DOI:10.1073/pnas.0805257105 |
| [95] | Taylor C, Hardiman E, Ahmad M, Sainsbury P, Norris P, Bugg T. Isolation of bacterial strains able to metabolize lignin from screening of environmental samples. Journal of Applied Microbiology, 2012, 113(3): 521-530. DOI:10.1111/j.1365-2672.2012.05352.x |
| [96] | Numata K, Morisaki K. Screening of marine bacteria to synthesize polyhydroxyalkanoate from lignin:contribution of lignin derivatives to biosynthesis by Oceanimonas doudoroffii. Acs Sustainable Chemistry & Engineering, 2015, 3(4): 569-573. |
| [97] | Riesenfeld CS, Schloss PD, Handelsman J. Metagenomics:Genomic analysis of microbial communities. Annual Review of Genetics, 2004, 38: 525-552. DOI:10.1146/annurev.genet.38.072902.091216 |
| [98] | Fernandez-Fueyo E, Ruiz-Due?as FJ, Ferreira P, Floudas D, Hibbett DS, Canessa P, Larrondo LF, James TY, Seelenfreund D, Lobos S. Comparative genomics of Ceriporiopsis subvermispora and Phanerochaete chrysosporium provide insight into selective ligninolysis. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(14): 5458-5463. DOI:10.1073/pnas.1119912109 |
| [99] | Khalil AS, Collins JJ. Synthetic biology:applications come of age. Nature Reviews Genetics, 2010, 11(5): 367-379. DOI:10.1038/nrg2775 |
| [100] | Salvachúa D, Katahira R, Cleveland NS, Khanna P, Resch MG, Black BA, Purvine SO, Zink EM, Prieto A, Martínez MJ. Lignin depolymerization by fungal secretomes and a microbial sink. Green Chemistry, 2016, 18(22): 6046-6062. DOI:10.1039/C6GC01531J |
| [101] | Xie SX, Li Q, Karki P, Zhou FJ, Yuan JS. Lignin as renewable and superior asphalt binder modifier. Acs Sustainable Chemistry & Engineering, 2017, 5(4): 2817-2823. |
| [102] | Li Q, Xie SX, Serem WK, Naik MT, Liu L, Yuan JS. Quality carbon fibers from fractionated lignin. Green Chemistry, 2017, 19(7): 1628-1634. DOI:10.1039/C6GC03555H |
| [103] | Wang P, Ye H, Yin YX, Chen H, Bian YB, Wang ZR, Cao FF, Guo YG. Fungi enabled synthesis of ultrahigh surface area porous carbon. Advanced Materials, 2019, 31(4): 1805134. DOI:10.1002/adma.201805134 |
