0 引言
【研究意义】自20世纪90年代转Bt基因棉花在中国大面积商业种植以来,其靶标鳞翅目害虫如棉铃虫(Helicoverpa armigera)等得到有效控制,棉田化学农药的施用频率及使用量大幅度降低,从而使得棉田害虫的生态位发生了一系列的演替变化,绿盲蝽(Apolygus lucorum)已上升成为长江及黄河流域棉区上的主要致灾性害虫[1-3]。目前,防治绿盲蝽主要以化学农药为主,但也随之带来了诸多问题,如抗药性的产生导致防治效果下降、污染环境及食品安全等[4]。因此绿盲蝽的防控减灾亟需开拓基于新靶标的有效技术。与化学农药相比,昆虫生长调节剂类杀虫剂具有高毒力且与环境友好的优点[5],其作用机理多为干扰昆虫蜕皮激素或保幼激素,导致昆虫不能蜕皮而死亡[6]。【前人研究进展】类固醇激素 20-羟基蜕皮酮(20-hydroxyecdysone,20E)是昆虫蜕皮激素的主要活性形式,在昆虫的变态发育过程中起着重要的调控作用[7]。已有研究表明,昆虫蜕皮激素受体(ecdysone receptors,EcR)为20E的作用靶标受体,在蜕皮激素信号传导中扮演着关键角色[8]。昆虫EcR隶属于核受体(nuclear receptor,NR)基因家族,该家族通常具有5个模块结构域:A/B域(反式调控域)、C域(DNA结合域,DNA binding domain,DBD)、D域、E域(配体结合域,ligand binding domain,LBD)和F域[9],其中C域及E域相对保守,且C域含有2个锌指结构[10]。迄今,已经明确了20E与其受体在调控昆虫蜕皮时的分子机制,EcR首先与20E结合形成一个配体-受体复合物,再与USP(超气门蛋白,另一个20E核受体)结合形成 20E-EcR-USP异源二聚体来行使生理功能[11]。此异源二聚体可对昆虫血淋巴中的蜕壳启动激素(ecdysis-triggering hormone,ETH)进行双重调控,当昆虫血淋巴中20E滴度下降后,羽化激素(eclosion hormone,EH)可促进ETH的分泌,最终使得ETH启动昆虫的蜕皮过程[12]。20E-EcR-USP绑定形成的配体-受体复合物引发20E初级应答基因的表达,由20E初级反应基因诱导表达的20E次级应答基因级联放大20E信号[13],从而在基因组途径上调控昆虫蜕皮、变态及生殖等重要生理过程。【本研究切入点】昆虫EcR自身在外源20E诱导下的应答反应如何,目前还不清晰。【拟解决的关键问题】在笔者实验室前期克隆获得的绿盲蝽蜕皮激素受体AlEcR-A基础上,分析其在外源20E诱导后的AlEcR-A mRNA表达量的变化趋势,及利用原核细胞表达系统,进行重组表达获得纯化蛋白,通过小鼠免疫、细胞融合获得特异性的AlEcR-A单克隆抗体,进一步分析外源20E诱导后AlEcR-A蛋白表达的差异。为在蛋白水平上进一步研究EcR的功能打下基础,同时也可为丰富20E信号传导的网络图谱提供依据。1 材料与方法
试验于2015年4月至2016年5月在江苏省农业科学院植物保护研究所完成。1.1 供试昆虫
初始绿盲蝽虫源采自江苏大丰及东台早春蚕豆(Vicia faba)田,于室内用四季豆(Phaseolus vulgaris)豆荚继代饲养,饲养条件为温度(25±1)℃,相对湿度70%±5%,光周期12L:12D,成虫期补充10%蜂蜜水。1.2 主要试剂与仪器
20E为Sigma公司产品,SYBR Premix Ex Taq Kit为TaKaRa产品,iCycler iQ为Bio-Rad产品,原核表达载体pCzn1、大肠杆菌Arctic express菌株、SP2/0细胞株及含有AlEcR-A的T载体均为笔者实验室前期保存,6—8周龄雌性BALB/c小鼠购于扬州大学兽医学院,限制性内切酶Nde I和Xba I,dNTPs,IPTG,Acr、Bis、Tris、ExTaq酶,质粒提取试剂盒及PEG为Sigma产品。Pfu DNA聚合酶为Zoonbio公司产品,卡那霉素、咪唑、尿素为上海生工工程生物公司产品,DNA胶纯化试剂盒、质粒小提试剂盒为AnyGen公司产品,TEMED为Bio-Rad公司产品,Tyrptone、Yeast Extract为Oxoid公司产品,Ni2+IDA亲和层析胶为Novagen公司产品,组织蛋白提取试剂盒为南京钟鼎公司产品。其余所需各种试剂、药品均为国产分析纯。1.3 AlEcR-A在大肠杆菌Arctic Express中的表达及纯化
1.3.1 重组蛋白AlEcR-A的诱导表达 Nde I和Xba I双酶切含有AlEcR-A的T载体及pCzn1载体,DNA Fragment Purification Kit回收,T4 DNA连接酶大片段连接。将上述阳性重组质粒转入大肠杆菌Arctic Express克隆菌株中,挑取阳性克隆子后,将1 μL质粒加入100 μL感受态细胞,冰孵20 min,42℃热激90 s后迅速置冰中5 min;最后加入600 μL LB培养液,37℃ 220 r/min振摇1 h后离心,涂布于含50 μg·mL-1 Amp的LB平板后培养过夜。挑取单个菌落接种于含50 μg·mL-1 Amp的3 mL LB培养基中,37℃ 220 r/min培养过夜,次日按1:100的比例接种于LB培养基中,37℃ 220 r/min振摇至菌体OD600值为0.6—0.8时,取1 mL培养物,10 000 ×g室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀,向剩余的培养物中加入IPTG至终浓度为0.5 mmol·L-1,37℃ 220 r/min振摇4 h,以诱导AlEcR-A-His融合蛋白表达,取1 mL培养物,12 000 ×g室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀,收集菌液,取适量菌液进行SDS-PAGE分析。对照为不加IPTG。
1.3.2 重组蛋白AlEcR-A的亲和纯化 于0℃,6 000×g离心上述菌液10 min后置于lysis buffer中进行沉淀重悬与超声破碎;将超声破碎的细胞裂解液于4℃,10 000×g离心20 min后收集沉淀;用洗涤液(20 mmol·L-1 Tris,1 mmol·L-1 EDTA,2 mol·L-1尿素,1 mol·L-1 NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次;用溶解缓冲液(20 mmol·L-1 Tris,5 mmol·L-1 DTT,8 mol·L-1尿素,pH 8.0),按比例溶解包涵体,将上述溶液滴加20 mmol·L-1 Tris-HCL及5 mmol·L-1 EDTA Buffer(pH 7.8)缓冲液中,逐步成倍梯度稀释缓慢搅拌,将蛋白溶液装入透析袋于PBS(pH 7.4)溶液中透析过夜。
将上述包涵体溶液上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析柱上,用Ni-IDA Binding-Buffer进行冲洗,再用Ni-IDA Washing-Buffer(20 mmol·L-1 Tris-HCl,20 mmol·L-1咪唑,0.15 mol·L-1 NaCl,pH 8.0)进行冲洗,最后用Ni-IDA Elution-Buffer(20 mmol·L-1 Tris-HCl,250 mmol·L-1咪唑,0.15 mol·L-1 NaCl,pH 8.0)洗脱目的蛋白,收集流出液,将上述收集的蛋白溶液用PBS缓冲液(pH 7.4)进行透析过夜。取适量透析液进行SDS-PAGE分析。
1.4 单克隆抗体的制备
1.4.1 免疫 选取5只6—8周龄雌性BALB/c小鼠,于其腹部和背部皮下多点注射上述纯化后的AlEcR-A重组蛋白,注射量为50—100 μg/只。具体方法:用等体积弗氏完全佐剂乳化AlEcR-A重组蛋白,每隔14 d用弗氏不完全佐剂乳化的蛋白免疫2次,2周后加强免疫1次(剂量加倍),四免后采血ELLSA确定血清抗体效价,并利用Western blot检测重组蛋白是否阳性,以进行下一步的细胞融合。1.4.2 建立杂交瘤细胞株 采用聚乙二醇(PEG)介导的融合方法将小鼠脾细胞与骨髓瘤细胞SP2/0进行融合[14]。融合后4 d查看杂交瘤细胞株的克隆率,将ELLSA法检测为阳性的杂交瘤细胞株进行亚克隆,有限稀释法克隆3次,待阳性杂交瘤细胞稳定分泌抗体后扩增培养定株。
1.4.3 制备腹水 将0.2 mL弗氏不完全佐剂注射至小鼠腹腔,于7 d后再注入适量的上述阳性杂交瘤细胞后收集腹水。
1.5 单克隆抗体的鉴定
1.5.1 抗体的纯化 将腹水与PBS按1:1混匀后缓慢上样置层析柱(蛋白A琼脂糖介质填装),待抗体结合后用甘氨酸洗脱缓冲液洗脱,立即在PBS中进行4℃透析过夜,隔日进行纯度、浓度和效价检测。1.5.2 Western blot检测单克隆抗体的特异性 Western blot测定方法按照SONG等[15]的方法进行并稍作修改。将原核表达的AlEcR-A重组蛋白及新鲜孵化的绿盲蝽3龄若虫进行SDS-PAGE分析。转印PVDF膜后封闭,一抗为上述制备的蛋白抗体,二抗为辣根过氧化物酶标记的羊抗鼠HRP。
1.6 20E微注射处理
蒸馏水溶解20E,配置成1.0 mg·mL-1母液后置于-20℃储存待用。于新鲜孵化的2龄若虫第一腹足注射20E,浓度为4 μg/头。每处理60头绿盲蝽若虫,3次重复,以注射蒸馏水为对照(Control组),注射后每隔1 d取样,共取8次,用于后续的AlEcR-A mRNA及蛋白表达量分析。1.7 Western blot分析AlEcR-A蛋白表达差异
将上述20E处理后的不同日龄绿盲蝽用组织蛋白提取试剂盒提取总蛋白,并用二奎琳甲酸法测定其浓度。Western blot测定方法同1.5。1.8 荧光定量PCR
TRIzol法提取各处理的绿盲蝽RNA样本, MMLV Reverse Transcriptase合成cDNA模板后进行RNase处理,-20℃保存待用。根据本实验前期克隆得到的AlEcR-A(KM401656)设计RT-PCR引物,具体为ALEcR-A-F:GGGCAGACGATGACTGGATG,ALEcR-A-R:GTAGCTGTTGCTGGACATAGTTG;并设定Al-β-Actin(JN616391)为内参基因:具体为AL-β-actin-F:ACCTGTACGCCAACACCGT,AL-β- actin-R:TGGAGAGAGAGGCGAGGAT。RT-PCR试验步骤按照SYBR Premix Ex Taq Kit说明书上进行。扩增程序:原始预变性95℃ 3 min;95℃ 5 s;60℃ 10 s;循环40次。每个样品设置3个独立的生物学重复,每个生物学重复设置5个技术重复,计算方法为2-ΔΔCt法[16]。1.9 数据分析
不同处理的绿盲蝽AlEcR-A相对表达量变化以2-ΔΔCt计算。差异显著性采用统计软件SAS 8.0中的Duncan’s新复极差法进行分析。2 结果
2.1 原核表达载体pCzn1-AlEcR-A的构建及重组AlEcR-A蛋白的表达
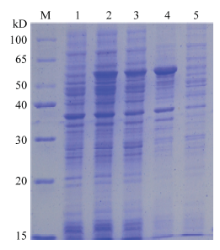
测序结果表明,T4 DNA连接酶可将经双酶切后的表达载体pCzn1及含有AlEcR-A序列的T载体大面积连接,表明重组质粒AlEcR-A已经亚克隆到pCzn1载体上,将其命名为pCzn1-AlEcR-A(图1)。随后将其转化至大肠杆菌Arctic Express表达菌株中,对在37℃培养下的pCzn1-AlEcR-A重组载体的蛋白表达情况进行了分析。SDS-PAGE电泳显示,经0.5 mmol·L-1 IPTG诱导的pCzn1-AlEcR-A重组质粒可特异性表达一个约55 kD的蛋白,与理论大小相符,说明AlEcR-A已在大肠杆菌Arctic Express细胞中成功表达,而不经IPTG诱导的pCzn1-AlEcR-A重组质粒无此条带的蛋白表达。此外,此诱导表达的重组AlEcR-A蛋白主要分布在沉淀体中,上清液中几乎没有表达,说明AlEcR-A重组蛋白主要以包涵体的形式存在(图2)。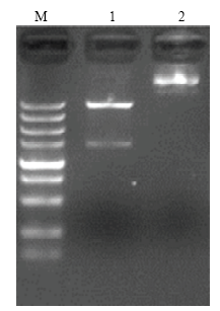 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1AlEcR-A原核表达质粒双酶切PCRM:DL10000;1:酶切前质粒Plasmid before enzyme digestion;2:酶切后质粒Plasmid after enzyme digestion
-->Fig. 1PCR of recombinant plasmid of AlEcR-A
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2pCzn1-AlEcR-A诱导表达的SDA-PAGE分析M:蛋白分子量标准物Protein molecular weight marker;1:对照(无IPTG诱导、沉淀)Un-induced (without IPTG induction, precipitate);2:37℃过夜培养(总蛋白1) Overnight culture of 37℃ (total protein 1);3:37℃过夜培养(总蛋白2)Overnight culture of 37℃ (total protein 2);4:37℃过夜培养(沉淀)Overnight culture of 37℃ (precipitate);5:37℃过夜培养(上清液)Overnight culture of 37℃ (supernatant)
-->Fig. 2SDS-PAGE analysis of pCzn1-AlEcR-A expression induced by IPTG
-->
2.2 重组蛋白的Ni柱亲和纯化
利用SDS-PAGE电泳分析了经Ni柱亲和纯化后pCzn1-AlEcR-A基因重组蛋白的纯化情况。经缓冲液洗脱、透析后,上述含有pCzn1-AlEcR-A基因重组蛋白的包涵体纯度有较大程度的改善,仅在55 kD附近有一条明显的特异性条带,并未见其他条带,说明已得到纯化的AlEcR-A重组蛋白 (图3)。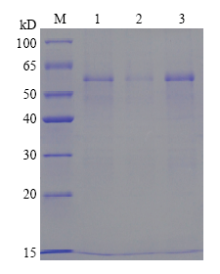 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3pCzn1-AlEcR-A蛋白的分子筛纯化M:蛋白分子量标准物Protein molecular weight marker;1:未纯化的包涵体Un-purified inclusion body;2:未与Ni柱结合的杂蛋白Miscellaneous protein un-combined with Ni;3:与Ni柱结合的目的蛋白Protein combined with Ni
-->Fig. 3The molecular sieve purification of pCzn1-AlEcR-A
-->
2.3 抗AlEcR-A蛋白单克隆抗体杂交瘤细胞株的建立
用上述制备的重组蛋白pCzn1-AlEcR-A免疫小鼠,细胞融合4 d后发现,包被抗原的细胞株阳性克隆率均达到了100%,且不同时期收集的杂交瘤细胞上清的OD450 nm值几乎没有变化。将得到的能稳定分泌抗AlEcR-A蛋白的单克隆抗体杂交瘤细胞株,命名为8H7,进而扩增培养定株,以进行下一步的抗体特异性鉴定。2.4 AlEcR-A蛋白单克隆抗体的特异性鉴定
ELISA检测效价结果显示,细胞株8H7的腹水效价达到了5.12×105。Western blot分析表明,所制备的单克隆抗体不仅能与绿盲蝽总蛋白结合,还可特异性与AlEcR-A重组蛋白反应(图4),且条带大小一致,说明制备的AlEcR-A单克隆抗体准确、有效,可以用于后续的Western blot检测。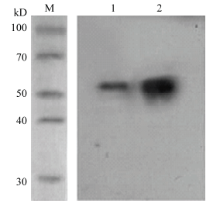 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4单克隆抗体的Western blot特异性分析M:蛋白分子量标准物Protein molecular weight marker;1:3龄绿盲蝽若虫3rd instar nymph;2:重组蛋白
-->Fig. 4Western blot analysis of monoclonal antibodies against the expressed AlEcR-A proteinpCzn1-AlEcR-A Recombinant protein pCzn1-AlEcR-A
-->
2.5 外源20E对绿盲蝽AlEcR-A mRNA含量的影响
RT-PCR结果表明,与注射蒸馏水相比,外源20E处理的绿盲蝽AlEcR-A相对表达量均显著或极显著升高(P<0.05或0.01)。在处理的8 d内,外源20E处理的AlEcR-A相对表达量分别为1.15、1.25、1.32、1.35、1.43、1.63、1.66和1.61,说明随着处理时间的延长,AlEcR-A相对表达量的增值幅度也逐渐增高,且在20E处理后的第7天达到峰值(图5),20E有诱导绿盲蝽AlEcR-A mRNA表达的作用。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同处理对AlEcR-A相对表达量的影响数据为平均值±标准误;柱上标注的不同字母表示同一天AlEcR-A相对表达量差异显著或极显著
-->Fig. 5The relative expressions of AlEcR-A in different treatmentsThe histogram bars represented mean±SE of at least three replicates. Different letters above each bar indicated statistical difference based on Duncan’s Multiple Comparison test
-->
2.6 外源20E对绿盲蝽AlEcR-A蛋白含量的影响
Western blot结果表明,随着20E处理时间的延长,绿盲蝽AlEcR-A蛋白表达量呈现出逐渐上升的趋势。此外,与蒸馏水处理组(CK)相比,20E处理的绿盲蝽AlEcR-A蛋白表达量均有一定富集效果,且注射蒸馏水处理组(CK)的AlEcR-A蛋白表达量的变化趋势与其mRNA相对表达量趋势较为一致(图6),20E有诱导绿盲蝽AlEcR-A蛋白表达的作用。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同处理对AlEcR-A蛋白表达量的影响
-->Fig. 6The protein expressions of AlEcR-A in different treatments
-->
3 讨论
可溶性蛋白质的异源表达已经有较多的表达系统可用,目前很多可溶性蛋白以融合蛋白的形式得到成功表达[17-19]。本研究在前期保存在含有完整AlEcR-A T载体的基础上,通过原核表达载体构建、IPTG诱导表达、Ni亲和纯化、小鼠免疫、细胞融合及腹水制备等技术手段,成功制备了绿盲蝽AlEcR-A的单克隆抗体,发现IPTG能够很好地诱导重组pCzn1- AlEcR-A质粒的表达,但主要以包涵体的形式存在。SDS-PAGE结果表明,经Ni柱的包涵体进行亲和纯化后,重组pCzn1-AlEcR-A质粒纯度可明显提高(图3),且无需经过尿素的变性和复性,避免了蛋白在此过程中活性的降解和产量的降低。单克隆抗体的成功制备需要良好的免疫原和稳定的筛选方法,在AlEcR-A单克隆抗体筛选过程中,以重组质粒pCzn1-AlEcR-A作为初始免疫制得的AlEcR-A蛋白单克隆抗体的细胞株,ELISA检测显示,该细胞株的腹水效价较高,Western blot分析结果也表明该单克隆抗体可同时与绿盲蝽总蛋白及AlEcR-A重组蛋白特异性结合(图4),可用于检测绿盲蝽体内AlEcR-A蛋白的丰度变化。由于A/B域的碱基差异,昆虫EcR基因分为 A、B1和B2这3个亚型蛋白,目前仅黑腹果蝇(Drosophila melanogaster)中发现同时存在3个亚型蛋白[20],而在其他昆虫中仅存在A型或B型。本试验的昆虫绿盲蝽中也存在A和B两种亚型蛋白[21-22]。近年来,针对昆虫蜕皮激素与EcR之间的互作机制越来越受到研究者的重视,尤其在它们的转录调控下游靶基因的机制获得了许多重要突破。研究表明,EcR-USP异源二聚体在分子伴侣蛋白复合物Hsp90和Hsc70的协助下才能获得DNA结合活性[23]。此外,20E需要通过解除共阻遏因子和募集共激活因子来激活EcR-USP异源二聚体并启动下游基因的转录[24]。研究还表明,蛋白激酶C(protein kinase)是一种昆虫蜕皮激素的细胞膜受体,在传递20E信号中的功能也可发挥重要作用[25]。此外,20E还能激活一种非基因组途径——钙离子/钙调蛋白来调控下游基因的表达[26]。上述的研究均侧重于20E传导过程中各种受体对其下游基因的影响,或者是进行了20E信号网络中各种影响因子的功能鉴定,而在这过程中,这些受体自身在20E诱导下的表达模式如何,如受体的mRNA及蛋白的表达目前还未见报道。前人研究结果表明,昆虫EcR的表达丰度与体内20E滴度息息相关,家蚕(Bombyx mori)丝腺中的EcR只有在20E滴度超过5 ng·mL-1时才启动转录[27]。在本研究中,对照处理组绿盲蝽AlEcR-A的mRNA及蛋白表达量表现为波浪线的变化趋势,由于本试验绿盲蝽为2龄初孵若虫,其平均若虫龄期为1.6、2.2、1.8和3.2 d(2—5龄若虫)[28],其表达量上升的时间正是绿盲蝽蜕皮的节点,一般来说,昆虫蜕皮时其体内的蜕皮激素含量较高。因此,绿盲蝽AlEcR-A mRNA及蛋白表达量有明显的龄期表达特性,即在其蜕皮时,EcR表达量显著上升。此外,本研究还发现,绿盲蝽AlEcR-A的mRNA表达量及蛋白表达量均可受到外源20E的诱导,呈现出表达量显著上升的趋势,再次证实了EcR是昆虫蜕皮激素的作用靶标,下一步的研究应着重进行20E的细胞膜受体的鉴定及其在20E信号传导中的功能分析。
4 结论
获得了AlEcR-A原核表达的纯化蛋白,制备了高特异性的AlEcR-A单克隆抗体,进一步明确了外源20E有诱导AlEcR-A mRNA及蛋白表达的作用。The authors have declared that no competing interests exist.
