0 引言
【研究意义】生殖细胞在生命循环和传承中有着不可替代的作用,因为其可以将遗传信息传递至下一代,这一特性使其迅速成为生命科学研究的重要课题之一。多年来,科研工作者一直致力于将ESC体外诱导分化为生殖细胞,以解决不孕不育的问题,并通过生殖细胞的研究来探索细胞增殖、分化和发育的调控机制[1]。【前人研究进展】细胞增殖、分化和发育与细胞内代谢水平息息相关,蛋白质代谢在细胞分化过程中具有重要的作用。韩明权[2]等在研究药物对肿瘤细胞的抑制效应时发现,肿瘤细胞的蛋白质代谢失常,S+G2/M期细胞比例降低,从而影响了肿瘤细胞的分化和增殖情况;Fei等[3-6]分别发现Smad 蛋白家族是细胞内重要的信号转导蛋白,在多种细胞分化和转分化过程具有重要的调控作用。TAN等[7]在研究精氨酸对新生仔猪小肠细胞的影响时发现,外源添加精氨酸能够调节新生仔猪体内精氨酸代谢,从而影响小肠细胞的增殖、分化和功能。这些研究都充分说明蛋白质代谢在细胞的增殖、分化和发育过程中扮演非常重要的作用。【本研究切入点】因此,本研究基于前期RNA-Seq深度测序的基础上,通过WEGO分析(http://wego.genomics.org.cn/cgi-bin/wego/index.pl)和KEGG(http://www.funnet.ws/)通路显著富集分析筛选与蛋白质代谢相关的通路和关键性差异基因,并对关键基因进行体内和体外抑制,旨在初步探究蛋白质代谢及其关键基因对雄性生殖细胞分化的调节机制,为建立固定、规范、有效的体外细胞诱导体系打下良好的基础。【拟解决的关键问题】本试验初步探究蛋白质代谢通路对雄性生殖细胞分化的影响,还需要通过RNA干扰、基因敲除或敲入、免疫共沉淀等一系列的方法进一步探究其具体的作用机制。1 材料与方法
1.1 实验材料和试剂
试验于2012年8月24日分离细胞起至2014年12月20日完成稿件,于扬州大学推广楼320课题组完成。试验受精蛋来自中国农业科学院家禽研究所实验禽场如皋黄鸡群,共使用18 340枚,分3个重复组,在37.5°C,相对湿度为60%的条件下孵化。孵化分期采用文献[12]和[13]建立的方法。DMEM培养液(Gibco)、小牛血清(Gibco)、丝裂霉素-C(Roche)、β-琉基乙醇(BBI)、鸡血清、L-谷氨酰胺、丙酮酸钠、胰蛋白酶、胶原酶I、碱性成纤维生长因子(bFGF)、人胰岛素样生长因子(hIGF)、人干细胞因子(hSCF)、小鼠白血病抑制因子(mUF)均源自Sigma公司、NOS2抑制剂S-Methylisothiourea sulfate(Santa Cruz)、维甲酸(RA)(Sigma)。
1.2 试验方法
1.2.1 鸡ESCs的分离、培养、传代及分选 ESCs的分离、培养及传代方法参见文献[13, 14]的方法。采用PCR方法对其进行雌雄鉴定,以排除雌性样本的干扰。
采用流式细胞分选技术,对运用抗体标记的ESC、PGC和SSC进行分选,确保获得高纯度的细胞。其中选择SSEA-1、SOX2干细胞表面特异抗原及分子标记物标记ESC,酪氨酸激酶受体C-kit及SSEA-1标记PGC,精原干细胞重要表面标志integrin α6及integrinβ1双重标记SSC。
1.2.2 RNA-Seq 参照Illumina公司mRNA-Seq步骤进行RNA建库,在上海欧易生物医学科技有限公司公司使用Illumina公司HisSeq2000进行测序,上样量为50ng。测序结果同数据库进行比对注释后,进行后续试验分析。RNA标准为RIN≥7,28S/18S>0.7。
1.2.3 QRT-PCR检测 利用RNeasy kit试剂盒提取细胞总RNA,并反转录成cDNA,以此为模版进行RT-qPCR。按照荧光定量PCR试剂盒说明,使用SYBR荧光试剂和7900 System荧光定量仪器进行Real-time PCR试验,最后在Microsoft Excel软件内用2-ΔΔCt相对定量法分析试验数据。引物具体信息见表1。
Table 1
表1
表1RT-QPCR相关基因的引物
Table 1Primers of related genes in RT-qPCR
| 基因名 Gene name | 引物序列(5′-3′) Squence of Primer (5′-3′) | 大小 Size(bp) | |
|---|---|---|---|
| LOC776984 | F: TGTCCCAGCCCTATGGTGAGC | R: GGGGGAAGATGGTGATGGCCGACAG | 150 |
| P4Hα3 | F: GGCTCCACTGCCTTCATCTA | R: TTGTTTGCCACCCACTTGT | 155 |
| P5CSL | F: GCCCTACATCAACATCCACA | R: GTCTCCAGCAGCATCTTCG | 168 |
| NOS2 | F: TTGAATACCCGCCAGAGATTA | R: CGTTGAAAGGACACGCAGTA | 156 |
| HGD | F: TCCTCCCTCAGTATGGCTGT | R: GGTTTCCCTGTCTTCGTTCA | 164 |
| FAH | F: GCCAGCACACATTGGAGATT | R: GGATACCACAACGGAAGACG | 157 |
| IDO | F: GTCAGGGACAGCACCAGAGA | R: GGCAGGGATGGAGGAGTTAG | 144 |
| C-kit | F: GCGAACTTCACCTTACCCGATTA | R: TGTCATTGCCGAGCATATCCA | 150 |
| Cvh | F: AGGAGGACTGGGACACG | R: GCCTCTTGATGCTACCG | 1646 |
| Dazl | F: TGTCTTGAAGGCCTCGTTTG | R: CATATCCTTGGCAGGTTGTTGA | 138 |
| Stra8 | F: CCACGGCTATTTCACACCTCTG | R: GCTCTTGGCAAGCATCCGTA | 114 |
| integrin α6 | F: GAAACCCGGGATATCATTGG | R: CAGCAACACCTTGCTGACAG | 140 |
| integrin β1 | F: TGTTTGTGGGGACCAGATTG | R: CCAGGTGACATTTCCCATCA | 120 |
| β-actin | F: CAGCCATCTTTCTTGGGTAT | R: CTGTGATCTCCTTCTGCATCC | 164 |
新窗口打开
1.2.4 NOS2体内、外抑制试验
1.2.4.1 NOS2体内抑制试验 取刚受精的鸡胚,注射方法参考文献[15],分组情况为:①空白组:不经任何处理,直接孵化;②对照组:中端注射100 μL ddH2O;③ 抑制组:中端注射100 μL 1μmol·L-1的NOS2抑制剂。分别取各组第0天的鸡胚、第5.5天的生殖脊、第18天的睾丸组织,提取RNA,反转录为cDNA,RT-qPCR检测NOS2、C-kit、Cvh、Stra8、Dazl、integrin
α6和integrin β1等基因的mRNA表达情况。
1.2.4.2 NOS2体外抑制试验 取培养至2代鸡ESCs,分组情况为:①对照组:添加普通培养基;②RA诱导组:采用RA诱导;③抑制剂组:对照组的基础上添加1μmol·L-1的:④RA+抑制剂组:在RA诱导的基础上添加工作液浓度1μmol·L-1的抑制剂。观察各组第2、4、6、8和10天的细胞的形态变化,并分别取各组第2、4、6、8和10天的细胞,提取RNA,反转录为cDNA,RT-qPCR检测NOS2、C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等基因的mRNA表达情况。
1.2.5 数据处理 所有数据以均数±标准误(X± SEM)表示,应用GraphPad Prism5 统计学软件,采用两样本均数间t检验的方法,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果
2.1 RNA-Seq分析
在ESC vs PGC和PGC vs SSC两组中分别存在7 967和6 496个差异基因,通过VENNY(http:// bioinfogp. cnb.csic.es/tools/venny/)分析发现,有3 580个差异基因同参与了雄性生殖细胞分化的整个过程,并通过DAVID(http://david.abcc.ncifcrf.gov/)数据库对其进行GO功能注释分类,发现有697个差异基因参与到生物代谢过程。针对这697个差异基因,再通过KEGG富集通路分析发现,参与雄性生殖细胞整个分化过程的代谢差异基因主要富集于精氨酸-脯氨酸代谢通路、酪氨酸代谢通路和色氨酸代谢通路。3条代谢通路中,在雄性生殖细胞分化的全过程中均差异显著的基因分别有5个(LOC777369、LOC776984、P4Hα3、P5CSL和NOS2)、2个(HGD和FAH)和1个(IDO)(表2)。
Table 2
表2
表2雄性生殖细胞分化过程相关调控差异基因
Table 2Related regulatory genes in differentiation process of male germ cells
| 通路 Pathway | 基因编号 Gene ID | 基因名称 Gene name |
|---|---|---|
| 精氨酸-脯氨酸代谢Arginine-proline metabolic | XM_001236825.1 | LOC777369 |
| XM_001236469.1 | LOC776984 | |
| XM_417248.2 | P4Hα3 | |
| XM_418406.2 | P5CSL | |
| NM_204961.1 | NOS2 | |
| 酪氨酸代谢 Tyrosine metabolic | XM_416553.1 | HGD |
| XM_413855.2 | FAH | |
| 色氨酸代谢 Tryptophan metabolic | XM_424397.2 | IDO |
新窗口打开
2.2 RT-qPCR验证通路基因
针对部分关键基因进行RT-qPCR验证,以其在ESC中表达量为对照,检测出其在PGC和SSC中的相对表达量(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1相关差异基因相对表达量
-->Fig. 1Relative expression of related differentiation genes
-->
根据RT-qPCR结果显示,在ESC分化为SSC的整个阶段中,LOC776984、P4Hα3、P5CSL、HGD、FAH和IDO均先上调后下调,LOC777369和NOS2为先下调后上调。这些基因表达趋势与其在RNA-Seq中的表达趋势基本一致。
2.3 NOS2体内、外抑制
2.3.1 NOS2体内抑制 体内抑制后,针对NOS2及C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因进行RT-qPCR检测,以其在第0天鸡胚的表达量为对照,检测其第5.5天生殖脊、第18天睾丸组织的mRNA表达量,结果显示,NOS2及C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因在空白组和对照组之间无显著性的差异,而在抑制剂组中,NOS2及C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因的mRNA表达量均出现了不同程度的降低,说明NOS2在被抑制后,ESCs向雄性生殖细胞分化过程也受到了抑制(图2)。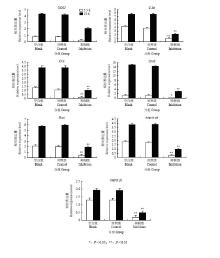 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2体内抑制中NOS2及相关生殖标记基因相对表达变化
-->Fig. 2Relative expression of NOS2 and related reproductive marker genes in inhibitory experitment in vivo
-->
2.3.2 NOS2体外抑制 取传至2代的ESCs进行不同分组处理,每隔2 d进行观察细胞形态变化发现,对照组中,ESCs在2、4、6、8和10 d内细胞不断增殖,但是未出现类胚体;RA诱导组中,2 d出现小的类胚体,4 d类胚体增大,且数量增多,6 d类胚体边缘开始出现破裂,8 d类胚体解体,10 d出现类精原样细胞;抑制剂组中,ESCs在2、4、6、8和10d内无类胚体出现,且相较于对照组细胞增殖缓慢;RA+抑制剂组中,2和4 d内无类胚体出现,细胞增殖缓慢,6d出现小的类胚体,8d类胚体数量少量增多,且体积稍显增大,10d类胚体开始裂解。说明NOS2在被抑制后,ESCs向雄性生殖细胞分化过程受到阻碍(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同处理组不同天数的ESCs形态变化
-->Fig. 3Morphological observation of chicken ESCs on different days among different groups (400×)
-->
每隔2 d分别取以上不同分组的细胞,提取细胞RNA,NOS2及C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因进行RT-qPCR检测,结果发现,经过抑制剂的抑制后,NOS2及C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因的表达量在RA诱导组、抑制剂组和RA+抑制剂组中相对于对照组均呈显著性或极显著性的下调趋势,这说明NOS2在受到抑制剂抑制后,ESCs向雄性生殖细胞的分化受到抑制(图4)。
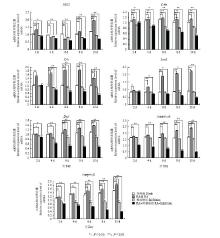 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4体外抑制中NOS2及相关生殖标记基因相对表达变化
-->Fig. 4Relative expression of NOS2 and related reproductive marker genes in inhibitory experitment in vitro
-->
3 讨论
鸡雄性生殖细胞的增殖、分化和发育与其各类代谢过程密切相关,目前已有报道称BMP4/Smad蛋白通路[16-17]、RA代谢[18]等通路对雄性生殖细胞的增殖、分化、迁移、凋亡具有重要的作用。在这些代谢过程中,蛋白质是生物细胞赖以生存的各种代谢和调控途径的主要执行者,因此蛋白质的代谢对于雄性生殖细胞的增殖、分化和发育至关重要。一氧化氮合成酶2(nitric oxide synthase 2,NOS2)与PGCs的发育和正常生殖细胞的分化密切相关。作为Nanos的同系物,NOS2是在秀丽隐杆线虫(C. Elegans)中首次发现,其结构与Nanos结构类似,都包含一个锌指结构域[19-20]。早期的研究发现,NOS2能够在生物体内催化生成NO,低浓度的NO对生殖细胞的的功能具有保护作用,而高浓度的NO反而具有损坏效应,这说明NOS2通过催化生成NO,在生殖细胞的各种活动中可能起重要的作用[21-24]。YUMIKO[25]等发现NOS2能够启动小鼠雄性生殖细胞的分化,而抑制雌性生殖细胞分化;该研究还发现NOS2表达于SSCs中,是精子形成时维持干细胞数量的一个内因;BARRIOS等[26]发现敲除NOS2的雄性小鼠表现不育,原因是由于在胚胎期缺乏生殖细胞,说明NOS2具有维持生殖细胞数量的作用,然而RA可以下调NOS2的表达,进而促进有丝分裂;CHILDS[27]等发现Cyp26b1基因敲除,小鼠胚胎生殖细胞中Stra8的表达急剧上调,从而诱导雄性生殖细胞启动减数分裂,这与TSUDA[28]等在NOS2基因敲除小鼠模型中发生的现象一致;NAKAMURA等[29]在以成年青鳉鱼为动物模型,获得NOS2-eGFP标记的卵源干细胞后发现卵源干细胞能够连续产生具备受精能力的干细胞,说明NOS2对生殖细胞的增殖、分化起到重要作用;KÖPRUNNER等[30]以斑马鱼为试验对象,发现缺少NOS1和NOS2时导致PGCs无法维持其功能,并大量死亡;KÖPRUNNER还发现NOS2在PGCs与性腺有效结合过程中也起到重要作用。这些都说明NOS2在生殖细胞自我增殖及其向SSCs分化中的重要作用。
本研究探索出在ESCs向SSCs分化的整个过程中,蛋白质代谢的主要信号通路是精氨酸-脯氨酸代谢通路、酪氨酸代谢通路以及色氨酸代谢通路,其中有大量的研究表明精氨酸-脯氨酸代谢通路上的关键基因NOS2参与了生殖细胞的各种活动,在此理论基础上,以NOS2特异性抑制剂分别在体内和体外对NOS2进行抑制,结果表明NOS2在被抑制后,引起C-kit、Cvh、Stra8、Dazl、integrin α6和integrin β1等生殖标记基因表达量的显著下降,使得ESCs向SSCs方向的分化明显受到抑制。然而,NOS2对ESCs向生殖方向分化的具体调节机制、以及精氨酸-脯氨酸代谢通路与其他的信号通路是否有互作等问题还需要进一步的探究。
另外,亦有多项研究[31-34]表明,FAH和IDO等基因也参与细胞的增殖、分化及其发育,但尚未有其关于影响雄性生殖细胞生成、分化的报道,因此,关于这些基因的具体调节机理还需进一步探索。
4 结论
本研究基于前期探究出NOS2及其所在的精氨酸-脯氨酸代谢通路在鸡雄性生殖细胞分化过程中起到重要调节作用的基础上,以抑制剂对NOS2进行体内、外的抑制,发现NOS2在被抑制后,ESCs向雄性生殖细胞分化的过程受到抑制。说明了精氨酸-脯氨酸代谢通路及关键基因NOS2对ESCs向雄性生殖细胞分化过程中起到重要的调节作用。The authors have declared that no competing interests exist.
