0 引言
【研究意义】流感病毒是重要的人兽共患传染病病原,可以在不同宿主间循环存在,不断发生突变及重组,严重威胁人类的生命和健康,并对经济造成沉重负担[1]。酵母双杂交技术在筛选与研究与已知蛋白相互作用的未知蛋白方面得到了广泛的应用,利用该技术构建覆盖面广的酵母双杂交cDNA文库,并鉴定与流感病毒蛋白发生直接相互作用的宿主蛋白,对深入理解流感病毒的复制和致病机制,创新抗流感病毒药物和疗法具有重要意义。【前人研究进展】A型流感病毒的基因组由8条单股负链RNA组成,已经报道可编码多达18种蛋白[2],根据表面蛋白血凝素(HA)和神经氨酸酶(NA)抗原性的不同分为18个HA亚型和11个NA亚型[3]。流感病毒的基因组极易发生变异,一方面,病毒基因组的分节段特性使得不同病毒在感染同一细胞时会发生病毒间基因片段的交换而产生新的基因重组病毒[4],另一方面,由于病毒的RNA聚合酶缺乏校正功能导致病毒在复制的过程中很容易发生基因突变[5]。流感病毒的高突变率和易于发生基因重组的特性导致流感病毒的抗原变异频繁,为以疫苗免疫为主的防控措施带来严重挑战。药物治疗是除了疫苗以外的另一种抗流感病毒策略。目前,针对流感病毒NA蛋白设计的药物奥塞米韦和扎那米韦在临床治疗方面发挥了显著的作用[6-7]。但在用药过程中,病毒的神经氨酸酶基因可能会发生突变而产生耐药性毒株,导致药物失去治疗效果[8-9]。为此,需要加强流感病毒的复制周期调控机制研究,揭示流感病毒生命周期中所依赖的宿主蛋白,为抗流感药物的研发提供新思路和潜在的靶标。截至目前,利用不同方法,已经发现了多种与流感病毒蛋白互作而影响病毒复制的宿主蛋白[10-11]。对于NP蛋白而言,它在病毒RNA合成、复制复合体运输和子代病毒包装等过程中发挥关键作用。NP蛋白作为流感病毒主要的结构蛋白,是组成病毒核糖核蛋白复合体vRNP的成分[12],在整个流感病毒生命周期发挥重要的作用,参与vRNP的入核[13]、病毒基因组的转录与复制、与M1蛋白和NEP蛋白一起介导vRNP出核[13-15]。而且,NP蛋白在不同亚型流感病毒中非常保守[16],可以作为抗流感药物的良好靶标。因此,与流感病毒NP蛋白互作宿主因子的研究也就自然成为一个研究热点。目前,利用不同方法发现的与NP蛋白互作的宿主蛋白包括有:DDX3[17]、MOV10[18]、importin α[19]、CRM1[20]、UAP56[21]和Tat-SF1[22]等。【本研究切入点】鉴于NP蛋白是流感病毒粒子中除M1蛋白以外含量最高的病毒蛋白且在病毒复制周期的多个环节发挥重要作用,挖掘与流感病毒NP蛋白互作的宿主蛋白具有重要意义。因此,本研究以流感病毒的NP蛋白为研究对象,力图发掘病毒复制周期中与NP蛋白互作的新的宿主因子。【拟解决的关键问题】系统深入的了解与NP作用的宿主蛋白,需要构建覆盖基因更全面的文库。为此,本研究成功构建了同时含有肺泡上皮细胞A549和肺腺癌细胞Calu-3两种肺脏细胞类型的酵母双杂交cDNA文库,并利用酵母双杂交系统筛选与流感病毒NP蛋白互作的宿主因子,为研究流感病毒复制和致病机制及设计针对NP和宿主因子的抗流感药物奠定基础。1 材料与方法
试验于2015年在中国农业科学院哈尔滨兽医研究所完成。1.1 主要试剂
Rneasy Plus Mini kit RNA提取试剂盒购自QIAGEN公司;酵母质粒小提取试剂盒购自碧云天生物公司;Ex Taq DNA聚合酶购自TaKaRa公司;胶回收试剂盒购自AXYGEN 公司;酵母文库构建试剂盒、各种酵母培养基及Aureobasidin A和X-α-gal均购自Clontech公司。1.2 RNA提取及第一链cDNA合成
采用RNeasy Plus Mini kit试剂盒,按说明书步骤提取等量A549细胞和Calu-3细胞总RNA。在无RNA酶的1.5 mL离心管中分别加入2 μg新提取的细胞总RNA和1 μmol·L-1 primer,用RNase-free H2O补至总体积4 μL;72℃水浴热激2 min,冰上冷却2 min,13 000×g瞬时离心10 s;加入2 μL 5×First-Strand Buffer、1 μL 100 mmol·L-1 DTT、1 μL 10 mmol·L-1 dNTP、1 μL SMART MMLV,混匀,42℃水浴10 min;加入1 μmol·L-1 SMART III-modified oligo,混匀后42℃继续孵育1 h,然后75℃ 10 min 终止反应;室温冷却后,加入1 μL RNase H(2 个活性单位),37℃孵育20 min。1.3 dscDNA 的长距离PCR(LD-PCR)扩增合成及其纯化
按照表1加入cDNA模板和各种反应试剂。按照以下扩增程序:95℃预变性30s;95℃变性10 s,68℃ 6 mina,26个循环(a表示每增加一个循环延伸时间都要增加5 s);68℃延伸5min,反应结束后4℃保存。最后,用CHROMA SPINTM+TE-400 纯化柱纯化dsDNA。Table 1
表1
表1LD-PCR扩增体系
Table 1The amplification system of LD-PCR
| 试剂 Reagent | 用量 Dosage (μL) |
|---|---|
| ddH2O | 62 |
| 10×优化PCR缓冲液 10×advantage 2 PCR buffer | 10 |
| 10×熔液 10×melting solution | 10 |
| 10×dNTP预混液 10×dNTP mix | 10 |
| 5′PCR 引物 5′ PCR primer | 2 |
| 3′ PCR 引物 3′ PCR primer | 2 |
| 第一链互补DNA First-strand cDNA | 2 |
| 50×聚合酶预混液 50× Polymerase mix | 2 |
新窗口打开
1.4 Y187酵母感受态制备
Y187 酵母菌株划线于YPDA固体培养板上,30℃培养;挑取单菌落于3 mLYPDA液体培养基中,30℃ 250 r/min震荡培养,待OD600≈0.3时,700×g室温离心5 min,弃去上清;以100 mL新鲜YPDA液体培养基重悬菌体,继续培养至OD600≈0.5,700×g离心5 min后以30 mL灭菌水重悬菌体,700×g离心5min收集菌体;1.5 mL 1.1×TE/ LiAc溶液重悬菌体,13 000×g高速离心30s,用600 μL 1.1×TE/ LiAc的溶液重悬即为酵母感受态。1.5 dscDNA与pGADT7-Rec转化及同源重组
Carrier DNA 95℃ 5 min后置于冰上10 min,如此反复2次备用;将pGADT7-Rec、纯化的dscDNA、预变性的Carrier DNA及制备好的Y187感受态于无菌15 mL离心管中混匀;加入2.5 mLPEG/LiAc混匀后于30℃孵育 45 min(每15 min摇匀一次);加入160 μL DMSO混匀,42℃水浴20 min(每10 min摇匀一次);室温700×g离心5 min后用3 mL YPD Plus重悬沉淀;30℃震荡培养90 min后700×g离心收集菌体,再以15 mL 0.9% NaCl溶液重新悬浮。取100 μL进行10倍倍比稀释,分别取100 μL稀释10倍及100倍的菌液涂于SD/-Leu 100 mm固体培养板,计算文库容量,剩余样品涂布于 70 个150 mm的SD/-Leu 培养板上。30℃ 倒置培养3d左右直至菌落出现。1.6 文库收集及滴度测定
将1.5中已经长出菌落的平板置于4℃过夜冷却;每个平板加入15个玻璃珠及5 mL的冻存培养液,轻轻摇晃收集所有菌体,用细胞计数板计算酵母细胞个数,使细胞密度达到2×107/mL,1 mL分装冻存。取100 μL文库稀释10-2、10-4、10-5、10-6 4个稀释度,各取100 μL涂于100 mm SD/-Leu平板上,30℃培养3 d,菌落计数,计算文库滴度:克隆数目/稀释混合物涂板体积×稀释倍数=cfu/mL。随机挑取24个菌落以ExTaq进行PCR鉴定,判定文库多样性及计算重组率。1.7 构建酵母双杂交诱饵质粒pGBKT7-NP及诱饵菌株
以A/Anhui/2/2005(H5N1)病毒的NP表达质粒pBD-NP为模板,用NP基因正向引物BD-NP-F(gcatatGAATTCATGGCGTCTCAAGGCAC)及反向引物BD-NP-R(gcaaatGGATCCTTAATTGTCATACT CCTCTGC),用prime STAR高保真DNA聚合酶扩增NP全长;对NP扩增片段及pGBKT7载体进行EcoRI和BamHI双酶切,连接转化后涂于卡那抗性(50 μg·mL-1)的LB固体培养板上,挑取单菌落进行菌液PCR及质粒测序鉴定。测序正确的诱饵质粒转化酵母菌株Y2HGold,涂布SD/-Trp固体培养板,单菌落加入500 μL含有25%甘油的YPDA培养液中冻存备用。共转化pGBKT7-53和pGADT7-T作为阳性对照,共转化pGBKT7-Lam和pGADT7-T作为阴性对照,共转化pGADT7和pGBKT7-NP后分别涂布到SD/-Trp/-Leu和 SD/-Trp/-Leu/X-α-gal/AbA检测诱饵质粒自激活。1.8 诱饵菌株与文库杂交
冻存的诱饵菌株于SD/-Trp固体培养板上划线培养2—3 d;挑取单菌落于50 mL SD/-Trp培养液中至OD600≈0.8,离心收集诱饵菌株后用5—6 mLSD/ -Trp培养液重悬,于2 L锥形瓶中同时加入一支1 mL的文库,再加入45 mL 2×YPDA,混匀;避光,30℃、40 r/min摇晃培养进行杂交,24 h后离心收集菌体;10 mL 0.5×YPDA重悬菌体,均匀涂布40个150 mm的SD/-Trp/-Leu/-Ade/-His(SD/-4)固体培养板上;挑取单个菌落重新划线到SD/-Trp/ -Leu/-Ade/-His/X-α-gal/AroA(SD/-4/X/A)固体培养板上,挑取变蓝且长粗的菌落到4—5 mL SD/ -Trp/-Leu(SD/-2)液体培养基中,30℃、250 r/min培养,准备提取质粒。1.9 酵母质粒的提取及回交验证
按照碧云天酵母质粒小提试剂盒说明书提取酵母质粒,进一步转化至DH5α,利用Axygen 质粒小量DNA提取试剂盒提取质粒,进行测序,Blast序列比对。筛选正确阅读的猎物质粒,将猎物质粒与诱饵质粒各500ng共同转化Y2HGold酵母感受态菌株中,涂布SD/-2、SD/-4和SD/-4/X/A固体培养板,30℃培养箱中静置培养3—7d,观察生长情况。2 结果
2.1 Calu-3细胞及A549细胞总RNA电泳
提取Calu-3及A549细胞RNA浓度分别为1 023和967 ng∙μL-1,OD260/OD280≈1.8,OD260/OD230≈2.0说明提取RNA纯度较高,蛋白以及其他离子污染较少;28S与18S条带清晰,5S条带暗淡,说明RNA基本没有降解,适合文库构建的后续试验(图1)。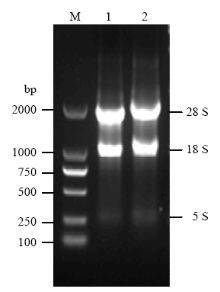 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1Calu-3 和A549细胞总RNA
M:DL2000 Marker;1:Calu-3细胞总RNA;2:A549细胞总RNA
-->Fig. 1Total RNAs extracted from Calu-3 and A549 cells
M: DL2000 Marker; 1: Total RNA of Calu-3 cell; 2: Total RNA of A549 cell
-->
2.2 dscDNA的鉴定
提取RNA反转录获得cDNA,以LD-PCR扩增合成dscDNA,利用CHROMA SPIN+TE-400对其进行纯化。1%核酸电泳显示dscDNA条带于500—2 000 bp之间呈弥散状(图2),说明不同丰度和不同大小的RNA均被反转录,可以用于文库构建。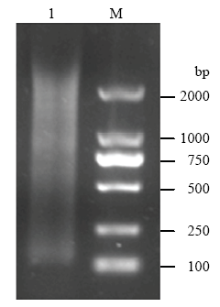 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2纯化的dscDNA电泳
M:DL2000 Marker;1:纯化的dscDNA
-->Fig. 2Electrophoresis of purified dscDNA
M: DL2000 Marker; 1: Purified dscDNA
-->
2.3 库容及滴度测定
将收集的文库以10倍倍比稀释后,取10-2、10-4、10-5、10-6四个稀释度各100 μL涂于100 mm SD /-Leu平板上。菌落计数106稀释度有22个菌落,计算所建文库滴度为2.2×108 cfu/mL(图3)。转化pGADT7-Rec和dscDNA的Y187菌液做1﹕10及1﹕100稀释,涂于SD/-Leu平板上,计算所建文库的库容为1.5×107,满足酵母双杂交试验的建库要求。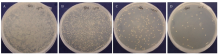 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3酵母文库滴度测定
酵母菌液分别稀释至(A)10-2、(B)10-4、(C)10-5和(D)10-6在SD/-Leu平板上的生长情况,用于计算文库滴度
-->Fig. 3The titer determination of cDNA library
The 10-2、10-4、10-5 and 10-6 diluted yeast suspensions were grown on SD/-Leu plate. The colony was counted and calculated for library titering
-->
2.4 文库PCR鉴定
随机挑取24个单菌落进行PCR鉴定,结果显示扩增片段大小分布在250—2 000 bp之间,且片段长度并不均一,24个克隆仅有3个没有检测到插入片段,重组率达到88%(图4),上述结果表明构建的文库质量较高,可用于后续的酵母双杂交试验。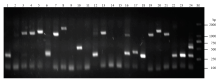 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4文库插入片段的PCR鉴定
M:DL2000 Marker;1-24:样品编号
-->Fig. 4PCR identification of the fragments inserted into the cDNA library
M:DL2000 Marker;1-24:Sample number
-->
2.5 诱饵质粒pGBKT7-NP的PCR鉴定和序列分析
挑取单菌落进行扩大培养,而后提取质粒,以NP特异性引物进行PCR扩增,获得与NP基因全长(1 565 bp)相近的DNA片段,对扩增大小正确的质粒进一步测序分析,结果表明诱饵质粒构建成功。2.6 回交验证
筛选得到的正确阅读的猎物质粒与诱饵质粒共转Y2H Gold酵母菌,分别以BD-P53/AD-T7作为阳性对照和BD-Lam/AD-T7作为阴性对照,经过筛选鉴定共发现11个猎物质粒和诱饵质粒,共转后在SD/-Trp/- Leu/-Ade/-His/X-α-gal/AroA(SD/-4/X/A)培养板上呈现阳性结果(图6),即蛋白间存在相互作用。所筛选得到的与流感病毒NP蛋白互作的宿主蛋白的编码基因信息见表2。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5NP诱饵质粒PCR鉴定
M:DL2000 Marker;1:诱饵质粒PCR产物
-->Fig. 5PCR identification of the NP bait plasmid
M: DL2000 Marker; 1: PCR of biat plasmid
-->
Table 2
表2
表2筛选得到与流感病毒NP互作蛋白的编码基因
Table 2The selected genes encoding proteins to interact with influenza virus nucleoprotein
| 编号 No. | GenBank 编号 GenBank No. | 基因名称 Gene name | 同源性 Identity (%) |
|---|---|---|---|
| X1 | AB079131.1 | 人类MYC相关锌指蛋白 Homo sapiens MYC associated zinc finger protein (MAZ) | 96 |
| X2 | XM_005257736.2 | 迁移侵袭增强因子1 Homo sapiens migration and invasion enhancer 1 (MIEN1) | 99 |
| X3 | FJ208848.1 | 半乳糖凝集素1 Homo sapiens galectin 1 (LGALS1) | 98 |
| X4 | NM_003245.3 | 转谷氨酞胺酶3 Homo sapiens transglutaminase 3 (TGM3) | 96 |
| X5 | NM_133639.3 | 人类ras同源基因家族成员V Homo sapiens ras homolog family member V (RHOV) | 99 |
| X6 | NM_033630.2 | 人类结合SCAN结构域蛋白1 Homo sapiens SCAN domain containing 1 (SCAND1) | 98 |
| X7 | NM_003969.3 | 人类泛素结合酶E2M Homo sapiens ubiquitin-conjugating enzyme E2M (UBE2M) | 96 |
| X8 | XR_950467.1 | 人类核(核细胞器)相关蛋白8 Homo sapiens gem (nuclear organelle) associated protein 8 (GEMIN8) | 100 |
| X9 | XM_008016995.1 | 人类丝氨酸蛋白酶抑制剂,Kunitz 1型 Homo sapiens serine peptidase inhibitor, Kunitz type 1 (SPINT1) | 95 |
| X10 | NM_198318.4 | 人类蛋白精氨酸甲基转移酶1 Homo sapiens protein arginine methyltransferase 1 (PRMT1) | 94 |
| X11 | XM_005247224.2 | 人类 MDS1和EVI1 复合物基因座 (MECOM) Homo sapiens MDS1 and EVI1 complex locus (MECOM) | 98 |
新窗口打开
2.7 Gene Ontology分析
利用在线网站https://david.ncifcrf.gov/对筛选得到的宿主因子进行Gene Ontology(GO)分析,结果显示11个宿主因子共参与7个生物过程,分别是:细胞凋亡调节、胚胎发育、可变剪接、多态性、金属结合、转录调节以及细胞增殖调节;分子功能有4种,包括GTP结合活性、金属离子结合活性、DNA结合活性及转录因子活性。具体信息见表3。Table 3
表3
表3与NP蛋白相互作用蛋白GO分析
Table 3GO analysis on the NP-interacting proteins
| 生物过程 Biological process | 基因GO注释百分比 Genes with GO annotation (%) | 分子功能 Molecular function | 基因GO注释百分比 Genes with GO annotation (%) | |
|---|---|---|---|---|
| 调节细胞凋亡 Regulation of cell apoptosis | 3 | GTP结合特性 GTP binding | 3 | |
| 胚胎发育 Embryonic development | 3 | 金属离子结合 Metal ion binding | 5 | |
| 可变剪辑 Alternative splicing | 4 | DNA结合特性 DNA binding | 4 | |
| 多态性 Polymorphism | 5 | 转录因子的活动 Transcription factor activity | 3 | |
| 金属结合特性 Metal-binding | 5 | |||
| 转录调节 Transcription regulation | 4 | |||
| 调控细胞增殖 Regulation of cell proliferation | 3 |
新窗口打开
3 讨论
酵母双杂交技术是一种被广泛用于研究蛋白质相互作用的成熟方法,该方法不需纯化蛋白,避免蛋白变性;接近于体内环境,能够比较真实反应机体内蛋白相互作用的情况;灵敏度非常高,对于蛋白之间非常微弱、瞬间发生的互作也能够筛选到;具有筛选量大、效率高及应用广泛等优点[23]。由于流感病毒主要感染人的肺部,在病毒的功能研究中,较常用的细胞类型为易感的人肺泡上皮细胞A549和肺腺癌细胞Calu-3。鉴于目前商品化的文库均基于单一细胞类型,为使基因覆盖更全面,本研究设计构建上述两种细胞类型的酵母双杂交cDNA文库,进而筛选与病毒蛋白互作的宿主蛋白。文库构建首先提取等量混合的Calu-3和A549细胞的总mRNA,反转录后经LD-PCR扩增获得dscDNA,dscDNA 与线性化pGADT7-Rec共转Y187酵母菌后发生同源重组,进一步收获菌体即为A549及Calu-3细胞的酵母双杂交cDNA文库。这个过程中提取mRNA的质量是成功构建cDNA文库的基本前提,本试验中提取mRNA质量优良,28S和18S条带清晰,而5S条带暗淡,说明RNA没有发生降解。由于体外反转录会产生大量小片段cDNA,小片段又易克隆插入载体,然而过小片段太多并不便于后期筛选。为提高文库的筛选质量,对扩增得到的dscDNA进行CHROMA SPIN+TE-400纯化,结果表明大部分条带均在500bp以上,说明小片段已去除。对于一个合格的cDNA文库,必须达到1×106cfu的库容及1×108cfu/mL的文库滴度,本研究构建的文库库容为1.5×107cfu,文库滴度为2.2×108cfu/mL,重组率为88%,PCR鉴定片段不等长,多样性良好,而且此文库同时含有A549和Calu-3两种细胞的cDNA,更丰富全面,为后续筛选与流感病毒编码蛋白互作的宿主因子奠定基础。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6猎物与诱饵在Y2H Gold中的相互作用
-->Fig. 6The interaction between prey and bait in Y2H Gold yeast strain
-->
流感病毒是有囊膜的单股负链RNA病毒,其病毒基因组分为8个节段,可编码多达18种蛋白。核蛋白NP由vRNA片段5编码,全长498个氨基酸,在中性pH条件下带正电荷,对RNA具有很强的结合力[24]。NP蛋白在结构上分为头部结构域、主体结构域和尾部结构域[25]。NP蛋白作为流感病毒核糖核蛋白复合体vRNP的重要组分,在不同亚型的流感病毒中相当保守,在病毒复制周期的多个环节发挥重要作用[26]。因此,通过挖掘与流感病毒NP蛋白互作的宿主蛋白,不仅可以深入了解宿主蛋白参与流感病毒复制周期调控的机制,而且有可能发现潜在的药物靶标,为研制新型抗流感病毒药物以及干预治疗提供理论依据。本研究构建诱饵质粒pGBKT7-NP进行酵母双杂交筛选,回交验证得到11个与其互作的宿主因子。这些蛋白具有多种分子功能,参与多个生物过程,但与病毒相关的研究仍相对较少。对这些NP互作蛋白的深入研究,将深化人们对NP蛋白功能、流感病毒感染和致病机制等的认知,并促进防控策略和手段的创新。
4 结论
本研究成功构建了高质量A549/Calu-3细胞cDNA的酵母双杂交文库,并以诱饵质粒pGBKT7-NP筛选到11个与流感病毒NP蛋白存在相互作用的宿主蛋白,为进一步研究NP蛋白功能及流感病毒致病机制奠定了基础。The authors have declared that no competing interests exist.
