0 引言
【研究意义】绵羊毛是毛纺工业最主要原料,毛色成为了主要经济特性。如今研究毛色种类,成为毛色研究的主要方向,而毛色的形成是一个复杂的过程,与毛色的发育和色素沉着有关。毛色主要由黑色素的合成和分布决定,主要影响皮肤、毛囊、眼睛等色素的沉着[1-2]。在细胞水平,黑色素由黑素细胞合成,黑素细胞位于表皮基底层,有规律的散布于基部的角质细胞之间。黑素细胞的发育和黑色素生成受许多基因调控。其中,小眼畸形相关转录因子(microphthalmia associated transcription factor,MITF)是黑素细胞发展和黑色素生成的主要调节者[3-4]。MITF调控3个主要的色素沉着酶的转录,TYR、TYRP-1和TYRP-2/ DCT[2, 5-10]。所以,研究MITF的表达和功能至关重要,使动物产生多彩羊毛纤维,形成不同的毛色。【前人研究进展】黑色素合成过程,受多个信号转录因子的调控,转录因子也调控诸多的黑色素相关基因。目前,MITF基因的研究主要集中于动物组织、皮肤、黑色素瘤、视网膜、及基因结构功能。郑嫩珠等[11]报道MITF基因表达量在白绒乌鸡各组织间差异表达由高到低:皮肤>肾>肌胃>肝>肌肉,皮肤表达量最高。ZHU等[2]研究表明在羊驼白色被毛皮肤组织中MITF基因表达量显著低于棕色毛皮肤组织。WANG等[12]研究报道黑素细胞/黑素瘤特有的MITF-M广泛表达于黑素细胞、黑素瘤细胞系和组织,在非黑素瘤细胞系中几乎检测不到。HARTMAN等[13]研究了在黑素瘤中抑制MITF活性,导致肿瘤退化,但是低水平MITF是致癌的。在成人视网膜上皮细胞中MARUOTTI等[14]证明“黑素细胞特有的”类型MITF-M有表达。有关基因结构功能的研究,KURITA 等[15] 探究C57BL/6J小鼠毛色变白,由于核苷酸在MITF的DNA结合区域突变形成的。此外,BARANOWSKA等[16]研究证明MITF-M启动子突变的长多态性(Lp)导致MITF-M的活性降低,也导致狗毛色形成白色斑点。还有报道在MITF磷酸化位点突变也会导致白色或白色斑点毛色[17]。DBBACHE等[18]研究表明小眼畸形相关转录因子丝氨酸磷酸化作用增加MITF转录活性,而稳定性下降,MITF的磷酸化状态调控其活性和稳定性。研究黑色素相关基因过表达在绵羊黑素细胞中的功能,从本质上揭示黑色素相关基因作用机制的重要性。【本研究切入点】目前,在小鼠、人类、肿瘤黑素细胞中研究了MITF表达,结果不太一致。然而,在绵羊黑素细胞中MITF过表达的研究未见报道,本试验将绵羊MITF-M在黑素细胞中过表达验证TYR以及酪氨酸酶相关蛋白的表达是否受到影响,调控黑色素生成。【拟解决的关键问题】本研究,在细胞水平,采用细胞转染技术在绵羊黑素细胞中过量表达MITF-M,以探究绵羊MITF-M过量表达对TYR、TYRP-1和TYRP-2的影响。1 材料与方法
试验于2015年2月—11月在山西农业大学羊驼生物工程实验室完成。1.1 试验材料
黑素细胞培养基(ScienCell)、RIPA裂解液(碧云天)、TRIZOL(Invitrogen,美国)、反转录PCR试剂盒(TaKaRa,大连)、 qRT-PCR kit(TaKaRa,大连)、MITF多克隆抗鼠IgG抗体(abcam,艾博抗上海)、TYR多克隆抗鼠IgG抗体(abcam,艾博抗上海)、T4 DNA Ligase(TaKaRa,大连)、蛋白marker(Fermentas公司);StepOne Fast Real time PCR System(Life technologies,美国)、电泳槽(北京六一仪器厂)、紫外凝胶成像系统(型号:WV-BP330,Panasonic公司,日本)、核酸蛋白测定仪(型号:Nanodrop-1000,Thermo,美国)。1.2 试验方法
1.2.1 绵羊MITF-M核酸序列查找和目的基因的克隆 使用NCBI信息查询系统检索绵羊小眼畸形相关转录因子(Oar MITF-M)的mRNA,找出CDS区的核酸序列。以cDNA为模版进行PCR扩增,产物跑电泳检测,切下目的条带,送公司进行测通,确定目的序列大小的正确。绵羊 MITF-M的引物,由华大科技公司合成。1.2.2 绵羊MITF-M克隆载体和真核表达载体的构建 绵羊MITF-M载体的构建。首先,用T载体试剂进行16℃过夜连接,然后转化、涂板,在培养箱中37℃培养;待菌长出蓝白斑进行挑菌、摇菌;待菌液浑浊,但未出现絮状沉淀时,即可使用试剂盒进行质粒提取,送公司测序,确定克隆载体是否构建成功。再将克隆载体质粒和表达载体进行酶切和电泳,回收目的基因和载体片段,用T4连接酶进行连接,之后步骤与连接克隆载体一样,最后获得质粒,送测序。
1.2.3 绵羊黑素细胞转染 使用实验室保存的第5代黑素细胞进行培养,在6孔板的每孔加入大约2 mL正常生长培养基,为转染提供在底壁长到60%—80%的正常细胞。设置3、9、18 μg DNA组和空载组,将试剂A与B混合在一起,在室温条件下孵育20 min。在去除培养基的培养孔中加入800 μL不含血清的培养基和脂质体,37℃培养24 h,换成正常培养基,培养48 h,提取总蛋白和RNA进行测定。
1.2.4 黑色素含量测定 收集转染后各组黑色素,PBS冲洗2—3次后,用0.2 mol·L-1 NaOH溶解黑素细胞,进行测值。
1.2.5 Real-time PCR检测 利用Premier 5.0引物设计软件,根据GenBank上绵羊MITF、TYR、TYRP-1和TYRP-2序列设计实时荧光定量PCR扩增引物,并通过NCBI初步检测引物的特异性。引物如表1。
Table 1
表1
表1引物序列
Table 1Primes used in this experiment
| 引物名称 Primer | 序列Sequence (5′-3′) |
|---|---|
| Oar MITF | Forward:AGACCTCCTCCAGCATCACG |
| Reverse:GAGAAAGGGTATCGTCCATGAG | |
| Oar TYR | Forward:ATGAGTACATGGGAGGTCGC |
| Reverse:GTCGTGGTTTCCAGGATTGC | |
| Oar TYRP1 | Forward:TTTGATGAATGGCTGAGGCG |
| Reverse:TCTATGTTGGTAATTGGAGGCC | |
| Oar TYRP2 | Forward:GCTGGGAGATTGTCTGTGATAG |
| Reverse:TCTGGAAGAACGGAGGACTG | |
| Oar β-Actin | Forward:GACCTTCAACACCCCTGCCA |
| Reverse:TCCTTGATGTCACGGACGATTT |
新窗口打开
按照实时荧光定量方法进行扩增后,判定PCR反应的特异性,根据标准曲线以及荧光曲线的CT值计算定量结果,目的基因的相对表达量采用ΔΔCT法计算[19]。数据用 Microsoft Excel进行统计分析,实时荧光定量PCR结果均用平均值±标准误(Means±SE)表示,其中各基因的表达量所示结果均应经内参基因β-actin表达量的校正,最后计算出的数据都采用Prism软件进行单因素方差分析检验。
1.2.6 蛋白免疫印迹试验方法 用总蛋白的提取试剂盒提取转染后黑色素细胞总蛋白,进行SDS-PAGE电泳,转膜,孵一抗,4℃过夜。孵育后,用TBST洗膜后,孵二抗,37℃孵育1 h;孵育二抗后,用TBST洗膜。按照发光试剂盒说明书配制发光液,显色后暗室曝光,获得有条带胶片,标定Marker,分析扫描。用Quantity one进行灰度值分析,β-actin作为内参,误差校正=目的蛋白灰度值/β-actin蛋白含量灰度值,用采用Prism软件进行单因素方差分析。
2 结果
2.1 绵羊MITF-M核酸序列获取和真核表达载体构建
NCBI中获得绵羊目的基因的CDS区,成功构建真核表达载体(图1)。慢病毒载体上连接一个启动报告基因绿色荧光蛋白和小鼠黑素细胞特异性TYRP2基因启动子,由Xba I和Sal I切开的载体间插入同样用 Xba I和Sal I切开克隆载体得到的绵羊 MITF- M序列。表达载体构建成功后,提出质粒,为了确保载体连接的准确性,对质粒进行了测序。通过对测序结果和在NCBI中找出的绵羊MITF-M的CDS区进行比对,分析结果显示:序列大小为1 242 bp,完全一致。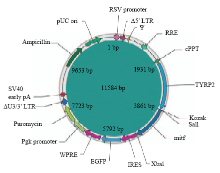 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1绵羊MITF-M真核表达载体结构
-->Fig. 1Structure of over-expressing Oar MITF-M
-->
2.2 黑素细胞转染前后的形态特征
正常的绵羊黑素细胞接种6 h贴壁伸展,第二天呈树突状。细胞培养2 d后即可进行传代或进行试验,此时细胞密集(图2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2绵羊MITF-M对黑素细胞形态学的影响A 为正常培养的黑素细胞(Control)(100×);B 为正常培养的黑素细胞(Control)(200×);C 为只转染空载体的黑素细胞(vector-GFP)(200×);D 为转染绵羊 MITF-M的黑素细胞(vector-GFP-Oar MITF-M)(200×)
-->Fig. 2The effect of Oar MITF-M on morphology of melanocytesA. Normal melanocytes (100×). B. Normal melanocytes (200×). C. The melanocytes transfected with empty vector (vector-GFP) (200×). D. The melanocytes transfected with Oar MITF-M (vector-GFP-Oar MITF-M) (200×)
-->
2.3 绵羊MITF-M在绵羊黑素细胞的转染
2.3.1 黑素细胞转染效率观察 在黑素细胞对数生长期进行转染,多次试验后发现在六孔板上,9 μgDNA/孔转染效率最高,此浓度做为转染试验选用浓度(图3)。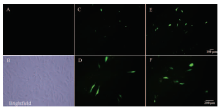 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3绵羊MITF-M转染黑素细胞的效率A 暗场正常培养的黑素细胞(Control,100×);B 明场正常培养的黑素细胞(Control,200×);C 为转染空载体的荧光图(Vector-GFP,100×);D 为转染空载体的荧光图(Vector-GFP,200×);E 为转染Vector-GFP-Oar MITF-M的荧光图(Vector-GFP-Oar MITF-M,100×);F 为转染Vector-GFP-Oar MITF-M的荧光图(Vector-GFP-Oar MITF-M,200×)
-->Fig. 3The efficiency of transfected melanocytes by Oar MITF-MA. Normal melanocytes in dark field (100×). B. Normal melanocytes in brightfield (200×). C. The melanocytes transfected with empty vector (100×). D. The melanocytes transfected with empty vector (200×). E. The melanocytes transfected with Vector-GFP-Oar MITF-M (100×). F. The melanocytes transfected with Vector-GFP-Oar MITF-M (200×)
-->
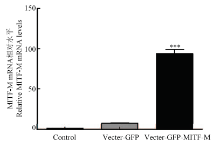
2.3.2 Real-time PCR检测MITF-M在绵羊黑素细胞系的转染效率 本试验设计了绵羊黑素细胞空白对照组,空载组和试验组,在对数生长期分别进行转染,结果发现试验组绵羊MITF-M被极显著的提高(P<0.001,图4)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4绵羊MITF-M转染黑素细胞中MITF-M mRNA水平
-->Fig. 4MITF mRNA levels in melanocytes transfected by the Oar MITF-M*** P<0.01
-->
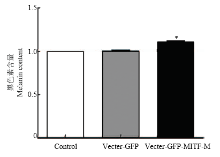
2.3.3 转染后黑色素含量测定 黑色素的含量用分光光度法进行测定,测定结果经分析得出,黑素细胞中黑色素含量增加1.15倍(P<0.05,图5)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5绵羊MITF-M转染黑素细胞中黑色素含量
-->Fig. 5Melanin content in melanocytes transfected by the Oar MITF-M
-->
2.3.4 Western blot检测转染后MITF和TYR蛋白在黑素细胞中的表达 本试验对所转染细胞进行蛋白提取,通过Western blot得出不同细胞蛋白的目的条带,再经软件统计分析,结果显示(图6),与空载组相比,试验组MITF蛋白显著升高至1.65倍,TYR蛋白显著升高至2.38倍(P<0.001)。由此得出,绵羊MITF-M可以显著增加MITF和TYR蛋白的产生。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6Western blot检测转染后黑素细胞中MITF、TYR蛋白的表达
-->Fig. 6Western blot analysis of MITF and TYR expression in melanocytes transfected by the oar MITF-M
-->
2.3.5 转染后黑素细胞TYR、TYRP-1和TYRP-2 mRNA检测 使用实时荧光定量PCR的方法检测了绵羊MITF-M过表达对TYR、TYRP-1和TYRP-2 mRNA的影响。统计分析结果显示:与空载组相比,绵羊MITF-M组的TYR mRNA极显著增加(P< 0.001),TYRP-1 mRNA升高至5.06倍(P<0.05),TYRP-2 mRNA升高至1.49倍,变化不明显(图7)。由此可以得出,绵羊 MITF-M能改变TYR和TYRP-1 mRNA的表达,对TYRP-2 mRNA影响不明显。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7RT-PCR检测转染后黑素细胞中TYR、TYRP-1和TYRP-2 mRNA的表达
-->Fig. 7Real-time PCR analysis of TYR,TYRP-1, and TYRP-2 expression in melanocytes transfected by the Oar MITF-M
-->
3 讨论
MITF基因对于毛色形成必不可少[20],调控诸多黑色素相关基因及相关因子,包括TYR、TYRP-1、TYRP-2、MART1/MLANA、SILV/PMEL17、AIM和TRPM1[21],引起毛色的变化,其中TYR、TYRP-1、TYRP-2是定位于黑素小体上直接参与黑色素生成关键酶,本试验通过构建绵羊MITF-M过表达载体,细胞转染技术,对绵羊MITF-M影响色素沉着酶的调节机制进行研究。试验表明,绵羊MITF-M过量表达增加黑素细胞MITF、TYR、TYRP-1 mRNA表达量,尤其是MITF、TYR表达量明显增加,TYRP-1表达量增加较小,TYRP-2增加不明显。结论显示,绵羊MITF-M在绵羊黑素细胞中的过表达上调TYR、TYRP-1的表达,对TYRP-2影响不明显,从而影响黑色素的生成。已有研究表明,在人类黑素细胞中MITF的过表达增加酪氨酸酶家族基因TYR和TYRP-1表达,不影响TYRP-2表达[22],与本试验结果一致。GAGGIOLI等[20]研究MITF过表达,在B16小鼠黑素瘤细胞或人类黑素细胞中,TYR表达几乎不变;转染MITF优势负性突变体会抑制内源性TYR、TYRP-1的表达,降低黑色素合成;可知MITF对于酪氨酸酶的表达是必需条件,但不是充分条件。此外,FANG等[23]也研究证实抑制黑素细胞转录因子MITF的活性,选择性下调酪氨酸酶家族TYRP-1基因。所以,与MITF互相作用调控黑素生成基因表达和黑色素合成的调控机制仍存在未知,仍需要继续进行探究。LI等[24]研究证明广泛表达的因子YY1能够与黑素细胞系特异的M-MITF协同作用调节黑素细胞中基因的组织特异性表达。DESPLAN等[25]研究显示PAX6调控MITF的视网膜色素上皮细胞亚型的表达,同时与MITF协同作用激活有关色素形成基因的表达。此外,研究证明转录因子GLI2、转化生长因子β[26]及miR-128[27]等抑制MITF基因表达,抑制酪氨酸酶活性,从而抑制黑色素的生成。以上报道,揭示MITF受不同基因调控的同时调节着多个下游基因,在黑素细胞和黑色素合成中的发挥着重要作用。是否还存在其他作用途径、影响因素等一些问题尚需继续探究。本试验研究MITF在绵羊黑素细胞中过表达调节黑色素生成关键酶的功能,有利于进一步揭示更多相关基因的作用机制。4 结论
在绵羊黑素细胞中通过转染脂质体过表达MITF- M,检测相关基因的表达,发现过表达MITF可以增加TYR表达,试验结果证明MITF能够通过调节黑素细胞中TYR、TYRP-1和TYRP-2的表达,从而影响到绵羊不同毛色的形成。The authors have declared that no competing interests exist.
