0 引言
【研究意义】土壤盐碱化严重影响植物生长发育,威胁粮食的产量和品质,因此,耐盐性改良已经成为作物分子育种的重要目标之一[1-2]。谷子起源于中国,具有抗旱、耐瘠薄、适应性强等突出特点,目前,谷子已经成为单子叶作物抗逆功能基因组研究的模式作物[3]。顺式作用元件和转录因子在调节植物胁迫相关基因方面发挥作用[4]。bZIP(the basic leucine zipper)类转录因子在植物抵御各种不良的环境胁迫中发挥重要作用。因此,克隆谷子抗逆相关基因,研究其调控途径,对谷子功能基因组研究及作物抗逆分子改良具有重要意义。【前人研究进展】bZIP转录因子家族参与多种生物学过程,包括花和种子的发育,种子的萌发,光信号通路,激素和糖的信号通路过程[5]。另外,bZIP类转录因子还参与植物对生物和非生物胁迫的响应,例如高盐、干旱、极端的温度、渗透胁迫和抵御病原体[6-7]。根据bZIP类转录因子DNA结合区的氨基酸序列同源性进行分类,拟南芥的75个bZIP类转录因子被分为10个亚组,其中13个成员属于A组,17个成员属于S组[6]。在水稻中有89个bZIP类转录因子,被分为10个亚组[8]。研究表明,在拟南芥中过表达ABF4/AREB提高了转基因植株的抗旱性[9]。在水稻中过表达OsbZIP23增加了转基因植物对干旱和盐的耐性[10]。另外,过表达玉米ABP9显著提高了拟南芥对非生物胁迫的抗性[11]。大量的分子研究证明脱落酸(ABA)在非生物胁迫响应过程中发挥重要作用[12]。高盐和干旱等渗透胁迫有着共同的信号传导途径,可分为ABA依赖型和非ABA依赖型信号途径[13],ABA依赖型的信号途径主要是由bZIP类转录因子调控,ABA非依赖型的途径由其他的转录因子调控,例如DREB类转录因子[14]。【本研究切入点】谷子具备优良的抗逆性和极强的适应性[15]。然而,目前对谷子抗逆的分子机制仍然了解较少。谷子全基因组测序的完成为开展谷子抗逆功能基因组研究创造了条件[16-17]。采用反向遗传学策略研究谷子抗逆相关基因的功能有利于进一步了解谷子的抗逆机制。【拟解决的关键问题】本研究通过在拟南芥中过表达抗逆相关转录因子基因SibZIP42来分析其生物学功能,并对SibZIP42参与的信号途径进行初步分析,为揭示谷子抗逆调控网络创造条件,同时为作物耐盐转基因育种提供新的候选基因。1 材料与方法
1.1 试验材料
谷子材料龙谷25由中国农业科学院作物科学研究所刁现民研究员课题组提供。野生型拟南芥种子(Col-0)、亚细胞定位绿色荧光蛋白标记载体16318hGFP和植物表达载体pBI121由中国农业科学院作物科学研究所马有志研究员课题组提供。植物总RNA提取试剂盒、琼脂糖凝胶回收试剂盒、普通质粒小提试剂盒等均购于天根公司。氨苄青霉素、卡那霉素、利福平和脱落酸等试剂均购自拜尔迪公司。高保真DNA聚合酶PrimeSTAR HS DNA Polymerase、In-Fusion HD Cloning Kit购于TaKaRa公司。常规试剂购于梦怡美公司,试验使用的引物由奥科鼎盛公司合成并进行测序工作。1.2 材料处理
谷子和拟南芥幼苗在温度22℃,相对湿度65%,16 h光照和8 h黑暗的温室中培养。基因表达模式分析参考闵东红等[18]的谷子处理方法。取正常培养10 d的谷子幼苗分别进行NaCl(100 mmol·L-1)、干旱(6% PEG-6000)、ABA(100 μmol·L-1)等处理。取谷子未处理(0 h)和处理后1、6、12、24和48 h的整个植株以及未处理的根、茎和叶材料,所有样品用液氮速冻,放置-80℃冰箱保存备用。1.3 谷子SibZIP42的生物信息学分析
用在线工具Compute pI/Mw tool(http://web. expasy.org/protparam/)计算SibZIP42蛋白的分子量和等电点;从数据库Phytozome(https://phytozome.jgi.doe. gov/pz/portal.html)获得谷子SibZIP42起始密码子上游2 000 bp作为启动子序列,用PLACE(http://www. dna.affrc.go.jp/PLACE/)数据库对SibZIP42启动子顺式作用元件进行分析;用NetPhos 2.0 Server预测SibZIP42蛋白磷酸化位点;用谷子SibZIP42的蛋白序列在数据库Phytozome中进行BLASTP比对,搜索与其同源性较高的其他物种的基因序列,并用ClustalX 2.0进行多序列比对;按照已报道的拟南芥bZIP家族分组搜索与谷子和水稻相对应的同源性最高的基因,用软件MEGA5.05以相邻法(Bootstrap设为1000)构建系统进化树。1.4 RNA提取和表达模式分析
用植物总RNA提取试剂盒提取谷子及拟南芥的RNA。用FastQuant RT Super Mix反转录试剂盒合成cDNA。使用实时荧光定量PCR仪(ABI7500)和RealMaster Mix(SYBR Green)试剂盒进行Real-time PCR反应。以谷子Si001873m.g为内参基因。采用3步法反应程序,根据各样品在特定荧光阈值下的Ct值,采用2-ΔΔCt法计算基因在不同样品中的相对表达量。1.5 SibZIP42蛋白亚细胞定位
构建pSibZIP42-16318hGFP融合表达载体,参考YOO等[19]的方法以生长2周的谷子叶片为材料进行原生质体制备,将对照GFP空载体和重组质粒通过瞬时转染法导入谷子原生质体中,室温培养16 h以后,使用激光共聚焦显微镜(Zeiss LSM700)观察谷子原生质体内的SibZIP42蛋白亚细胞定位情况。1.6 转基因植株的获得
将扩增得到的SibZIP42 cDNA序列通过In-Fusion® HD Cloning Kit克隆试剂盒(Clontech)插入带有CaMV 35S启动子的pBI121表达载体上,转入GV3101农杆菌感受态中,参考CLOUGH等[20]的方法进行SibZIP42的拟南芥遗传转化。用含有50 mg·L-1卡那霉素的MS培养基筛选收获的T0拟南芥种子,繁殖并用筛选得到的T3种子用于表型鉴定试验。1.7 转基因植株的抗性鉴定
将野生型拟南芥WT及转基因株系OE1和OE2的种子用70%的无水乙醇处理4 min,ddH2O漂洗3次,然后用1%的NaClO溶液浸泡15 min,期间上下颠倒离心管数次,ddH2O漂洗3次后,点播于MS和分别含有NaCl浓度为90、120和150 mmol·L-1的MS培养基上,低温春化3 d后,在温度为22℃,相对湿度为65%,光照周期为16 h光照和8 h黑暗的条件下进行培养。每隔12 h统计各个株系的萌发率;待出现两片子叶后开始统计各株系的绿化率。将经相同方法清洗过的WT和过表达株系的种子点播于MS和分别含有ABA浓度为0.5、1和2 μmol·L-1 MS培养基上,在同样的培养条件下每隔12 h统计各个株系的萌发率和绿化率。2 结果
2.1 生物信息学分析结果
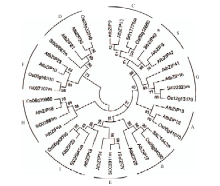
谷子SibZIP42(Si031238m.g)全长546 bp,编码由181个氨基酸组成的亲水性蛋白,分子量约为20.3 kD,等电点为7.15,其bZIP保守结构域位于氨基酸序列的第82到137位。用PLACE在线工具分析SibZIP42上游2 000 bp启动子区序列的顺式作用元件(表1),发现启动子区域中包含ABRE、MYB、MYC、W-box、LTRE和GT-1等逆境胁迫响应顺式作用元件。其中MYC元件最多,为30个,其次为MYB元件,共23个,W-box元件为20个。这些元件在植物干旱、ABA和低温等胁迫响应中发挥作用。磷酸化位点分析表明SibZIP42含有丝氨酸(Serine)、苏氨酸(Threonine)和酪氨酸(Tyrosine)等多个磷酸化位点,其中以丝氨酸位点最多,有14个,苏氨酸和酪氨酸位点分别为4个和1个,由此推测磷酸化作用可能与SibZIP42蛋白的活性调控有关。用ClustalX 2.0将SibZIP42和来自水稻、玉米、大豆等植物中同源性较高的bZIP类转录因子蛋白做序列比对分析,发现这些蛋白都含有一个由DNA结合区和亮氨酸拉链组成的bZIP蛋白保守域(图1)。根据已报道的拟南芥bZIP转录因子分组,搜索谷子和水稻中与拟南芥各个组亲缘关系最近的基因,用MEGA 5.05软件对SibZIP42蛋白及拟南芥和水稻中的同源蛋白做系统进化树分析(图2),发现谷子bZIP类转录因子被分为10组,SibZIP42属于S亚组,与拟南芥中的AtbZIP42进化关系最近,同源性最高。进化树分析结果显示在bZIP转录因子10个亚组中均有单子叶植物水稻、谷子和双子叶植物拟南芥的bZIP蛋白,每个亚组都含有单子叶植物和双子叶植物的bZIP基因,说明bZIP基因家族在单子叶植物和双子叶植物分化之前就已经存在了。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1SibZIP42与其他物种同源bZIP类蛋白的氨基酸序列比对黑色下划线标记为bZIP保守域序列(N-x7-R/K-x9-L-x6-L-x6-L)
-->Fig. 1Multiple alignment of amino acid sequence of SibZIP42 and homologous bZIP like proteins from other plantsThe bZIP conserved sequence (N-x7-R/K-x9-L-x6-L-x6-L) is underlined
-->
Table1
表1
表1SibZIP42启动子逆境相关顺式作用元件分析
Table1Analysis of stress related cis-elements in the SibZIP42 promoter
| 顺式作用元件 cis-elements | 数目 Number | 识别序列 Target sequences | 功能 Functions |
|---|---|---|---|
| ABRE MYB MYC W-box LTRE GT-1 | 1 23 30 20 1 15 | ACGT C/TAACNA/G CANNTG TTGAC CCGAA/C GAAAAA | ABA响应元件ABA responsive element 干旱响应元件Drought responsive element ABA和低温胁迫响应元件ABA and cold responsive element 伤害响应元件Wound responsive element 低温响应元件Cold responsive element 盐胁迫响应元件Salt stress responsive element |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2SibZIP42的系统进化树分析结果(带星号的为SibZIP42)
-->Fig. 2Phylogenetic tree analysis of SibZIP42 (SibZIP42 was labeled with asterisk)
-->
2.2 表达模式分析
通过荧光定量PCR检测在NaCl(150 mmol·L-1)、干旱(6% PEG-6000)和ABA(100 μmol·L-1)不同胁迫处理下以及对照仅用液体MS培养基处理的谷子幼苗中SibZIP42的表达情况(图3),在NaCl和ABA处理下,SibZIP42的表达趋势相似,表达量逐渐上升并在48 h时达到最高,表达量分别达到未处理的8倍和16倍;在PEG处理条件下表达量也逐渐上升,在48 h时达到处理前的3倍。表明SibZIP42受高盐和干旱胁迫以及ABA处理的诱导表达。谷子组织特异性表达分析显示(图4-C),在正常生长条件下SibZIP42在根、茎和叶中均有表达,SibZIP42在根部的表达量最高,推测SibZIP42主要是在地下部分表达,响应高盐及干旱胁迫。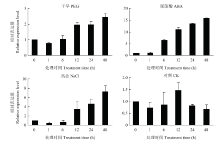 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同处理条件下SibZIP42表达谱分析结果
-->Fig. 3Expression profile of SibZIP42 under various stress treatment conditions
-->
2.3 SibZIP42蛋白亚细胞定位
将融合表达载体pSibZIP42-GFP转化到谷子原生质体中,在激光共聚焦显微镜下观察SibZIP42- GFP融合蛋白亚细胞定位情况。结果显示,对照GFP蛋白在细胞膜、细胞质和细胞核中均有表达(图4-A),而SibZIP42-GFP融合蛋白只在细胞核中显示绿色荧光,表明SibZIP42定位在胞核中(图4-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4SibZIP42蛋白亚细胞定位及SibZIP42在不同组织的相对表达量A:对照GFP;B:融合蛋白SibZIP42-GFP;C:SibZIP42在根、茎、叶中的相对表达量
-->Fig. 4Subcellular localization of SibZIP42 and the tissue specific expression analysis of SibZIP42A: Control GFP; B: Fusion protein SibZIP42-GFP; C: Tissue specific expression of SibZIP42 in foxtail millet
-->
2.4 转SibZIP42拟南芥植株的抗逆性分析
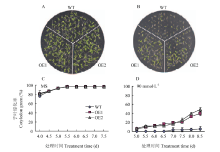
在MS培养基上,野生型拟南芥WT和转SibZIP42拟南芥种子萌发速率基本一致(图5-A和图5-E),但在90 mmol·L-1 NaCl处理条件下,WT的萌发率显著低于转基因株系OE1和OE2,在第二天转基因株系OE1和OE2萌发率达到70%,而WT的萌发率只有20%(图5-B和图5-F)。在120 mmol·L-1 NaCl和150 mmol·L-1 NaCl处理条件下,转SibZIP42拟南芥株系的萌发速率也显著高于WT(图5-C、图5-G/图5-D、图5-H),表明SibZIP42可以在种子萌发期提高植物对高盐胁迫抗性。在90 mmol·L-1 NaCl处理条件下,转基因拟南芥植株的子叶绿化率也显著高于WT(图6)。另一方面,ABA处理结果显示:在MS培养基上转基因拟南芥与WT萌发率和子叶绿化率没有明显差异,在0.5、1和2 μmol·L-1 ABA处理条件下,转基因拟南芥与WT种子萌发率也无明显差异,但是子叶绿化率却存在较大差异,转基因株系子叶绿化率显著低于野生型拟南芥WT(图7)。在1 μmol·L-1 ABA处理下,WT的子叶绿化率约是转基因株系的3倍。这些结果表明转SibZIP42拟南芥在种子萌发后期对ABA的敏感性显著强于WT。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图535S::SibZIP42转基因拟南芥种子在不同浓度NaCl处理下的萌发率
-->Fig. 5Seed germination rates of 35S::SibZIP42 transgenic lines under different concentrations of NaCl treatment conditions
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图635S::SibZIP42转基因拟南芥种子在不同浓度NaCl处理下的子叶绿化率
-->Fig. 6The cotyledon green rates of 35S::SibZIP42 transgenic lines under different concentrations of NaCl treatment conditions
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图735S::SibZIP42转基因拟南芥种子在不同浓度ABA处理下的子叶绿化率
-->Fig. 7The cotyledon green rates of 35S::SibZIP42 transgenic lines under different concentrations of ABA treatment conditions
-->
2.5 ABA响应相关基因在转SibZIP42植株中的表达
为了研究SibZIP42耐高盐胁迫和对ABA响应的机制,检测150 mmol·L-1 NaCl处理下,在SibZIP42转基因植株中ABA响应有关基因的表达情况(图8)。结果显示,在NaCl处理条件下,在SibZIP42转基因拟南芥中,RD29B、RAB18和HIS1-3等ABA响应相关基因表达量都明显提高,其中RD29B在处理后3 h表达量比WT中提高了2倍,HIS-3和RAB18表达量比WT中提高了3倍;MYB44表达量在转基因株系和WT中没有显著差异;CBF3属于非ABA依赖途径,在转基因株系和WT中表达量相似,PIP2A为水通道蛋白基因,在6 h和12 h时表达量明显高于WT,表明SibZIP42可能通过影响部分ABA信号途径相关基因和胁迫相关基因的表达来提高植物对高盐胁迫的抗性。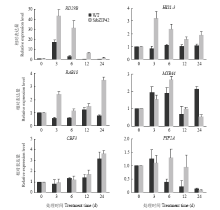 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8在盐处理条件下WT和SibZIP42转基因植物ABA及胁迫响应相关基因的表达分析
-->Fig. 8Expression analyses of ABA and stress response genes in WT and SibZIP42 transgenic plants under salt stress conditions
-->
3 讨论
bZIP转录因子由一个与DNA结合的碱性结构域和一个亮氨酸拉链组成,是真核生物中分布最广、最保守的一类转录因子[21]。根据DNA结合区的保守型,bZIP转录因子在拟南芥中被分为A、B、C、D、E、F、G、H、I和S组[7]。在本研究中,系统进化树分析发现SibZIP42属于S组。S组是拟南芥中最大的一个组,其中,在拟南芥中有17个成员[22],在水稻中有16个[23]。但是只有ATbZIP11/ATB2被深入研究,大多数S组成员的功能还不清楚[7]。和其他组bZIP类转录因子相比,S组的转录因子bZIP保守域多出8个疏水性氨基酸。根据bZIP保守域的同源性,拟南芥S组的17个成员可以被进一步分为3个亚组,S1,S2和S3[22]。POURABED等[24]和NIJHAWAN[8]发现bZIP转录因子S组和C组在进化关系上较近,可能是由于这两个亚组在氨基酸序列上的高度相似性(图2)。ABA参与多种重要的生物学过程,例如种子成熟和萌发、根和茎的生长、生物和非生物胁迫等[25]。当植物受到高盐、干旱或低温等非生物胁迫时,会激活ABA依赖途径和ABA非依赖途径两种信号途径来抵御不良环境的影响[26]。ABRE是ABA响应相关基因表达的主要顺式作用调节元件[27]。大多数与ABRE结合的bZIP转录因子属于A组,一些成员可以被ABA和非生物胁迫强烈的诱导表达[7]。本研究发现SibZIP42与A组bZIP转录因子有着相似的特点,也通过ABA依赖途径调节植物的抗逆反应,说明S组和A组的bZIP类转录因子可能在功能上有相类似的作用;从进化关系上看,A组、S组和C组的进化关系较近(图2)。SibZIP42的启动子区含有LTRE、MYB、MYC和GT-1等非生物胁迫相关的顺式作用元件,以及响应ABA的顺式作用元件ABRE。启动子分析结果表明,SibZIP42的启动子区包含1个ABRE元件和30个MYC元件(表1)。植物响应高盐胁迫与ABA信号途径可能密切相关,为了分析SibZIP42在高盐和ABA处理后的表达模式变化,本研究用qRT-PCR分析SibZIP42在ABA和NaCl胁迫下的表达模式。结果表明,SibZIP42对高盐和ABA处理的响应模式基本相同,ABA处理6 h后表达量迅速提高,在处理后6到48 h的过程中,表达逐渐升高到处理前的15倍;高盐处理6 h之前表达量没有明显变化,但在处理的12 h后,表达量逐渐增加。说明在高盐和ABA处理后,可能通过ABA对相关胁迫基因的表达激活来提高植物的耐盐性,表明SibZIP42在高盐胁迫响应过程中通过ABA信号途径发挥重要的作用。
基因功能分析结果显示,在高盐处理条件下,转基因株系比WT萌发率和子叶绿化率高(图5和图6),但是转基因拟南芥幼苗在PGE和高盐胁迫条件下与WT长势表现基本一致(结果未显示),并没有提高转基因植株的抗逆性,SibZIP42转基因株系在种子萌发后期增加了植物对ABA的敏感性(图7),而在种子萌发期和幼苗期却没有表现这一特点(结果未显示),推测SibZIP42在NaCl胁迫响应中的功能可能需要其他调控因子的协同作用,或者在不同的生长发育阶段对胁迫发挥的作用不同。GAO等[28]发现ABA对拟南芥种子萌发后子叶绿化有推迟作用,说明SibZIP42可能在种子萌发后期正向调控植物ABA信号途径及耐盐反应。
为了在分子水平研究过表达SibZIP42提高植物耐盐性的机制,选取6个胁迫相关基因和ABA响应相关基因。在150 mmol·L-1 NaCl条件下分别取处理0、3、6、12和24 h的WT和转基因拟南芥幼苗并检测上述相关基因的表达情况。结果显示盐胁迫相关基因HIS1-3在处理3 h后表达量约为WT的3倍;在NaCl处理条件下,ABA响应相关基因RD29B和RAB18在转基因株系中表达量明显高于WT。这些结果说明了SibZIP42可能通过ABA信号途径正向调节植物的耐盐反应。大豆基因GmbZIP132[29]和GmbZIP1[30]通过ABA依赖途径能显著提高转基因植株的耐盐能力。玉米的ABP9[12]也可通过ABA信号途径显著提高拟南芥耐盐能力,YING等[31]将玉米ZmbZIP72转录因子转到拟南芥中,提高了拟南芥的耐盐性。本研究初步证明谷子SibZIP42在高盐胁迫响应过程中发挥重要作用,同时正调植物对ABA的反应,为进一步了解谷子的抗逆机制提供了新的证据,也为作物抗逆分子育种提供了潜在的候选基因。
4 结论
从谷子中克隆得到了一个bZIP类转录因子基因SibZIP42。该基因主要在根部表达,其蛋白定位在细胞核,受多种胁迫处理如PEG、NaCl和ABA等的诱导表达。在拟南芥中过表达该基因提高了种子萌发期对高盐胁迫的抗性及对ABA的敏感性。推测该基因可能通过ABA信号途径正向调控植物的耐盐性。The authors have declared that no competing interests exist.
