0 引言
【研究意义】苹果果实含有较高比例、人体比较容易吸收利用的游离多酚,营养保健价值高,在预防心脑血管疾病、抗肿瘤及抗氧化等方面有较好的作用,世界上许多国家都大力推荐其为主要消费果品[1-2]。中国是世界苹果生产和消费大国,大多为‘富士’,且主要用于鲜食[3]。因此,围绕新疆野苹果及其红肉变型(Malus sieversii f.neidzwetzkyana(Dieck)Langenf.)等苹果资源的科学保护与持续高效利用及栽培苹果品种遗传多样性的拓展,开展功能型苹果育种具有重要意义[4]。【前人研究进展】有关苹果类黄酮及其代谢机理的研究在近几年取得了较大的进展。已报道的苹果果实类黄酮达34种,分属黄烷醇、黄酮醇、二氢查尔酮、花青苷和二氢黄酮醇等5类[5]。有关苹果类黄酮生物合成与调控机理的研究主要集中在花青苷上,目前已克隆、鉴定了CHS、ANS、UFGT等结构基因[6];在苹果转录因子方面,有研究发现MdMYB1和(MdMYBA)受光照诱导,能够调控果皮花青苷的合成,并从苹果中克隆鉴定了5个MdMYB1等位基因MdMYB1-1—5[7-9];随后,有研究表明MdMYB10转录因子能够调控苹果叶片和果肉的红色发育,并且其调控活性需要转录因子MdbHLH3和MdbHLH33的参与[10-11];AN等[12]研究发现,苹果MdTTG1仅与bHLH蛋白存在直接相互作用,而无法与MdMYB1发生互作。TELIAS等[13]研究表明,‘蜜脆’苹果品种着色模式(条红与晕红)的可变性主要是由于MYB10启动子区甲基化的不稳定性;ESPLEY等[14]研究发现,红肉苹果品种‘Red Field’MdMYB10启动子由于6个23 bp重复序列的插入,使得MdMYB10具有自激活特性和组成型表达,枝、叶、花及果实各部分均为红色,并将这种含有6个重复序列的启动子基因型命名为R6;而叶片和果心均为绿(白)色、仅果实外皮层组织为红色的‘Sangrado’和‘jpp35’苹果品种,则由MdMYB10同源基因MdMYB110a和MdMYB110a-jp调控其红色部位花青苷的合成[15-16],上述研究结果表明,不同苹果品种的转录调控机理存在明显差异。【本研究切入点】新疆野苹果及其红肉变型不仅是苹果品质育种的重要基因库,同时也是世界栽培苹果的祖先种[17-18]。但新疆野苹果资源正遭到严重破坏,濒临灭绝[19];为此,笔者课题组在群体遗传结构等相关研究的基础上,于2006年率先构建了新疆红肉苹果与栽培苹果品种的杂种分离群体[20-25]。张芮等[26]研究结果表明,杂种后代绵、脆肉株系果实质地发育受乙烯调控;JI等[27-28]探讨了激素和氮对愈伤组织花青苷生物合成的影响,并对红色和黄色愈伤组织进行了RNA-seq分析,而WANG等[29]则对F1分离群体中的红色和绿色单株各20株进行了RNA-seq分析,筛选到了与类黄酮合成(图1)相关的差异表达基因,而有关红肉株系间类黄酮差异和果肉着色的分子机理尚有待研究。【拟解决的关键问题】本研究以紫红2号及红脆1、2、4号等红肉程度存在明显差异的4个株系发育后期的果实为试材(图2),进行MYB10启动子类型鉴定,并测定类黄酮和组分含量及相关基因的相对表达量,旨在为进一步完善功能型苹果育种的理论与技术体系提供参考。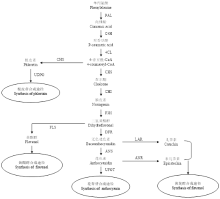 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1苹果类黄酮代谢途径[
-->Fig. 1Metabolic pathway of flavonoid in apple[
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图24个苹果株系成熟期截面图
-->Fig. 2Sectional drawing of 4 apple strains in the mature period
-->
1 材料与方法
试验于2012—2015年在山东农业大学作物生物学国家重点实验室及泰安市横岭果树育种基地进行。1.1 植物材料及试剂
1.1.1 植物材料 从新疆红肉苹果(Malus sieversii f. neidzwetzkyana)中的‘塔尔阿尔玛’与‘烟富3号’(M. domestica cv. Fuji)杂种一代选育出紫红2号及红脆1、2、4号等红肉程度存在明显差异的4个株系,以其发育后期(近成熟期)的果实(图2)为试材,从果实近成熟期到果实完全成熟期,共采3次样,分别为花后110、117和125 d。每次采样均采10个果实,用液氮研磨成粉后,分装成3份作为重复,在-80℃保存备用。1.1.2 试剂盒及菌株等 DNA提取试剂盒、RNA提取试剂盒、反转录试剂盒、SYBR染料、phusion高保真DNA扩增酶、琼脂糖凝胶回收试剂盒、零背景快速克隆试剂盒、DH5α感受态细胞均购自天根生化科技北京有限公司,芦丁标准品(rutin;Sigma chemical,St,Louis,USA,≥98%)。
1.2 试验方法
1.2.1 MYB10启动子基因型鉴定及序列分析 基因的启动子序列为2 000 bp左右,以NCBI中登录号为AB557643.1的序列为模板,设计上下游引物分别为F:5′-CAATGTGTTAGGTGTAGCGT-3′,R:5′-CAGAAGCAAACACTGACAAG-3′。以红脆1、2、4号及紫红2号果肉的DNA为模板,phusion高保真酶扩增,琼脂糖凝胶电泳鉴定MYB10启动子类型,胶回收后,按照天根零背景快速克隆试剂盒做连接、转化,摇菌活化涂板,挑取单克隆,菌液PCR鉴定选择6个阳性克隆测序。测序后序列比对采用ClustalX2软件[32],每个克隆间测序结果一致。1.2.2 花青苷含量的测定 参考冯守千等[33]的方法,取0.5 g克果肉液氮研磨成粉后,用10 mL 1%HCl/甲醇于4℃浸提4 h,12 000 r/min离心10 min,取上清液用分光光度计测定提取液在553 nm和600 nm处吸光值。以每g果肉鲜质量的提取液的吸光度变化值D553-D600=0.01作为1个花青苷单位,以U表示。
1.2.3 类黄酮含量的测定 参考JIA[34]的方法,称取1 g果肉,用液氮研磨成粉后,加入10 mL 65%预冷的乙醇,4℃避光浸提4 h,12 000 r/min离心 20 min,保留上清。吸取0.5 mL上清液于试管中,按顺序分别加入 1 mL NaNO2(5%)、1 mL Al(NO3)3(10%),4 mL NaOH(2 mol·L-1),混匀静置15 min,在510 nm下测定吸光值(以80%乙醇作为空白对照)。以芦丁为标样制作标准曲线,类黄酮含量表示为mg芦丁·g-1 FW。重复3次,操作步骤同上。
1.2.4 类黄酮组分的测定 参考陈学森等[4]的方法,去除果皮,称取10 g用液氮研磨成粉的果肉,加入50 mL 0.5%盐酸甲醇溶液,4℃浸提2 h,过滤,滤液4℃暂时避光保存,残渣加入50 mL 0.5%盐酸甲醇溶液,4℃浸提1 h,过滤,合并滤液后37℃旋蒸去除丙酮,残留部分5 000 r/min离心,上清液用甲醇定溶至10 mL。取5 mL定容后的溶液,用购自Waters公司的C18Sep-Pak小柱进行纯化[35]。进样前,所有流动相和样品均过0.22 μm的有机滤膜。
液相色谱条件:色谱仪(WATERS ACQUITY UPLC)采用BEH C18柱(100 mm×2.1 mm)为色谱柱,1.7 μm填料粒径,柱温45℃,进样体积1 μL。流动相:已过滤的乙腈(A),体积分数为0.2%的甲酸溶液(B);梯度:A:0—0.1 min 5%;A:20 min,20%;A:22 min,80%;A:22.1 min,5%;A:25 min,5%,流速为0.3 mL·min-1。350 nm下分析黄酮醇类物质,在280 nm下分析黄烷醇和二氢查尔酮类物质。为确定各类物质在紫外-可见光下的吸收特征,采用WATERS ACQUITY PDA检测器,PAD扫描波长范围200—700 nm。
1.2.5 实时荧光定量PCR 荧光定量PCR仪型号为伯乐CFX96,荧光定量PCR 反应体系按SYBR® Green PCR Master Mix 说明书配制,每个样品设3个重复。反应体系为20 μL:10 μL 2.5×RealMasterMix/ 20×SYBR Solution,1 μL cDNA(50 ng·μL-1),上下游引物各1 μL(5 μmol·L-1),7 μL ddH2O。反应条件如下:①95.0℃预变性30 s;②95.0℃变性5 s;③58℃退火10 s;④72.0℃延伸30 s(②—④共45个循环);⑤65℃孵育20 s;⑥溶解温度从55℃到95℃,每升高0.5℃保持1 s;⑦停止反应。以MdActin为内参,每个基因扩增均有内参同时扩增,默认条件下读取Ct值,采用2-ΔΔCT方法[36]进行数据分析。
1.3 荧光定量引物设计
CHI、F3H、DFR、ANR、UFGT、bHLH3、Actin荧光定量引物参考文献[37],MYB12荧光定量引物参考文献[38],FLS(AF119095)、LAR(AY830131)、ANS(DQ139835)、MYB10(EU518249.2)、TTG1(GU173814.1)、MYB16(HM122617.1)、MYB111(HM122615.1)利用Beacon Designer7(http://www. premierbiosoft.com/molecular_beacons/)设计荧光定量引物(表1)。Table 1
表1
表1苹果类黄酮生物合成相关基因qPCR扩增引物序列
Table 1Primer sequence for qPCR amplification of flavonoids -biosynthesis genes in apple fruit
| 基因名称 Gene name | 引物序列(5°-3°) Primer sequence (5°-3°) | QPCR产物长度 QPCR product length (bp) |
|---|---|---|
| CHI | GGGATAACCTCGCGGCCAAA GCATCCATGCCGGAAGCTACAA | 114 |
| F3H | TGGAAGCTTGTGAGGACTGGGGT CTCCTCCGATGGCAAATCAAAGA | 116 |
| DFR | GATAGGGTTTGAGTTCAAGTA TCTCCTCAGCAGCCTCAGTTTTCT | 122 |
| FLS | TTCTTACAGGGAAGCTAATGAA GAGGACATGGTGGGTAGTAGT | 173 |
| LAR | ACACCGTCAAGTCCTTCAAAG GTACCAACTGCCGCAATG | 178 |
| ANR | GTTCTGAAGTCGTGCGTGAA CAAGTGGGTGGCTTTACATTAGT | 161 |
| ANS | CCAAGTGAAGCGGGTTGTGCT CAAAGCAGGCGGACAGGAGTAGC | 137 |
| UFGT | CCACCGCCCTTCCAAACACTCT CACCCTTATGTTACGCGGCATGT | 107 |
| MYB10 | TGCCTGGACTCGAGAGGAAGACA CCTGTTTCCCAAAAGCCTGTGAA | 100 |
| bHLH3 | ACCACCTCAGCCAGAACCT CCTTCACCTTGGCTCTTAGTT | 224 |
| TTG1 | AGAATCCCATCTCAGAGCGG AGGGTCGGGTTCGGCTTTATT | 204 |
| MYB12 | AGACCAATGTGATAAGACCTCAG AACCAAAAACTTGTGAAGAGTTC | 121 |
| MYB16 | CCCTGACTTGAATCTTGACCTT CAATAGCATCCCTCCCACAG | 152 |
| MYB111 | CATCTCGTGACTTGAATCTTGAC AATGCTGGAGGTTTGTTTCG | 132 |
| Actin | TGACCGAATGAGCAAGGAAATTACT TACTCAGCTTTGGCAATCCACATC | 147 |
新窗口打开
1.4 数据分析
采用Excel进行数据处理和作图,用DPS 7.05软件(http://www.chinadps.net)进行显著性检验。2 结果
2.1 4个苹果株系MYB10启动子基因型鉴定
4个苹果株系MYB10启动子基因型鉴定结果见图3、4、5、6。图3(DNA Marker为天根D2000)显示红脆1、2、4号琼脂糖凝胶电泳为两条带,紫红2号为一条带;图4显示红脆1、2、4号和紫红2号在659—681 bp有一个23 bp重复序列(GTTAGACTGGTAGCTATTAACAA)[14],紫红2号在520—630 bp比红脆1、2、4号多5个重复序列;图5显示,红脆1、2、4号R6与紫红2号R6基本一致,均含有6个重复序列。因此,根据R6型的序列(图6),推测红脆1、2、4号MYB10启动子为R6R1型,而紫红2号MYB10启动子类型为R6R6型。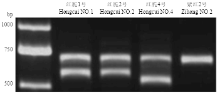 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图34个苹果株系果实MYB10启动子基因型鉴定
-->Fig. 3Genotype of MYB10 promoter in 4 apple strains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4红脆1、2、4号MYB10启动子R1序列与紫红2号R6序列比对结果
-->Fig. 4Sequence alignment consequence of MYB10 promoter in R1 of Hongcui NO.1、2、4 and R6 of Zihong NO. 2
-->
2.2 4个苹果株系果实发育后期类黄酮、类黄酮组分及花青苷含量
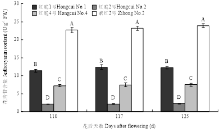
由图7可以看出,在果实近成熟期(花后110—125 d),红脆1号和紫红2号果实类黄酮含量总体呈上升趋势,其中成熟期(花后125 d),二者果实类黄酮含量分别为(3.0±0.16)mg·g-1和(3.1±0.18)mg·g-1;而红脆2号和红脆4号果实类黄酮含量总体呈下降趋势,其中成熟期(花后125 d),二者果实类黄酮含量分别仅为(2.1±0.05)mg·g-1和(1.9±0.08)mg·g-1,红脆1号和紫红2号与红脆2号和红脆4号差异极显著(P<0.01)。由图8可以看出,4个株系果实发育后期花青苷含量存在极显著差异(P<0.01),在成熟期紫红2号最高(23.9±0.63 U·g-1 FW),红脆1号、红脆4号和红脆2号分别为(12.2±0.37)、(7.5±0.43)和(2.2±0.14)U·g-1 FW。4个苹果株系成熟期果实除花青苷之外的其他类黄酮组分及其含量的HPLC检测结果见表2(合计为每个样品每个重复值对应相加后的平均值)。由表2可以看出,4个功能型苹株系成熟期果实类黄酮组分及其含量存在明显差异,其中从红脆1号成熟果实中检测到黄烷醇、二氢查尔酮和黄酮醇等3类11种组分,总含量高达(2 355.01±15.9)mg·kg-1,而红脆2号成熟果实中检测到黄烷醇、二氢查尔 酮和黄酮醇等3类8种组分,总含量仅为(1 247.4± 12.4)mg·kg-1。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5红脆1、2、4号MYB10启动子R6序列与紫红2号R6序列比对结果
-->Fig. 5Sequence alignment consequence of MYB10 promoter in R6 of Hongcui NO.1, 2, 4 and R6 of Zihong NO.2
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6R6型MYB10启动子6个重复序列[
-->Fig. 66 repeat sequences of R6 promoter in MYB10[
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图74个苹果株系发育后期类黄酮含量变化
-->Fig. 7Change of flavonoid contents in 4 apple strains during the latter growth period
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图84个苹果株系发育后期花青苷含量变化
不同字母表示差异极显著P<0.01
-->Fig. 8Change of anthocyanin contents in 4 apple strains during the latter growth period
Different letters indicate significant difference at P<0.01 level
-->
Table 2
表2
表24个苹果株系成熟期果肉类黄酮组分及其含量
Table 2Comparison in composition and content of flavonoid among 4 apple strain’s flesh in the mature period (mg·kg-1)
| 类黄酮组分 Flavonoid constituents | 红脆1号 Hongcui NO.1 | 红脆2号 Hongcui NO.2 | 红脆4号 Hongcui NO.4 | 紫红2号 Zihong NO.2 | |
|---|---|---|---|---|---|
| 黄烷醇 Flavanol | 儿茶素 Catechin | 478.1±10.3A | 94.1±5.9D | 116.6±3.7C | 270.8±5.2B |
| 表儿茶素 Epicatechin | 1197.2±28.3A | 716.1±10.4D | 760.5±6.4C | 855.9±6.7B | |
| 原花青素B2 Procyanidin B2 | 19.7±2.8A | 4.5±0.5C | 4.2±0.1C | 13.3±0.8B | |
| 二氢查尔酮 Dihydrochalcone | 根皮苷 Phloridzin | 250.8±9.0A | 182.7±4.3B | 140.7±1.8D | 156.2±3.8C |
| 根皮素-葡萄糖苷 Phloretin glucoside | 2.48±0.07C | 3.5±0.09B | 2.36±0.03C | 5.26±0.07A | |
| 黄酮醇 Flavonol | 槲皮素 Quercetin | 387.4±5.7A | 239.6±7.2C | 305.1±5.3B | 320.5±10.5B |
| 槲皮素-半乳糖苷 Quercetin galactoside | 6.34±0.08A | 2.1±0.04C | 2.38±0.03B | 2.37±0.04B | |
| 槲皮素-葡萄糖苷 Quercetin glucoside | 9.9±0.6A | 4.5±0.2B | 5.4±0.5B | 9.4±0.5A | |
| 槲皮素-木糖苷 Quercetin xyloside | 1.84±0.07A | 0 | 0.21±0.01C | 1.6±0.06B | |
| 槲皮素-阿拉伯糖苷 Quercetin arabinoside | 0.87±0.02 | 0 | 0 | 0 | |
| 槲皮素-鼠李糖苷 Quercetin rhamnoside | 0.38±0.01 | 0 | 0 | 0 | |
| 合计 Total | 2355.1±15.9A | 1247.4±12.4D | 1337.5±5.1C | 1635.3±15.2B | |
新窗口打开
2.3 4个苹果株系果实发育后期类黄酮生物合成相关结构基因和转录因子的表达分析
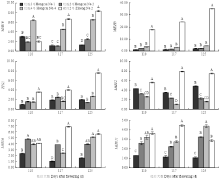
由图9、10可以看出,紫红2号MYB10、bHLH3、TTG1等转录因子及花青苷合成相关基因ANS和UFGT在果实发育后期(花后110—125 d)均具有较高的表达量,而CHI、F3H、DFR、FLS、LAR等6个类黄酮生物合成相关结构基因表达量较低;红脆4号的MYB10虽然在果实发育后期(花后110—125 d)表达量较高,但bHLH3、TTG1、ANS和UFGT均表达量较低;红脆1号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较高,而MYB16和MYB111表达量较低;红脆2、4号MYB12转录因子及FLS、LAR和ANR等类黄酮生物合成相关结构基因表达量较低,而MYB16和MYB111转录因子表达量较高。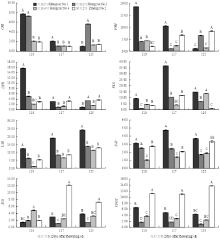 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图94个苹果株系果实发育后期相关结构基因表达量的变化
不同字母表示差异显著P < 0.01。下同
-->Fig. 9Changes of expression of structure-related genes in 4 functional apple strains during the latter period
Different letters indicate significant difference at P < 0.01 level. The same as below
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图104个苹果株系果实发育后期相关转录因子基因表达量的变化
-->Fig. 10Changes of expression of transcription factors-related genes in 4 functional apple strains during the latter period
-->
3 讨论
3.1 苹果果实花青苷合成差异及其与相关结构基因和转录因子的关系
花青苷与苹果多种组织器官的呈色有关[39],同时在人类医疗保健方面有重要的营养价值和药理作用[40-41]。花青苷合成是类黄酮合成途径的一个分支,其合成代谢涉及多个结构基因、转录因子以及紫外辐射、干旱、低温、茉莉酸、蔗糖、低氮等环境信号的诱导[42-43]。在苹果花青苷合成途径中,结构基因ANS和UFGT对苹果花青苷的合成具有决定性作用[44-45];在苹果转录因子方面,MdMYB10能够调控果肉的颜色,其调控活性需要转录因子MdbHLH3和MdbHLH33的参与,且MdMYB10具有自激活特性[10,14];AN[12]及BRUEGGEMANN[46]等研究发现,MYB、bHLH和WD40转录因子能够形成MBW复合体促进花青苷的合成,但MdTTG1仅与bHLH类(MdbHLH3和MdbHLH33)转录因子相互作用,而无法与MdMYB1发生互作。上述研究结果表明,MdMYB10(MdMYB1)、bHLH和MdTTG1是苹果花青苷生物合成的主要转录调控因子。在本研究中,从‘红富士’(R1R1)等苹果品种与新疆红肉苹果(R6R1)杂种一代群体选育的紫红2号,MYB10启动子基因型为R6R6型,在参试的4个株系中红肉程度最大,果肉深红色,成熟期果实花青苷含量(23.9 U·g-1 FW)是红脆1号(12.2 U·g-1 FW)的2倍,MYB10、bHLH3、TTG1等转录因子及ANS和UFGT等花青苷合成关键基因在果实发育后期(花后110—125 d)均具有较高的表达量;MYB10启动子类型为R6R1型的红脆4号,虽然在果实发育后期(花后110—125 d)MYB10表达量较高,但bHLH3、TTG1、ANS和UFGT表达量较低。因此,其成熟期果实花青苷含量(7.5 U·g-1FW)仅是紫红2号的31.4%。上述研究结果表明,MdMYB10、bHLH和MdTTG1是紫红2号苹果花青苷生物合成的关键转录调控因子,这与已有的研究结果一致。因此,进一步探讨MdMYB10、bHLH和MdTTG1在调控紫红2号苹果花青苷生物合成进程中的互作关系是今后研究的重要切入点。
STEVEN等[47]对4个资源圃的3 000份红肉苹果种质资源进行了MYB10启动子类型的鉴定和分类,其中包含了栽培种、野生种和杂交种,结果发现,几个R6R1类型的果肉深红,而R6R6类型的果肉却只是轻微粉红,表明R6位点起作用也要取决于它们的遗传背景,具体有待进一步研究。
3.2 苹果果实类黄酮含量和组分差异及其与相关结构基因和转录因子的关系
已报道的苹果果实类黄酮达34种,分属黄烷醇、黄酮醇、二氢查尔酮、花青苷和二氢黄酮醇等5类[4]。张小燕等[20]研究发现,新疆野苹果多酚物质含量的遗传多样性极为丰富,总酚及主要多酚物质含量显著高于‘红星’苹果品种,表现出明显的高黄酮特性。聂继云等[48]研究发现,冬红果和山荆子等22种苹果属野生种质资源的果实总黄酮含量均明显高于栽培品种。除了花青苷之外,有关苹果黄烷醇及黄酮醇生物合成及调控机理的研究报道相对较少。LIN-WANG等[49]将MdMYB16和MdMYB111转入过表达bHLH3+ MdMYB10的烟草叶片中,发现能够抑制DFR启动子的活性,认为MdMYB16和MdMYB111属于苹果类黄酮代谢途径的负调控因子;周兰等[38]在苹果中克隆出与拟南芥AtMYB12同源的MdMYB12,其功能与AtMYB12相同,都能够促进黄酮醇的合成,认为MdMYB12是苹果类黄酮代谢途径的正调控因子;AN等[50]发现,苹果MdMYB9和MdMYB11能够促进原花青素的合成;WANG等[29]则对新疆红肉苹果F1分离群体中的红色和绿色单株各20株进行了RNA-seq分析,筛选到了与类黄酮合成相关的差异表达基因,推测MdMYB12和MdMYB6可能参与了类黄酮代谢途径。
在本研究中,紫红2号和红脆1号果实成熟期类黄酮含量相当,分别为3.0 mg·g-1和3.1 mg·g-1,但紫红2号花青苷含量(23.9 U·g-1FW)是红脆1号(12.2 U·g-1FW)的2倍,黄烷醇和黄酮醇等类黄酮组分含量(1 635.3 mg·kg-1)仅是红脆1号(2 355.0 mg·kg-1)的69%,而紫红2号FLS、LAR及ANR等类黄酮生物合成结构基因的低表达水平可能是其类黄酮组分含量低的主要原因;HAN等[51]研究发现,苹果MdANR在转基因烟草中过表达,导致儿茶素和表儿茶素(黄烷醇)含量增加,而抑制了CHI和DFR的表达及花青苷的合成;因此,紫红2号MYB10、bHLH3、TTG1等转录因子及ANS和UFGT等花青苷合成关键基因在果实发育后期的高水平表达,可能是FLS、LAR及ANR等类黄酮生物合成结构基因表达量低的主要原因,其调控关系有待进一步研究。
红脆1、2、4号的MYB10启动子基因型均为R6R1,类黄酮组分含量分别为2 355.0 mg·kg-1、1 247.5 mg·kg-1和1 337.5 mg·kg-1,差异显著;红脆1号MYB12、CHI、F3H、DFR、FLS、LAR和ANR等转录因子及类黄酮生物合成相关结构基因表达量较高,而MYB16和MYB111表达量较低;红脆2、4号MYB12表达量较低,而MYB16和MYB111表达量较高。因此,MYB12、MYB16和MYB111等转录因子及DFR、FLS、LAR和ANR类黄酮生物合成相关结构基因的差异表达,可能是导致MYB10启动子基因型均为R6R1型的红脆1、2、4号等3个株系类黄酮及组分含量差异的主要原因。进一步探讨MYB12、MYB16和MYB111等转录因子在功能型苹果株(品)系类黄酮生物合成中的调控机理,是今后研究的重要切入点之一。
4 结论
红脆1、2、4号的MYB10启动子基因型均为R6R1,而紫红2号MYB10启动子类型为R6R6型。紫红2号和红脆1号果实成熟期类黄酮含量相当,但紫红2号花青苷含量是红脆1号的2倍。MYB10、bHLH3和TTG1等转录因子及ANS和UFGT等花青苷生物合成结构基因在果实发育后期的高水平表达,可能是导致紫红2号成熟期果肉花青苷含量高的主要原因;而MYB12、MYB16和MYB111等转录因子及DFR、FLS、LAR和ANR类黄酮生物合成相关结构基因的差异表达,可能是导致MYB10启动子基因型均为R6R1型红脆1、2、4号等3个株系类黄酮及组分含量差异的主要原因。The authors have declared that no competing interests exist.
