 ,, 史宇星, 王莎莎, 刘智慧, 蔡文杰, 周敏, 王世贵, 唐斌
,, 史宇星, 王莎莎, 刘智慧, 蔡文杰, 周敏, 王世贵, 唐斌 ,杭州师范大学生命与环境科学学院,杭州 311121
,杭州师范大学生命与环境科学学院,杭州 311121Sequence Analysis of Harmonia axyridis Pyruvate Kinase Gene and Its Regulation of Trehalose Metabolism
GE XinZhu ,, SHI YuXing, WANG ShaSha, LIU ZhiHui, CAI WenJie, ZHOU Min, WANG ShiGui, TANG Bin
,, SHI YuXing, WANG ShaSha, LIU ZhiHui, CAI WenJie, ZHOU Min, WANG ShiGui, TANG Bin ,College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 311121
,College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 311121通讯作者:
责任编辑: 岳梅
收稿日期:2021-06-2接受日期:2021-07-2
| 基金资助: |
Received:2021-06-2Accepted:2021-07-2
作者简介 About authors
葛欣竺,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2042KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
葛欣竺, 史宇星, 王莎莎, 刘智慧, 蔡文杰, 周敏, 王世贵, 唐斌. 异色瓢虫丙酮酸激酶基因序列分析及其调控海藻糖代谢功能. 中国农业科学, 2021, 54(23): 5021-5031 doi:10.3864/j.issn.0578-1752.2021.23.008
GE XinZhu, SHI YuXing, WANG ShaSha, LIU ZhiHui, CAI WenJie, ZHOU Min, WANG ShiGui, TANG Bin.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】相比于使用化学农药控制害虫,天敌昆虫在控制害虫发生、防止抗药性产生、保护环境、维持生态平衡等方面具有明显优势。在捕食性瓢虫中,异色瓢虫(Harmonia axyridis)广泛分布于中国各地,是一类重要的天敌昆虫资源。但对该物种的开发利用一直受到各种因素的制约,比如人工饲料。昆虫的生长发育与能量代谢密切相关,因此,探究异色瓢虫的能量代谢有助于促进天敌昆虫应用于害虫防治。【前人研究进展】糖酵解是葡萄糖氧化的主要代谢途径,为其他途径提供能量和中间前体。丙酮酸激酶(pyruvate kinase,PYK)能催化磷酸烯醇式丙酮酸转化为烯醇式丙酮酸,并产生ATP[1]。且丙酮酸激酶负责调节糖酵解和糖异生之间的平衡[2],因此它是能量代谢过程中的一个关键酶。据报道,大豆食心虫(Leguminivora glycinivorella)和棉铃虫(Helicoverpa armigera)在滞育期间体内主要的代谢酶为丙酮酸激酶[3,4]。美洲蟑螂(Periplaneta americana)和沙漠蝗(Schistocerca gregaria)的飞行肌肉中丙酮酸激酶的酶促反应符合Michaelis-Menten动力学[5,6]。PAPADOPOULOS等研究发现,面对各种生理变化,比如伤害、饥饿、杀虫剂、注射丙酮,黄粉虫(Tenebrio molitor)体内丙酮酸激酶的动力学特征发生变化[7]。丙酮酸激酶作为在糖酵解过程中催化形成第二个ATP反应的酶,在丙酮酸稳态调节和昆虫生命活动方面起着重要作用。在昆虫中,海藻糖是一种非还原性的二糖,主要在脂肪体内合成,既是一种贮藏性碳水化合物,也是应激代谢的重要产物[8]。海藻糖作为昆虫的血糖,其在昆虫生长发育和抵抗逆境方面扮演着重要的角色[9,10]。对于昆虫,尿苷二磷酸葡萄糖和6-磷酸葡萄糖首先在海藻糖-6-磷酸合成酶(trehalose-6- phosphate synthase,TPS)的催化下合成6-磷酸海藻糖,接着在海藻糖-6-磷酸磷酸酯酶(trehalose 6-phosphate phosphatase,TPP)催化下去磷酸化生成海藻糖,该过程被称为TPS/TPP途径[9,11]。海藻糖酶(trehalase,TRE)是昆虫体内能够水解海藻糖的酶类,每个海藻糖分子都可以通过海藻糖酶水解为两个葡萄糖分子[11]。迄今为止,已鉴定出两种形式的海藻糖酶,分别为可溶性海藻糖酶(TRE1)和在N-羟基上具有跨膜结构的膜结合型海藻糖酶(TRE2)[9,12-13]。【本研究切入点】昆虫海藻糖代谢是能量代谢的重要部分,不仅异色瓢虫丙酮酸激酶基因(HaPYK)未见报道,而且有关丙酮酸激酶在海藻糖代谢中的功能研究几乎空白。【拟解决的关键问题】分析异色瓢虫HaPYK的序列特征和结构,进一步抑制HaPYK在mRNA水平上的表达,检测对海藻糖代谢的影响,为理解丙酮酸代谢与海藻糖代谢之间的联系及后续研究HaPYK在异色瓢虫体内的其他生物学功能提供依据。1 材料与方法
试验于2020年5月至2021年4月在杭州师范大学完成。1.1 供试材料
将2020年5—7月从杭州师范大学仓前校区及周边田间采集得到的异色瓢虫与本实验室长期饲养的种群混合饲养。首先种植蚕豆苗供豌豆蚜(Acyrthosiphon pisum)取食,然后将接有蚜虫的蚕豆苗放入养虫笼里供异色瓢虫取食。饲养条件为温度(25±1)℃,相对湿度(70±5)%,光周期为14L﹕10D。1.2 HaPYK序列的生物信息学分析
从异色瓢虫全基因组中获得3条HaPYK序列,然后用在线工具ORF Finder(1.3 双链RNA合成
首先,采用Trizol法提取异色瓢虫总RNA[14],然后制备1%的琼脂糖凝胶用于电泳以检测抽提出的总RNA的质量,使用微量核酸测定仪NanoDropTM 2000测定RNA的浓度和纯度。接着使用反转录试剂盒TaKaRa PrimeScript RT Reagent Kit with gDNA Eraser合成cDNA的第一条链。采用Primer 5软件设计3个HaPYK双链RNA(dsRNA)特异性引物用于PCR反应(表1),1%的琼脂糖凝胶电泳方法检测PCR产物。对特异性且片段大小合适的条带进行切胶回收,根据胶回收试剂盒TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver. 4.0说明书的方法进行操作。使用载体pMD®18-T和DH5α感受态细胞对回收得到的PCR产物进行连接转化,随后将经过菌落PCR验证后的菌液送往浙江尚亚生物技术有限公司进行测序并返回质粒。使用带T7启动子的引物对测序正确的质粒进行交叉PCR反应,接着根据dsRNA合成试剂盒Promega T7 RiboMAXTM Express RNAi System说明书方法合成目的基因的dsRNA。同时,以注射绿色荧光蛋白(green fluorescent protein,GFP)基因的dsRNA为对照组,用相同的方法合成dsGFP。
Table 1
表1
表1dsRNA合成和实时荧光定量PCR所需引物
Table 1
| 引物名称 Primer name | 正向引物 Forward primer (5′-3′) | 反向引物 Reverse primer (5′-3′) | 用途 Application |
|---|---|---|---|
| dsHaPYK1-1 | ACATGGTCTTCGCCTCCTTCA | TGCAGCCAGACACTTAGCAGA | 合成dsRNA dsRNA synthesis |
| dsHaPYK1-2 | ACAAGGGACGCTGACACTGT | TCAAGTGTGCAGATCGTCCAGT | |
| dsHaPYK2 | ATAGTAACGTCGCGGTCACT | GATCCTCCTTTGATGCGCTG | |
| dsGFP | AAGGGCGAGGAGCTGTTCACCG | CAGCAGGACCATGTGATCGCGC | |
| dsHaPYK1-1-T7 | T7-ACATGGTCTTCGCCTCCTTCA | T7-TGCAGCCAGACACTTAGCAGA | |
| dsHaPYK1-2-T7 | T7-ACAAGGGACGCTGACACTGT | T7-TCAAGTGTGCAGATCGTCCAGT | |
| dsHaPYK2-T7 | T7-ATAGTAACGTCGCGGTCACT | T7-ATAGTAACGTCGCGGTCACT | |
| dsGFP-T7 | T7-AAGGGCGAGGAGCTGTTCACCG | T7-CAGCAGGACCATGTGATCGCGC | |
| qHaPYK1-1 | AGTTGACCACAGACAAGGCT | AGACAGCAGGTAGATCGACG | qRT-PCR |
| qHaPYK1-2 | CTGGACGATCTGCACACTTG | CACGAGCGTTCACATCTTGT | |
| qHaPYK2 | GCAAACTTGTTCAGCCAGGA | GCAGCCTGATGTTTCTCTCG | |
| qHaTRE1-1 | CTTCGCCAGTCAAATCGTCA | CCGTTTGGGACATTCCAGAT | |
| qHaTRE1-2 | TGACAACTTCCAACCTGGTAATG | TTCCTTCGAGACATCTGGCTTA | |
| qHaTRE1-3 | ACAGTCCCTCAGAATCTATCGTC | GGAGCCAAGTCTCAAGCTCATC | |
| qHaTRE1-4 | TTACTGCCAGTTTGATGACCAT | CATTTCGCTAATCAGAAGACCCT | |
| qHaTRE1-5 | TGATGATGAGGTACGACGAGA | GTAGCAAGGACCTAACAAACTG | |
| qHaTRE2-like | TTCCAGGTGGGAGATTCAGG | GGGATCAATGTAGGAGGCTGTG | |
| qHaTRE2 | CAATCAGGGTGCTGTAATGTCG | CGTAGTTGGCTCATTCGTTTCC | |
| qHaTPS | GACCCTGACGAAGCCATACC | AAAGTTCCATTACACGCAC | |
| qrp49 | GCGATCGCTATGGAAAACTC | TACGATTTTGCATCAACAGT |
新窗口打开|下载CSV
1.4 显微注射dsRNA
使用Eppendorf TransferMan® 4r显微注射系统进行注射。注射龄期为羽化第1天的瓢虫成虫,未区分雌雄;注射部位为瓢虫成虫腹部柔软部位;注射量为600 ng(浓度约5 000 ng·μL-1),注射后分别于48、72 h取材用于后续试验,试验材料未区分雌雄。1.5 实时荧光定量PCR(qRT-PCR)
使用TaKaRa TB Green® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒检测,PCR反应体系(20 μL)为正反向引物各1 μL,TB Green试剂10 μL,异色瓢虫cDNA 2 μL,灭菌水6 μL。PCR反应程序为95℃预变性30 s,95℃变性5 s,60℃延伸20 s,40个循环。以核糖体蛋白质49(ribosomal protein 49,rp49;GenBank登录号:AB552923)为内参基因[15],qRT-PCR数据采用2-ΔΔCT法进行分析[16]。1.6 糖含量与海藻糖酶活性的检测
将注射后3只成虫放进同一个离心管中,并进行3次生物学重复。每个样品先加入200 μL磷酸缓冲盐溶液(PBS)超声破碎30 min,然后用PBS溶液补足至1 000 μL。在4℃,1 000×g条件下离心20 min,将上清液转移到两个离心管中,各350 μL。一部分上清液用于检测海藻糖、糖原、蛋白质含量,另一部分上清液在4℃,20 800×g条件下继续离心60 min。然后取300 μL上清液用于检测葡萄糖、蛋白质含量及可溶性海藻糖酶活性,向原离心管中加入300 μL PBS混匀制成悬浮液,用于检测葡萄糖、蛋白质含量及膜结合型海藻糖酶活性。海藻糖含量通过蒽酮法检测,葡萄糖、糖原、酶活性的测定使用Sigma葡萄糖分析试剂盒,蛋白质含量使用贝博BCA试剂盒检测。具体试验步骤参考文献[14]。1.7 数据处理
使用Microsoft Office Excel 2010软件整理和分析试验数据。以dsGFP注射组为对照,采用IBM SPSS Statistics 20软件中独立样本T检验分析差异显著性,*:P<0.05, **:P<0.01。使用GraphPad Prism version 8.4.0软件绘制柱状图。2 结果
2.1 HaPYK理化性质
对3条异色瓢虫HaPYK的mRNA序列进行生物信息学分析,发现HaPYK1-1、HaPYK1-2、HaPYK2的开放阅读框分别为1 350、1 569、1 656 bp,蛋白大小分别为449、522、551 aa,其他具体信息见表2。Table 2
表2
表2HaPYK序列的基本理化性质
Table 2
| 基因 Gene | 登录号 Accession number | 开放阅读框长度 ORF length (bp) | 分子量 Molecular weight (Da) | 理论等电点Theoretical pI | 大小 Size (aa) | 原子总数 Total number of atoms | 脂肪系数 Aliphatic index | 不稳定系数 Instability index |
|---|---|---|---|---|---|---|---|---|
| HaPYK1-1 | MZ327965 | 1350 | 110346.47 | 5.04 | 449 | 14206 | 30.52 | 36.04 |
| HaPYK1-2 | MZ327966 | 1569 | 127708.83 | 5.02 | 522 | 16470 | 32.63 | 41.01 |
| HaPYK2 | MZ327967 | 1656 | 134975.87 | 5.01 | 551 | 17416 | 32.55 | 38.92 |
新窗口打开|下载CSV
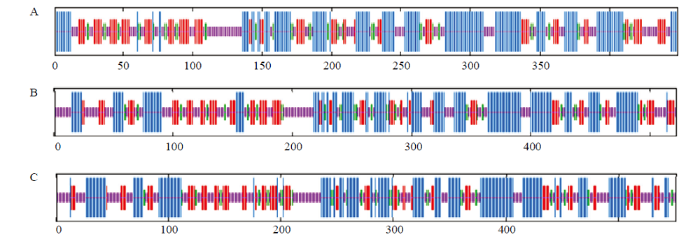
2.2 HaPYK序列结构预测
HaPYK1-1和HaPYK1-2氨基酸有两个特异性位点,分别是pyruv_kin和PykF(图1-A、1-B)。3条HaPYK均为Pyruvate_kinase超家族成员(图1)。利用SOPMA对3条HaPYK蛋白的二级结构进行预测(图2),发现HaPYK的开放阅读框蛋白序列的二级结构主要为α-螺旋(蓝色)和无规则卷曲(紫色),另外也含有延伸链(红色)和β-转角(绿色)。HaPYK1-1、HaPYK1-2、HaPYK2预测得到α-螺旋所占比例分别为37.64%、36.02%、35.93%;无规则卷曲所占的比例分别为30.73%、34.87%、36.48%;延伸链所占比例分别为21.60%、20.50%、19.96%;β-转角所占比例分别为10.02%、8.62%、7.62%。图3为三维结构预测结果,HaPYK1-1基于Template 6du6.1.A建立,序列同源性为72.79%,建模范围为2—440;HaPYK1-2和HaPYK2均基于Template 1aqf.1.A建立,序列同源性分别为52.64%和33.08%,建模范围分别为12—522、26—538。3条序列的寡聚物类型均为同源四聚体。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1HaPYK氨基酸序列的保守结构域预测
A: HaPYK1-1; B: HaPYK1-2; C: HaPYK2
Fig. 1Prediction of conserved domain of HaPYK amino acid sequences
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2HaPYK的二级结构预测
蓝色Blue:α-螺旋α-helix;紫色Purple:无规则卷曲Random coil;红色Red:延伸链Extended strand;绿色Green:β-转角β-turn
A: HaPYK1-1; B: HaPYK1-2; C: HaPYK2
Fig. 2Prediction of the secondary structure of HaPYKs
图3
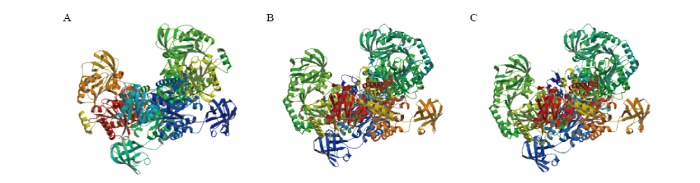 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3HaPYK蛋白的三维结构预测
A: HaPYK1-1; B: HaPYK1-2; C: HaPYK2
Fig. 3Three-dimensional structure prediction of HaPYK proteins
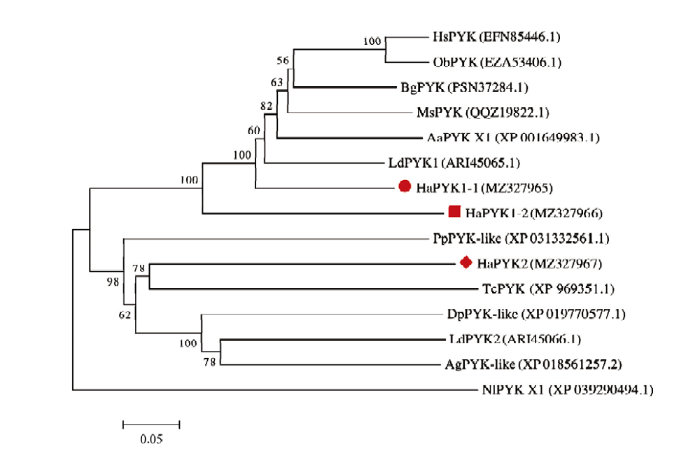
2.3 HaPYK的进化树分析
选取赤拟谷盗(Tribolium castaneum)、马铃薯甲虫(Leptinotarsa decemlineata)、埃及伊蚊(Aedes aegypti)、德国小蠊(Blattella germanica)、东方黏虫(Mythimna separata)等昆虫的丙酮酸激酶采用邻接法构建分子系统进化树(图4)。结果表明,HaPYK1-1和HaPYK1-2聚在一支,与同为鞘翅目的马铃薯甲虫PYK1(LdPYK1)亲缘关系更近。而HaPYK2与同为鞘翅目的赤拟谷盗PYK(TcPYK)聚为一支。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4基于氨基酸序列构建的HaPYK与其他昆虫丙酮酸激酶的系统进化树
图中分支上的数字表示Bootstrap验证中基于1000次重复该节点的可信度,丙酮酸激酶名称后面括号里的字母及数字为GenBank登录号The number on the branch in the figure represents the reliability of the node based on 1000 repetitions in Bootstrap verification, the letters and numbers in parentheses following the name of pyruvate kinase are the GenBank accession numbers。HsPYK:跳镰猛蚁丙酮酸激酶Harpegnathos saltator pyruvate kinase;ObPYK:毕氏卵角蚁丙酮酸激酶Ooceraea biroi pyruvate kinase;BgPYK:德国小蠊丙酮酸激酶Blattella germanica pyruvate kinase;MsPYK:东方黏虫丙酮酸激酶Mythimna separata pyruvate kinase;AaPYK X1:埃及伊蚊丙酮酸激酶亚型X1 Aedes aegypti pyruvate kinase isoform X1;LdPYK1、LdPYK2:马铃薯甲虫丙酮酸激酶1、丙酮酸激酶2 Leptinotarsa decemlineata pyruvate kinase 1, pyruvate kinase 2;HaPYK1-1、HaPYK1-2、HaPYK2:异色瓢虫丙酮酸激酶1-1、丙酮酸激酶1-2、丙酮酸激酶2 Harmonia axyridis pyruvate kinase 1-1, pyruvate kinase 1-2, and pyruvate kinase 2;PpPYK-like:萤火虫丙酮酸激酶样Photinus pyralis pyruvate kinase-like;TcPYK:赤拟谷盗丙酮酸激酶Tribolium castaneum pyruvate kinase;DpPYK-like:中欧山松大小蠢丙酮酸激酶样Dendroctonus ponderosae pyruvate kinase-like;AgPYK-like:光肩星天牛丙酮酸激酶样Anoplophora glabripennis pyruvate kinase-like;NlPYK X1:褐飞虱丙酮酸激酶亚型X1 Nilaparvata lugens pyruvate kinase isoform X1
Fig. 4Phylogenetic tree of HaPYK and pyruvate kinases from other insect species based on amino acid sequence
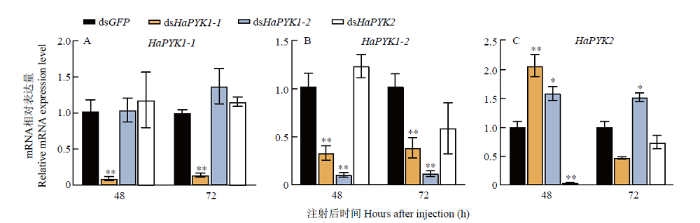
2.4 异色瓢虫目的基因干扰效果评价
注射dsHaPYK1-1后,在48和72 h检测到HaPYK1-1和HaPYK1-2在mRNA水平的表达量极显著降低,而HaPYK2在48 h表现为极显著升高(P<0.01)(图5)。当注射dsHaPYK1-2后,靶标基因HaPYK1-2在两个时间点的检测结果均表现为极显著下调(图5-B)。另外,HaPYK2的表达水平也受到影响,在48和72 h检测结果为显著升高(P<0.05)。而注射dsHaPYK2组与对照组相比,仅在48 h时HaPYK2极显著下调,在72 h后HaPYK2表达量上升,抑制作用减弱(图5-C)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5RNAi后HaPYK的mRNA相对表达量
数据为平均值±标准误,*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。下同
Fig. 5Relative mRNA expression levels of HaPYKs after RNAi
Data were presented as mean±SE. * indicated significant differences (P<0.05), **indicated extremely significant differences (P<0.01). The same as below
2.5 RNAi后对海藻糖代谢途径相关基因表达量的影响
研究结果显示,当抑制HaPYK1-1表达后72 h,qRT-PCR检测得到仅HaTRE1-4的表达水平显著下调(P<0.05)(图6-D),多个基因表现为上调,其中包括HaTRE1-1、HaTRE1-2、HaTRE2-like、HaTPS(图6-A、6-B、6-F、6-H)。dsHaPYK1-2组与对照dsGFP注射组相比,在48 h检测到HaTRE1-1、HaTRE1-3、HaTPS在mRNA水平的表达量显著升高(图6-A、6-C、6-H),在72 h检测到HaTRE1-1、HaTRE1-2、HaTRE1-5、HaTRE2、HaTPS表达水平也显著升高(图6-A、6-B、6-E、6-G、6-H)。注射dsHaPYK2后,与对照组相比,在48 h发现仅HaTRE1-1的表达量极显著上调(P<0.01)(图6-A),而HaTRE1-3、HaTRE1-4、HaTRE1-5的表达水平显著下降(图6-C、6-D、6-E),在72 h发现HaTRE1-3、HaTRE1-5、HaTRE2-like、HaTRE2的表达水平均表现为显著或极显著下调(图6-C、6-E、6-F、6-G)。图6
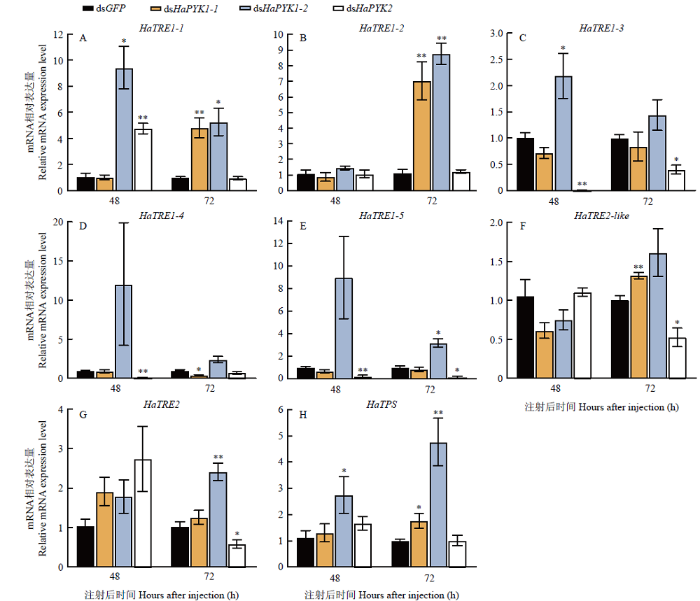 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6RNAi后异色瓢虫海藻糖代谢途径相关基因表达水平的变化
Fig. 6Changes in the expression levels of genes related to the trehalose metabolism pathway of H. axyridis after RNAi
2.6 HaPYK RNAi后对海藻糖酶活性的影响
与对照组相比,仅dsHaPYK1-2组的可溶性海藻糖酶的活性在48 h表现为极显著减弱(P<0.01)(图7-A)。根据图7-B结果显示,与注射dsGFP组相比,注射后72 h dsHaPYK组膜结合型海藻糖酶的活性均有所上升,其中dsHaPYK1-1和dsHaPYK2组具有显著性差异(P<0.01)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7RNAi后异色瓢虫海藻糖酶活性的变化
Fig. 7Changes in trehalase activities of H. axyridis after RNAi
2.7 HaPYK RNAi后葡萄糖、海藻糖及糖原含量的变化
与dsGFP组相比,注射dsHaPYK1-1和dsHaPYK2后48 h可以检测到葡萄糖含量极显著下降(P<0.01),而72 h葡萄糖含量在两组中表现为显著上升(P<0.05)(图8-A)。在注射后48 h,检测结果显示dsHaPYK1-2组海藻糖含量极显著上升(P<0.01),而dsHaPYK2组显著降低;在注射后72 h,dsHaPYK1-1和dsHaPYK2两组海藻糖含量均显著升高(P<0.05)(图8-B)。糖原含量在注射dsHaPYK1-2或dsHaPYK2后48 h极显著上升(P<0.01)(图8-C)。图8
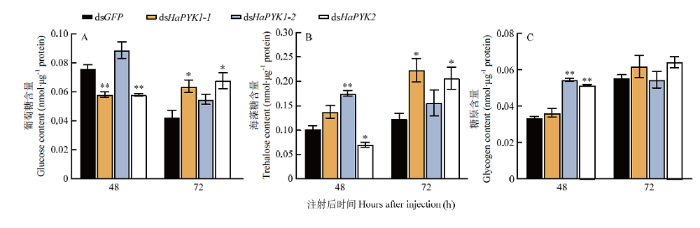 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8RNAi后异色瓢虫糖类含量的变化
Fig. 8Changes in carbohydrate content of H. axyridis after RNAi
3 讨论
目前,丙酮酸激酶基因在多种生物体内被鉴定和克隆,包括双翅目埃及伊蚊[17]、黑腹果蝇(Drosophila melanogaster)[18],半翅目褐飞虱(Nilaparvata lugens)[19]、桃蚜(Myzus persicae)[20],等翅目黑胸散白蚁(Reticulitermes chinensis)[21],鳞翅目家蚕(Bombyx mori)[22]。分析结果显示异色瓢虫3条HaPYK均属于Pyruvate_kinase超家族(图1),但在HaPYK2中未发现特异性位点,可能与所得的片段并非全长有关。在埃及伊蚊中鉴定出编码丙酮酸激酶的两种可变剪接的mRNA变体,即AaPYK1和AaPYK2[17]。蜜蜂和果蝇体内也存在多条能编码PYK的基因[19]。本文根据编码的蛋白与马铃薯甲虫LdPYK1和LdPYK2的亲缘关系(图4),分别命名为HaPYK1-1、HaPYK1-2、HaPYK2。张志林等研究表明,家蚕微孢子虫(Nosema bombycis)丙酮酸激酶的蛋白二级结构预测显示其含有38%的螺旋、21%的延伸片段和40%的无规则卷曲[23],同样地,异色瓢虫HaPYK也具有这些特征,但所占比例存在差异。大多数情况下,PYK是以相同亚基的四聚体形式存在[24,25],本研究结果与此一致(图3)。本研究首先检测了靶标基因的表达水平是否被成功抑制。结果显示,注射dsHaPYK1-1后48 h,不仅HaPYK1-1的表达水平显著下降,HaPYK1-2的表达水平也受到影响,但抑制程度不及HaPYK1-1(图5)。这可能是由于HaPYK1-1和HaPYK1-2的序列同源性较高,合成的dsHaPYK1-1片段同时也作用于HaPYK1-2。合成的dsHaPYK1-2和dsHaPYK2的特异性高,只作用于靶标基因(图5)。由此可证明本研究RNAi效果明显,后续试验结果可靠。但当HaPYK1-1和HaPYK1-2被抑制表达时,HaPYK2的表达水平显著上升,推测HaPYK2可能具有协调平衡的作用。在弓形虫(Toxoplasma gondii)中表达两种PYK,虽然数据表明PYK1为主要酶,但是在PYK1耗尽时,PYK2就表现出其重要性[26]。由此可见,昆虫可能通过调节多个PYK的表达水平来维持丙酮酸稳态。
昆虫的各类生命活动离不开能量代谢,其中海藻糖代谢尤为重要。研究证实,海藻糖用于细胞代谢之前必须先由海藻糖酶分解成葡萄糖,然后葡萄糖可用于合成糖原或者通过糖酵解以及戊糖磷酸途径被分解[27]。糖原可经过多步反应转化为尿苷二磷酸葡萄糖,接着可在TPS和TPP的催化下合成海藻糖[14]。为满足细胞需求,葡萄糖转化为丙酮酸的速率受到己糖激酶、磷酸果糖激酶和丙酮酸激酶的严格调控[25]。本研究结果表明,HaPYK与海藻糖代谢关键基因之间调节关联。注射dsHaPYK1-1后48 h,所测基因的表达水平均无差异性变化,推测与检测时间有关,影响可能延迟;进一步检测72 h的影响情况,发现部分HaTRE的表达水平升高,而HaTRE1-4等基因表现为下调表达,推测以上结果综合导致海藻糖酶(TRE)活性无显著性变化(图6、图7)。另外,dsHaPYK1-1注射组瓢虫海藻糖在72 h时积累可能是受HaTPS表达水平增加的影响,但HaTRE的表达水平上调又促进海藻糖转化为葡萄糖(图6、图8)。在dsHaPYK1-2组中,推测在可溶性海藻糖酶(TRE1)活性降低,HaTPS表达量增加的共同作用下使得48 h时海藻糖含量升高,之后在海藻糖酶的催化下海藻糖不断被消耗利用,从而导致含量减少(图6—图8)。然而,生物体内的调控机制是精密而复杂的,如dsHaPYK2组中2个HaTRE2的表达水平显著下调,但膜结合型海藻糖酶(TRE2)的活性却增加(图6、图7)。推测原因在于基因转录水平到酶代谢水平中间还存在有待研究的调控机制。此外,3个HaPYK单独被RNAi后,引起3个基因的表达水平存在差异(图5),进而导致对海藻糖代谢途径的影响情况不同。在关于弓形虫的研究中也提到,敲除PYK1后会提高丙酮酸上游的大多数糖酵解代谢物,包括葡萄糖-6-磷酸、果糖-6-磷酸、磷酸烯醇式丙酮酸的丰度,而丙酮酸、乳酸、谷氨酰胺、谷氨酸的水平降低[26]。这些结果表明PYK在生物碳代谢中起着稳态的作用。结合三唑磷和dsPYK处理,GE等检测发现褐飞虱体内可溶性糖含量降低[19]。除了PYK外,磷酸果糖激酶(PFK)也是糖酵解通路的限速酶,邱玲玉研究发现调低其表达后,褐飞虱海藻糖酶基因TRE1-1、TRE1-2、TRE2的表达量显著下调,膜结合型海藻糖酶活性明显下降,海藻糖含量无差异表现,葡萄糖和糖原含量显著上升[28]。综上可知,糖酵解与海藻糖代谢之间联系紧密。实际上,不仅PYK可调控碳水化合物水平,反之碳水化合物水平也可对PYK产生影响。在哺乳动物中,PYK以4种不同的组织特异性同工酶L、R、M1和M2类型存在[29]。FAN等[30]在草鱼(Ctenopharyngodon idella)中克隆得到3个PYK,分别为PYKL、PYKMa和PYKMb,且发现饲喂草鱼高碳水化合物饲料会显著提高PYK的表达水平。总体来看,抑制PYK表达会对海藻糖代谢产生影响。
雌激素相关受体(ERR)在发育、能量代谢中起着不可或缺的作用,已有多篇论文证实ERR和糖酵解限速酶(己糖激酶、丙酮酸激酶、磷酸果糖激酶)之间存在调节关联,从而调控能量代谢影响昆虫胚胎发育和繁殖力[20,22,31]。在埃及伊蚊和黑腹果蝇胚胎发生过程中,丙酮酸激酶的活性也被证明升高,表明在胚胎中糖酵解增加[18,32]。从中可以推断出丙酮酸激酶可能在昆虫繁殖力中起作用。GE等[19]研究表明,褐飞虱NlPYK可能通过增加葡萄糖代谢而在昆虫繁殖力中起作用。然而,在异色瓢虫中未见报道,将来可进一步研究HaPYK表达与成虫繁殖力之间的关系。
4 结论
异色瓢虫体内存在3个HaPYK,HaPYK属于Pyruvate_kinase超家族,二级结构较简单,以相同亚基的四聚体形式存在。此外,通过RNAi技术能成功干扰靶标基因的表达水平,且抑制表达后海藻糖代谢会受到影响,但3个HaPYK的调控机制存在差异。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1002/pro.505URL [本文引用: 1]
DOI:10.1006/bbrc.2000.3238URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.18632/aging.v10i5URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/BF00687476URL [本文引用: 1]
DOI:10.1016/j.pestbp.2005.01.002URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1111/imb.2005.14.issue-5URL [本文引用: 1]
DOI:10.1186/1471-2199-9-51URL [本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
DOI:10.1038/s41598-018-20612-wURL [本文引用: 1]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
DOI:10.1016/j.ibmb.2018.12.010URL [本文引用: 2]
DOI:10.1089/10445490252810267URL [本文引用: 2]
[本文引用: 4]
DOI:10.1016/j.ibmb.2021.103529URL [本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1111/imb.v29.2URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1074/jbc.M001870200URL [本文引用: 1]
DOI:10.1002/pro.v28.10URL [本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1042/bj3370001URL [本文引用: 1]
DOI:10.1007/s10695-019-00688-5URL [本文引用: 1]
DOI:10.1016/j.cmet.2011.01.005URL [本文引用: 1]
DOI:10.1186/1471-213X-10-25URL [本文引用: 1]
