 ,, 吴晓宇, 杨柳, 段巧红
,, 吴晓宇, 杨柳, 段巧红 ,, 黄家保
,, 黄家保 ,山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018
,山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018Genome-Wide Identification and Expression Analysis of ACA Gene Family in Brassica rapa
WANG Jie ,, WU XiaoYu, YANG Liu, DUAN QiaoHong
,, WU XiaoYu, YANG Liu, DUAN QiaoHong ,, HUANG JiaBao
,, HUANG JiaBao ,College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 270108, Shandong
,College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 270108, Shandong通讯作者:
责任编辑: 赵伶俐
收稿日期:2021-01-25接受日期:2021-06-1
| 基金资助: |
Received:2021-01-25Accepted:2021-06-1
作者简介 About authors
王洁,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (7047KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王洁, 吴晓宇, 杨柳, 段巧红, 黄家保. 大白菜ACA基因家族的全基因组鉴定与表达分析. 中国农业科学, 2021, 54(22): 4851-4868 doi:10.3864/j.issn.0578-1752.2021.22.012
WANG Jie, WU XiaoYu, YANG Liu, DUAN QiaoHong, HUANG JiaBao.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】大白菜(Brassica rapa L. ssp. pekinensis)为十字花科芸薹属作物,属于孢子体自交不亲和型植物,在育种生产中常喷施2%—3%食盐水来克服大白菜自交不亲和以进行亲本留种[1]。盐害和冷害也常影响大白菜的生长和产量。钙离子信号转导是植物响应各种环境因子的重要机制,逆境条件下细胞质钙离子浓度升高,引发一系列钙依赖的下游信号传递。Ca2+-ATPase(ACA)作为调节细胞内钙离子浓度的重要蛋白质之一,维持细胞内钙离子浓度的平衡[2,3]。ACA是Ca2+-ATPase最重要的亚家族成员之一,在维持细胞内钙离子浓度的平衡方面发挥着重要作用。【前人研究进展】钙离子作为第二信使,在动植物一生中都具有重要作用。PUTENEY[4]在1986年首次报道了细胞内钙离子内流的相关信息。钙离子ATP泵(又称P型ATP酶)[5]最早可以追溯到英国科学家Ringer在1885年发现钙离子对动物肌肉收缩有影响[6],10年后科学家们获得肌浆网钙泵氨基酸序列[7]。近些年拟南芥[8,9]、番茄[10,11]、水稻[12,13]、甘蓝[14]、大豆[15]和苜蓿[16]等植物陆续有钙泵的编码序列被报道。ACA蛋白属于P型ATP酶超级组基因家族的钙离子泵,典型的ACA基因家族蛋白,具有Haloacid dehalogenase- like hydrolase功能域、C端Cation transporting ATPase功能域、E1-E2 ATPase功能域和N端Cation transporter/ ATPase功能域4个高度保守的功能结构域[17]。根据其蛋白序列N端有无自抑结构域,分为内质网膜型钙离子泵和自抑制型钙离子泵[18,19,20]。目前在拟南芥、水稻、大豆和苜蓿的ACA基因家族已经作了比较全面地分析。拟南芥ACA基因家族有13个成员,其中AtACA3、AtACA5和AtACA6为内质网膜型钙离子泵;AtACA1、AtACA2、AtACA4、AtACA7、AtACA8、AtACA9、AtACA10、AtACA11、AtACA12和AtACA13属于自抑制型钙离子泵[21,22,23]。有数据显示定位于质膜上的AtACA8在拟南芥的所有器官中均有表达,同样在拟南芥所有器官表达的还有与其高度同源的AtACA10,拟南芥幼苗期外施植物激素脱落酸使AtACA8和AtACA10表达量显著升高[24]。已有研究表明与野生型相比,拟南芥突变体aca8在冷害和高温胁迫下,抗逆性增强[8]。还有研究表明,AtACA9、AtACA10和AtACA13在拟南芥有性生殖方面扮演着重要角色[24],AtACA6对提高盐离子毒害的耐受性有至关重要的作用[25]。水稻ACA基因家族由15个成员组成,其中有3个属于内质网膜型钙离子泵,12个属于自抑制型钙离子泵。水稻OsACA6在烟草中表达会积累大量的脯氨酸,从而增强烟草的抗盐和抗旱能力[26]。大豆的ACA基因家族有29个基因成员,其中有5个属于内质网膜型钙离子泵,24个属于自抑制型钙离子泵。大豆中,SUN等[15]研究证实,野生大豆Ca2+-ATPase(GsACA1)在调节植物对碳酸盐碱性和中性盐胁迫的耐受性方面有积极效果。苜蓿Ca2+-ATPase家族由16个成员组成,其中3个属于内质网膜型钙离子泵,13个属于自抑制型钙离子泵。研究发现苜蓿ACA基因家族的蛋白序列具有高度保守性,其中MtACA8和MtACA9在响应低温胁迫过程中可能发挥着重要作用[19]。大白菜中同属于Ca2+-ATP亚家族且具有钙运输功能的ECA基因家族在生长发育过程中发挥重要作用[27]。【本研究切入点】大白菜作为人们日常餐桌上的重要蔬菜,ACA蛋白可能在其育种和生产过程中的自交不亲和、盐胁迫和冷胁迫等诸多方面发挥作用,而BraACAs相关的鉴定和功能解析还未见报道。【拟解决的关键问题】本研究拟通过生物信息学手段鉴定出大白菜ACA基因家族成员,并进行特征分析和表达分析,为研究大白菜ACA家族基因的功能、基因编辑育种和开发分子标记进行辅助育种奠定基础。1 材料与方法
试验于2020年在山东农业大学国家重点实验室和南校实验站进行。1.1 大白菜ACA基因家族成员鉴定及基本理化性质分析
在TAIR(1.2 系统进化树的构建与绘制基因结构图
运用MEGA 5.0软件对大白菜ACA基因家族蛋白按照邻近法构建系统进化树,校验参数步值(bootstrap)设置为1 000,其余参数均为默认值,通过GSDS(1.3 染色体定位和启动子元件分析
利用TBtools对BraACAs家族基因进行染色体位置分析,并同拟南芥ACA家族基因在McscanX进行共线性分析[33,34],参数默认。选择BraACA家族基因上游2 000 bp的序列,利用在线工具plantCARE(1.4 蛋白保守结构域分析与序列比对
利用在线软件Pfam(1.5 大白菜总RNA的提取和qRT-PCR分析
材料取自植物培养室。组织特异性表达研究分别取‘848蛋黄白’植株定植2个月后的根、茎、叶、当天开放的花、果荚以及冷胁迫(4℃处理0、2、4、6和12 h)与盐胁迫(150 mmol∙L-1 NaCl处理0、2、4、6和12 h)处理一定时间后的幼苗。均取3个生物学重复。采用Universal RNA Extraction Kit试剂盒(Bioteke Corporation)提取总RNA,1%琼脂糖凝胶电泳评估RNA的完整性,分光光度计(Thermo Nano Drop One)测量RNA浓度和纯度。利用HiScript® II Q RT SuperMix for qPCR Sample试剂盒(诺唯赞)进行反转录反应获得cDNA,稀释十倍后-20℃保存备用。
qRT-PCR的反应体系:2×SYBR qPCR Master Mix 10.0 μL,上、下游引物(10 μmol∙L-1)各0.4 μL,cDNA模板1.0 μL,ddH2O 8.2 μL,总反应体系20 μL。反应程序:95℃,30 s;95℃,10 s,60℃,22 s,40个循环;95℃,25 s,60℃,60 s,95℃,7 s。内参使用BraActin 2。3个技术重复。采用2-∆∆CT法[37]对数据进行分析,使用Excel进行数据汇总,TBtools作图。引物序列见表1,使用qPrimerDB-qPCR Primer Database(
Table 1
表1
表1qRT-PCR引物
Table 1
| 基因名称 Gene name | 上游引物(5´-3´) Forward primer (5´-3´) | 下游引物(5´-3´) Reverse primer (5´-3´) |
|---|---|---|
| Bra017841 | AAAAGCTTCTGGGTGTTCGTAT | GGTAGCTATCCCAACGATCAAA |
| Bra039940 | ACCAGAATTTTGACGTTAAGGC | GAGATAAATTGGAATGCGGCTT |
| Bra010605 | GCTGTTGGTTCAGTCGATATTC | GGCTCAACTTTCACCACTTTAC |
| Bra010917 | GAAGCTTCAAGATGGTTCTCAC | ATTGTCTCACAAGCAGCTAGAT |
| Bra023790 | TCGACAAGCTTACTTCTTCGAT | ATCGCTTTTCGTATTCTTTCCG |
| Bra033900 | GTCTGCTACCACTATCTGTACC | TTGATTCTAAACCGGACCAGAA |
| Bra023899 | TCAAGCACTAAGGAAAAACGG | ATATTTGCATACACAGAACGGC |
| Bra031259 | AATAACGGTGATGGGTAGATCC | ATATTTGCATACACAGAACGGC |
| Bra016926 | ATCTCTGACGTCATTGAAGGTT | AATCGCTTTAGCTGTGCTTATG |
| Bra003276 | GCTGATGTGATCATAATGGACG | ATACAAAGTTGATGATCAGCGC |
| Bra007319 | GTATCCATCGTGAAAAACCGAG | GTTTATATTCTGTCCGTGCACC |
| Bra019960 | GTGATTCTGCTGATATTGGCTG | GCTATATTTGCTTGGTAGGCAC |
| Bra031701 | TTCTGTCACGCCATTGTCCT | GGTCTATGGCAAGGCAAGGT |
| Bra002762 | GAGAGTTCGGACATCATCATCT | GTTAATGATAAGAGCAGCGACG |
| Bra035649 | GTAGTATTTACGTCCCAGAGGG | AGAATAGAAGACTGCGATCTGG |
| Bra011144 | GCTCATAATACAACTGGCAGTG | GCATCGAAATTCATGCCTAACT |
| Bra024117 | CTTGTCGTCCGCTATTTTACTG | TAGGCAAGAGTCAAGGTAACAG |
| Bra037404 | CGGAGATAGGCAAGATACAGAG | TGTAGTTGATGATCCAGACGAG |
| BraActin2 | CGGTGTCATGGTTGGGAGA | CGTGCTCGATGGGGTACTTC |
新窗口打开|下载CSV
1.6 亚细胞定位
根据BraACAs的CDS序列,用CE Design V1.04(诺维赞)软件设计携带同源臂的PCR扩增引物(表2)。以大白菜cDNA作为模板,对其基因片段进行扩增。反应条件为:95℃预变性3 min,95℃变性15 s,55℃退火15 s,72℃延伸3 min,34个循环;72℃彻底延伸5 min。片段回收后与35S-GFP/pCAMBIA1300载体通过同源重组的方法进行连接。构建好的融合载体热击转化大肠杆菌感受态DH5α,涂抗性板。第2天长出单菌落后挑单克隆小量培养,提取质粒,测序鉴定。鉴定正确后转化农杆菌GV3101感受态,PCR鉴定。最后挑单菌落摇菌,注射烟草叶片,2—3 d后在荧光显微镜(Nikon DS-Ri2,Japan)下观察GFP表达情况并拍照、分析。Table 2
表2
表2部分克隆基因引物序列
Table 2
| 引物名称 Primer name | 正向引物(5´-3´) Forward primer(5´-3´) | 反向引物(5´-3´) Reverse primer(5´-3´) |
|---|---|---|
| Bra002762-pCAMBIA1300-GFP | ATGACCAGTCCCTTCAAGCCA | GAGTGAACCTTCTCCAGAAGATTTTT |
| Bra035649-pCAMBIA1300-GFP | ATGACTAGCCTCTTCAAGCAATCTC | CAAGGCTTCAAAAGTTTGTTGTTT |
| Bra031701-pCAMBIA1300-GFP | ATGGAAGACGCTTACGCCAG | CGCCGGTCCTTGGGGAGT |
| Bra024117-pCAMBIA1300-GFP | ATGAGTGGTGGACAAGGACAGTT | ACCTGATGAATTCCTTCTCCATCG |
| Bra003276-pCAMBIA1300-GFP | ATGTCTAATCTCCTCAAGGATTTTCA | GGCAGAGTCAGATGGACCAGAA |
新窗口打开|下载CSV
2 结果
2.1 大白菜ACA基因家族成员信息
运用生物信息学手段鉴定出18个BraACAs家族成员,并对其理化性质进行分析(表3)。BraACAs家族成员分子量在110 370.20 Da(Bra017841)—119 249.50 Da(Bra023899),平均分子量114 171.00 Da;CDS平均长度为3 142 bp;蛋白的平均长度约1 047 aa;理论等电点在5.06(Bra019960)—8.75(Bra023790),平均理论等电点为6.28;BraACAs基因家族蛋白均定位在细胞质膜,除Bra023899跨膜结构数量为10,其余BraACAs蛋白跨膜结构数量为7和8。同时利用模式植物拟南芥对BraACAs基因家族进行同源比对分析,得到比对结果最高相似度的基因(表3)。Table 3
表3
表3大白菜ACA基因家族成员信息
Table 3
| 基因ID Gene ID | 理论等电点 pI | 分子量 Molecular weight (Da) | CDS长度 CDS length (bp) | 氨基酸 No. of amino acids (aa) | 亚细胞定位 Subcellular location | 跨膜结构数量 Number of membrane spanning domain | 拟南芥对应ID Arabidopsis corresponds ID |
|---|---|---|---|---|---|---|---|
| Bra017841 | 5.58 | 110370.20 | 3045 | 1015 | 细胞质膜Plas | 8 | AT4G37640 |
| Bra039940 | 5.65 | 110609.40 | 3045 | 1015 | 细胞质膜Plas | 8 | AT2G22950 |
| Bra010605 | 5.45 | 112318.20 | 3093 | 1031 | 细胞质膜Plas | 8 | AT4G37640 |
| Bra010917 | 5.40 | 110689.40 | 3054 | 1017 | 细胞质膜Plas | 8 | AT1G27770 |
| Bra023790 | 8.75 | 112419.20 | 3054 | 1018 | 细胞质膜Plas | 8 | AT3G22910 |
| Bra033900 | 8.28 | 112171.60 | 3048 | 1016 | 细胞质膜Plas | 8 | AT3G22910 |
| Bra023899 | 6.16 | 119249.50 | 3291 | 1097 | 细胞质膜Plas | 10 | AT3G21180 |
| Bra031259 | 6.09 | 119273.50 | 3288 | 1096 | 细胞质膜Plas | 8 | AT3G21180 |
| Bra016926 | 5.43 | 112256.90 | 3099 | 1033 | 细胞质膜Plas | 8 | AT2G41560 |
| Bra003276 | 6.08 | 111847.50 | 3078 | 1026 | 细胞质膜Plas | 8 | AT3G57330 |
| Bra007319 | 5.84 | 111456.90 | 3066 | 1022 | 细胞质膜Plas | 8 | AT3G57330 |
| Bra019960 | 5.06 | 113187.20 | 3138 | 1046 | 细胞质膜Plas | 7 | AT1G10130 |
| Bra031701 | 5.26 | 118294.80 | 3256 | 1086 | 细胞质膜Plas | 8 | AT1G10130 |
| Bra002762 | 8.03 | 116025.10 | 3222 | 1074 | 细胞质膜Plas | 7 | AT5G57110 |
| Bra035649 | 7.81 | 116661.70 | 3231 | 1077 | 细胞质膜Plas | 7 | AT5G57110 |
| Bra011144 | 6.48 | 116775.40 | 3210 | 1070 | 细胞质膜Plas | 8 | AT5G57110 |
| Bra024117 | 6.39 | 115856.20 | 3186 | 1062 | 细胞质膜Plas | 8 | AT4G29900 |
| Bra037404 | 5.31 | 115615.30 | 3165 | 1055 | 细胞质膜Plas | 8 | AT4G00900 |
| 平均数 Average | 6.28 | 114171.00 | 3142 | 1047 | \ | \ | \ |
新窗口打开|下载CSV
2.2 大白菜ACA家族系统进化与基因结构分析
利用大白菜ACA家族蛋白序列构建系统进化树(图1-A)。大白菜18个BraACA家族成员根据亲缘关系的远近可分为4类,命名为Group Ⅰ、Group Ⅱ、Group Ⅲ和Group Ⅳ,各组中分别含有3、4、4和7个BraACAs,其中在Group Ⅰ、Group Ⅱ、Group Ⅲ步长值高达99%的分别为Bra003276/Bra007319,Bra031259/Bra023899和Bra002762/Bra035649,GroupⅢ和GroupⅣ步长值为98%的分别为Bra039940/ Bra017841和Bra019960/Bra031701,进一步说明构建的BraACAs蛋白间进化关系比较可靠(图1-A)。同时利用在线软件GSDS绘制大白菜ACA家族基因结构图(图1-B),结果表明大白菜ACA基因家族成员之间的内含子数量差异较大(0—33个),5个内含子以下的BraACAs有3个,5—20个内含子的BraACAs有7个,20个以上内含子的BraACAs有8个。其中20个以上的主要集中在Group Ⅳ,除Bra037404外,其他均具有相同的内含子-外显子组成模式,即33-34(33个内含子,34个外显子)。Group Ⅱ直观上观察可以分为2种组成模式,即Bra023899/Bra031259和Bra023790/Bra33900。结果显示大白菜ACA蛋白家族成员间基因结构存在差异。图1
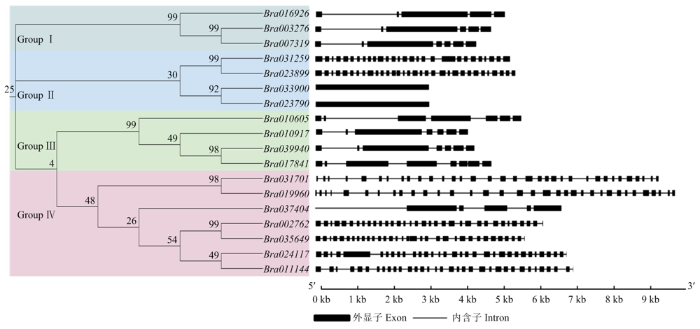 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1大白菜ACA基因家族系统进化树与基因结构图
Fig. 1Phylogenetic tree and gene structure of ACA gene family in Brassica rapa
2.3 大白菜ACA家族基因染色体定位及与拟南芥基因的共线性分析
根据基因位置文件对18个BraACAs家族基因染色体定位进行分析(图2),结果显示其不均匀分布在大白菜10条染色体上,其中9号染色体上的基因最多,含有4个成员;其次是1号染色体上有3个基因成员;3号、5号和8号分别各有2个基因成员;2号、4号、6号、7号和10号染色体分别仅有1个基因成员(图2-A),进一步分析发现Bra023790/ Bra023899、Bra010605/Bra010917存在基因重复现象(图2-B),同时还存在片段复制情况,发现了6对片段复制基因,分别为Bra011144和Bra024117、Bra023899和Bra031259、Bra035649和Bra002762、Bra017841和Bra010605、Bra016926和Bra007319、Bra007319和Bra003276,表明BraACAs基因家族某些成员之间的基因功能具有相似性。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2大白菜与拟南芥ACA基因在染色体上的位置及基因重复事件
Fig. 2Synteny analysis and gene duplication events ACA genes between Brassica rapa and Arabidopsis
为了更好地了解大白菜ACA家族基因所具备的功能,参照已详细报道过的拟南芥AtACAs进行直接同源基因比对,预测大白菜ACA家族所具有的生物学功能。通过对拟南芥和大白菜ACA基因家族进行共线性分析,结果显示16对AtACA/BraACA处于共线性区域,分别是AT1G10130/Bra019960、AT1G10130/Bra031701、AT2G41560/Bra016926、AT2G41560/Bra007319、AT2G22950/Bra039940、AT3G21180/Bra023899、AT3G22910/Bra023790、AT3G21180/Bra031259、AT3G22910/Bra033900、AT3G57330/Bra003276、AT4G29900/Bra011144、AT4G29900/Bra024117、AT4G37640/Bra010605、AT4G00900/Bra037404、AT5G57110/Bra035649、AT5G57110/Bra002762(图2-B)。
2.4 大白菜ACA基因家族启动子元件分析
启动子元件分析发现,大白菜ACA基因家族均含有较多的光响应元件,50%以上的BraACAs含有低温和干旱响应元件,80%以上含有厌氧诱导应答元件,40%以上有茉莉酸甲酯、脱落酸、赤霉素与脱落酸响应元件,其中Bra031259和Bra031701包含水杨酸响应元件,还有部分基因有分生组织、根特异性、生物钟等响应元件,暗示大白菜ACA基因家族参与光合作用、生长发育等过程,同时在大白菜应对逆境胁迫方面也发挥着重要作用(图3)。图3
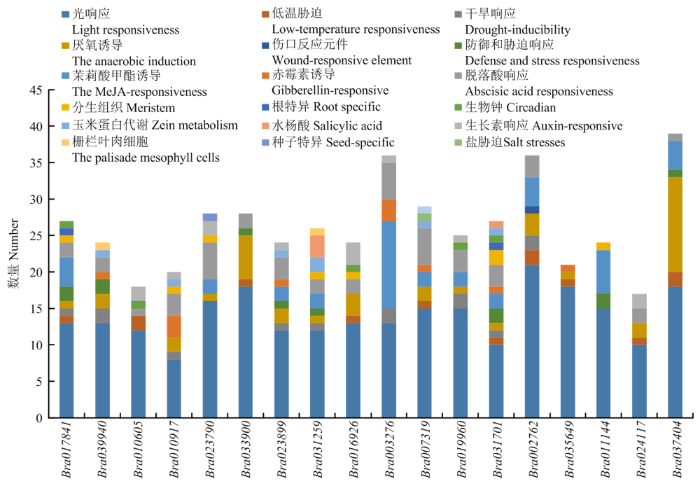 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3大白菜ACA家族基因启动子元件分析
Fig. 3Analysis of cis-elements in promoter of ACA family genes in Brassica rapa
2.5 大白菜ACA家族成员蛋白保守结构域分析
利用在线工具Pfam和MEME分别对大白菜ACA家族蛋白保守结构域进行分析(图4),获得了10个保守基序,分别命名为Motif 1—Motif 10,大白菜ACA家族均含有Motif 1、Motif 3、Motif 6和Motif 10保守基序(图4)。通过进一步分析发现Motif 1末端含有连续高度保守的天冬氨酸(D)-赖氨酸(K)-苏氨酸(T)-甘氨酸(G)-苏氨酸(T)-亮氨酸(L)-苏氨酸(T)等7个氨基酸,Motif 3前端含有连续高度保守的亮氨酸(L)-亮氨酸(L)-色氨酸(W)-缬氨酸(V)-天冬氨酸(N)等5个氨基酸,Motif 6含有4个不连续高度保守的甘氨酸(G)(图4)。对蛋白的保守功能域进行分析,发现大白菜ACA基因家族蛋白的4个保守功能域分别对应着4个保守基序(图4和图5),即Haloacid dehalogenase-like hydrolase功能域对应Motif 1,C端Cation transporting ATPase功能域对应Motif 3,E1-E2 ATPase功能域对应Motif 6以及N端Cation transporter/ATPase功能域对应Motif 10。除此之外,发现大白菜ACA基因家族蛋白的N端自抑制功能域存在于13个BraACAs家族成员中,即Bra017841、Bra039940、Bra010605、Bra010917、Bra023899、Bra031259、Bra016926、Bra003276、Bra007319、Bra002762、Bra035649、Bra011144和Bra024117。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4大白菜ACA家族基因成员蛋白保守结构域分析
Fig. 4Characterization conserve domains within the Brassica rapa ACA family protein
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5大白菜ACA家族保守结构域蛋白序列比对
Fig. 5Alignment of conserved motifs of the Brassica rapa ACA family
2.6 BraACAs家族基因表达分析
2.6.1 组织特异性表达分析 利用qRT-PCR技术鉴定BraACA基因家族各成员在大白菜不同器官中的表达,以根的表达量作为对照,显示大多数BraACAs在大白菜果荚中高表达,其次是花,而在根、茎和叶片中的表达量普遍偏低(图6)。其中Bra031259在果荚和花中的表达量都最高,除此之外,在果荚中表达量由高到低依次是Bra039940、Bra023899和Bra035649,在花中表达量由高到低依次是Bra023899和Bra035649;Bra016926在大白菜茎和叶片中表达最高,其余基因在茎和叶片中的表达都略低。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6BraACAs在大白菜不同器官的表达分析
Fig. 6Expression of BraACAs in different organs of Brassica rapa
2.6.2 冷胁迫下的表达 大白菜生产过程中经常面临冷害威胁。对BraACA家族在冷胁迫不同时间后的表达情况进行分析(图7),发现除Bra031259、Bra002762和Bra035649外,其余基因的表达量随冷胁迫时间的延长呈“降-升-降”的趋势;Bra031259的表达量随冷胁迫时间的延长呈“降-升-降-升”的趋势;而Bra002762和Bra035649这2个基因最值得关注,在受到冷胁迫的前6 h内呈现递增上升的趋势,最具规律性。前期在对这2个基因上游2 000 bp启动子序列的元件分析发现分别含有2和1个低温响应元件(图3),同时发现Bra002762、Bra035649与AtACA8(AT5G57110)相似性较高(表3),对这3个基因蛋白序列进行比对发现其相似性为94.21%(图8),前期有研究表明AtACA8在拟南芥抵抗冷胁迫发挥重要作用,本研究qRT-PCR表明Bra002762和Bra035649在低温环境下表达量上调,这与拟南芥研究结果类似[8]。
图7
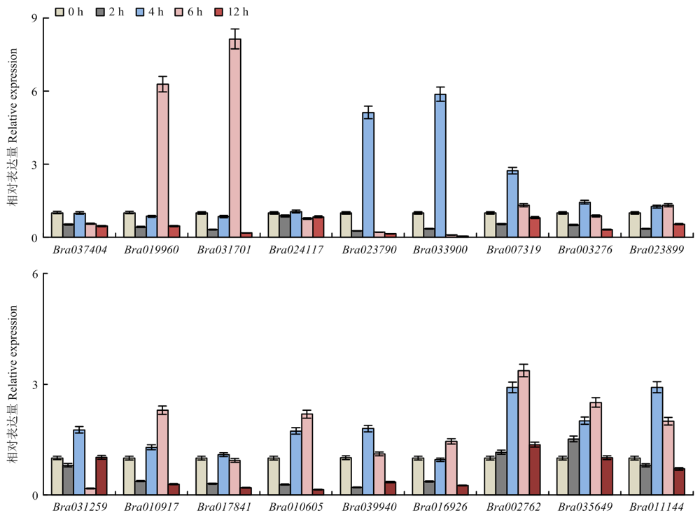 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7BraACAs冷胁迫处理不同时间下基因表达情况
Fig. 7Expression analysis of BraACAs under cold stress at different time points
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8Bra0002762,Bra035649和AT5G57110蛋白序列比对
Fig. 8Alignment of the amino acid sequences Bra0002762, Bra035649 and AT5G57110
2.6.3 盐害处理下的表达 Bra039940和Bra023790在受到盐胁迫后表达量变化最为显著,相比对照,分别上调了4倍和3倍(图9)。大多数ACA基因成员表达量在受到盐胁迫后呈现下调趋势,Bra019960、Bra035649、Bra010605和Bra002762在受到盐胁迫12 h内,基因表达量趋于稳定。其中Bra031701在受到盐胁迫后表达量呈现明显上升的趋势,前期对启动子元件分析发现其含有2个茉莉酸甲酯响应元件(图3),大量试验数据显示茉莉酸甲酯可以有效地缓解盐胁迫对植物的危害[38,39]。与拟南芥同源比对,发现Bra031701与AtACA6(AT1G10130)相似性较高(表3),蛋白比对结果显示其相似性为85.70%(图10),已有文章报道AtACA6在缓解盐害方面有显著作用[25],这与定量结果相吻合。
图9
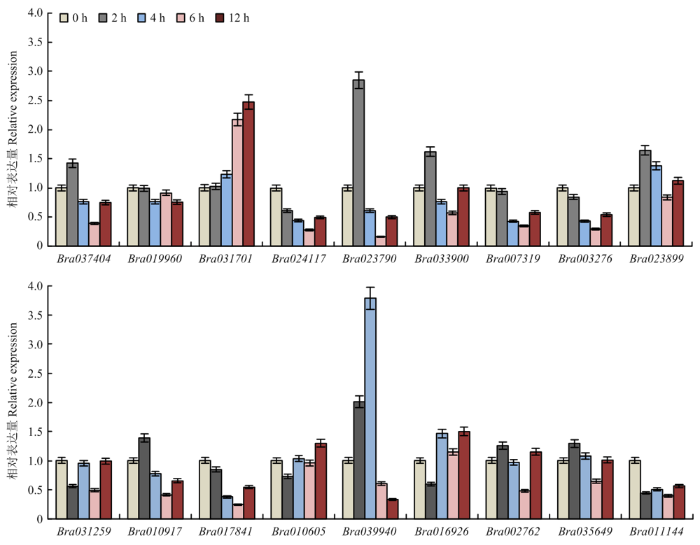 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9BraACAs盐胁迫处理不同时间下基因表达情况
Fig. 9Expression analysis of BraACAs under salt stress at different time points
图10
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10Bra031701和AT1G10130蛋白序列比对
Fig. 10Alignment of the amino acid sequences Bra031701 and AT1G10130
2.6.4 在大白菜中不亲和/亲和反应中的表达 提取大白菜初花期的柱头总RNA,进行RNA-seq测序,获取柱头中基因的表达量信息。结果表明,18个成员中大约一半的基因属于低表达基因(FPKM≤10),中表达基因(10<FPKM≤40)相对较多,而高表达的基因(FPKM>40)较少[40],Bra024117表达水平最高(图11)。以大白菜未授粉、自交授粉(发生不亲和反应)和异交授粉(发生亲和反应)柱头为模板,选取大白菜ACA家族中部分花期高表达量基因进行定量PCR检测,发现Bra035649、Bra023899、Bra011144、Bra010917、Bra017841、Bra023790及Bra003276无论是自交还是异交授粉后的基因表达量与未授粉时基因表达量差异较小,有的甚至普遍较低(图12)。对较为关注的花期FPKM值最高的Bra024117定量分析发现,在授粉15 min和30 min,自交授粉后的基因表达量明显高于异交授粉的基因表达量,表明其在自交不亲和过程中可能发挥重要作用。其中花期FPKM值次高的Bra003276在自交授粉后的表达量也具有这一特性。
图11
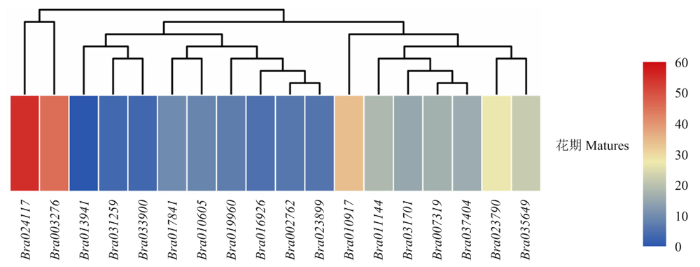 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11白菜花期柱头中BraACAs各成员的表达水平分析
在柱头RNA-seq数据中提取BraACAs的FPKM值作图
Fig. 11Expression levels of BraACAs in stigmas of Brassica rapa at matures stage
FPKM values of BraACAs were extracted from stigma RNA-seq data for drawing
图12
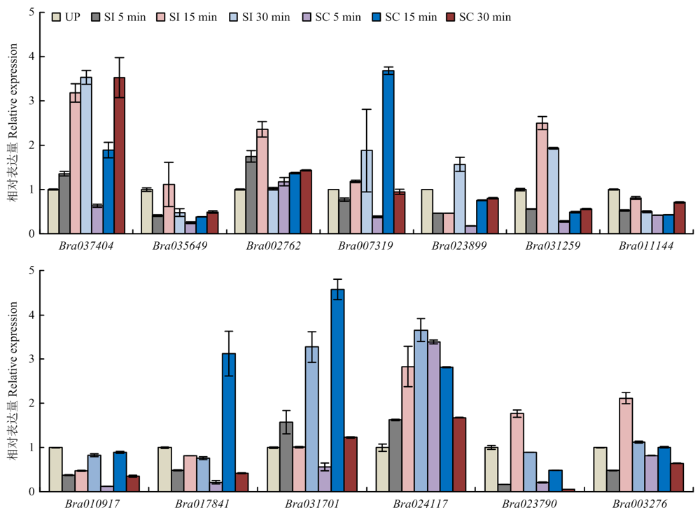 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图12BraACAs基因在柱头未授粉(UP)、自交(SI)和异交(SC)下表达情况
Fig. 12Expression level of BraACA genes under un-pollination (UP), self-pollination (SI) and cross-pollination (SC)
2.7 部分大白菜ACA基因克隆和亚细胞定位分析
对已经初步了解生物学功能的Bra002762、Bra035649、Bra031701、Bra003276和Bra024117设计引物,从大白菜‘848蛋黄白’柱头cDNA中进行PCR扩增,克隆基因。电泳显示目标条带大小以及测序结果正确(图13)。将5个BraACAs的CDS连接35-GFP/pCAMBIA1300载体,转入农杆菌,进行烟草叶片瞬时表达。结果显示这5个BraACAs均定位在细胞膜上(图14)。图13
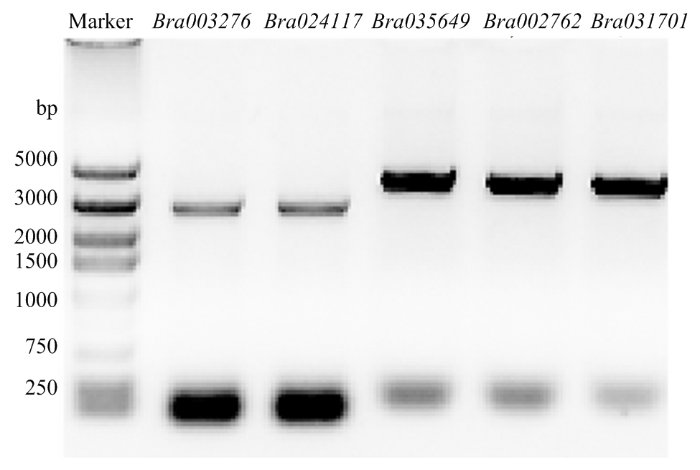 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图13BraACAs的琼脂糖凝胶电泳
Fig. 13Agarose gel electrophoresis of BraACAs
图14
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图14BraACAs亚细胞定位
CK:无载体注射烟草叶片;GFP:35s-GFP/pCAMBIA1300空载体在烟草叶片表达情况。标尺=10 μm
Fig. 14Subcellular localization of BraACAs
CK: Vector free injection of tobacco leaves; GFP: Expression of 35s-GFP/pCAMBIA1300 empty vector in tobacco leaves. Scale bar=10 μm
3 讨论
钙离子在植物生长、发育中起着至关重要的作用[41,42],维持体内钙离子浓度平衡显得尤其重要,钙离子泵是调节钙离子浓度的重要蛋白之一。钙离子泵在拟南芥、水稻等模式植物中已经研究得相对较清楚,尤其是ACA家族基因研究得比较透彻[43,44,45]。本研究鉴定得出18个大白菜ACA基因家族成员,其中有13个BraACA带有N端的自抑结构域。有研究表明N端的自抑结构域能有效抑制ATPase结构域的活性,从而保持钙泵较低的活性[46]。大白菜经历三倍化复制事件,而后可能因为BraACA在进化过程中发生基因丢失,使大白菜与拟南芥在ACA基因数目上没有太大差异。对功能结构域深入分析发现,Haloacid dehalogenase-like hydrolase功能域含有高度保守的D-K-T-G-T-L-T基序,C端Cation transporting ATPase功能域含有高度保守的L-L-W-V-N基序,E1-E2 ATPase功能域含有4个不连续高度保守的G基序,表明大白菜ACA基因家族进化具有固定的模式,进化关系具有保守性。研究表明,钙离子在果实发育过程中起着重要的调控作用[47]。ACA基因家族蛋白作为调节钙离子浓度的重要成员,其家族中某些基因的表达会影响果实发育。qRT-PCR分析发现,ACA基因主要集中在大白菜的果荚中表达,说明ACA基因可能在果荚发育过程中发挥主要作用。还有研究显示,钙离子在缓解非生物胁迫和生殖生长方面发挥重要作用[48,49,50]。在受到冷胁迫时,Bra002762与Bra035649的表达量比较有规律,均表现出上调趋势,且都在4—12 h内达到最高峰,Bra002762在冷胁迫2—4 h出现急剧上升的趋势,而Bra035649在冷胁迫6 h内上升趋势较为缓和,这说明Bra002762对低温的感应要比Bra035649强。在盐胁迫处理下,大部分ACA基因表达量呈现下调趋势,其中Bra031701表达量呈现上升的趋势,且在4—6 h内出现急剧上升,说明Bra031701对盐胁迫的响应需要时间差。Bra002762和Bra035649具有潜在抵御冷害的作用,Bra031701具有抵御盐害的潜在生物学功能。这3个基因具体如何抵御非生物胁迫还需深入研究。转录组测序中花期表达量高的Bra003276和Bra024117,在自交授粉和异交授粉的差异性表达数据,可为后续进一步研究大白菜有性生殖提供基础。
4 结论
本研究筛选出18个大白菜ACA基因家族成员,可分为4组,不均匀分布在大白菜10条染色体上。低温胁迫条件下,Bra002762和Bra035649被诱导上调表达,可能与大白菜低温胁迫有关;盐胁迫条件下,Bra031701显著上调,可能与大白菜抗盐性有关;在自交/异交授粉中,Bra003276和Bra024117表达表现出相反的表达模式,其可能通过调控钙离子参与大白菜有性生殖过程。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.pbi.2011.08.001URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/0143-4160(86)90026-6URL [本文引用: 1]
DOI:10.1016/S0014-5793(03)01086-XURL [本文引用: 1]
DOI:10.1105/tpc.105.032508URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1074/jbc.273.2.1099URL [本文引用: 1]
DOI:10.1073/pnas.89.19.9205URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1006/jmcc.1997.0475URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1007/s11033-012-2047-4URL [本文引用: 1]
DOI:10.1007/s11103-015-0426-7URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1146/biophys.2011.40.issue-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
DOI:10.1104/pp.126.2.696URL [本文引用: 1]
DOI:10.1093/jxb/ery073URL [本文引用: 1]
DOI:10.1073/pnas.94.16.8579URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
DOI:10.1104/pp.108.119909URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/nar/27.1.295URL [本文引用: 2]
DOI:10.1093/nar/gks400URL [本文引用: 2]
DOI:10.1093/nar/gkm259URL [本文引用: 1]
DOI:10.1093/molbev/msr121URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.molp.2020.06.009URL [本文引用: 1]
DOI:10.1093/nar/gkr1293URL [本文引用: 1]
DOI:10.1093/bioinformatics/bts533URL [本文引用: 1]
DOI:10.1093/nar/gkl198URL [本文引用: 1]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1038/nmeth.1226URL [本文引用: 1]
DOI:10.1042/BJ20070255URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.103.021923URL [本文引用: 1]
DOI:10.1111/tpj.2013.76.issue-6URL [本文引用: 1]
DOI:10.1105/tpc.113.121350URL [本文引用: 1]
DOI:10.1093/jxb/err346URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11103-014-0220-yURL [本文引用: 1]
