0 引言
【研究意义】鸭瘟(即鸭病毒性肠炎),是鸭、鹅、天鹅的一种急性、热性、败血性传染病。其病原体为鸭瘟病毒(duck plaque virus,DPV),又称鸭肠炎病毒(duck enteritis virus, DEV);小鹅瘟是由鹅细小病毒(goose parvovirus,GPV)引起的雏鹅和雏番鸭的一种急性或亚急性的败血性传染病,死亡率高。目前,已有新型GPV感染樱桃谷鸭的病例出现。迄今为止,接种弱化疫苗仍是预防和控制致死性DEV和GPV感染的主要途径。与常规弱化疫苗相比,以鸭瘟病毒作为载体表达GPV抗原的新型重组活载体疫苗不仅可一针防两病,节约成本,也可减少免疫副反应,更便于鉴别诊断。因此,本研究拟在建立的鸭瘟病毒疫苗株反向遗传操作平台的基础上,进一步探索以DEV作为载体表达GPV抗原、研发GPV-DEV二联苗的可能性。【前人研究进展】DEV在分类上属疱疹病毒科,α-疱疹病毒亚科。α-疱疹病毒是一类极具开发前景的病毒活载体,不仅具有基因组大、非必需基因多、能插入外源基因的容量大、遗传稳定、受母源抗体干扰小、体内存活时间较长等优点,而且已成功研制了许多基因缺失疫苗株,是作为病毒活载体极佳的候选之一[1, 2]。表达鸡传染性法氏囊病(IBD)病毒VP2蛋白的火鸡疱疹病毒(HVT)活载体疫苗,可以有效防控IBD和马立克氏病,疫苗已经在养禽业得到广泛应用[3]。此外,以HVT、伪狂犬病病毒(PRV)、马立克氏病毒(MDV)、马1型疱疹病毒(EHV- 1)、牛1型疱疹病毒(BHV-1)和牛疱疹病毒4型(BHV-4)等作为载体的重组病毒研究已经非常广泛,这些疱疹病毒成为表达其他病毒性疾病保护性抗原基因比较理想的动物病毒活载体[4-17]。鸭瘟疫苗具有良好的免疫效果和安全性,疫苗生产和应用技术成熟。近年来,随着鸭瘟病毒基因组全序列的解析和反向遗传系统技术的建立[18-20],鸭瘟病毒作为疫苗活载体研究取得了显著的进展。WANG等分别以UL44(gC)基因缺失的鸭瘟病毒强毒株和疫苗株为载体,表达了H5N1禽流感病毒的HA基因[19, 21];ZOU等也以鸭瘟病毒疫苗株为载体表达了同源和异源高致病性H5N1禽流感病毒的HA基因,携带HA基因的重组鸭瘟病毒能诱导机体产生应答H5病毒的体液反应和T细胞免疫,且对H5N1和DEV感染产生快速、持久的保护[22];LIU 等研究证实,在DEV疫苗株UL41基因内部插入外源基因既不影响病毒复制表型,也不增加鸭瘟病毒疫苗株对鸭的毒力[23];LIU等成功构建了US2基因缺失或gI/gE双基因缺失的重组鸭瘟病毒,并以之为载体表达了鹅H5亚型禽流感病毒的HA基因[25];CHEN等分别以DEV作为载体表达了鸭坦布苏病毒的主要抗原蛋白,重组病毒皆能诱导机体产生鸭坦布苏病毒的中和抗体[26-28]。【本研究切入点】目前关于以鸭瘟病毒作为载体表达鹅细小病毒抗原基因的研究仍是空白,研制出这两种病毒的重组疫苗对生产实践具有重要的意义。【拟解决的关键问题】本研究拟将GPV的主要保护性抗原基因VP2插入到DEV疫苗株基因组的US7和US8基因间,构建表达该免疫原性基因的重组鸭瘟病毒细菌人工染色体,继而在鸡胚成纤维细胞(CEFs)上拯救获得了重组病毒rDEV-VP2,并对其在CEFs细胞上的生物学特性进行了初步研究,该研究为研制GPV-DEV基因重组活载体疫苗奠定了基础。1 材料与方法
试验于2013年1月至2014年7月在浙江省农业科学院畜牧兽医研究所完成。1.1 菌株、质粒和病毒株
pEP-BGH-end质粒、鸭瘟病毒感染性克隆质粒pDEV-vac和pDEV-EF1,大肠杆菌菌株GS1783和鸭瘟病毒重组病毒株rDEV-Cre均由浙江省农科院畜牧兽医研究所构建并保存[20,28]。1.2 主要试剂
快速连接试剂盒、限制性内切酶、DNA凝胶纯化试剂盒,均购于大连宝生物工程有限公司;质粒提取纯化试剂盒购于OMEGA公司;DMEM、胎牛血清均购于Gibcol BRL公司;磷酸钙转染试剂盒购于Promega公司。GPV VP2多克隆抗体由本实验室制备;HRP标记的山羊抗小鼠IgG和FITC标记山羊抗小鼠IgG购于中杉金桥生物公司。1.3 序列优化、引物设计、及合成
鹅细小病毒VP2基因序列参考GenBank(U25749.1),由GenScript公司以禽为宿主进行优化合成。DEV和GPV VP2引物分别参考序列GenBank(EU082088.2)、GPV VP2优化序列设计,由生工公司合成,序列见表1。pDEV vac-in-s和pDEVvac-in-as用于将表达框pCMV-VP2-BGH-pA插入到DEV基因组的US7和US8基因之间。下划线部分与pEP-BGH-VP2同源,粗体部分分别与位于US7和US8基因间插入位点上、下游的序列同源。引物Rec-JD-F和Rec-JD-R用于外源基因插入BAC基因组中的验证。Table 1
表1
表1本文所用引物
Table 1Primers used in this study
| 引物名称Primer | 序列Sequence |
|---|---|
| pDEVvac-in-s | 5′-TACTAATTTAAGTGTGCAGCCTGGTTAACTGTATTATGCGCGG AGCGATGTACGGGCCAGATA-3′ |
| pDEVvac-in-as | 5′- TCCGTAGTCTGGCCGGCAGTATGTTGGTGTTTAGTACTCCA AACCCATAGAGCCCACCGCATCCCC-3′ |
| Rec-JD-F | 5′-CTACCACAAGCGTCATCAACCA-3′ |
| Rec-JD-R | 5′-TGTCCATTACCAAATCCGAAAA-3′ |
| 18F | 5′-CGACGAGAGTATCAGCACTCATC-3′ |
| 15R | 5′-ATCGACGAACAACTAAGAGTTTGC-3′ |
新窗口打开
1.4 pEP-BGH-VP2质粒的构建
以禽为宿主进行优化合成的GPV VP2基因合成时在其5′和3′端分别引入了KpnI和Not I酶切位点,将片段用KpnI和Not I进行双酶切之后插入到pEP-BGH-end相应的酶切位点中。通过PCR和酶切鉴定筛选获得阳性克隆,送Invitrogen生物公司测序。1.5 pDEV-VP2突变体的构建
通过RedE/T重组将Pcmv-VP2-BGH-pA表达框插入到egfp基因CMV启动子替换为EF1的鸭瘟病毒疫苗株BAC克隆pDEV-EF1[28]。获得的Bac质粒命名为pDEV-VP2。以pEP-BGH-VP2质粒为模板,用引物pDEVvac-in-s和pDEVvac-in-as(序列见表1)扩增长度约为3 913 bp的片段,胶回收后电转化至pDEV-EF1/ GS1783感受态细胞。最后以pDEV-VP2为模板,用引物Rec-JD-F和Rec-JD-R(序列见表1)扩增,获得大小约3 408 bp的片段,胶回收后克隆至pMD18-T载体,选取阳性克隆送至Invitrogen公司测序。1.6 重组病毒在CEFs细胞中的拯救
用碱裂解法分别提取pDEV-vac、pDEV-EF1和pDEV-VP2质粒,根据Promega磷酸钙转染试剂盒说明书转染CEFs,于37℃ 5%CO2继续培养,待出现70%—80%病变后收取病毒,拯救的病毒分别命名为rDEV-BAC、rDEV-EF1和rDEV-VP2。为了去除rDEV-VP2病毒基因组上的mini-F序列,将4 μg pDEV-VP2和1 μg Cre重组酶表达质粒pCAGGS-NLS/Cre以磷酸钙法共转染至CEFs细胞,第二天铺上含有1.5%甲基纤维素的DMEM培养基,置于CO2培养箱,37℃继续培养,直至出现病毒蚀斑,挑取非荧光蚀斑进行稀释和继代,经过几轮重复,直至获得纯化的非荧光蚀斑病毒。抽提病毒DNA,采用18F/15R引物对病毒进行PCR扩增,鉴定mini-F序列是否去除。鉴定正确的病毒命名为rDEV-VP2-Cre。
1.7 重组病毒的细胞增殖特性
1.7.1 重组病毒蚀斑大小的测定 将105.5 TCID50 rDEV- BAC、rDEV-EF1和rDEV-VP2病毒冻存液按照10的倍数进行稀释,接种于12孔板中的单层CEFs上,2 h后,换上含有1.5%甲基纤维素的DMEM培养基,放于CO2培养箱,37℃培养48 h,在荧光显微镜下每种病毒各拍100张蚀斑照片,用Image J软件来测量不同病毒的蚀斑面积,计算各病毒的平均值,将rDEV-BAC蚀斑面积设成100%,其他病毒蚀斑面积以之为标准换算成百分比。1.7.2 病毒生长曲线 以常规病毒学方法测定rDEV-BAC、rDEV-EF1和rDEV-VP2的体外增殖特性。CEFs细胞单层接种0.02MOI病毒后,依次吸附90 min,PBS(pH 7.2)洗涤2次,以冰浴的CBS缓冲液(40 mmol·L-1柠檬酸钠、10 mmol·L-1氯化钾、135 mmol·L-1氯化钠,pH3.0)处理3 min,PBS(pH 7.2)洗涤2次,加入1 mL维持液继续培养。接种后0、12、24、36、48、60、72 h分别收集细胞培养上清和细胞,细胞用PBS(pH 7.2)洗涤2次。收集的上清和细胞冻存于-80℃直至进行滴度测定。分别取100 μL细胞培养上清和细胞裂解液按照常规的方法测定TCID50,每个稀释度重复接种3孔。计算上述各时间点收获的病毒毒价,绘制病毒在体外的多步生长曲线。
1.8 GPV VP2蛋白的表达分析
1.8.1 间接免疫荧光检测(IFA)蛋白表达 分别接种rDEV-VP2-Cre和对照毒株rDEV-Cre[26]于96孔板的CEFs细胞中,培养72 h,PBS(pH7.0)洗涤3次,用预冷的甲醇/丙酮(1﹕1)固定液于-20 ℃固定30 min,PBS-1%NP40洗涤。一抗采用小鼠抗GPV VP2多克隆抗体(1﹕100),于37 ℃湿盒中孵育1 h,洗涤3次之后,滴加伊文斯兰溶液稀释的FITC标记的山羊抗小鼠IgG(1﹕100),再次于37 ℃孵育1 h,同样洗涤之后,碱性甘油封片,于Olympus荧光显微镜下观察。1.8.2 Western blot方法检测蛋白表达 蛋白样品于SDS-PAGE电泳完毕,采用半干转印法将蛋白转移至PVDF膜上,取出PVDF膜,放入封闭液中4 ℃封闭过夜。以小鼠抗GPV VP2多克隆抗体(1:500稀释)作为一抗,HRP标记的山羊抗小鼠IgG(1:5 000稀释)作为二抗于37 ℃孵育1 h,最后用DAB显色法进行显色。
1.9 动物试验
将24只7日龄无鸭瘟抗体的雏番鸭随机分为3组(n = 8),饲养于不同的房间。分别接种1×106 TCID50 rDEV-EF1、1×106 TCID50 rDEV-VP2,并设立细胞培养物作为阴性对照组。免疫后1、2和3W采血,分离血清,以大肠杆菌PET28a(+)/BL21系统表达,His-tag凝胶纯化的GPV VP2重组蛋白为一抗、HRP标记的抗禽IgG单克隆抗体为二抗进行间接ELISA,测定VP2抗体水平。2 结果
2.1 pDEV-VP2突变体的鉴定
分别提取pDEV-vac、pDEV-EF1、pDEV-kanVP2和pDEV-VP2 DNA,经过BamH I和Xhol I酶切鉴定,电泳图谱与预测结果基本一致(图1),且以引物对Rec-JD-F和Rec-JD-R进行PCR扩增片段测序结果也与预期一致,说明外源基因GPV VP2按照预期结果插入。2.2 重组病毒的拯救
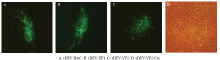
磷酸钙转染细胞48 h后荧光显微镜下观察发现rDEV-BAC、rDEV-EF1和rPRV-VP2孔内均出现荧光噬斑,待细胞80%以上出现荧光时收获病变细胞培养物,即获得拯救病毒(图2-A-C)。将pDEV-VP2和pCAGGS-NLS/Cre共转染至CEFs细胞,经过3轮非荧光蚀斑挑选和PCR鉴定,获得了去除载体序列的病毒rDEV-VP2-Cre(图2-D)。
2.3 病毒蚀斑大小测定
rDEV-BAC、rDEV-EF1和rDEV-VP2感染细胞2 d后,各拍摄病毒蚀斑照片100个,并用ImageJ软件测量各个蚀斑面积并计算平均值。将rDEV-VP2蚀斑面积分别与rDEV-BAC和rDEV-EF1进行比较,发现rDEV-VP2蚀斑面积较rDEV-BAC增加了0.3%(P = 0.119),较rDEV-EF1减少了12.2%(P =0.061)(图3),差异不显著,表明VP2基因的插入,对鸭瘟病毒细胞间感染能力无显著影响。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1重组克隆pDEV-VP2的BamH I和Xhol I酶切鉴定
-->Fig. 1Indentification of pDEV-VP2 by BamH I and Xhol I digestion
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2拯救重组病毒
-->Fig. 2Rescued recombinant viruses (100×)
-->
2.4 重组病毒的体外增殖特性
测定重组病毒rDEV-VP2的生长曲线,并与rDEV-BAC和rDEV-EF1进行比较,结果如图4所示,rDEV-VP2在细胞内的滴度从12 h到72 h稳步增加,并于60 h达到最高,12 h到48 h之内病毒滴度较rDEV-EF1和rDEV-BAC稍有降低,而60 h时高于后两者。对36 h和60 h病毒滴度进行统计学分析,结果表明rDEV-VP2较rDEV-BAC(P = 0.105,P = 0.100)和rDEV-EF1(P = 0.100, P = 0.080)的差异无统计学意义。rDEV-VP2病毒在上清中的滴度,从12 h到72 h稳步增加,与对照rDEV-BAC和rDEV-EF1无明显差异,统计学分析表明该结论具有统计学意义(P< 0.05)。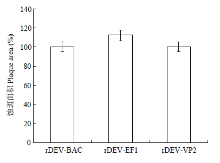 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3rDEV-BAC、rDEV-EF1和rDEV-VP2在CEFs上的蚀斑面积测定及比较
-->Fig. 3Plaque area measurement of rDEV-BAC, rDEV-EF1 and rDEV-VP2 on CEFs
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4rDEV-BAC、rDEV-EF1和rDEV-VP2在CEFs细胞上的体外生长曲线
-->Fig. 4Multi-step growth curves of rDEV-BAC, rDEV-EF1 and rDEV-VP2
-->
2.5 外源蛋白VP2表达分析
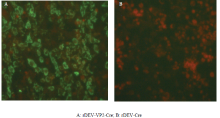
将rDEV-VP2-Cre和对照rDEV-Cre感染CEFs,以鼠抗GPV VP2多抗为一抗,FITC标记羊抗鼠IgG为二抗进行间接免疫荧光检测,结果表明rDEV-VP2- Cre感染细胞中检测出特异的绿色荧光(图5 A),而对照病毒感染细胞呈阴性(图5 B),表明VP2蛋白在重组病毒感染细胞中获得了表达。
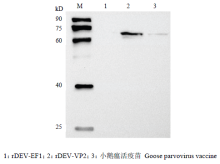
Western blot检测结果显示rDEV-VP2和rDEV- VP2-Cre感染的细胞样品较rDEV-EF1感染的细胞样品在72 kD处有一条特异性条带,与预期蛋白大小一致(图6),说明VP2蛋白获得了有效表达。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5IFA检测重组病毒rDEV-VP2-Cre感染细胞中蛋白表达
-->Fig. 5Detection of VP2 expression in rDEV-VP2-Cre -infected cells by IFA
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6Western blot检测病毒感染细胞中VP2的表达
-->Fig. 6Detection of VP2 expression in rDEV-VP2 -infected cells by Western blot
-->
2.6 重组病毒接种鸭抗体生成情况
为了明确重组病毒rDEV-VP2感染鸭是否能产生针对VP2蛋白的抗体,3组7日龄雏番鸭均于免疫后1W、2 W和3 W采血检测GPV VP2抗体,rDEV-VP2重组病毒免疫抗体阳转率分别为1/8、3/8和4/8,而rDEV-EF1组和细胞培养液组VP2抗体均为阴性。3 讨论
鸭瘟病毒和鹅细小病毒(GPV)可以引起番鸭、鹅小鹅瘟、鸭和半番鸭“喙萎缩综合征”,给养禽业造成了严重的危害。VP2是GPV的主要结构蛋白和保护性抗原,是目前GPV疫苗亚单位疫苗研究的主要候选基因之一[29]。因此,用鸭瘟病毒疫苗株为活载体来表达GPV VP2基因,构建rDEV-VP2研制小鹅瘟-鸭瘟活载体疫苗具有重要实际应用价值。构建表达载体存在两方面的难题:一是将目的基因插入到病毒载体基因组;二是插入基因是否可以在细胞内获得表达。本文是在鸭瘟病毒疫苗株全基因组感染性克隆基础上,采用“Red E/T”两步重组法对基因组进行基因替换、外源基因插入等序列修饰,该技术不需要特定的酶切位点,仅需35—50 bp碱基序列作为同源臂,从而实现PCR产物或寡核苷酸可以直接作为供体分子对目标DNA进行打靶修饰。“Red E/T”两步重组技术不仅简化了同源重组的操作过程,也提高了重组的效率,同时,因为同源臂不受碱基序列的组成限制,可以人为随意选择,所以运用该技术可以方便地对各种DNA分子尤其是基因组或染色体大分子进行修饰。该技术不仅操作简单、省时、省力,而且可以精准地在全长感染性克隆的基础上进行序列修饰[30-31]。
rDEV-VP2与rDEV-BAC毒株相比,其蚀斑面积和生长曲线皆无显著差异,说明外源基因VP2的插入不影响DEV病毒在CEFs细胞上的增殖特性。本试验中,IFA和Western blot结果皆表明VP2获得了表达,但Western blot分析显示VP2蛋白分子量约72 kD。根据ORF推测,GPV VP2分子量为61 kD,但李茂祥等的研究表明VP2分子量位于60—72 kD之间[32],JU等用杆状病毒表达的GPV VP2其分子量为75 kD[29],与笔者获得的72 kD大小相近。对VP2 氨基酸序列的糖基化、乙酰化、磷酸化位点进行预测,结果表明VP2序列上存在上述位点,说明VP2蛋白存在不同程度的翻译后修饰。对照野生型鹅细小病毒VP2蛋白分子量与本试验结果的一致更验证了笔者的分析。VP2插入不影响病毒增殖特性以及VP2蛋白在DEV病毒载体中成功表达,为动物试验诱导抗体产生提供了保证。
体液免疫在抵抗小鹅瘟病毒感染过程中发挥着主要作用。经过GPV感染康复的雏鹅以及曾经隐性感染的成年鹅,均能产生高水平的抗体,并持续较长时间,而且能将抗体通过卵黄传给后代,使孵出的雏鹅获得抵抗GPV感染的能力。通过免疫母鹅或用高免血清注射雏鹅都对此病有预防作用[33]。JU等利用杆状病毒表达系统在昆虫细胞中分别表达了GPV 结构蛋白VP1、VP2和VP3,它们皆能自组装成病毒样颗粒(VLPs),且具有良好的免疫原性[29]。LEE等利用昆虫-杆状病毒表达系统表达GPV VP2,加以佐剂免疫9日龄鸭,首次免疫后14d进行二次免疫,能产生良好的抗体应答[34]。CHEN等同样利用昆虫-杆状病毒表达系统表达了密码子优化的GPV VP2基因,VP2能组装成VLPs,且VLPs保持了良好的免疫原性和免疫反应原性[35]。笔者的研究表明rDEV-VP2感染雏番鸭能诱导产生针对VP2蛋白的特异性抗体,推测其对小鹅瘟具有免疫保护能力。本研究是在鸭瘟病毒疫苗株BAC基础上开展,具有良好的安全性,且由该BAC拯救出来的病毒rDEV-BAC和rDEV-Cre两病毒株皆对鸭瘟强毒株的攻击具有100%保护作用[26],推测本研究构建的重组病毒也具有保护鸭瘟强毒株攻击的能力,但攻毒保护试验有待进一步研究。
4 结论
成功构建了表达鹅细小病毒VP2蛋白的重组鸭瘟病毒。该重组病毒细胞生长特性与亲本毒株基本一致,且重组病毒在感染细胞中能表达外源蛋白VP2,接种雏番鸭能诱导VP2特异性抗体生成,具有研制小鹅瘟-鸭瘟二联活载体疫苗的潜力。(责任编辑 林鉴非)
The authors have declared that no competing interests exist.
