0 引言
【研究意义】鸭坦布苏病毒病(duck Tembusu virus infection),又称鸭黄病毒病,是2010年在中国首先暴发的一种新型传染病。临床上以种鸭、蛋鸭产蛋量骤减,育成鸭、商品肉鸭出现神经症状为主要特征,该病来势迅猛,传播广泛,给中国的种鸭养殖业造成的巨大经济损失[1-10]。目前,该病已经成为一种常见病、多发病。本研究通过将鸭坦布苏病毒在SPF鸡胚上连续传代,筛选出一株符合活疫苗标准的弱毒株,为鸭坦布苏病毒活疫苗的研发奠定基础。【前人研究进展】该病的病原为鸭坦布苏病毒,属于黄病毒科黄病毒属。病毒基因组为不分节段的具有感染性的正链单股RNA,由10 990个核苷酸组成,只有一个长的开放阅读框,其中5′端有帽状结构,3′端无polyA尾[11-16]。编码3个结构蛋白基因:衣壳蛋白(C)、膜蛋白(PrM)、囊膜蛋白(E)和7个非结构蛋白,其中E蛋白与病毒致病力、组织亲嗜性、宿主嗜性、免疫保护等密切相关[17-18]。【本研究切入点】疫苗免疫是用于家禽疫病防控的主要措施,活疫苗的使用省时省力,适于在鸭群中批量免疫,但目前还没有商品化的鸭坦布苏病毒活疫苗,也没有鸭坦布苏病毒自然弱毒株的相关报道。【拟解决的关键问题】将鸭坦布苏病毒BZ_2010株在SPF鸡胚上进行传代致弱,将120代次VC2毒株进行了安全性、遗传稳定性和免疫效力评价,旨在选育一株安全性高、免疫原性好的活疫苗毒株。1 材料与方法
试验于2011年1月至2015年5月在山东省家禽疫病诊断与免疫重点实验室和山东省农业科学院家禽研究所进行。1.1 病毒、鸡胚、雏鸭、种鸭
鸭坦布苏病毒BZ_2010株于2010年分自山东地区A种鸭场(在10d SFP鸭胚上的ELD50为10-6.2/0.1mL);鸭坦布苏病毒SX-12株于2012年分自山东地区B种鸭场(在10 d SFP鸭胚上的ELD50为10-5.9/0.1mL);SPF鸡胚由山东省昊泰动物繁育有限公司提供;鸭坦布苏病毒抗体阴性的樱桃谷雏鸭和种鸭由山东省德州市某种鸭场提供。1.2 病毒传代与滴定
将鸭坦布苏病毒BZ_2010株用生理盐水以1:1 000倍稀释,通过尿囊腔途径接种9d SPF鸡胚,弃掉接种24h内死亡的鸡胚,观察并记录鸡胚死亡时间。收集接种24h后死亡鸡胚的尿囊液,按照前面的接种方法继续进行传代,直至第120代(命名为VC2)。分别取第20、40、60、80、100和120代病毒在9 d SPF鸡胚上测定鸡胚半数致死量(ELD50)。方法如下:将病毒分别作10倍系列稀释,即10-2、10-3…10-7、10-8共7个不同稀释度,分别经尿囊腔接种9 d鸡胚,每个稀释度接种5枚,0.1mL/枚,同时设生理盐水对照组,观察记录接种后24—168 h内鸡胚死亡情况,并按Reed-Muench法计算ELD50。1.3 E蛋白与NS4A蛋白变异分析
参照BZ_2010株基因组序列(GenBank登录号:KC990540)设计两对引物,分别用于扩增VC2的E基因和NS4A基因,引物由上海立菲生物技术有限公司合成。按照RNAiso Reagent(TAKARA, JAPAN)试剂说明提取VC2病毒RNA,按照常规RT-PCR方法扩增E基因和NS4A基因并测序。将VC2的 E蛋白与NS4A蛋白序列同BZ_2010株进行比对分析。1.4 安全性试验
将鸭坦布苏病毒BZ_2010株和VC2株分别通过颈部皮下接种1 d雏鸭,接种剂量为104.0 ELD50/只,每组试验鸭接种20只。10只对照鸭用同样体积的生理盐水进行颈部皮下接种。接种后观察试验鸭的精神状态与死亡情况。采集接种后发病或死亡试验鸭的肝脏制备病理切片;若无发病或死亡的情况,则于接种后第7天剖杀试验鸭取肝脏制备病理切片。将鸭坦布苏病毒BZ_2010株和VC2株分别通过腿肌注射30周龄的产蛋种鸭,接种剂量为106.0 ELD50/只,每组试验鸭接种30只。10只对照鸭用同样体积的生理盐水进行腿肌接种。接种后观察试验鸭的精神状态与产蛋情况。
1.5 病毒毒力返强试验
将VC2以105.0 ELD50/只的剂量通过腿肌注射的方式接种1 d雏鸭10只,5 d后剖杀取肝、脾、脑制成20%悬液,冻融3次后,取上清液再接种1 d雏鸭10只,连续传代5次,观察雏鸭的精神状态。将第5代的组织悬液通过颈部皮下接种1 d雏鸭10只,接种剂量为104.0 ELD50/只,观察雏鸭的精神状态。采集第5代组织接种后发病或死亡实验鸭的肝脏制备病理切片;若无发病或死亡的情况,则于接种后第7天剖杀试验鸭取肝脏制备病理切片。1.6 免疫后抗体中和效价的测定
将VC2以103.5 ELD50/只的剂量通过胸肌注射的方式免疫18周龄种鸭200只,每隔4周随机采集20份鸭血清通过鸡胚中和试验测定其中和抗体,直至免疫后56周,取中和抗体的平均值绘制抗体消长曲线。1.7 免疫后攻毒保护试验
将VC2以103.5 ELD50/只的剂量通过胸肌注射的方式免疫25周龄种鸭2 000只,分别于免疫后第2周和第50周利用鸭坦布苏病毒SX-12株对试验鸭进行攻毒,每组攻毒免疫鸭100只,阴性对照鸭100只,攻毒剂量为105 ELD50/只。观察并记录试验鸭发病情况及产蛋情况。2 结果
2.1 病毒传代
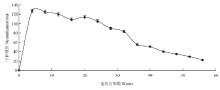
将鸭坦布苏病毒BZ_2010在SPF鸡胚上进行连续传代,结果发现鸡胚的平均死亡时间有缩短的趋势,而病毒毒价有逐渐提高的趋势,ELD50由第20代的10-5.3/0.1mL提高到第120代的10-5.8/0.1mL,而且第80代之前提高较快,后期基本稳定(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同代次病毒的鸡胚半数致死量
-->Fig. 1ELD50 of duck Tembusu virus VC2 strain at different passage times
-->
2.2 E蛋白与NS4A蛋白的变异分析
通过测序分析发现,VC2的E基因和NS4A基因与亲本毒BZ_2010相比,分别有11个和3个碱基的差异,同源性分别为99.3%和99.2%。E基因的变异导致第86、157、189、301和312位氨基酸发生变化,而NS4A基因的变异导致第54位氨基酸由F变为L(表1)。2.3 安全性试验
将BZ_2010和VC2分别通过颈部皮下接种1 d雏鸭20只,接种14 d内BZ_2010接种组有7只死亡,大部分试验鸭死亡前有神经症状,而VC2接种组无死亡,且不表现神经症状。肝脏的病理切片显示,BZ_2010组试验鸭的肝脏有明显的脂肪变性,而VC2组与对照组相比无明显变化(图2)。
将BZ_2010和VC2分别通过腿肌注射30周龄的产蛋种鸭,结果发现,BZ_2010接种组从接种后第4天开始出现绿色粪便,产蛋同时下降,至第9天产蛋量由接种前的26枚降到5枚。VC2接种组的产蛋量保持稳定,粪便也无变化。
2.4 病毒毒力返强试验
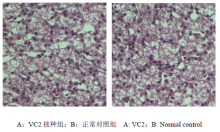
将VC2在1 d雏鸭进行连续5次传代,未发现试验鸭有任何异常症状。第5代组织悬液颈部皮下接种1 d雏鸭,也未发现任何异常症状。第5代组织接种后第7天剖杀实验鸭取肝脏制备病理切片,结果显示,VC2组与对照组相比,肝脏无明显病理变化(图3)。2.5 免疫后抗体中和效价的测定
VC2免疫18周龄种鸭后定期采集血清,利用鸡胚中和试验测定其中和抗体,绘制抗体消长曲线(图4)。结果显示,VC2免疫后前4周中和抗体上升很快,到第4周时基本达到高峰,高峰期维持20周,然后缓慢下降,到56周时中和抗体效价仍能达到1﹕22。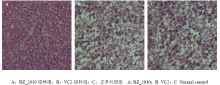 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2BZ_2010和VC2接种雏鸭后肝脏的病理变化
-->Fig. 2Liver pathological changes of ducklings injected with BZ_2010 or VC2 (400×)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3第5代组织接种雏鸭后肝脏的病理变化
-->Fig. 3Liver pathological changes of ducklings injected by fifth tissue (400×)
-->
Table 1
表1
表1第120代次病毒株的核苷酸与氨基酸突变情况
Table 1Change of nucleotide and amino acid of Tembusu virus at passage 120
| 基因 Gene | 核苷酸位置1) Situation of nt | 核苷酸突变 Nucleotide mutation | 氨基酸位置2) Situation of aa | 氨基酸突变 Mutation of amino acid | |
|---|---|---|---|---|---|
| BZ_2010 | VC2 | ||||
| E | 258 | A | G | 86 | K→D |
| 469 | A | G | 157 | I→V | |
| 566 | T | C | 189 | F→S | |
| 903 | G | C | 301 | K→N | |
| 935 | T | C | 312 | V→A | |
| NS4A | 160 | T | C | 54 | F→L |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4VC2免疫种鸭抗体消长曲线
-->Fig. 4Neutralization antibodies change curve of adult duck after VC2 immunization
-->
2.6 免疫后攻毒保护试验
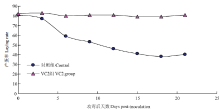
VC2免疫25周龄种鸭,分别于免疫后第2周和第40周对试验鸭进行攻毒,结果显示:免疫后第2周攻毒的对照组从攻毒后第4天开始出现绿色粪便,产蛋率从第3天开始下降,到第15天降至20%,VC2免疫组在攻毒后未出现异常症状,粪便正常,产蛋率保持正常的上升趋势(图5)。免疫后第50周攻毒的对照组从攻毒后第5天开始出现绿色粪便,产蛋率从第5天开始出现明显下降,到第15天降至33%,VC2免疫组在攻毒后未出现异常症状,粪便正常,产蛋率保持稳定(图6)。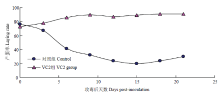 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5VC2免疫后第2周攻毒种鸭产蛋率的变化
-->Fig. 5Laying rate change of ducks with SX-12 challenging at weeks 2 post-vaccination
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6VC2免疫后第50周攻毒种鸭产蛋率的变化
-->Fig. 6Laying rate change of ducks with SX-12 challenging at weeks 50 post-vaccination
-->
3 讨论
鸭坦布苏病毒病自从2010年在中国暴发以来,一直困扰着种鸭业的发展,生产中急需高效疫苗来预防该病。本研究将鸭坦布苏病毒山东分离株BZ_2010在SPF鸡胚进行连续传代,直至第120代,获得的第120代次毒株VC2的ELD50由亲本毒的10-5.3/0.1mL提高到10-5.8/0.1mL,说明病毒在传代过程中毒价在逐步上升。为了确定VC2株是否已经致弱,笔者分别通过颈部皮下接种1d雏鸭和肌肉接种30周龄产蛋种鸭,结果显示,VC2接种后试验鸭无异常症状和死亡,粪便和产蛋率也保持正常。这些都说明VC2毒株已完全丧失了对鸭的致病力。进而又将该致弱株在1 d雏鸭体内进行了毒力返强试验,连续传5代未出现任何返强迹象,这些数据表明,VC2候选疫苗株具有良好的安全性。鸭坦布苏病毒的E蛋白与病毒致病力、宿主嗜性等密切相关,而有报道非结构蛋白NS4A影响日本乙型脑炎对小鼠的致病力[19-25]。因此,选择了E和NS4A这两个蛋白进行测序分析,试图在基因水平上找到VC2丧失对鸭的致病力原因。通过与亲本毒BZ_2010比对分析发现,E蛋白的第86、157、189、301和312位氨基酸发生变化,其中第157、189位氨基酸位于结构域I区,这一区域内发生的很多突变都与黄病毒毒力相关而NS4A蛋白只有一个氨基酸的突变,即第54位氨基酸由F变为L。这些突变或者突变组合(包括其他蛋白)可能是导致VC2致病力减弱的关键因素[26-30]。
为了评价弱毒株VC2的免疫效果,笔者进行中和抗体追踪和攻毒保护试验。结果显示,VC2免疫种鸭后抗体水平上升很快,并且维持时间较长,衰减缓慢;VC2免疫后第2周和第50周都可产生完全保护,这说明VC2的免疫期很长,基本可以持续整个产蛋期。
4 结论
通过将鸭坦布苏病毒在SPF鸡胚上进行连续传代,获得了安全性高、免疫原性好的弱毒株VC2,为鸭坦布苏病活疫苗的研发奠定了基础。The authors have declared that no competing interests exist.
