0 引言
【研究意义】研究鸭呼肠孤病毒(duck reovirus,DRV)对鸡胚的致病作用,同时探讨DRV在垂直传播中的情况,旨在对鸡场DRV感染的防护与控制提出积极有效的意见。【前人研究进展】禽呼肠孤病毒的易感动物包括鸡、鹅、火鸡、鸭等[1]。禽呼肠孤病毒能引起雏禽的病毒性关节炎(腱鞘炎)、呼吸道和肠道疾病、肝炎、心肌炎、免疫抑制等[2-9],另外有研究表明,禽呼肠孤病毒可以经卵垂直传播[10]。2003年至今鸭呼肠孤病毒陆续在中国被报道,感染鸭呼肠孤病毒相关的疾病归结为4种,即鸭多脏器坏死症、多脏器出血症、肝坏死症和脾坏死症[11-15]。而华中农业大学兽医病理学实验室对DRV多年研究结果证实,DRV引起病变主要以造成鸭软脚为主要临床特征,肝脏和脾脏表面有大量的白色坏死灶、肾脏以肿大、出血为主要病变特点[16-21]。【本研究切入点】尽管禽呼肠孤病毒的宿主范围广泛,鸡、鹅、火鸡、鸭、鸽子、鹦鹉、鸵鸟等家养禽类与野生禽类均可感染,但本试验所分离的鸭呼肠孤病毒是否也可感染鸡群等其他动物一直未予验证,为此拟建立SPF鸡胚DRV感染模型。【拟解决的关键问题】建立SPF鸡胚DRV感染模型,通过尿囊腔接种鸭呼肠孤病毒,培养鸡胚至雏鸡出壳,运用临床观察、病理剖检、组织病理学观察等技术研究鸭呼肠孤病毒对鸡胚的致病性。1 材料与方法
1.1 试验时间、地点
本研究室内试验于2015年在华中农业大学兽医病理学实验室进行。1.2 试验材料
1.2.1 病毒 接种材料为华中农业大学动物医学院兽医病理学实验室分离鉴定并保存的HP080421株鸭呼肠孤病毒。1.2.2 试验动物 SPF鸡胚12只,购自武汉市畜牧科技研究所。
1.3 试验方法
1.3.1 试验动物分组 10日龄SPF鸡胚12枚分为两组,接毒组与对照组。接毒组SPF鸡胚经尿囊腔注射鸭呼肠孤病毒HP080421株(ELD50=10-5.75/0.2mL),0.2mL/枚;对照组SPF鸡胚尿囊腔接种等量灭菌生理盐水0.2mL/枚。37℃温箱培养,适时观察。1.3.2 临床观察及尸体剖检 每天照蛋观察,第一天死亡的鸡胚弃去。待鸡胚啄壳、出壳,处死雏鸡,剖检观察。剖检鸡胚,接毒组与对照组对比观察。对试验感染组、对照组鸡胚剖检时,对比切取雏鸡肝脏、脾脏、脑、法氏囊、胸腺、肺脏、肾脏、腺胃及小肠有病变或疑似有病变的部位,4%多聚甲醛固定。
1.3.3 病理切片制作及显微观察 常规石蜡切片制作[22-24],切片厚4μm,H.E染色和IHC染色。IHC染色方法为SABC法,AEC显色,鼠抗鸭呼肠孤病毒单克隆抗体(中国农业大学苏敬良教授赠送)工作浓度是1﹕400,染色结果在生物光学显微镜(Nikon80i)观察,采集图片(NIS-Elements高清晰度彩色图文分析系统),记录结果。
2 结果
2.1 感染鸭呼肠孤病毒后鸡胚的存活状况
对照组6枚全部存活,孵化培养至20—21d陆续啄壳并出壳;试验组6枚全部存活,孵化培养至22—23日龄均啄壳,但不能自主出壳,于是人工剥壳并处死雏鸡。2.2 剖检病理变化
肝脏肿大、质脆、表面及实质分布有大量肉眼可见的大小不等的黄白色坏死灶(图1-A)。脾脏肿胀近球形、质脆、表面及实质分布有大量肉眼可见的绿豆大小的黄白色坏死灶(图1-B)。脑组织肿胀,表面分布有大小不一的出血点和出血斑。对照组雏鸡各组织器官眼观病理变化不明显。2.3 组织病理学变化
肝细胞不同程度变性坏死崩解,其间夹杂出血灶,并见大量炎性细胞浸润,肝脏坏死灶机化形成包囊,(图2-A);脾脏白髓内淋巴细胞凋亡、数量减少,部分淋巴细胞空泡变性、核碎裂、崩解坏死,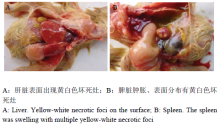 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1雏鸡剖检病理变化
-->Fig. 1Necropsy pathologic changes of infected chicken
-->
坏死灶周围可见多核巨细胞、炎性细胞浸润形成肉芽肿(图2-B);胸腺皮质部淋巴细胞排列疏松,髓质部组织细胞间充满红细胞,淋巴细胞变性坏死崩解,数量减少,可见胸腺小体(图2-C);法氏囊肌层与黏膜间距增大,组织水肿,滤泡的皮质、髓质部细胞排列疏松,滤泡髓质部有大量细胞核碎片,淋巴细胞减少、凋亡(图2-D);大脑血管、神经细胞与周围组织细胞间隙增大(图2-E);腺胃和小肠黏膜固有层中有大量炎性细胞浸润(图2-F);肾小管周围毛细血管扩张,充满了红细胞,部分肾
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2感染雏鸡病理组织学变化
-->Fig. 2Histopathological changes of infected chicken
-->
小管上皮细胞变性并与基底膜分离,脱落至管腔(图2-G);肺脏小静脉、毛细血管充满红细胞,肺小叶间隔增宽(图2-H)。对照组未见明显的组织病理变化。
免疫组织病理学变化表明:阳性信号主要位于肝脏、脾脏的坏死灶周围的巨噬细胞的细胞质内,另外法氏囊和肺支气管粘膜上皮细胞内亦可见阳性信号(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3感染雏鸡免疫组织化学变化
-->Fig. 3Immunohistochemical changes of infected chicken (200×)
-->
3 讨论
3.1 鸭呼肠孤病毒感染后鸡胚存活状况
已知在孵化正常的情况下,健雏出壳时间比较一致,通常在孵化第20日龄开始出雏,满21日龄出雏结束;而病雏、弱雏会过早或过迟出雏,出雏时间延至22日龄以上[25]。在培养条件一致的情况下,对照组孵化培养至20—21日龄陆续啄壳并出壳,而接毒组孵化培养至22—23 d啄壳却不能出壳。垂直传播指感染母鸡通过卵将病原体传给子代的过程,垂直传播病是危害养禽业健康发展的全球性的一大类重要疾病;尤其是蛋用种鸡,因其可以将病原体通过卵直接传给商品代蛋鸡,引起生殖系统损伤,表现为发病率高、产蛋率低,疾病在鸡场内长期存在并难以消除和经济损失严重等特点[26]。本研究结果表明:鸭呼肠孤病毒尿囊腔接种SPF鸡胚后,能够在鸡胚体内增殖并垂直传播,且对鸡胚有致弱作用,导致其不能正常出壳,影响生长发育。3.2 鸭呼肠孤病毒感染SPF鸡胚后剖检变化
对照组雏鸡组织器官未见明显病理变化,接毒组雏鸡的主要病理变化集中在肝脏和脾脏,表面和实质分布有肉眼可见大小不一的黄白色坏死灶;而其他组织器官如心脏、脑组织、腺胃、小肠、肾脏、肺脏、胸腺等未出现坏死,仅出现出血、水肿等轻微病理变化。这些病理变化与DRV感染引起雏鸭的病理变化具有相似性[16-21],表明HP080421株鸭呼肠孤病毒(DRV)对SPF鸡胚有致病性,且能引起与鸭感染DRV后相似的病理变化。
3.3 鸭呼肠孤病毒感染SPF鸡胚后组织病理学变化
脾脏、肝脏坏死灶内细胞坏死,周围有炎性细胞浸润;法氏囊滤泡髓质部、胸腺髓质部组织排列疏松、呈空洞状、淋巴细胞数量减少,细胞核碎裂或溶解消失;而肺脏、肾脏、腺胃及小肠、脑组织存在不同程度的水肿和出血、淤血。从结果中可以看出,雏鸡的病理变化主要集中在肝脏和淋巴器官,病毒的阳性信号主要出现在肝、肺、脾和法氏囊,并且位于上皮细胞和巨噬细胞的细胞质和胞核内。鸭呼肠孤病毒侵染胚体免疫器官后,引起淋巴细胞凋亡,继而免疫器官内淋巴细胞数量减少,提示鸭呼肠孤病毒可能会通过损伤免疫器官,减弱免疫系统的功能,引起雏鸡的免疫抑制,与李爽得出的鸭源禽呼肠孤病毒感染能引起雏鸭机体免疫抑制的结论具有一致性[18]。4 结论
鸭呼肠孤病毒株HP080421能够在SPF鸡胚中复制增殖,并使雏鸡产生明显的病理变化。因此本研究表明鸭呼肠孤病毒存在交叉感染,而且鸭呼肠孤病毒能够通过鸡胚垂直传播,因此在实际养殖过程中,要防止病毒对鸡胚的污染,切断传播途径。鸭呼肠孤病毒感染引起鸡胚免疫器官损伤,推测鸡场感染鸭呼肠孤病毒,鸡群免疫力低下,可能会加重其他病原对鸡群的致病性,更易发生继发感染。(责任编辑 林鉴非)
The authors have declared that no competing interests exist.
