 ,, 汤亚飞
,, 汤亚飞 ,, 李正刚, 于琳, 蓝国兵, 佘小漫
,, 李正刚, 于琳, 蓝国兵, 佘小漫 ,, 何自福
,, 何自福 ,广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广州 510640
,广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广州 510640Molecular Characteristic of Squash Leaf Curl China Virus (SLCCNV) Infecting Cucurbitaceae Crops in Guangdong Province
ZHANG Li ,, TANG YaFei
,, TANG YaFei ,, LI ZhengGang, YU Lin, LAN GuoBing, SHE XiaoMan
,, LI ZhengGang, YU Lin, LAN GuoBing, SHE XiaoMan ,, HE ZiFu
,, HE ZiFu ,Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640
,Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640通讯作者:
责任编辑: 岳梅
收稿日期:2021-03-1接受日期:2021-04-15
| 基金资助: |
Received:2021-03-1Accepted:2021-04-15
作者简介 About authors
张丽,E-mail:
汤亚飞,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2808KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张丽, 汤亚飞, 李正刚, 于琳, 蓝国兵, 佘小漫, 何自福. 侵染广东省葫芦科作物的中国南瓜曲叶病毒的分子特征. 中国农业科学, 2021, 54(19): 4097-4109 doi:10.3864/j.issn.0578-1752.2021.19.006
ZHANG Li, TANG YaFei, LI ZhengGang, YU Lin, LAN GuoBing, SHE XiaoMan, HE ZiFu.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】中国南瓜曲叶病毒(squash leaf curl China virus,SLCCNV)属于双生病毒科(Geminiviridae)菜豆金色黄花叶病毒属(Begomovirus)[1],由烟粉虱(Bemisia tabaci)以持久性方式进行传播,不能通过机械摩擦和种子带毒传播[2,3]。中国南瓜曲叶病毒主要侵染南瓜、葫芦、冬瓜、甜瓜等葫芦科(Cucurbitaceae)作物,引起植株长势弱、叶片卷曲、皱缩等症状,严重影响果实的商品价值和产量[1,4-5],已成为危害葫芦科作物的重要病毒之一[2,3]。葫芦科作物在农业生产中占有重要的地位,广东省常年种植有南瓜、冬瓜、黄瓜、节瓜等多种葫芦科蔬菜作物,田间病毒病和烟粉虱发生非常普遍。烟粉虱传病毒病也成为影响广东葫芦科蔬菜产业发展的一个制约因子。因此,对危害广东省葫芦科作物的SLCCNV的分子特征和致病性开展研究,可为该病毒病的防控提供科学依据。【前人研究进展】SLCCNV是一种单链环状DNA病毒,基因组含DNA-A和DNA-B两个组分,属于双组分病毒,基因组大小为2.5—2.8 kb。DNA-A编码6个ORF,其中病毒链上包含2个ORF,分别为AV1(编码外壳蛋白)和AV2(编码与病毒移动相关蛋白),互补链上包含4—5个ORF,分别为AC1(编码复制相关蛋白)、AC2(编码转录激活蛋白)、AC3(编码复制增强蛋白)、AC5(编码复制或转录调控因子)[6]。DNA-B编码2个ORF,其中病毒链上的BV1编码核穿梭蛋白,互补链上的BC1编码运动蛋白[7,8]。DNA-A和DNA-B在序列、位置和结构上存在保守的基因间隔区(intergenic region,IR),也称为共同区(common region,CR)。该区域含有双生病毒复制起始相关的“TAATATT/AC”9碱基保守序列。SLCCNV最先发现于20世纪90年代广西南宁田间表现曲叶症状的南瓜病样中,根据其外壳蛋白(coat protein,CP)基因序列比较分析鉴定为一个双生病毒新种[1]。随后,在越南[9]、印度[10,11,12]、菲律宾[13]、泰国[14]、巴基斯坦[15]、东帝汶[16]等多国的南瓜上也相继发现了SLCCNV;而在我国,目前已在广西、河南、云南、海南等多省报道有该病毒病的发生[1,17-22]。已报道的SLCCNV可侵染的自然寄主有南瓜[1]、葫芦[23,24]、冬瓜[25]、黄瓜[26]、甜瓜[17]、哈密瓜[21]多种葫芦科作物。【本研究切入点】2018—2020年,笔者系统调查了广东省葫芦科作物病毒病发生情况,发现南瓜、冬瓜、葫芦以及白瓜等作物的病毒病及烟粉虱发生均十分普遍,其中有一些植株表现叶片卷曲。利用菜豆金色黄花叶病毒属病毒(begomoviruses)的简并引物AV494/CoPR[27,28]进行PCR检测,证实这些表现叶片卷曲症状的病样中存在begomoviruses。目前文献中尚未见对危害广东葫芦科作物的SLCCNV及其致病性的相关报道。【拟解决的关键问题】研究危害广东葫芦科作物的烟粉虱传双生病毒种类及其分子特征,明确其致病性,为该病毒病的防控提供科学依据。1 材料与方法
试验于2018年7月至2021年1月在广东省农业科学院植物保护研究所完成。1.1 样品来源
2018—2020年,从广东省湛江市雷州市、湛江市徐闻县、惠州市博罗县、河源市源城区以及佛山市高明区葫芦科蔬菜种植区随机采集疑似病样53份,其中南瓜31份、葫芦10份、冬瓜7份、白瓜5份,采集的植物样品带回实验室置于-80℃冰箱保存。1.2 样品总DNA提取
取植株病叶组织100 mg,利用北京全式金生物技术有限公司的植物DNA提取试剂盒(Easypure Plant Genomic DNA Kit)抽提其总DNA,具体操作按试剂盒说明书进行。DNA沉淀溶解于50 μL TE(10 mmol·L-1 Tris-HCl,1 mmol·L-1 EDTA,pH 8.0)溶液中。1.3 PCR检测
利用菜豆金色黄花叶病毒属病毒AV1基因部分序列的通用简并引物AV494:GCCYATRTAYAGRAAGC CMAG/CoPR:GANGSATGHTRCADGCCATATA[27,28],对53份疑似病样进行PCR检测。反应体系:待测病样总DNA 1 μL(约20 ng),灭菌水9.5 μL,PCR Mixer 12.5 μL(TaKaRa公司),10 μmol·L-1上、下游引物各1 μL,总体积25 μL。反应程序:94℃ 4 min;94℃ 45 s;52℃ 45 s;72℃ 45 s,35个循环;72℃ 10 min。PCR产物经1%琼脂糖凝胶进行电泳检测。1.4 全基因组序列的扩增
1.4.1 DNA-A组分全长序列扩增及克隆 挑取PCR检测为阳性的病样总DNA为模板,利用TempliPhiTM RCA Kit(GE Healthcare)进行滚环扩增(rolling circle amplification,RCA)获得病毒的基因全长[29]。具体操作步骤:1 μL总DNA样品(约20 ng)加入5 μL样品缓冲液(sample buffer),混匀,95℃变性3 min;立即置冰上冷却;随后加入5 μL反应缓冲液(reaction buffer)和0.2 μL DNA聚合酶,在30℃反应18—20 h;最后在65℃下加热10 min以终止反应,RCA产物保存于-20℃备用。RCA扩增产物分别用BamHⅠ、EcoRⅠ、Hind Ⅲ、PstⅠ限制性内切酶(Thermo公司)进行酶切。酶切反应体系:RCA产物2 μL、内切酶1 μL、10×内切酶缓冲buffer 1 μL,总酶切反应体系10 μL。在37℃条件下酶切1 h,之后电泳分析。若酶切出2.7—3.0 kb或1.5 kb左右的条带,应用琼脂糖凝胶回收试剂盒(Thermo公司)回收RCA酶切产物,纯化后连接到相应酶切处理的pGEM-3Z/5Z载体上,并转化大肠杆菌菌株Trans-T1,每个平板随机挑取3个阳性克隆送上海生工生物股份有限公司测序。1.4.2 DNA-B组分全长序列扩增及克隆 根据已报道SLCCNV的DNA-B组分序列(GenBank登录号:KC171649),设计一对背向引物F1/R1,用于扩增DNA-B组分全长,引物序列为F1:CAATGTAGCGTT TACATTTGATTTC/R1:AATAAAGGCGTGTGATAA ATTTATTG,反应体系:待测病样总DNA 1 μL(约20 ng),灭菌水9.5 μL,PCR Mixer 12.5 μL(TaKaRa公司),10 μmol·L-1上、下游引物各1 μL,总体积25 μL。反应程序:94℃ 5 min;94℃ 1 min;50℃ 1 min;72℃ 3 min,35个循环;72℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测。应用琼脂糖凝胶回收试剂盒(Thermo公司)回收目的大小片段,连接至pMD19-T载体,并转化大肠杆菌菌株Trans-T1,每个平板随机挑取3个阳性克隆送上海生工生物股份有限公司测序。
1.5 序列分析
利用DNAStar软件(DNASTAR Inc,Madison,USA)对测序的基因序列进行拼接,获得病毒各分离物基因组两个组分的全长序列,进一步将所获病毒基因组全长序列在NCBI(1.6 SLCCNV侵染性克隆构建
1.6.1 DNA-A侵染性克隆的构建 以采自河源市源城区的南瓜样品HYNG-01为毒源,构建该病毒分离物的侵染性克隆。设计引物分别扩增两个1.0倍的DNA-A,扩增引物分别为SLA1-F:ATATCGAATTCC TGCAGC CCCTTCTT CTTCT TCTGTGGTTGC / SLA1-R:GAAGAA GAAGA ACATCA GGCGTAG ACGAATTG;SLA2-F:GCCTGAT GTTCTTCT TCTTCTTCTG TGGTTGC/SLA2-R:CTAGAACT AGTGGATCC CCCAACATCA GGCGT AGACGA ATTG(下划线为同源重组序列)。序列经测序验证无误后,将所获得的两个1.0倍的DNA-A通过同源重组技术连接到pGreenⅡ0229载体上,进一步对所得重组质粒进行酶切和PCR鉴定,最终获得DNA-A组分的侵染性克隆pGreenⅡ0229- 2.0A。1.6.2 DNA-B侵染性克隆的构建 以采自河源市源城区的南瓜样品HYNG-01为毒源,设计引物分别扩增两个1.0倍的DNA-B,扩增引物分别为SLB1-F:ATATCGAA TTCCTGC AGCCCT ATGGTC TGCTGGTGAC AGAAACC/SLB1-R:GCAGACCA TACAAAAA CCTCAGCGGAT TAGATG;SLB2-F:GAGGTTTTTG TATGGTCTG CTGGTG ACAGAAACC/SLB2-R:CTAGAACTAG TGGATCCCCC CAAAAACC TCAGCGG ATTAG ATG(下划线为同源重组序列)。序列经测序验证无误后,将所获的两个1.0倍的DNA-B通过同源重组技术连接到pGreenⅡ0229载体上,对得到的质粒进行酶切和PCR鉴定,最终获得DNA-B组分的侵染性克隆pGreenⅡ0229-2.0B。
1.7 侵染性克隆的接种
将质粒pGreenⅡ0229-2.0A和pGreenⅡ0229-2.0B(约0.5 μg)分别转入100 μL GV3101(含pSoup)农杆菌感受态细胞(上海唯地生物技术有限公司),28℃培养48 h,对单菌落进行PCR验证。分别将含有pGreenⅡ0229-2.0A和pGreenⅡ0229-2.0B质粒的农杆菌单菌落接种于5 mL LB液体培养基中(100 μg·mL-1卡那霉素、25 μg·mL-1利福平),28℃条件下,220 r/min培养过夜,4 000 r/min离心10 min,弃上清,收集沉淀,用农杆菌悬浮缓冲液(10 mmol·L-1 MES,10 mmol·L-1 MgCl2,150 μmol·L-1 AS)重悬,将菌液OD600值调至约1.0。在室温静置3 h后对南瓜(品种:蜜本3号)进行注射接种。1.8 Western blot检测
取50 mg发病及健康对照的南瓜植株样品于2 mL离心管中,经液氮速冻及组织研磨机研磨,加入300 μL蛋白上样缓冲液,充分振荡混匀。沸水浴10 min,立即置于冰上2 min,12 000 r/min离心10 min,取20 μL上清进行Western blot检测。Western blot一抗选用与SLCCNV CP氨基酸序列相似性为61.1%的广东番茄曲叶病毒(tomato leaf curl Guangdong virus,ToLCGuV)CP多克隆抗体,兔二抗购自Sigma Aldrich。2 结果
2.1 样品采集及检测
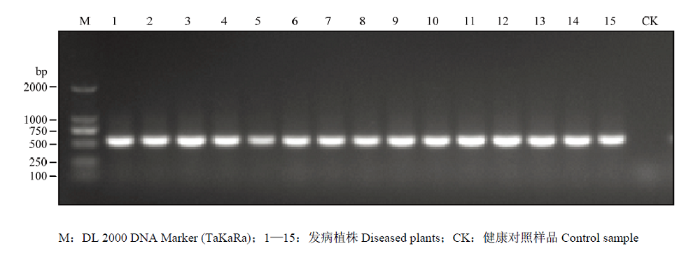
2018—2020年,对广东省葫芦科作物病毒病进行调查,发现部分田间的南瓜、葫芦、冬瓜、白瓜4种葫芦科作物叶片表现为叶片皱缩、卷曲等症状(图1),疑似感染了菜豆金色黄花叶病毒属病毒,分别随机采集疑似病样53份(表1)。利用begomoviruses特异简并引物AV494/CoPR[27,28]进行PCR检测,52份病样总DNA中能扩增出大小为570 bp的特异目的片段,对照中未扩增出片段(图2)。表明除了1份冬瓜病样外,其他52份病样中存在菜豆金色黄花叶病毒属病毒(表1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图14种葫芦科作物植株典型的田间症状
Fig. 1Typical symptoms of four Cucurbitaceae crops in fields
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2疑似病样中烟粉虱传双生病毒PCR检测
Fig. 2PCR detection of suspected samples infecting whitefly-transmitted geminivirus
Table 1
表1
表1采集样品及检出率
Table 1
| 采样地区Sampling area | 作物Crop | 样品数Sample number | 检出率Detection rate (%) |
|---|---|---|---|
| 湛江市雷州市 Leizhou City, Zhanjiang City | 南瓜Pumpkin | 3 | 100.0 |
| 湛江市徐闻县 Xuwen County, Zhanjiang City | 南瓜Pumpkin | 5 | 100.0 |
| 惠州市博罗县 Boluo County, Huizhou City | 南瓜Pumpkin | 7 | 100.0 |
| 葫芦Cucurbits | 10 | 100.0 | |
| 冬瓜Wax gourd | 7 | 85.7 | |
| 河源市源城区 Yuancheng District, Heyuan City | 南瓜Pumpkin | 6 | 100.0 |
| 佛山市高明区 Gaoming District, Foshan City | 南瓜Pumpkin | 10 | 100.0 |
| 白瓜White melon | 5 | 100.0 |
新窗口打开|下载CSV
2.2 病毒分离物基因组的克隆与序列分析
2.2.1 病毒基因组结构 对于每一采样地的每种葫芦科作物病样,各挑选一个PCR检测为阳性的样品总DNA进行RCA和酶切,利用BamH Ⅰ酶切均可以切出一条2.7 kb的条带,经克隆和序列测定,共获得8个广东分离物的基因组全长(表2),这8个广东分离物均含有DNA-A和DNA-B两个组分。进一步分析发现,8个分离物基因组结构特征基本一致,都为闭合环状结构,且均有一个共同区(CR),该CR区含有9碱基保守序列TAATATT/AC[32]。DNA-A组分编码6个ORF,其中,病毒链编码2个蛋白,AV1编码外壳蛋白,AV2编码与移动相关蛋白;互补链编码4个蛋白,AC1编码复制相关蛋白,AC2编码转录激活蛋白,AC3编码复制增强蛋白,AC5编码复制或转录调控因子。DNA-B组分编码2个ORF,BC1和BV1,编码与病毒运动相关的蛋白。8个分离物DNA-A和DNA-B组分ORF区域见表3。Table 2
表2
表2广东分离物序列全长和GenBank登录号
Table 2
| 采样地区 Sampling area | 作物 Crop | 分离物 Isolate | DNA-A | DNA-B | ||
|---|---|---|---|---|---|---|
| GenBank登录号 Sequence ID | 序列全长 Length (nt) | GenBank登录号 Sequence ID | 序列全长 Length (nt) | |||
| 湛江市雷州市Leizhou City, Zhanjiang City | 南瓜 Pumpkin | LZNG | MW389929 | 2736 | MW389930 | 2701 |
| 湛江市徐闻县Xuwen County, Zhanjiang City | 南瓜 Pumpkin | XWNG | MW389919 | 2737 | MW389920 | 2721 |
| 惠州市博罗县Boluo County, Huizhou City | 南瓜 Pumpkin | HZNG | MW389921 | 2737 | MW389922 | 2721 |
| 葫芦 Cucurbits | HZHL | MW389925 | 2739 | MW389926 | 2719 | |
| 冬瓜 Wax gourd | HZDG | MW389927 | 2735 | MW389928 | 2721 | |
| 河源市源城区Yuancheng District, Heyuan City | 南瓜 Pumpkin | HYNG | MW389917 | 2736 | MW389918 | 2721 |
| 佛山市高明区Gaoming District, Foshan City | 南瓜 Pumpkin | FSNG | MW389915 | 2736 | MW389916 | 2719 |
| 白瓜 White melon | FSBG | MW389923 | 2736 | MW389924 | 2718 | |
新窗口打开|下载CSV
Table 3
表3
表38个广东分离物ORF位点
Table 3
| ORF | HYNG | HZNG | HZHL | HZDG | FSNG | FSBG | LZNG | XWNG | |
|---|---|---|---|---|---|---|---|---|---|
| DNA-A | AV1 | 279-1049 | 280-1050 | 279-1049 | 279-1049 | 279-1049 | 279-1049 | 279-1049 | 280-1050 |
| AV2 | 41-457 | 6-458 | 41-457 | 41-457 | 41-457 | 41-457 | 41-457 | 72-458 | |
| AC1 | 1507-2583 | 1464-2585 | 1507-2583 | 1507-2583 | 1507-2583 | 1507-2583 | 1507-2583 | 1508-2584 | |
| AC2 | 1191-1595 | 1192-1473 | 1191-1595 | 1191-1595 | 1191-1595 | 1191-1595 | 1191-1595 | 1192-1596 | |
| AC3 | 1046-1456 | 1047-1457 | 1046-1456 | 1046-1456 | 1046-1456 | 1046-1456 | 1046-1456 | 1047-1457 | |
| AC5 | 309-827 | 310-828 | 309-827 | 309-827 | 309-827 | 309-827 | 309-827 | 310-828 | |
| DNA-B | BV1 | 479-1285 | 479-1285 | 479-1285 | 479-1285 | 478-1284 | 478-1284 | 475-1281 | 479-1285 |
| BC1 | 1268-2314 | 1365-2186 | 1364-2314 | 1364-2314 | 1363-2184 | 1267-2184 | 1335-2180 | 1338-2183 |
新窗口打开|下载CSV
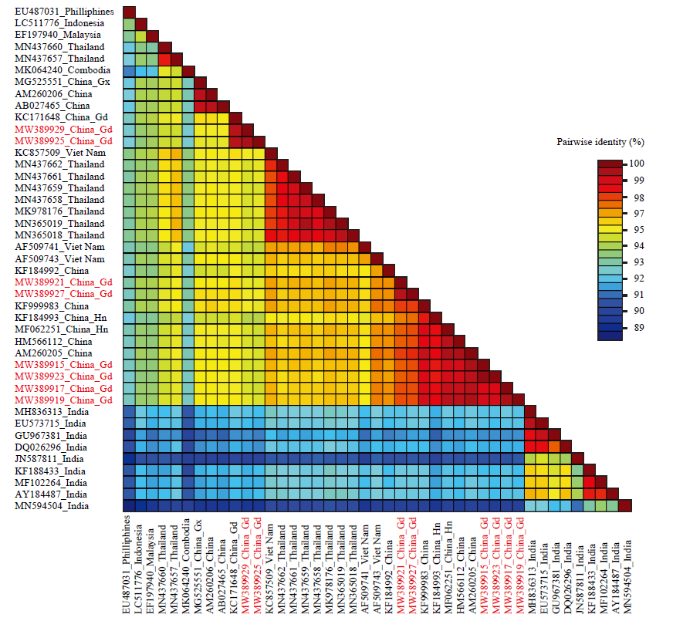
2.2.2 病毒序列相似性分析 序列比对发现(图3),8个广东分离物DNA-A组分之间的序列相似性在94.9%以上。其中,佛山南瓜分离物FSNG和佛山白瓜分离物FSBG的相似性最高,为99.9%,河源南瓜分离物HYNG和湛江徐闻南瓜分离物XWNG的相似性仅次于前者,为99.5%,湛江雷州南瓜分离物LZNG和惠州葫芦分离物HZHL的相似性为99.4%,惠州南瓜分离物HZNG和惠州冬瓜分离物HZDG的相似性为99.3%。BLAST检索结果表明,8个广东分离物的DNA-A与已登录GenBank的SLCCNV各个分离物DNA-A相似性均大于88%;进一步分析发现,8个广东分离物与来自我国不同地区的10个SLCCNV分离物以及泰国、越南、马来西亚、菲律宾、印度尼西亚的16个SLCCNV分离物相似性均在92%以上,其中与来自我国不同地区的分离物相似性最高,在95%以上;而与来自印度的9个分离物的相似性较低,均在92%以下(图3)。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3SLCCNV 8个广东分离物与其他35个分离物DNA-A序列相似性
Fig. 3The DNA-A sequence identity comparison between eight Guangdong isolates and other 35 isolates of SLCCNV
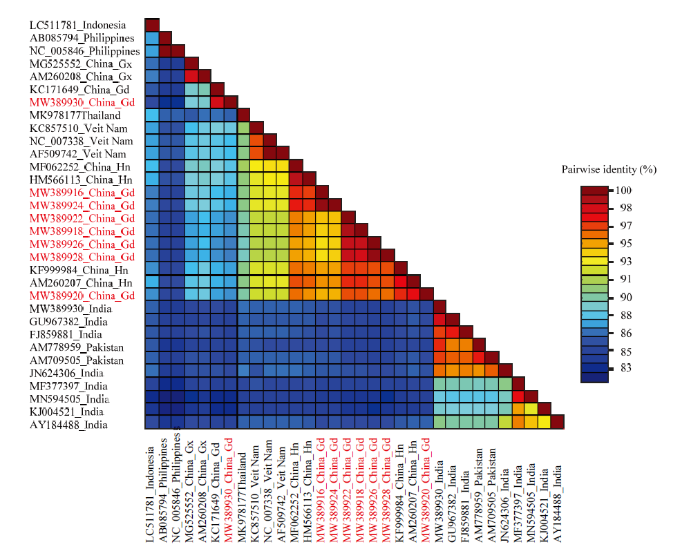
8个SLCCNV 广东分离物DNA-B组分的序列相似性均在86.7%以上,除雷州南瓜分离物LZNG外,其余7个分离物之间的相似性都在94.7%以上。惠州冬瓜分离物HZDG与惠州葫芦分离物HZHL相似性最高,为99.8%;佛山南瓜和白瓜分离物FSNG、FSBG与徐闻南瓜分离物XWNG,雷州南瓜分离物LZNG,惠州南瓜、葫芦和冬瓜分离物HZNG、HZHL、HZDG的相似性都在95%以下;雷州南瓜分离物LZNG与佛山白瓜分离物FSBG的相似性为87.6%。BLAST检索结果表明,8个广东分离物的DNA-B与已登录GenBank的SLCCNV的各个分离物DNA-B相似性均大于83%,其中与来自我国不同地区的7个分离物的相似性为87%—98%,与泰国、越南、菲律宾、印度尼西亚等7个SLCCNV分离物相似性为83%—92%,而与来自印度的8个分离物和巴基斯坦的2个分离物相似性均在86%以下,分离物LZNG与印度J1分离物(登录号:MN594505)的相似性最低,仅83.1%(图4)。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4SLCCNV 8个广东分离物与其他24个分离物的DNA-B序列相似性
Fig. 4The DNA-B sequence identity comparison between eight Guangdong isolates and other 24 isolates of SLCCNV
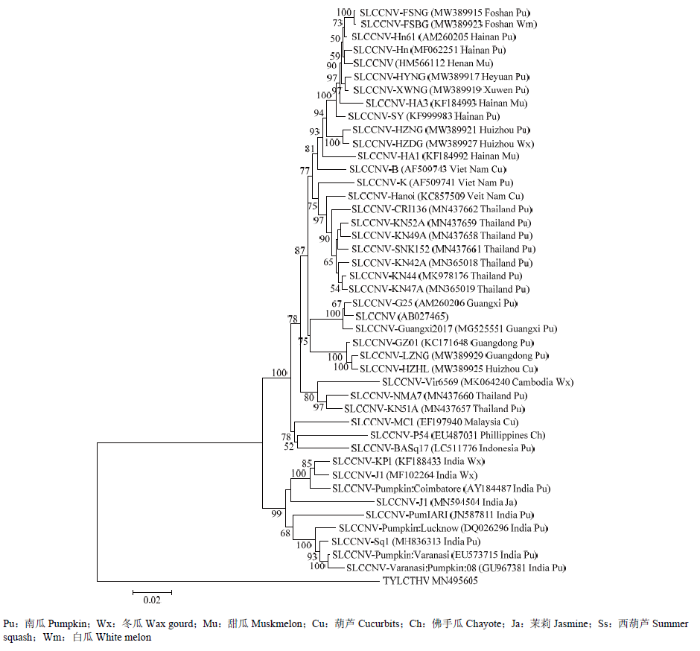
2.2.3 病毒亲缘关系分析 为了分析8个广东分离物DNA-A与SLCCNV其他35个分离物的亲缘关系,以泰国番茄黄化曲叶病毒(tomato yellow leaf curl Thailand virus)DNA-A组分(登录号:MN495605)为外组,利用MEGA7软件以邻接法构建了系统进化树。结果显示(图5),8个广东分离物与来自中国不同地区、越南、泰国、柬埔寨等23个SLCCNV分离物聚类在一个分支,亲缘关系较近;进一步与印度尼西亚、菲律宾和马来西亚3个SLCCNV分离物形成一个大的分支;而来自印度的9个SLCCNV分离物聚类在另一个分支,8个广东分离物与其亲缘关系较远。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5基于SLCCNV DNA-A全长序列8个广东分离物与其他35个分离物的系统进化树
Fig. 5DNA-A phylogenetic tree between eight Guangdong isolates and other 35 isolates based on full-length sequence of SLCCNV
SLCCNV DNA-B组分亲缘关系分析显示,8个广东分离物DNA-B与来自我国不同地区及越南和泰国等11个SLCCNV分离物亲缘关系较近,聚类在一个分支;进一步与印度8个分离物和巴基斯坦2个分离物形成一个大的分支;而2个菲律宾分离物和1个印度尼西亚分离物与上述分离物的亲缘关系均较远(图6)。
图6
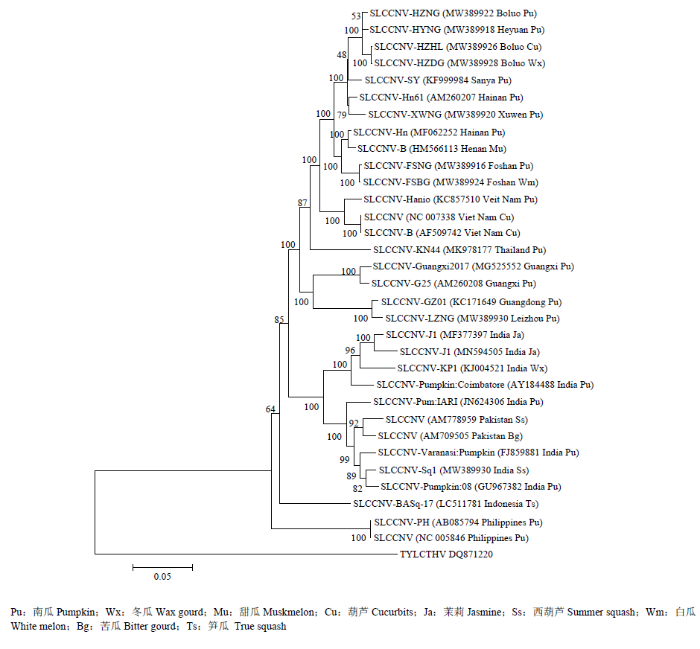 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6基于SLCCNV DNA-B全长序列8个广东分离物与其他24个分离物的系统进化树
Fig. 6DNA-B phylogenetic tree between eight Guangdong isolates and other 24 isolates based on full-length sequence of SLCCNV
2.3 HYNG-01分离物的致病性测定
将构建的SLCCNV分离物HYNG-01的侵染性克隆按照pGreenⅡ0229-2.0A+pGreenⅡ0229-2.0B(1﹕1)处理注射接种南瓜子叶。结果显示,15 dpi时,接种的9株南瓜中有3株上部叶片出现了明显的皱缩、卷曲症状;30 dpi时,症状更加明显(图7-A)。利用检测DNA-A的引物AV494/CoPR和DNA-B的引物F1/R1对接种植株进行PCR检测,结果显示,两对引物均能从显症植株总DNA扩增出预期大小的特异片段,而健康对照植株未扩增出任何条带(图7-B);进一步Western blot结果显示,显症植株中可以检测到CP条带,而健康对照植株中没有检测到条带(图7-C)。这些结果说明,显症植株中确实存在SLCCNV。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7SLCCNV分离物HYNG接种南瓜的症状及检测结果
A:HYNG接种南瓜上的症状及健康对照植株 Symptoms of pumpkin infected by isolate HYNG and healthy plant。Mock:未接种对照植株 Control plant without inoculation。右图为白色方框放大图 The right figure is magnification of the white frame。B:接种植株PCR检测结果 PCR detection of inoculated plants。C:Western blot检测结果Result of Western blot detection。Mock:未接种对照植株 Control plant without inoculation。M:Protein marker
Fig. 7Symptoms of pumpkin inoculated with SLCCNV isolate HYNG and detection
3 讨论
本文应用RCA扩增及基因克隆方法,从采集于广东多地葫芦科作物感染烟粉虱传双生病毒的病样中克隆获得8个双生病毒分离物基因组全序列,该基因组为双组分,其中DNA-A组分序列间相似性在94.9%以上,DNA-B组分序列间相似性86.7%—99.8%,而8个广东分离物的DNA-A组分与已报道的SLCCNV各分离物序列相似性均在88%以上。根据国际双生病毒科分类方案[33],从广东葫芦科作物分离获得的8个病毒分离物均属于SLCCNV。SLCCNV为双生病毒科菜豆金色黄花叶病毒属成员。该属病毒是双生病毒科中种类最多、分布最广、危害最重的一个属,主要通过烟粉虱传播,广泛分布于热带和亚热带地区,严重威胁番茄、辣椒、木薯、南瓜、甘薯、番木瓜等多种重要经济作物的生产安全。早在1994年,洪益国等[1]在广西南宁市南瓜表现曲叶病植株上检测到烟粉虱传双生病毒,并鉴定出该病毒为SLCCNV,是双生病毒科一个新种。随着烟粉虱在我国大范围的发生和扩散,也导致SLCCNV在我国广西、河南、海南等地葫芦科作物上流行,并造成较大经济损失。本文对危害广东省葫芦科作物的烟粉虱传双生病毒进行分子鉴定,明确该病毒是SLCCNV,并证明了该病毒是引起广东南瓜曲叶病的病原,这是首次在广东发现SLCCNV。
关于危害广东葫芦科作物的SLCCNV来源,目前GenBank上的SLCCNV基因组全序列有24个,系统进化分析结果显示,来自中国、越南、泰国、菲律宾、印度尼西亚的分离物聚类在一个分支,组成东亚-东南亚组;而来自印度分离物聚类在另一个分支,组成南亚组。进一步分析发现,来自广东HYNG、HZNG、HZDG、FSNG、FSBG、XWNG这6个分离物与河南、海南、越南、泰国等地的SLCCNV分离物亲缘关系较近,而分离物LZNG、HZHL与广西分离物亲缘关系较近。由此推测,侵染广东葫芦科作物的SLCCNV可能有两个来源,一是海南或越南、泰国,二是广西;传入途径主要是通过调运葫芦科作物种苗及其携带的烟粉虱带毒传入。
农杆菌介导的侵染性克隆接种技术是研究双生病毒致病性的有效手段,被研究者普遍采用。本研究利用同源重组技术成功构建了SLCCNV广东河源南瓜分离物的侵染性克隆,通过农杆菌介导的侵染性克隆注射接种蜜本3号南瓜子叶,明确了SLCCNV广东河源南瓜分离物DNA-A和DNA-B组分共同侵染南瓜时可以引起与田间症状相同的南瓜曲叶病,从而证实了广东南瓜曲叶病是由双组分病毒SLCCNV侵染所引起的病害。除南瓜病样外,本研究也从冬瓜、葫芦、白瓜3种葫芦科作物中检测出SLCCNV,SLCCNV对冬瓜、葫芦、白瓜以及其他葫芦科作物的致病性如何,还有待进一步试验验证。
SLCCNV首次发现于中国广西,除我国海南、云南、河南外,在越南、印度、菲律宾、泰国、巴基斯坦、印度尼西亚等多国多地也已发生,报道的自然寄主有南瓜、葫芦、冬瓜、黄瓜、甜瓜、哈密瓜等多种葫芦科作物。2020年,赵丽玲等[22]在云南的非葫芦科作物水茄上检测到该病毒。本研究也首次在白瓜上检测到SLCCNV。可见,SLCCNV地理分布和寄主范围正在不断扩大,危害越来越重。SLCCNV主要靠烟粉虱带毒近距离传播和带毒种苗调运进行远距离传播,对未发生区域应加强检疫,确保种植无毒种苗,从源头控制该病毒的危害;同时,生产上尽可能选择抗病品种,控制田间烟粉虱的发生,以有效地控制该病毒的发生与流行。
广东种植有南瓜、冬瓜、节瓜、黄瓜、丝瓜、葫芦等多种葫芦科作物,病毒病是制约葫芦科作物正常生产的重要因子之一,本实验室对其相关病原病毒开展了研究,李正刚等[34]明确了侵染广东连州葫芦的黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)的分子特征以及其致病性;LI等[35]利用小RNA深度测序技术鉴定出侵染广东葫芦科作物的有来源10个不同属的17种病毒,其中来自双生病毒科菜豆金色黄花叶病毒属的病毒仅有SLCCNV一种。本文采用RCA扩增及基因克隆方法,从广东葫芦科病样中仅鉴定出SLCCNV,这一结果与LI等[35]的研究结果一致。虽然目前危害广东葫芦科作物的菜豆金色黄花叶病毒属病毒仅有SLCCNV,但广东地区存在其他多种菜豆金色黄花叶病毒属病毒,加上烟粉虱发生极为普遍,也容易导致其他病毒种类危害葫芦科作物。因此,极有必要后续继续对危害广东省葫芦科作物的菜豆金色黄花叶病毒属病毒种类进行监测,及时了解病毒种类动态变化。
4 结论
中国南瓜曲叶病毒(SLCCNV)侵染广东南瓜、葫芦、冬瓜、白瓜等葫芦科作物,是广东南瓜曲叶病的病原,危害广东葫芦科作物的SLCCNV可能来自广西、海南等地,也可能来自与广东农产品贸易频繁的越南、泰国等国家。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 6]
[本文引用: 6]
DOI:10.1002/ps.2014.70.issue-10URL [本文引用: 2]
DOI:10.1146/annurev-phyto-082712-102346URL [本文引用: 2]
DOI:10.1080/03235400902952301URL [本文引用: 1]
DOI:10.5197/j.2044-0588.2013.028.020URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1111/mpp.2013.14.issue-6URL [本文引用: 1]
DOI:10.1080/07352689209382350URL [本文引用: 1]
DOI:10.1007/s00705-003-0109-6URL [本文引用: 1]
DOI:10.1111/j.1439-0434.2007.01347.xURL [本文引用: 1]
DOI:10.1007/s11262-009-0396-4URL [本文引用: 1]
DOI:10.1080/03235408.2011.646670URL [本文引用: 1]
DOI:10.1046/j.1439-0434.2003.00764.xURL [本文引用: 1]
[本文引用: 1]
DOI:10.1071/DN10009URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/S2095-3119(19)62642-0URL [本文引用: 2]
[D].
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.2306/scienceasia1513-1874.2009.35.131URL [本文引用: 1]
[本文引用: 1]
DOI:10.5197/j.2044-0588.2015.031.003URL [本文引用: 1]
DOI:10.14692/jfiURL [本文引用: 1]
DOI:10.1094/Phyto-86-1288URL [本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
DOI:10.1371/journal.pone.0108277URL [本文引用: 1]
DOI:10.1093/molbev/msw054URL [本文引用: 1]
DOI:10.1080/07352689991309162URL [本文引用: 1]
DOI:10.1007/s00705-015-2398-yURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
