 ,, 曹克强河北农业大学植物保护学院,河北保定 071001
,, 曹克强河北农业大学植物保护学院,河北保定 071001Molecular Variation and Phylogenetic Relationship of Apple Scar Skin Viroid in Seven Cultivars of Apple
LI ZiTeng, CAO YuHan, LI Nan, MENG XiangLong, HU TongLe, WANG ShuTong, WANG YaNan ,, CAO KeQiangCollege of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei
,, CAO KeQiangCollege of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei通讯作者:
责任编辑: 岳梅
收稿日期:2021-03-10接受日期:2021-04-23
| 基金资助: |
Received:2021-03-10Accepted:2021-04-23
作者简介 About authors
李紫腾,E-mail:
曹钰晗,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (4449KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李紫腾, 曹钰晗, 李楠, 孟祥龙, 胡同乐, 王树桐, 王亚南, 曹克强. 苹果锈果类病毒在7个品种苹果上的分子变异及系统发育关系. 中国农业科学, 2021, 54(20): 4326-4336 doi:10.3864/j.issn.0578-1752.2021.20.007
LI ZiTeng, CAO YuHan, LI Nan, MENG XiangLong, HU TongLe, WANG ShuTong, WANG YaNan, CAO KeQiang.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】我国的苹果栽培面积和产量均居世界首位,苹果产业在农业结构调整、农民增收和优化生态等方面具有重要地位[1]。近几年,苹果锈果病在我国苹果产业中危害严重,在我国北方苹果主产区发病率达4.8%—48.6%[2,3]。苹果锈果病由苹果锈果类病毒(apple scar skin viroid,ASSVd)侵染所致。ASSVd为侵染苹果的最小类病毒病原体之一[4],属马铃薯纺锤块茎类病毒科(Pospivioidae)苹果锈果类病毒属(Apscaviroid)[5]。ASSVd存在于细胞核内,具有中央保守序列且不具核酶活性,以非对称滚式复制。一般是由330个左右的核苷酸组成的共价闭合环状单链,呈棍棒状二级结构[6]。ASSVd侵染苹果植株后,树体的正常生理机能会遭受干扰和破坏,感病植株的果实变小、硬度增加、表面有花脸或锈斑、风味变劣[7,8,9,10,11]。在与寄主长期互作和进化过程中,病毒的分子变异不可避免。研究不同苹果品种ASSVd的分子变异及系统发育,可为病毒与寄主互作机制的揭示打下基础,对苹果锈果病的有效防控具有重要意义。【前人研究进展】类病毒具有自主复制能力,大多数类病毒在细胞核中复制,有一个中心保守区(central conserved region,CCR)[12,13]。目前已经发现超过30种类病毒,根据物理、化学、生物学和分子生物学特征,将其划分为两个科,分别为马铃薯纺锤块茎类病毒科和鳄梨日斑类病毒科(Avsunviroidae)[14,15]。尽管类病毒不编码蛋白质,但仍可侵染高等植物,并在许多经济作物上引起病害[16,17,18,19,20,21]。1985年,陈炜等[22]从苹果锈果病组织中提取总核酸,发现苹果锈果病组织中存在一种环状结构的类病毒RNA;刘娟[23]对山东苹果的ASSVd进行全序列分析,发现同一地区不同品种上的ASSVd存在一定的寄主专化性和地区专化性;朱慧[24]对梨上的ASSVd分离物序列进行分析,发现源自37份梨样品和13份苹果样品的ASSVd全长RNA序列经系统发育分析后其ASSVd分离物聚为两组,且碱基发生变化的主要区域为左、右端区和致病区;查富蓉[25]从山东、山西和辽宁省采集的苹果果实中选取11个ASSVd分离物,共得到71个ASSVd序列,比对共有序列并构建二级结构,可标出71个ASSVd克隆的变异位点,除了在ASSVd二级结构的右末端区(TR区)变异较小,只有一个碱基位点的变异,左末端区(TL区)、致病区(P区)、中央保守区(C区)和可变区(V区)均覆盖了大量碱基位点的变异,这些变异大部分为单个克隆的变异,变异概率小;刘洪玉等[26]对山东苹果‘舞美’果实的ASSVd全序列分析后发现,分离物基因组主流序列为333 nt(登录号MG745387),与GenBank中已报道的ASSVd序列一致性为92%—99%。序列多重比对及系统进化树分析发现,该分离物的末端保守区和中央保守区与ASSVd参考序列一致,且与不同来源的ASSVd分离物亲缘关系较近。【本研究切入点】前人关于ASSVd分子变异的研究多数只单纯分析了某分离物分子变异位点及变异区域,自然界中病原与植物经过长期的斗争和演化,类病毒重组现象又很普遍,寄主中存在类病毒单一基因组的可能性很小,尤其是对于类病毒这种微小的病原,变异率很高,存在不同变体群体的可能性更大。因此,本研究针对不同苹果品种上携带的ASSVd基因组进行大量测序,分析不同品种中ASSVd变体群体的特点。【拟解决的关键问题】探究不同苹果品种中ASSVd基因组群体组成的差异,为进一步揭示ASSVd分子变异机制提供理论依据。1 材料与方法
1.1 供试材料
斗南、王林、中秋王、富士和金冠苹果样本于2018年采自河北保定顺平,信侬黄、信侬红品种样本采自国家苹果产业技术体系河北农业大学苹果实验园,表现症状如图1所示(金冠症状不明显,图略)。携带ASSVd和不携带ASSVd的样本均进行了RT-PCR鉴定。每个品种选择6棵染病果树,每棵树按照东、西、南、北4个方向采样并混合作为一个样本,共计42份苹果样品,进行PCR扩增和分子克隆。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1携带ASSVd各苹果品种果实的症状
a—f依次为富士、斗南、信侬红、王林、中秋王、信侬黄品种的健康果实;A—F依次对应富士(花脸型)、斗南(花脸型)、信侬红(花脸型)、王林(锈果和畸形)、中秋王(锈果型)、信侬黄(果面凹凸不平)品种的感病果实
Fig. 1The fruit symptom of different cultivars of apple infected by ASSVd
a-f is the healthy fruit of Fuji, Tonami, Xin Nonghong, Wang Lin, Mid-Autumn King and Xin Nonghuang cultivars; A-F corresponds to the susceptible fruits of Fuji (color dappling), Tonami (color dappling), Xin Nonghong (color dappling), Wang Lin (russeting and distortion), Mid-Autumn King (russeting) and Xin Nonghuang (uneven and rough fruit surface)
1.2 RNA提取及cDNA合成
使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技(北京)有限公司)按照说明书提取样本的总RNA。利用NanoDrop 2000分光光度计测定RNA的浓度及纯度。使用EasyScript® First-Strand cDNA Synthesis SuperMix试剂盒(北京全式金生物技术有限公司)按照说明书进行cDNA合成,保存于-20℃备用。1.3 PCR扩增、产物回收与纯化
以cDNA为模板进行PCR扩增,根据GenBank已经发表的ASSVd序列,选择保守性区域设计特异性引物,上游引物序列为Qxin-5′:GAACCCACAGCG GAACTGG,下游引物序列为Qxin-3′:GCCTACAAG AACGTACGGTGTTGA,引物委托生工生物工程(上海)股份有限公司合成。25 μL反应体系:cDNA模板1 μL,上、下游引物(20 pmol·μL-1)各1 μL,2×Es Taq MasterMix 12.5 μL,ddH2O定容至25 μL。PCR反应程序:94℃预变性10 min;94℃变性1 min,退火49.1℃ 1 min,72℃延伸1 min,35个循环;最后72℃延伸1 min。1%的琼脂糖凝胶电泳检测,普通琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司)对PCR产物进行回收。1.4 连接及转化
使用pEASY®-T1 Simple Cloning Kit(北京全式金生物科技有限公司)按照说明书进行连接反应,置于冰上备用。取出冻存于-80℃的Trans1-T1感受态细胞置于冰上解冻,将连接产物加入到感受态细胞中(体积比为1﹕10),轻弹混匀后置于冰上30 min,42℃热激30 s,冰上冷却2 min。加入250 μL不含抗生素的LB培养基,37℃、200 r/min振荡培养1.5 h。吸取150 μL菌液均匀涂布于含有氨苄、IPTG和X-gal的LB平板上,37℃倒置培养12—16 h。1.5 阳性克隆筛选及测序
采用蓝白斑法及PCR方法筛选阳性克隆,委托华大基因公司进行测序。每个品种6份样本,分子克隆结合Chromas 2.4.1分析,获得30条准确的基因组序列,7个品种共获得210条ASSVd的全长序列,进行比对分析。将有差异的病毒基因组认定为一个变体。1.6 系统发育和RNA二级结构分析
使用DNAMAN软件分析序列之间的一致性后,使用TBtools软件进行热图的绘制;应用SDT1.2软件对序列进行分析,采用Muscle法进行比对,邻接法(neighbor-joining,NJ)对结果进行聚类;应用MEGA 7.0软件进行系统发育分析,采用Clustal W法对序列进行比对,邻接法进行系统发育树构建,系统发育树中各分支置信度(Bootstrap)进行1 000次重复分析;最后使用RNA structure(参数设置:MAX% energy difference为10%,MAX number of structure为20)预测所得序列的二级结构。2 结果
2.1 不同苹果品种中ASSVd基因组序列分析
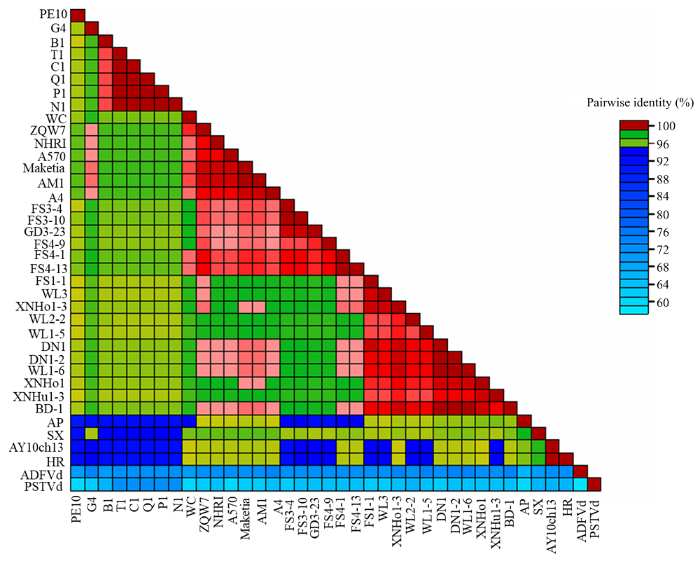
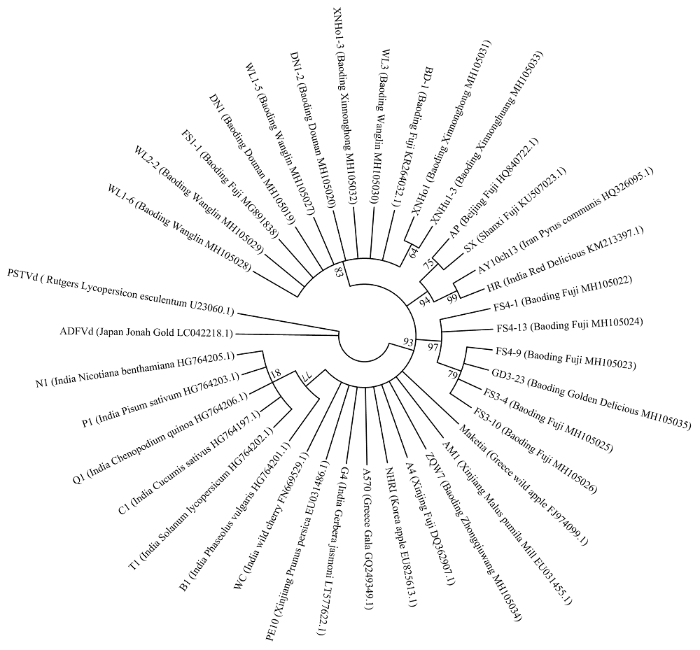
对7个品种的42份苹果样本中的ASSVd扩增产物进行克隆和测序,共获得210条ASSVd全长序列,经分析,包括17种变体,基因组大小在325—333 nt,上传到GenBank,登录号为 MH105019、MH105020、MG891838和MH105022—MH105035。对17种变体进行序列比对分析,结果如图2所示,各变体之间一致性在96.4%—100%。对不同苹果品种的ASSVd 17种变体与已报道的 21个分离物进行自动聚类和系统发育分析,结果如图3和图4所示,17种变体可分为3组,组Ⅰ包含XNHo1-3(MH105032)、WL3(MH105030)、WL1-6(MH105028)、DN1-2(MH105020)、DN1(MH105019)、FS1-1(MG891838)、WL1-5(MH105027)、WL2-2(MH105029)、XNHo1(MH105031)和XNHu1-3(MH105033),同已报道的保定富士分离物(KR264032)亲缘关系较近;组Ⅱ包含FS4-13(MH105024)、FS4-1(MH105022)、FS3-4(MH105025)、FS3-10(MH105026)、GD3-23(MH105035)和FS4-9(MH105023)单独聚类;组Ⅲ包含ZQW7(MH105034),与新疆红富士苹果上的分离物(EU031455.1)亲缘关系较近。
图2
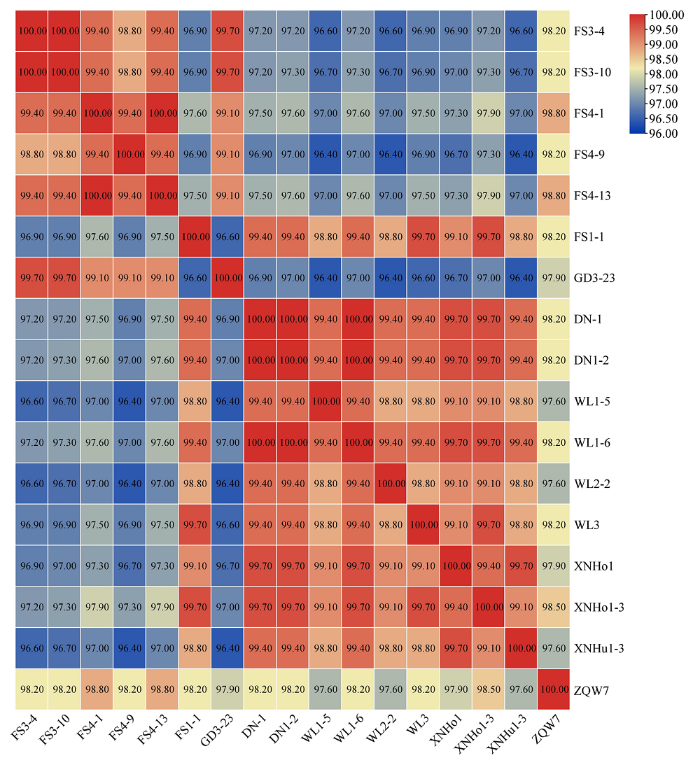 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图27个苹果品种中ASSVd 17种变体序列的一致性比较
各序列的具体信息见
Fig. 2The identity comparison among 17 variants of ASSVd from 7 cultivars of apple
The specific information of each sequence is shown in
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图37个苹果品种中ASSVd 17种变体序列与其他代表性序列聚类分析
Fig. 3The cluster analysis between 17 ASSVd variants from 7 apple cultivars and other representative isolates
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图47个苹果品种中17种ASSVd变体与其他代表性分离物系统发育关系
采用MEGA7.0中邻接法构建系统进化树,置信度(Bootstrap)进行1 000次重复分析。图中内容表述形式为分离物名称/来源及品种/登录号,未显示低于60%的数值
Fig. 4The phylogenetic relationship between 17 ASSVd variants from 7 apple cultivars and other representative isolates
The phylogenetic tree was constructed with MEGA 7.0 by the neighbor-joining method, the Bootstrap was repeated 1 000 times. The description is represented as the isolate/origin and cultivar/accession number. The bootstrap values below 60% are not shown
2.2 不同苹果品种中ASSVd基因组突变位点分析
将7个苹果品种上所得的17种ASSVd变体序列同河北保定首次报道的ASSVd富士分离物BD-1(KR264032.1)进行比对,碱基位点以BD-1为参照,结果如图5所示,斗南分离物DN1、DN1-2(MH105019,MH105020)有5个碱基位点发生了缺失,均在C区(98—101,CCGG缺失;221位T缺失)。富士分离物FS1-1、FS4-1、FS4-9、FS4-13、FS3-4、FS3-10(MG891838,MH105022,MH105023,MH105024,MH105025,MH105026)有22个碱基位点发生了变化,有10个位点在TL区(0,G缺失;2,T→G;3,A→T;22,T→A;41,T→A;42,A→G;44,A→T;46,T缺失;284,G→A;302,T→A),8个位点在C区(96,G→T;97—99,GCC缺失;221,T缺失;244,C→G;249,T→C;251,G缺失),4个位点在TR区(150,T缺失;160—161,GT缺失;163,C→T)。王林分离物WL1-5、WL1-6、WL2-2、WL-3(MH105027,MH105028,MH105029,MH1050230)有11个碱基位置发生了变化,9个位点发生在C区(95,A→G;98—101,CCGG缺失;106,A→G;221,T缺失;230,T→A;251,G→T),2个位点在V区(198,G→A;215,T→C)。信侬红分离物XNHo1、XNHo1-3(MH105031,MH105032)同已报道的保定分离物相比(KR264032.1),有2个碱基位点发生了变化,分别为位于V区的116位点(C→T)和位于C区与P区交界处的251位点(G→T)。信侬黄分离物XNHu1-3(MH105033)有2个碱基位点发生了变化,均处于V区(116,C→T;206,G→A)。中秋王分离物(MH105034)有7个碱基位点发生了变化,4个位点位于TL区(41,T→A;42,A→G;44,A→T;46,T缺失),1个位点位于P区和C区的交界处(251,G→T),2个位点位于TR区(284,G→A;321,T→A)。金冠分离物GD3-23(MH105035)有13个碱基位点发生了变化,9个位点发生在TL区(0,G缺失;2,T→G;3,A→T;41,T→A;42,A→G;44,A→T;46,T缺失;284,G→A;302,T→A),1个位点发生在TR区(163,C→T),3个位点发生在C区(244,C→G;249,T→C;251,G缺失)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5本研究所得全部分离物序列与已报道ASSVd保定序列比对
0—47和281—331为TL区,48—76和252—281为P区,77—106和219—251为C区,107—138和190—218为V区,139—189为TR区 0-47 and 281-331 are TL, 48-76 and 252-281 are P, 77-106 and 219-251 are C, 107-138 and 190-218 are V, 139-189 are TR。TL:左末端区Left terminal region;P:致病区Pathogenic region;C:中央保守区Central conserved region;V:可变区Variable region;TR:右末端区Right terminal region。碱基位点以保定分离物BD-1(KR264032.1)为参照。标注的位置为突变位点 BD-1 (KR264032.1) was used as reference site. The marked position is the mutation site
Fig. 5Comparison of the sequences of all the isolates in this study with the ASSVd sequence from Baoding
将所得17种ASSVd变体进行序列比对分析,碱基位点以保定分离物BD-1为参照,根据碱基位点差异,可以将全部的分离物序列分为6种类型(图5):1、nt 0—3(GGTA)+ nt 41—46(TAAAAT)+ nt 221(T)+ nt 251(T)+ nt 284(G)+ nt 302(T);2、nt 0—3(XGGT)+ nt 41—46(AGATAX)+ nt 221(T)+ nt 251(X)+ nt 284(A)+ nt 302(A);3、nt 0—3(XGGT)+ nt 41—46(AGATAX)+ nt 221(X)+ nt 251(T)+nt 284(A)+ nt 302(A);4、nt 0—3(XGGT/GGTA)+ nt 41—46(AGATAX)+nt 221(T)+ nt 251(T)+ nt 284(A)+ nt 302(A);5、nt 0—3(GGTA)+ nt 41—46(TAAAAT)+nt 221(X)+ nt 251(G)+ nt 284(G)+ nt 302(T);6、nt 0—3(GGTA)+ nt 41—46(TAAAAT)+nt 221(T)+ nt 251(G)+ nt 284(G)+ nt 302(T)。其中X表示缺失。
2.3 不同苹果品种中ASSVd群体组成分析
分析7个品种获得的210条基因组序列,结果如表1所示,发现每个品种含多种碱基类型,各不相同,也存在不同品种含有相同碱基类型的现象。富士品种含有6种碱基类型的ASSVd变体,以碱基类型4为主(47.5%)、碱基类型5占比25.0%,碱基类型6占比12.5%,碱基类型1占比10.0%,碱基类型2和3均占比2.5%;王林品种以碱基类型5为主(43.0%),碱基类型1占比28.4%,碱基类型6占比28.6;金冠以碱基类型4为主(60.0%),碱基类型2占比33.3%,碱基类型3占比6.7%;信侬红以碱基类型1为主(83.3%),碱基类型6占比16.7%;信侬黄以碱基类型1为主(62.5%),碱基类型5占比25.0%,碱基类型6占比12.5%;斗南品种只包含碱基类型5;中秋王只包含碱基类型4。Table 1
表1
表1不同苹果品种携带ASSVd的碱基类型
Table 1
| 苹果品种 Apple cultivar | 碱基类型Base type | |||||
|---|---|---|---|---|---|---|
| Type 1 | Type 2 | Type 3 | Type 4 | Type 5 | Type 6 | |
| 富士Fuji | 10.0 | 2.5 | 2.5 | 47.5 | 25.0 | 12.5 |
| 王林Wang Lin | 28.4 | 0 | 0 | 0 | 43.0 | 28.6 |
| 金冠Gold Delicious | 0 | 33.3 | 6.7 | 60.0 | 0 | 0 |
| 斗南Tonami | 0 | 0 | 0 | 0 | 100.0 | 0 |
| 中秋王Mid-Autumn King | 0 | 0 | 0 | 100.0 | 0 | 0 |
| 信侬红Xin Nonghong | 83.3 | 0 | 0 | 0 | 0 | 16.7 |
| 信侬黄Xin Nonghuang | 62.5 | 0 | 0 | 0 | 25.0 | 12.5 |
新窗口打开|下载CSV
2.4 ASSVd二级结构分析
使用RNA structure构建ASSVd不同分离物的二级结构,所得二级结构均为传统棍棒状,与已报道的二级结构一致(结果未显示)。同时分析了各变体的最小自由能,结果如表2所示,DN1-2的最小自由能最低,为-583.2 kJ·mol-1,是斗南品种的优势变种-碱基类型5;WL1-6的最小自由能同样也最低,为-583.2 kJ·mol-1,为王林品种优势变种-碱基类型5;WL2-2的最小自由能也较低,为-577.8 kJ·mol-1,是王林品种的优势变种-碱基类型6;XNHo1-3的最小自由能也相对较低,为-579.5 kJ·mol-1,为信侬红的优势变种-碱基类型1。Table 2
表2
表2不同ASSVd分离物二级结构最小自由能
Table 2
| 来源 Source | 编号 Number | 长度 Length (nt) | 登录号 Accession number | 碱基类型 Base type | 最小自由能 Minimum free energy (kJ·mol-1) |
|---|---|---|---|---|---|
| 斗南Tonami | DN1 | 325 | MH105019 | 5 | -561.9 |
| 斗南Tonami | DN1-2 | 331 | MH105020 | 5 | -583.2 |
| 富士Fuji | FS1-1 | 329 | MG891838 | 1 | -563.1 |
| 富士Fuji | FS4-1 | 330 | MH105022 | 4 | -565.6 |
| 富士Fuji | FS4-9 | 329 | MH105023 | 3 | -567.7 |
| 富士Fuji | FS4-13 | 329 | MH105024 | 3 | -567.7 |
| 富士Fuji | FS3-4 | 326 | MH105025 | 2 | -558.1 |
| 富士Fuji | FS3-10 | 329 | MH105026 | 2 | -575.7 |
| 王林Wang Lin | WL1-5 | 332 | MH105027 | 6 | -568.1 |
| 王林Wang Lin | WL1-6 | 331 | MH105028 | 5 | -583.2 |
| 王林Wang Lin | WL2-2 | 333 | MH105029 | 6 | -577.8 |
| 王林Wang Lin | WL3 | 328 | MH105030 | 1 | -558.1 |
| 信侬红Xin Nonghong | Xnho1 | 332 | MH105031 | 6 | -576.1 |
| 信侬红Xin Nonghong | Xnho1-3 | 332 | MH105032 | 1 | -579.5 |
| 信侬黄Xin Nonghuang | Xnhu1-3 | 332 | MH105033 | 6 | -572.3 |
| 中秋王Mid-Autumn King | ZQW7 | 331 | MH105034 | 4 | -563.5 |
| 金冠Gold Delicious | GD3-23 | 329 | MH105035 | 2 | -575.7 |
新窗口打开|下载CSV
3 讨论
类病毒不能编码蛋白质,因此其复制和侵染过程都依靠寄主酶系统[27]。ASSVd基因组序列含有5个功能区,TL区(左末端区)、P区、C区(中央保守区)、V区、TR区(右末端区)。P区与类病毒所致病害的症状相关,TL和TR区的相对保守序列有利于复制酶的结合,这两个区域在类病毒之间可以通过互换来进行基因重组,有利于类病毒的进化;C区为中央保守区,是控制类病毒复制的关键区域;而V区的构造变化则同类病毒的复制能力密切相关[28,29]。本研究采集7个不同苹果品种的42份染病样本,获得210条ASSVd全长序列,归为17种变体。同保定首次报道的ASSVd分离物序列进行比对后发现,在上述5个区域内都有碱基位点的变化,多数变体的变异位点集中在TL区和C区。陈冉冉等[30]对我国不同苹果产区的ASSVd序列分析发现,末端保守区及中央保守区保守,在致病区和左端区域有突变,一些分离物的突变位点相同。产生这种差异的原因可能与采集的范围和品种不同有关。但在相同的碱基位点251均发现了变异,不同的是,陈冉冉等发现碱基位点251的变化为G→A,对应的龙冠果实表现症状为畸形,本研究发现碱基位点251的变化为G缺失或G→T,未发现与症状有明显的相关性。对ASSVd系统进化关系分析发现,本研究所得17种变体可分为3组,未表现出明显的地域专化性和寄主专化性。各品种寄主均携带不同ASSVd碱基类型组成的混合种群,携带ASSVd变体类型和所占比例有很大差异,说明寄主品种对ASSVd的自然选择压力造成了病毒基因组的变异及种群结构的变化。由于苹果为多年生木本植物,童期较长,且高度杂合,加上生长周期长,导致寄主本身的遗传背景比较复杂,从而导致与其互作的病毒的变异研究也比较复杂。这可能也是不同品种果树中携带ASSVd复合群体多样的原因之一。
已知类病毒的基因组为非编码RNA,在侵染过程中复制、长距离运输等过程可能均依靠病毒紧密的二级结构[28,31-32]。结合类病毒的抗RNA沉默机制推测最小自由能越小,解螺旋所需要耗费的ATP越多,二级结构也越稳定。笔者发现不同苹果品种中所占比例较多的ASSVd优势变体,多数最小自由能是相对较小的,这与前人报道一致,研究结果为类病毒分子变异及病毒与寄主互作机制研究提供了线索。
4 结论
根据ASSVd nt 0—3、221、251、284、302这8个位点的碱基变异,将富士、斗南、王林、中秋王、金冠、信侬红、信侬黄品种中17种变体分为6种类型,不同苹果品种携带的ASSVd种群结构不同。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/sj.embor.7400706URL [本文引用: 1]
DOI:10.1007/s007050050318URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s13337-020-00625-8URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00705-014-2200-6URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1146/micro.2014.68.issue-1URL [本文引用: 1]
DOI:10.3390/v1020317URL [本文引用: 1]
DOI:10.1002/wrna.22URL [本文引用: 1]
DOI:10.1016/j.plantsci.2014.05.006URL [本文引用: 1]
DOI:10.1016/j.virusres.2015.02.027URL [本文引用: 1]
DOI:10.1016/0923-2516(91)90015-UURL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1146/phyto.2005.43.issue-1URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1080/15476286.2015.1086863URL [本文引用: 1]
[本文引用: 1]
