 ,, 李紫腾
,, 李紫腾 ,, 张静怡, 张静娜, 胡同乐, 王树桐, 王亚南
,, 张静怡, 张静娜, 胡同乐, 王树桐, 王亚南 ,, 曹克强
,, 曹克强 ,河北农业大学植物保护学院,河北保定 071001
,河北农业大学植物保护学院,河北保定 071001Analysis of dsRNA Carried by Alternaria alternata f. sp. mali in China and Identification of a dsRNA Virus
CAO YuHan ,, LI ZiTeng
,, LI ZiTeng ,, ZHANG JingYi, ZHANG JingNa, HU TongLe, WANG ShuTong, WANG YaNan
,, ZHANG JingYi, ZHANG JingNa, HU TongLe, WANG ShuTong, WANG YaNan ,, CAO KeQiang
,, CAO KeQiang ,College of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei
,College of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei通讯作者:
责任编辑: 岳梅
收稿日期:2021-04-6接受日期:2021-05-10
| 基金资助: |
Received:2021-04-6Accepted:2021-05-10
作者简介 About authors
曹钰晗,E-mail:
李紫腾,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (3794KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
曹钰晗, 李紫腾, 张静怡, 张静娜, 胡同乐, 王树桐, 王亚南, 曹克强. 我国苹果斑点落叶病菌携带dsRNA分析及一种dsRNA病毒的鉴定. 中国农业科学, 2021, 54(22): 4787-4799 doi:10.3864/j.issn.0578-1752.2021.22.007
CAO YuHan, LI ZiTeng, ZHANG JingYi, ZHANG JingNa, HU TongLe, WANG ShuTong, WANG YaNan, CAO KeQiang.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】苹果斑点落叶病(apple Alternaria blotch)又称褐纹病,是由链格孢苹果专化型(Alternaria alternata f. sp. mali)侵染而引起的一种世界性分布气传病害,该病危害苹果叶片、新梢和果实,严重影响苹果生产[1,2],现已成为亚洲国家苹果产区的主要病害[3,4]。目前,苹果斑点落叶病的防治途径主要包括种植抗性品种、化学防治和生物防治,生产上一直以使用化学药剂防治为主[5,6,7],但随着经济的发展,人们开始关注食品安全和环境问题,一些化学杀菌剂的使用已在发达国家和地区受到了严重限制[8,9],生物防治日益受到人们的关注,利用携带病毒的弱毒株引起病原菌群体致病力衰退,将成为真菌病害生物防治的新途径[10,11]。【前人研究进展】真菌病毒是指能够侵染真菌并在其中完成自我复制的病毒。真菌病毒的分类依据主要有两个,首先依据真菌病毒的核酸类型将其分为DNA病毒和RNA病毒,就目前所发现的真菌病毒而言,大多数为RNA病毒,包括双链RNA(dsRNA)和单链RNA(ssRNA)[12,13]。从具有弱毒特性的病毒入手寻求新的生防因子,对深入了解病毒及其对寄主真菌的影响具有重要意义。链格孢属真菌中也发现了很多真菌病毒,1988年,SHEPHERD[14]从棉花种子中分离出链格孢菌株共21个,其中6株携带真菌病毒,且这6株均不产生色素;1997年,ZABALGOGEAZCOA等[15]从茄链格孢(A. solani)中检测到未经包被的两条大小分别为8.3和5.5 kb的dsRNA;1988年,HAYASHI等[16]研究的12个链格孢日本梨致病型(A. alternata Japanese pear pathotype)菌株中,有7个菌株含有dsRNA;2009年,AOKI等[17]从链格孢菌株EGS 35-193中分离到Alternaria alternata virus 1(AaV1),该病毒使菌株的菌丝生长变得异常,并且出现大量的囊泡结构;2015年,LIN等[18]从长柄链格孢(A. longipes)HN28中发现Alternaria longipes dsRNA virus 1(AlRV1),其分类地位尚未明确;2016年,KOMATSU等[19]从乔木链格孢(A. arborescens) 中发现一个新的维多利亚病毒Alternaria arborescens victorivirus 1(AaVV1);ZHONG等[20]从芸薹生链格孢(A. brassicicola)中发现病毒 Alternaria brassicicola fusarivirus 1(AbFV1);2017年,向均[21]从链格孢日本梨致病型中分离出病毒Alternaria botybirna virus 1(ABRV1);2018年,日本****OKADA等[22]从链格孢日本梨致病型中分离出病毒Alternaria alternata chrysovirus 1(AaCV1)。AaCV1损害宿主真菌的生长,同时影响宿主AK毒素的产生。【本研究切入点】目前,已报道了多种作物链格孢属真菌病毒,但关于苹果斑点落叶病菌真菌病毒还未见报道,有待进一步解析。【拟解决的关键问题】在我国苹果产区8个省份采集苹果斑点落叶病样本,通过dsRNA提取,明确我国苹果斑点落叶病菌携带dsRNA的多样性;通过生物学测定揭示携带dsRNA菌株的生物学特征,分析dsRNA多样性与寄主病原菌生物学性状的关系;最后,鉴定弱毒力菌株携带dsRNA病毒的种类。为寻找对苹果斑点落叶病具有生防潜力的弱毒菌株打下基础。1 材料与方法
1.1 供试材料
102株苹果斑点落叶病菌菌株:2018年5—8月自我国河北、河南、山东、甘肃、辽宁、黑龙江、陕西及云南8个省份采集有典型斑点落叶症状的叶片样本,采用组织分离法和单孢子稀释法进行病原菌的分离纯化[23]。在叶片和果实上利用柯赫氏法则进行验证。具体样本信息见表1。Table 1
表1
表1本研究中苹果斑点落叶病样本信息
Table 1
| 序号 Number | 菌株编号 Strain number | 采集地点 Collection location | 采集时间 Collection time | 品种 Cultivar | 树龄 Tree age (a) |
|---|---|---|---|---|---|
| 1 | ND | 河北保定Baoding, Hebei | 05-10 | 中秋王Mid-autumn King | 10 |
| 2-7 | WA-3, WA-8, WA-17, WA-20, WA-25, WA-28 | 河北武安Wuan, Hebei | 05-12 | 富士Fuji | 10 |
| 8-13 | QY-2, QY-3, QY-4, QY-5, QY-6, QY-8 | 河北保定Baoding, Hebei | 05-22 | 藤木一号Vine Wood One | 10 |
| 14-16 | SMX-1-1, SMX-1-3, SMX-1-9 | 河南三门峡Sanmeixia, Henan | 06-22 | 金冠Golden Delicious | 6 |
| 17 | SMX-2-1 | 河南三门峡Sanmeixia, Henan | 06-22 | 嘎啦Gala | 6 |
| 18 | SMX-3-1 | 河南三门峡Sanmeixia, Henan | 06-22 | 红尾Red Tail | 6 |
| 19-24 | WH-5, WH-8, WH-12, WH-15, WH-17, WH-3-1 | 山东威海Weihai, Shandong | 06-21 | 威海金Weihai Gold | 3 |
| 25-31 | SQ-1-1, SQ-1-2, SQ-1-5, SQ-1-6, SQ-1-7, SQ- 1-8, SQ-1-9 | 河南商丘Shangqiu, Henan | 06-21 | 礼泉Liquan | 9 |
| 32-33 | SQ-2-2, SQ-2-3 | 河南商丘Shangqiu, Henan | 06-21 | 新红星New Red Star | 24 |
| 34-40 | SQ-3-1, SQ-3-6, SQ-3-7, SQ-3-8, SQ-3-11, SQ- 3-13, SQ-3-14 | 河南商丘Shangqiu, Henan | 06-21 | 长富2号Changfu 2 | 24 |
| 41-44 | CL-2-6, CL-2-3, CL-2-9, CL-2-12 | 河北昌黎Changli, Hebei | 06-21 | 太平洋玫瑰Pacific Rose | 4 |
| 45-49 | CL-3-1-1, CL-3-2-1, CL-3-2-2, CL-3-2-3, CL-3-2-4 | 河北昌黎Changli, Hebei | 06-21 | 秋香Qiuxiang | 3 |
| 50-55 | CL-4-1, CL-4-2, CL-4-9, CL-4-7, CL-4-6, CL-4-13 | 河北昌黎Changli, Hebei | 06-21 | 北斗Beidou | 4 |
| 56 | YA | 陕西延安Yan’an, Shaanxi | 06-23 | 延丰Yanfeng | 8 |
| 57-62 | LN-2, LN-6, LN-7, LN-8, LN-9, LN-10 | 辽宁Liaoning | 06-29 | 绿帅Lvshuai | 13 |
| 63 | YT-2-1 | 山东烟台Yantai, Shandong | 07-03 | 富士Fuji | 5 |
| 64-66 | YT-3-1, YT-3-7, YT-3-9 | 山东烟台Yantai, Shandong | 07-03 | 岳红Yuehong | 13 |
| 67-69 | YT-4-1, YT-4-2, YT-4-3 | 山东烟台Yantai, Shandong | 07-03 | 粉红女士Pink Lady | 13 |
| 70-77 | HLJ-1-3, HLJ-1-4, HLJ-1-6, HLJ-1-7, HLJ-1-8, HLJ-1-9, HLJ-1-10, HLJ-1-11 | 黑龙江牡丹江Mudanjiang, Heilongjiang | 07-14 | QRZ-1 | 6 |
| 78-85 | HLJ-2-1, HLJ-2-2, HLJ-2-3, HLJ2-5, HLJ-2-6, HLJ2-7, HLJ2-8, HLJ-2-9 | 黑龙江牡丹江Mudanjiang, Heilongjiang | 07-14 | QRZ-2 | 5 |
| 86-90 | GS-1-1, GS-1-2, GS-1-8, GS-1-14, GS-1-17 | 甘肃天水Tianshui, Gansu | 07-17 | 富士Fuji | 未知Unknown |
| 91-95 | GS-3-2, GS-3-3, GS-3-7, GS-3-11, GS-3-12 | 甘肃天水Tianshui, Gansu | 07-17 | 金冠Golden Delicious | 未知Unknown |
| 96-100 | SJZ-1, SJZ-2, SJZ-3, SJZ-4, SJZ-8 | 河北石家庄Shijiazhuang, Hebei | 07-20 | 嘎啦Gala | 8 |
| 101 | YN-1-2 | 云南石林Shilin, Yunnan | 08-20 | 红露Honglu | 4 |
| 102 | YN-2-3 | 云南弥勒Mile, Yunnan | 08-20 | 富士Fuji | 3 |
新窗口打开|下载CSV
1.2 主要试剂、仪器和引物
1.2.1 主要试剂和仪器 氯仿,北京酷莱博科技有限公司;纤维素粉,阿拉丁试剂(上海)有限公司;3M乙酸钠、氨苄,北京索莱宝科技有限公司;Taq Mix、载体PMD18-T,宝生物工程有限公司;感受态细胞Tans1-T、TRlzol、反转录试剂盒,北京全式金生物科技有限公司;DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;RNeasy Mini Kit总RNA提取试剂盒,杭州沃森生物技术有限公司。组织研磨破碎仪,德国QIAGEN公司;台式冷冻高速离心机,默克生命科学(上海)有限公司;超低温冰箱、PCR仪,赛默飞世尔科技;DYY-12型电泳仪、DYY-31DN型琼脂糖水平电泳槽,北京六一仪器厂;BioRad凝胶成像系统,美国SYNGENE公司;超净工作台,江苏苏净集团公司。1.2.2 引物 本研究所用引物具体信息见表2。
Table 2
表2
表2本试验所用引物
Table 2
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) | 条带大小 Product size (bp) | 用途 Purpose | 来源 Source |
|---|---|---|---|---|
| CRV1-5F | GCAAAAAAGAACTAAAGGAC | 800 | AaCV2 ORF5的扩增 Amplification of AaCV2 ORF5 | 自行设计 Designed in this study |
| CRV1-5R | ACACACAAATGGGATACC | |||
| CRV1-1F | ATCTCAAGGTACCGGAGTCA | 450 | AaCV2 RT-PCR验证 Identification of AaCV2 by RT-PCR | 自行设计 Designed in this study |
| CRV1-1R | GCTGCTTAAACATCACCTGCA |
新窗口打开|下载CSV
1.3 dsRNA的提取
参考李波[24]的报道,采用纤维素粉的方法对102株苹果斑点落叶病菌纯化菌株进行dsRNA提取,最后加入无水乙醇和乙酸钠(3 mol·L-1)在-80℃沉淀,12 000 r/min离心后,用1 mL的70%乙醇洗涤沉淀,20 μL DEPC H2O溶解,取8 μL在1%(W/V)的琼脂糖凝胶电泳中检测(电压80 V,50 min),紫外灯下观察dsRNA电泳条带。1.4 苹果斑点落叶病菌带毒菌株的生物学特性
1.4.1 培养特性及菌丝生长速率的测定 将5株带毒菌株及随机选取的20株不带毒菌株同时扩繁,25℃ PDA培养7 d后,观察菌落的形状、颜色,每个菌株设置3个重复。用十字交叉法测菌落直径,计算生长速率。1.4.2 在苹果叶片和果实上致病力的测定 采集海棠幼嫩无病叶片,清水洗净,放于铺有两层浸湿滤纸的瓷盘中,使用接种针将叶片的叶脉一侧刺伤;从25个苹果斑点落叶病菌菌株的PDA平板相同位置的边缘打取菌饼,将菌丝块倒置于叶片的伤口处,每个菌株设置3个重复;用保鲜膜将瓷盘包裹严实,置于25℃条件下培养7 d后,测量病斑大小。
取表观相近的同一批次健康富士苹果,先清水冲洗,再用75%的酒精擦洗干净,75%酒精淋湿,放于超净工作台中吹干。用接种针将果实表面刺一个针孔,从25个苹果斑点落叶病菌菌株的PDA平板相同位置边缘打取菌饼,有菌丝的一面贴于伤口处,保鲜膜包裹保湿,每个菌株至少3个重复。25℃培养7 d后测量病斑大小。
1.4.3 数据处理 数据采用SPSS Statistics 17.0单因素分析法中的均值比较法进行分析。
1.5 菌株QY-2携带病毒的高通量测序
1.5.1 RNA的抽提与质检 采用RNeasy Mini Kit进行菌株QY-2的total RNA抽提,然后通过Agilent Bioanalyzer 2100电泳分析仪进行RNA质量检测,合格后纯化total RNA。1.5.2 文库构建与测序 委托上海伯豪生物技术有限公司采用宏转录组测序的方法,对纯化后的total RNA进行rRNA去除、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、3′末端加A、连接接头、富集等步骤,完成测序样本文库构建,采用paired-end程序,进行双端测序。测序过程由Illumina提供的data collection software进行实时数据分析。
1.5.3 QY-2携带病毒种类分析及基因组序列分析 通过高通量测序结果分析QY-2菌株携带的病毒种类及占比。将样本测序获得的reads进行reference mapping,获得病毒reads覆盖度,用RPKM(reads per kilo bases per million reads)量化标准对reads覆盖度进行表达量计算,计算公式:transcription reads /(transcription length×total assembly reads in run)其中,transcription reads为覆盖病毒整个UniGene的reads数目,transcription length为UniGene长度,total assembly reads in run为该样本所有参与拼接的总reads数目。通过Vector NTI 11.0软件去除载体序列和序列比对;NCBI上预测开放阅读框(ORF);运用MEGA 7.0中的邻接法进行序列系统发育分析,重复1 000次。
1.6 菌株QY-2携带病毒的RT-PCR鉴定
1.6.1 病毒特异性引物的设计 根据已报道的病毒序列,使用Premier5.0设计该病毒的特异性引物,委托生工生物工程(上海)股份有限公司进行合成。引物具体信息见表2。1.6.2 总RNA的提取 取适量纯化好的新鲜菌丝,液氮研磨成粉末状,转移至2 mL离心管中,加入1 mL的Trizol试剂,颠倒混匀,室温下放置5 min;继续加入200 μL的氯仿,剧烈振荡15 s,室温下放置3 min;4℃,14 000 r/min离心15 min;取上清700 μL到1.5 mL的离心管中,加入700 μL的异丙醇,颠倒混匀,室温下放置10 min;4℃,14 000 r/min离心10 min,弃上清,吸除残留;加入1 mL 75%的乙醇洗涤沉淀;4℃,9 000 r/min离心5 min,弃上清,短暂离心后吸除残留的乙醇;室温干燥5—10 min,加入50 μL的DEPC-H2O。
1.6.3 反转录合成cDNA 使用全式金反转录试剂盒合成cDNA,操作方法参考说明书。具体步骤如下:dsRNA样品2 μL;Random Primer(N9)(0.1 μg·μL-1)1 μL;2×ES Reaction Mix 10 μL;Easy Script RT Mix 1 μL;DEPC-H2O 6 μL。25℃反应10 min,42℃反应30 min,然后85℃反应5 min,即为cDNA。
PCR反应体系:cDNA样品,1 μL;2×Taq mix,10 μL;引物F 1 μL;引物R 1 μL;DEPC-H2O 7 μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸45 s,35个循环后,72℃完全延伸7 min。1%琼脂糖凝胶电泳检测目的片段。
1.6.4 目的片段的克隆测序 采用琼脂糖凝胶回收试剂盒回收DNA,按试剂盒说明书进行操作。按照pMD18-T载体试剂盒说明书进行载体连接,利用感受态细胞Tans1-T进行转化,挑取单菌落到含有氨苄抗生素的液体LB中,37℃,200 r/min振荡至液体浑浊。以菌液为模板,菌落PCR鉴定阳性克隆,阳性克隆委托华大基因测序公司进行测序。
2 结果
2.1 苹果斑点落叶病菌的dsRNA多态性分析
对102株苹果斑点落叶病菌菌株进行dsRNA的提取,使用DNase I及S1核酸酶消解,在102个菌株中有5个菌株携带dsRNA,如图1所示,菌株名称分别为CL-2-6、QY-2、SQ-1-1、SJZ-4、YT-3-7。dsRNA分为4种类型:菌株YT-3-7携带的dsRNA条带大小在8、2.5和1.5 kb左右;菌株SJZ-4携带的dsRNA条带在8 kb左右;菌株QY-2携带的dsRNA条带在3和0.8 kb左右;菌株CL-2-6和SQ-1-1携带的dsRNA条带在2.5和1.5 kb左右。图1
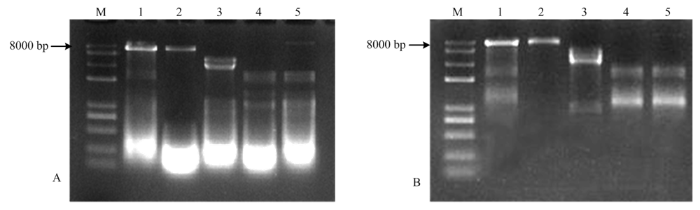 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1我国苹果斑点落叶病菌dsRNA的条带类型
A:酶处理前dsRNA Untreated dsRNA;B:酶处理后dsRNA Enzyme-treated dsRNA
Fig. 1DsRNA types of A. alternata f. sp. mali in China
M: DL8000; 1: YT-3-7; 2: SJZ-4; 3: QY-2; 4: CL-2-6; 5: SQ-1-1
2.2 苹果斑点落叶病菌带毒菌株的培养性状
将苹果斑点落叶病菌带毒菌株和不带毒菌株在PDA培养基上25℃黑暗培养7 d,观察菌落颜色、气生菌丝形态等特征,将5个带毒菌株划分为两类。第1类(图2):菌丝灰白色或灰绿色,个别菌落后期有黑色素产生。菌丝分布均匀,多数菌株的菌丝层较薄,个别菌株的气生菌丝发达呈棉絮状。具有这一类特征的菌株有12个,包括两个带毒菌株SJZ-4和CL-2-6以及10个不带毒菌株,分别为HLJ-2-1、HLJ-2-3、CL-4-1、QY-5、QY-4、YT-3-9、YT-4-3、HLJ-1-6、HLJ-2-9、SQ-1-2。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2苹果斑点落叶病菌菌株的培养类型 I
A、B:带毒菌株The strains taking virus (SJZ-4, CL-2-6);C—L:未带毒菌株The strains without virus (HLJ-2-1, HLJ-2-3, CL-4-1, QY-5, QY-4, YT-3-9, YT-4-3, HLJ-1-6, HLJ-2-9, SQ-1-2)
Fig. 2Cultivation type I of A. alternata f. sp. mali strains
第2类(图3):菌丝前期白色,后期呈绿色,多数菌株内部的绿色菌丝和外围的白色菌丝间形成明显的环状界限。具有这一类特征的菌株有13个,包括3个带毒菌株,分别为QY-2、YT-3-7、SQ-1-1,以及10个不带毒菌株,分别为SQ-3-14、QY-8、CL-4-2、SQ-3-6、CL-2-9、CL-4-9、SMX-1-3、SQ-1-6、YA、LN-9。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3苹果斑点落叶病菌菌株的培养类型 II
A—C:带毒菌株The strains taking virus (QY-2, YT-3-7, SQ-1-1);D—M:未带毒菌株The strains without virus (SQ-3-14, QY-8, CL-4-2, SQ-3-6, CL-2-9, CL-4-9, SMX-1-3, SQ-1-6, YA, LN-9)
Fig. 3Cultivation type II of A. alternata f. sp. mali strains
2.3 苹果斑点落叶病菌带毒菌株菌丝的生长速率
苹果斑点落叶病菌不同菌株的菌丝生长速率测定结果如图4所示,带毒菌株与非带毒菌株相关性差异不明显,各菌株间生长速度的快慢因菌株而异。图4
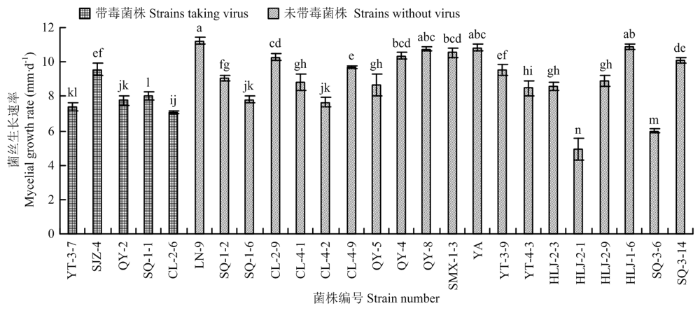 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4苹果斑点落叶病菌不同菌株的菌丝生长速率
Fig. 4The mycelial growth rate of different A. alternata f. sp. mali strains
2.4 苹果斑点落叶病菌带毒菌株的致病力
将带毒菌株和20个不带毒菌株接种海棠叶片,测定各菌株的致病力。测量接种第7天的病斑大小(图5),发现在5个带毒菌株中QY-2和YT-3-7的致病力较弱,其余菌株致病力中等。在20个不带毒的菌株中LN-9和CL-2-9的致病力较强,其他菌株的致病力中等(图6)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5苹果斑点落叶病菌不同菌株在海棠叶片及苹果果实上的病斑大小
A:CK;B—F:接种带毒菌株Inoculation of strains taking virus (YT-3-7, SJZ-4, QY-2, SQ-1-1, CL-2-6);G—Z:接种不带毒菌株Inoculation of strains without virus (LN-9, SQ-1-2, SQ-1-6, CL-2-9, CL-4-1, CL-4-2, CL-4-9, QY-5, QY-4, QY-8, SMX-1-3, YA, YT-3-9, YT-4-3, HLJ-2-3, HLJ-2-1, HLJ-2-9, HLJ-1-6, SQ-3-6, SQ-3-14)
Fig. 5Spots size of different strains of A. alternata f. sp. mali on cherry-apple leaves and apple fruits
图6
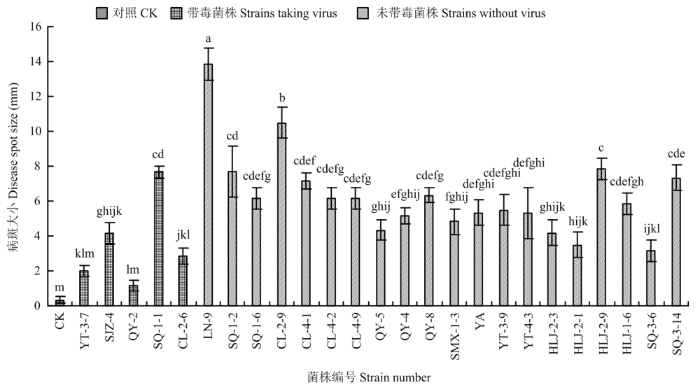 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6苹果斑点落叶病菌不同菌株在海棠叶片上的致病力
Fig. 6Pathogenicity of different strains of A. alternata f. sp. mali on cherry-apple leaves
将带毒菌株和20个不带毒菌株接种富士苹果,测量第7天的病斑大小,发现在5个带毒菌株中QY-2为弱致病力菌株,SJZ-4的致病力较强,其余菌株致病力中等。在20个不带毒的菌株中LN-9、CL-2-9、CL-4-9、YA、YT-3-9、HLJ-2-9、HLJ-1-6、SQ-3-14的致病力较强,其他菌株致病力中等(图7)。
图7
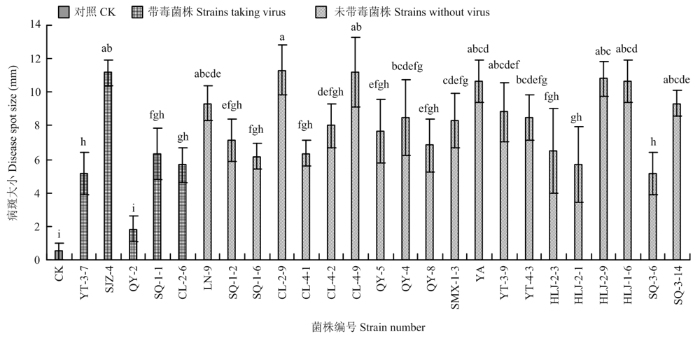 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7苹果斑点落叶病菌不同菌株在苹果果实上的致病力
Fig. 7Pathogenicity of different strains of A. alternata f. sp. mali on apple fruits
带毒菌株QY-2在叶片和果实上的致病力均较弱,从寻找具有弱毒特性的菌株方面考虑,该菌株可能具有潜在的应用价值,选为进一步研究的对象。
2.5 苹果斑点落叶病菌菌株QY-2中dsRNA病毒的鉴定
2.5.1 病毒的全基因组序列 通过分析QY-2菌株中dsRNA高通量测序结果,获得了4条与真菌病毒相关的序列,经过Blast表明4个Contig均与来源于链格孢日本梨致病型的AaCV1序列有较高的相似性,以AaCV1的4个dsRNA片段序列为参考序列,有1 451 570、2 331 542、1 167 609、1 268 863 个reads与AaCV1 dsRNA片段序列相符,经比对和拼接获得了Contig 10、Contig 41、Contig 38、Contig 24,对reads覆盖度进行表达量计算,4个Contig的RPKM值在所有基因中是最高的,达到了4 820—9 292。E-value数值很小,说明了结果的可靠性(表3)。Table 3
表3
表3高通量测序苹果斑点落叶病菌菌株QY-2携带病毒信息
Table 3
| 基因ID Unigene ID | 基因长度 Unigene length (nt) | 蛋白描述 Protein description | 登录号 Accession number | E-value | Reads数量 Number of Reads | RPKM |
|---|---|---|---|---|---|---|
| Contig 10 | 3665 | RNA-dependent RNA polymerase [AaCV1] | BBC27878.1 | 0.00E+00 | 1451570 | 4820 |
| Contig 41 | 3054 | Putative coat protein [AaCV1] | BBC27881.1 | 3.5E-176 | 2331542 | 9292 |
| Contig 38 | 2824 | Hypothetical protein [AaCV1] | BBC27880.1 | 2.9E-108 | 1167609 | 5032 |
| Contig 24 | 2819 | Hypothetical protein [AaCV1] | BBC27879.1 | 2.3E-137 | 1268863 | 5478 |
新窗口打开|下载CSV
已报道的AaCV1基因组具有5条dsRNA片段,而高通量测序结果只获得了病毒的4条dsRNA序列,QY-2 dsRNA琼脂糖凝胶电泳(图1)显示在800 bp左右处也存在一条dsRNA,根据已报道的AaCV1设计其第5个片段的特异性引物CRV1-5进行分子克隆测序,最终获得了菌株QY-2 dsRNA病毒的第5个片段序列。综上,菌株QY-2 dsRNA病毒包括5个dsRNA片段,分别为dsRNA1—dsRNA5,片段大小依次为3 665、3 054、2 824、2 819、831 nt。5条dsRNA序列已全部提交到GenBank,登录号分别为MK672910、MK672913、MK672912、MK672911、MK836314。
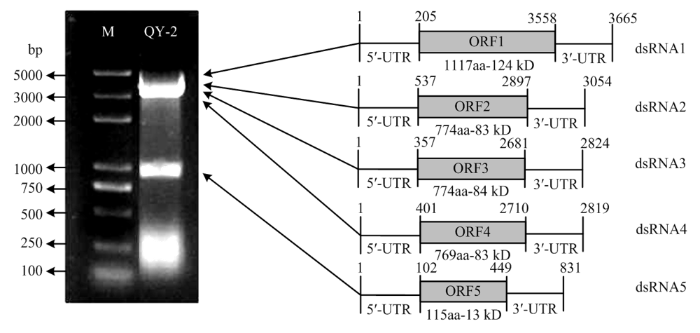
2.5.2 病毒的基因组结构分析 将dsRNA1—dsRNA5的序列在NCBI网站上进行ORF分析,结果显示dsRNA1—dsRNA5分别编码一个推定的ORF,依次为ORF1—ORF5。 ORF1—ORF5依次含有1 117、774、774、769、115 aa,编码蛋白的分子量依次为124、83、84、83、13 kD。dsRNA1—dsRNA5的5′端非翻译区(UTR)大小分别为205、573、357、401、102 nt;3′ UTR大小分别为107、157、133、109、382 nt(图8)。
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8苹果斑点落叶病菌菌株QY-2 dsRNA病毒基因组模式图
Fig. 8A schematic diagram of the genomic organization of A. alternata f. sp. mali QY-2 dsRNA virus
2.5.3 病毒开放阅读框序列相似性分析 将QY-2菌株dsRNA病毒ORF1—ORF5编码的氨基酸序列在NCBI上进行blastp搜索,结果显示与其相似性相对较高的病毒有4个,分别是AaCV1、Botryosphaeria dothidea chrysovirus 1(BdCV1)、Asperqillus themomutatus chrysovirus 1(AtCV1)、Penicillium janczewskill chrysovirus 2(PjCV2)(表4)。与QY-2菌株dsRNA病毒ORF1(RdRP)氨基酸序列相似性分别为93%、56%、55%、52%,核苷酸序列相似性为77%、59%、57%、54%;ORF2氨基酸序列相似性为91%、47%、44%、40%,核苷酸序列相似性为75%、54%、50%、49%;ORF3氨基酸序列相似性为80%、35%、32%、32%,核苷酸序列相似性为70%、40%、42%、42%;ORF4氨基酸序列相似性为90%、47%、43%、43%,核苷酸序列相似性为76%、51%、50%、56%;与ORF5氨基酸序列相似性较高的只有AaCV1编码的假定蛋白,相似性为87%,核苷酸序列相似性为95%。根据国际病毒分类委员会(ICTV)2020年发布的Chrysoviridae内种的分类标准(
Table 4
表4
表4苹果斑点落叶病菌菌株QY-2的dsRNA与其他病毒的核苷酸及氨基酸序列的相似性
Table 4
| 名称 Name | ORF1 | ORF2 | ORF3 | ORF4 | ORF5 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| nt (%) | aa (%) | nt (%) | aa (%) | nt (%) | aa (%) | nt (%) | aa (%) | nt (%) | aa (%) | |
| AaCV1 | 77 | 93 | 75 | 91 | 70 | 80 | 76 | 90 | 95 | 87 |
| BdCV1 | 59 | 56 | 54 | 47 | 40 | 35 | 51 | 47 | ||
| AtCV1 | 57 | 55 | 50 | 44 | 42 | 32 | 50 | 43 | ||
| PjCV2 | 54 | 52 | 49 | 40 | 42 | 32 | 56 | 43 | ||
新窗口打开|下载CSV
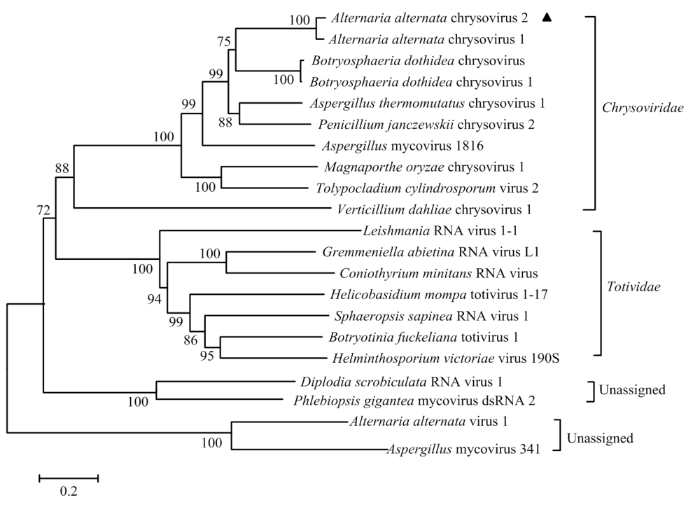
2.5.4 病毒系统进化关系分析 为分析病毒系统进化关系,将苹果斑点落叶病菌菌株QY-2携带的AaCV2 RdRP氨基酸序列与Chrysoviridae、Totiviridae以及一些未分类病毒的RdRP氨基酸序列构建系统发育树。结果表明,菌株QY-2携带的病毒与Chrysoviridae的Chrysovirus聚在一个分支,并且与病毒AaCV1遗传关系最近,其自展支撑值为100(图9)。因此将QY-2菌株携带的病毒暂定命名为Alternaria alternata chrysovirus 2(AaCV2)。
图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9以真菌病毒的RdRP氨基酸序列为基础构建的系统发育树
Fig. 9Phylogenetic tree based on RNA-dependent RNA polymerase amino acid sequence of mycovirus
2.6 菌株QY-2携带病毒的RT-PCR鉴定
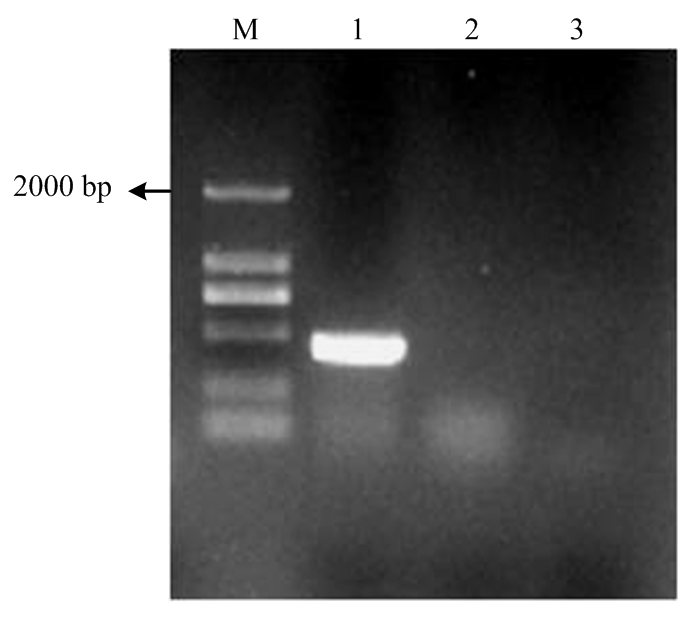
根据获得的QY-2 dsRNA病毒基因序列,设计特异性引物CRV1-1对其进行RT-PCR检测。琼脂糖凝胶电泳显示,菌株QY-2出现了453 bp的病毒特异性目的条带,对照菌株及清水对照均没有条带出现,进一步说明了菌株QY-2中AaCV2的存在(图10)。图10
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10苹果斑点落叶病菌菌株QY-2中AaCV2 RT-PCR鉴定
M:DL2000;1:QY-2;2:对照菌株Control strain;3:清水对照Water control
Fig. 10Identification of AaCV2 in A. alternata f. sp. mali strain QY-2 by RT-PCR
3 讨论
目前,苹果斑点落叶病防治的主要方式为化学防治。为避免化学防治对人体和环境产生的不利影响,寻求安全有效的绿色生防措施颇为重要。部分真菌病毒可导致真菌致病力的衰退,因此可作为一种生防因子用于真菌病害的防治[25,26]。本研究对采自我国8个省份苹果主产区的102株苹果斑点落叶病菌菌株进行dsRNA检测,根据琼脂糖凝胶电泳结果,明确了其中5个菌株具有明显的dsRNA条带,可能携带真菌病毒,约占5%的菌比例,在苹果斑点落叶病菌中dsRNA具有一定的普遍性,且根据条带大小来看,病毒种类具有多样性。据报道链格孢属真菌目前发现的病毒包括:从棉花种子中分离出6个携带真菌病毒的链格孢菌株,dsRNA片段在1.0—5.1 kb [14];从茄链格孢中检测到两条dsRNA大小分别为8.3和5.5 kb[15];另外还有真菌病毒AaV1(dsRNA片段:3 617、2 794、2 576、1 420 bp)[17]、AlRV1(dsRNA片段:3 145 bp)[18]、AaVV1(dsRNA片段:5 203 bp)[19]、AbFV1(ssRNA片段:6 639 bp)[20]、ABRV1(dsRNA片段:6 188、5 903 bp)[21]、AaCV1(dsRNA片段:3 647、2 857、2 785、2 772、836 bp)[22]。不同的链格孢菌株携带dsRNA条带差异较大,且与本研究所分离到的dsRNA病毒条带有较大差异。因此,本研究发现的苹果斑点落叶病菌真菌病毒有可能是未揭示的新病毒。
随着真菌病毒种类及数量不断增多,人们开始研究病毒对真菌生物学功能方面的影响,发现大多数病毒在菌株中能够稳定遗传[27,28],但因病毒种类不同,对真菌致病力及其他方面会有不同的影响。真菌病毒与寄主间的相互作用成为现代病毒学研究的热点领域。本研究主要针对携带dsRNA病毒的5个菌株进行了形态学观察、生长速率测定及致病力鉴定,同时与不携带dsRNA病毒的其他菌株进行比较,以明确携带病毒是否引起了菌株的特异性或其是否具有生防意义。通过测定发现,带毒菌株间菌落形态、菌丝的生长速率和菌株的致病能力存在显著差异,不带毒菌株间这3个方面同样也存在显著差异。菌株的菌落特征、生长速率与dsRNA携带与否及类型没有明显的关系,致病力测定表明含有dsRNA病毒的供试菌株大多属于低毒力类型,其中的线性关系或多因素关系,还有待进一步研究。
在含有dsRNA病毒的低致病力菌株中,QY-2致病力最低,与清水对照无显著性差异。经鉴定该菌株中携带大量的产黄青霉病毒科、β产黄青霉病毒属的Alternaria alternata chrysovirus,这是苹果斑点落叶病菌中该病毒的首次报道。王利华等[29]明确了产黄青霉病毒科成员Botryosphaeria dothidea Chrysovirus 1(BdCV1)对梨轮纹病菌(B. dothidea)的菌落形态、生长速度有明显抑制作用,是引起梨轮纹病菌致病力衰退的主要因子;MA等[30]报道细链格孢(A. tenuissima)携带AaCV1-AT1,AaCV1-AT1的感染降低了宿主真菌的菌落生长速度和产孢能力;OKADA等[22]报道了AaCV1对链格孢日本梨致病型具有两个方面的作用,一是影响真菌宿主的生长速度,二是影响真菌宿主毒素的产生。因此,AaCV2也可能是引起QY-2菌株致病力衰退的主要原因。下一步将对QY-2携带的AaCV2进行深入研究,以开发对苹果斑点落叶病具有生防潜力的dsRNA病毒。
4 结论
我国苹果斑点落叶病菌菌株携带dsRNA的概率在5%左右,dsRNA群体多样,有4种类型:类型I的dsRNA在8、2.5和1.5 kb左右;类型II的dsRNA在8 kb左右;类型III的dsRNA在3和0.8 kb左右;类型IV的dsRNA在2.5和1.5 kb左右。dsRNA的有无及类型与寄主病原菌培养性状没有明显相关性,携带dsRNA的菌株多为弱致病力,致病力最低的QY-2菌株携带产黄青霉病毒科、β产黄青霉病毒属的Alternaria alternata chrysovirus 2。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/BF02931111URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1094/PHYTO-99-4-0369URL [本文引用: 1]
DOI:10.21273/JASHS.136.2.109URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.cropro.2006.04.007URL [本文引用: 1]
DOI:10.1126/science.215.4532.466URL [本文引用: 1]
DOI:10.1128/mr.56.4.561-576.1992URL [本文引用: 1]
DOI:10.1038/196962a0URL [本文引用: 1]
DOI:10.1007/s00705-008-0272-xURL [本文引用: 1]
DOI:10.1007/s00705-009-0507-5URL [本文引用: 1]
DOI:10.1128/jvi.62.10.3888-3891.1988URL [本文引用: 2]
DOI:10.1017/S0953756296003097URL [本文引用: 2]
DOI:10.3186/jjphytopath.54.250URL [本文引用: 1]
[本文引用: 2]
DOI:10.1007/s00705-014-2218-9URL [本文引用: 2]
DOI:10.1007/s00705-016-2796-9URL [本文引用: 2]
DOI:10.1016/j.virusres.2015.11.012URL [本文引用: 2]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.1016/j.virol.2018.03.027URL [本文引用: 3]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1128/JVI.01830-09URL [本文引用: 1]
[本文引用: 1]
DOI:10.1080/07060669709500576URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.virusres.2020.197904URL [本文引用: 1]
