0 引言
【研究意义】飞蝗(Locusta migratoria)是中国历史上重要的农业害虫[1],研发飞蝗绿色防控新技术是农业植保领域的重要课题。如多种昆虫一样,飞蝗在生长发育过程中也有周期性蜕皮的现象,而表皮的主要成分为几丁质。因此,在研发飞蝗等害虫的绿色防控新技术领域——几丁质代谢途径中,关键的功能基因如β-N-乙酰氨基葡萄糖苷酶(β-N- acetylglucosaminidases,NAGs,EC 3.2.1.52)等可作为重要的分子靶标[2-3]。而探索LmNAG1的生物学功能和酶学特性就具有重要的科学意义。【前人研究进展】几丁质是由β-1,4糖苷键连接的N-乙酰氨基葡萄糖线性多聚物[4],在昆虫表皮中主要以α-型存在[5]。几丁质酶(chitinases,CHTs,EC 3.2.1.14)和NAGs参与昆虫几丁质的降解[3,6]。NAGs为几丁质外水解酶,属于糖基水解酶20家族,可水解位于非还原端的以β糖苷键连接的N-乙酰氨基葡萄糖,催化生成乙酰氨基葡萄糖单体(N-acetylglucosamine,GlcNAc)。β-N-乙酰氨基葡萄糖苷酶在昆虫体内由多个基因编码,有研究者在褐飞虱(Nilaparvata lugens)中找到11个NAG基因,并进行了进化分析,发现昆虫NAGs可分为O-GlcNAcase、FDL(fused lobe gene)、NAG1、NAG2、Hex(Hexosaminidases)以及HexD-like 共6个亚家族[7]。NAG1最初发现于烟草天蛾(Manduca sexta)的蜕皮液中,其能够与CHTs发挥协同效应高效水解几丁质[8],推断其具有专一性地水解以β-1,4糖苷键连接的几丁质寡糖的活性。利用RNAi技术对其功能进行研究,发现沉默了NAG1基因后昆虫出现发育受阻,蜕皮困难死亡等现象,表明该基因在昆虫的蜕皮过程中起至关重要的作用[9]。NAG2与NAG1不同,具有广泛的底物谱,可水解不同类型的糖复合物[10]。NAG3可能参与精卵识别过程[11]。FDLs可能参与糖基化修饰[12-13]。【本研究切入点】近年来,笔者课题组致力于研发飞蝗绿色防控新技术,不断探索飞蝗几丁质代谢通路中的关键功能基因,开展了一系列的研究工作。例如,RONG等[14]克隆获得LmNAG1全长序列,利用RNA干扰(RNA interference,RNAi)技术沉默LmNAG1后发现若虫发育受阻,出现蜕皮时间延迟、新旧表皮无法完全分离而死亡的表型。由此可见,LmNAG1可以作为飞蝗新型绿色防控的重要靶标,但其酶学特性还未进行深入研究。【拟解决的关键问题】利用Bac-to-Bac杆状病毒表达系统异源表达LmNAG1,进一步分离纯化得到高纯度的重组蛋白,体外检测该酶的动力学参数、最适pH、最适温度、以及pH和热稳定性等特性,为飞蝗绿色防控分子靶标研发提供理论与实践依据。1 材料与方法
试验于2014—2015年在山西大学应用生物学研究所完成。1.1 主要试剂
Taq酶、T4连接酶、DNA Marker均购于TaKaRa公司;限制性内切酶BamH I和Hind III购于美国New England Biolabs公司;胶回收试剂盒、质粒提取试剂盒购于美国OMEGA公司;SFX-INSECT培养基和胎牛血清购于美国Hyclone公司;Lipofectamine 2000 转染试剂购自Invitrogen公司;标准蛋白Marker购于美国Thermo Fisher Scientific公司;His单克隆抗体购于美国Santa Cruz公司;羊抗鼠免疫球蛋白G购于北京中杉金桥公司;BCIP/NBT-AP显色试剂盒购于碧云天生物公司;4MU-GlcNAc购于美国Sigma公司;Ni-NTA琼脂糖柱购于德国QIAGEN公司;引物合成和测序由生工生物工程(上海)有限公司完成。1.2 构建重组载体及转染Sf9细胞
LmNAG1的编码区已经在飞蝗中成功扩增并保存为Blunt-LmNAG1菌株,保存于山西大学应用生物学研究所。引物中设计适当的酶切位点BamH I和Hind III(下划线表示),将LmNAG1的编码区克隆到pFastBacTM-Dual载体上。在下游引物中引入6×His标签,引物序列见表1。在37℃条件下,对LmNAG1编码区PCR扩增片段和pFastBacTM-Dual载体同时双酶切2 h后,经琼脂糖凝胶电泳检测,并回收纯化。用T4 DNA连接酶对回收产物进行连接转化至Trans-T1感受态细胞中,挑单克隆测序验证,获得重组的pFastBac-LmNAG1质粒。Table 1
表1
表1PCR引物序列
Table 1Primers used to amplify the coding region fragments
| 引物Primer | 引物序列Sequence of primers (5′-3′) |
|---|---|
| LmNAG1-F | CGCGGATCCATGAGTGTCATATCTACAAC |
| LmNAG1-R | CCCAAGCTTTTAATGATGATGATGATGATGTGCATAGCAG |
| pUC/M13-F | CCCAGTCACGACGTTGTAAAACG |
| pUC/M13-R | AGCGGATAACAATTTCACACAGG |
新窗口打开
DH10Bac感受态细胞中包含有一个具有mini- attTn7靶位点和辅助质粒的杆粒,将重组的pFastBac- LmNAG1质粒转化至DH10Bac感受态细胞,重组质粒可以重组到杆状病毒穿梭载体杆粒中,用pUC/M13引物PCR扩增挑选阳性克隆,获得重组Bacmid。将重组Bacmid转染Sf9细胞,获得重组杆状病毒。
Sf9细胞的培养条件为27℃,使用含有2%—5%胎牛血清的SFX-INSECT培养基。被重组Bacmid转染的Sf9细胞培养72 h后到达对数生长中期,细胞密度为1.5×106—2.5×106 cells/mL,500 ×g离心5 min,在上清液中收集到第1代病毒(P1 virus)。P1代病毒感染Sf9细胞后,重组目的蛋白大量表达。收集细胞之前用无血清的培养基对细胞进行清洗。
1.3 Western blot分析
目的蛋白经12%的SDS-PAGE电泳,然后转膜到硝酸纤维素膜上(100 V,100 min)。用含5% w/v牛血清白蛋白(BSA)的TBST缓冲液(20 mmol·L-1 pH 7.4的Tris-HCl,150 mmol·L-1 NaCl,0.05% Tween-20)在室温下封闭2 h,然后与His单克隆抗体4℃孵化过夜。TBST洗膜3次,每次10 min,将膜与碱性磷酸酶共价结合的羊抗鼠免疫球蛋白G孵育1 h,TBST洗膜3次,每次10 min。使用BCIP/NBT-AP显色试剂盒进行显色。1.4 纯化由Sf9细胞表达的重组蛋白
重组目的蛋白LmNAG1的C-端含有6×His标签,用Ni-NTA琼脂糖层析进行纯化。通过500 ×g离心6 min收集被病毒感染的密度约为2×106 cells/mL的100 mL Sf9细胞,加入10 mL Sf9细胞裂解缓冲液(20 mmol·L-1 pH 8.0的磷酸钠缓冲液, 1 mmol·L-1 EDTA,1 mmol·L-1 MgCl2,10% Glycerin,200 mmol·L-1 NaCl,0.5% NP-40)和100 μL 1 mmol·L-1的蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)进行超声破碎。裂解产物置于冰上30 min,4℃条件下14 000 ×g离心90 min。10 mL裂解产物加1 mL Ni-NTA琼脂糖柱和19 mL His-bind缓冲液(20 mmol·L-1 pH 8.0的磷酸钠缓冲液,500 mmol·L-1 NaCl,20 mmol·L-1咪唑,10%甘油和1% pH 8.0的TritonX-100)。将过柱前混合物(Bc)与Ni柱在室温下孵育2 h后过柱,4℃ 1 503 ×g离心8 min收集流出组分(Ft),20 mL His-wash缓冲液(His-bind缓冲液)清洗Ni-NTA柱。结合在Ni-NTA柱上的目的蛋白用20 mL His-elution缓冲液(20 mmol·L-1 pH 8.0的磷酸钠缓冲液,500 mmol·L-1 NaCl,20—500 mmol·L-1咪唑,10%甘油和1% pH 8.0的TritonX-100)进行洗脱,收集洗脱液共20管(E1—E20),每管1 mL。洗脱组分通过12%的SDS-PAGE后用考马斯亮蓝染色检测。将含目的蛋白的一些馏分合并,放入透析袋中,置于500 mL透析缓冲液(20 mmol·L-1 pH 8.0的磷酸钠缓冲液,10%甘油)中4 h。透析后的目的蛋白样品用不含NaCl的透析-A缓冲液到含1 mol·L-1 NaCl的透析-B缓冲液梯度洗脱(各10 mL),收集洗脱液共20管(E1—E20),每管1 mL。洗脱组分通过12%的SDS-PAGE后用考马斯亮蓝染色检测。
使用Bradford法[15]测定蛋白浓度。
1.5 酶活测定
最适pH的测定:100 μL反应体系包括0.1 μg的LmNAG1、16 μL 0.1 mmol·L-1的4MU-GlcNAc底物以及适当体积不同pH(pH 3—11)的BR缓冲液[16]。37℃条件下,避光反应10 min,加100 μL 0.5 mmol·L-1 pH 10.3的Glycine-NaOH终止反应。在酶标仪(Bio Tek,Synergy Mx,Winooski,VT,USA)中测定A365/460荧光值。产物的生成量通过4MU标准曲线进行测定。以荧光值最大的为100%,相对活性为纵坐标,不同pH为横坐标绘制曲线。pH稳定性的测定和最适pH测定的体系相同,酶与底物反应之前先将酶加到不同pH的BR buffer中,37℃孵育2 h,之后加入底物反应同上。最适温度的测定:100 μL反应体系包括0.1 μg的LmNAG1、16 μL 0.1 mmol·L-1的4MU-GlcNAc底物以及适当体积最适pH的BR buffer。在不同温度梯度(30、35、40、45、50、55、60℃)条件下,避光反应10 min,加100 μL 0.5 mmol·L-1 pH 10.3的Glycine-NaOH终止反应。在酶标仪中测定A365/460荧光值。以荧光值最大的为100%,相对活性为纵坐标,不同温度为横坐标绘制曲线。热稳定性的测定和最适温度测定的体系相同,酶与底物反应之前先将酶加到不同温度梯度(30、35、40、45、50、55、60℃)的最适pH的BR buffer中,孵育2 h,之后加入底物反应同上。
在最适温度和最适pH条件下,利用4MU-GlcNAc底物对LmNAG1的动力学参数进行测定。100 μL反应体系包括0.1 μg LmNAG1酶、不同体积(0、1、2、4、8、16 µL)0.1 mmol·L-1的4MU-(GlcNAc)3寡聚底物以及适当体积最适pH的BR buffer。在37℃条件下,避光反应10 min,加100 μL 0.5 mmol·L-1 pH 10.3的Glycine-NaOH终止反应。根据Lineweaver-Burk plots双倒数作图法[17]测定Km和Kcat值,重复3次,数据表示为平均数±标准误。
2 结果
2.1 重组杆状病毒表达载体的构建
用实验室保存的Blunt-LmNAG1菌株做模板,用表1中的LmNAG1-F/R引物,PCR扩增得到的目的条带大约1 863 bp,LmNAG1的开放可读框为1 845 bp,加上18 bp的His标签等,与LmNAG1序列(GenBank: JX888720.1)长度一致。将目的片段双酶切连接至pFastBacTM-Dual质粒上,得到重组pFastBac-LmNAG1质粒(图1-A)。重组pFastBac-LmNAG1质粒经BamH I和Hind III双酶切后鉴定结果如图1-B所示,pFastBacTM-Dual质粒全长为5 238 bp,与图中相应条带位置一致,测序结果也显示重组质粒pFastBac- LmNAG1构建成功。重组质粒转化至DH10Bac感受态细胞中后,利用蓝白斑和抗生素筛选重组的Bacmid,挑选白斑进行菌液PCR验证,PCR产物大小约为4 423 bp,包括1 863 bp的目的片段以及2 560 bp的载体序列。如图1-C所示,7号克隆为蓝斑做对照,只扩增出来pUC/M13上下游引物中间约300 bp的片段。1、5、6号克隆没有目标条带,3、4号克隆虽然有目标条带,但在300 bp左右的位置有条带,说明这个克隆不是纯白斑。2号克隆既有目标条带,且在300 bp没有条带,视为纯白斑,提取Bacmid转染细胞。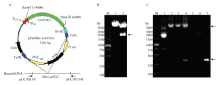 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1重组杆状病毒表达载体的构建A:重组杆状病毒表达载体的构建示意图 Map of the recombinant Bacmid;B:重组pFastBac-LmNAG1质粒双酶切鉴定 Recombinant pFastBac-LmNAG1 digested with BamH I and Hind III。M:DNA分子量标准物 DNA standard size markers;1:pFastBacTM-Dual质粒双酶切Empty vector pFastBacTM-Dual digested with BamH I and Hind III;2:重组质粒双酶切pFastBac-LmNAG1 digested with BamH I and Hind III;C:重组Bacmid的PCR验证 Verification of recombinant Bacmid by the bacteria liquid PCR。1—6:白斑 White clones;7:蓝斑 Blue clones。箭头指示为目的条带
-->Fig. 1Construction of the recombinant BacmidThe arrow pointed to the target band
-->
2.2 目的蛋白LmNAG1的异源表达及纯化
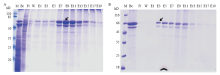
目的蛋白LmNAG1通过Bac-to-Bac杆状病毒表达系统成功表达,并通过Western blot进行鉴定(图2),结果显示在67 kD附近有明显的单一条带出现,表明目的蛋白LmNAG1表达成功。经Ni-NTA琼脂糖层析纯化后的LmNAG1通过12% SDS-PAGE进行分析(图3-A),结果显示在67 kD附近有明显的目的条带出现,但还有其他杂带。透析后采用阴离子交换柱Q纯化,检测结果如图3-B所示,杂蛋白较少,显示纯化成功。选取纯度最高的E3组分进行酶活性测定,Bradford法测定该组分的蛋白浓度为0.057 µg·µL-1。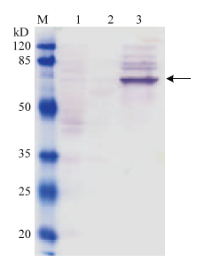 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2重组蛋白LmNAG1的Western blot鉴定M:标准蛋白Marker Standard size protein Markers;1:Sf9细胞裂解上清 Sf9 cells lysate;2:感染空Bacmid的Sf9细胞裂解上清 Sf9 cells lysate transfected by Bacmid;3:感染重组Bacmid的Sf9细胞裂解上清 Sf9 cells lysate transfected by recombinant Bacmid。箭头指示为目的蛋白
-->Fig. 2Western blot analysis of recombinant LmNAG1 proteinThe arrow pointed to the target protein
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3纯化后LmNAG1蛋白的SDS-PAGE分析A:经镍柱纯化的LmNAG1 SDS-PAGE电泳检测 SDS-PAGE analysis of LmNAG1 purified by Ni-NTA;B:经阴离子交换柱Q纯化的LmNAG1 SDS-PAGE电泳检测 SDS-PAGE analysis of LmNAG1 purified by Q。M:标准蛋白Marker Standard size protein Markers;Bc:Ni-NTA柱或Q柱纯化前的粗蛋白组分 Before column fraction;Ft:未与柱结合的组分 Flow through column fraction;W:洗脱液洗脱杂蛋白的组分 Wash fraction;E1—E19:含不同浓度咪唑或NaCl的洗脱液对结合有目的蛋白LmNAG1进行洗脱的组分 Eluted fractions washed by different concentrations of imidazole/NaCl。箭头指示为目的蛋白
-->Fig. 3The analysis of the purified LmNAG1 by SDS-PAGEThe arrow pointed to the target protein
-->
2.3 pH和温度对LmNAG1催化活性的影响
以4MU-GlcNAc作为底物,LmNAG1在pH 8.0条件下具有最高的水解活性(图4-A),在pH 6.0—8.0范围内具有较高的稳定性(图4-B)。LmNAG1在40℃时具有最高的水解活性(图5-A),在40℃以下具有高稳定性,当温度高于45℃时热稳定性迅速下降(图5-B)。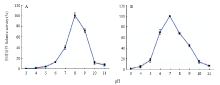 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4以4MU-GlcNAc为底物测定pH对LmNAG1的影响A:最适pH Optimum pH;B:pH稳定性 pH stability。用4MU-GlcNAc作为酶活力测定的底物,在A365/460处读取4MU的荧光值,用BR缓冲液作为3—11的pH缓冲体系,在37℃条件下反应
-->Fig. 4Effects of pH on activity of the purified LmNAG1 using the substrate 4MU-GlcNAcThe enzyme activity was determined by using the substrate, 4MU-GlcNAc, the liberation of 4MU was measured at the excitation wavelength of 365 nm and the emission wavelength of 460 nm. The universal buffer (Britton-Robinson buffer) was chosen for its wide range of pH from 3 to 11. The reactions were performed at 37℃
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5以4MU-GlcNAc为底物测定温度对LmNAG1的影响A:最适温度 Optimum temperature;B:热稳定性 Thermal stability。用4MU-GlcNAc作为酶活力测定的底物,在A365/460处读取4MU的荧光值,在pH 8.0条件下反应
-->Fig. 5Effects of temperature on activity of the purified LmNAG1 using the substrate 4MU-GlcNAcThe enzyme activity was determined by using the substrate, 4MU-GlcNAc, the liberation of 4MU was measured at the excitation wavelength of 365 nm and the emission wavelength of 460 nm. The reactions were performed at pH 8.0
-->
2.4 LmNAG1蛋白的动力学参数
以4MU-GlcNAc为底物,采用Lineweaver-Burk plots双倒数作图法测得LmNAG1的动力学参数Km和Kcat,其中Km值为(0.28±0.02)mmol·L-1,Kcat值为(902.88±38.15)s-1,Kcat/Km值为(3 215.12± 61.98)mmol·L-1·s-1。3 讨论
飞蝗是重要的农业害虫,笔者课题组一直致力于探索飞蝗绿色防控的分子靶标。昆虫表皮的主要成分为几丁质,且高等动物不具几丁质,这意味着在几丁质代谢过程中涉及的关键基因可以作为重要的分子靶标。β-N-乙酰氨基葡萄糖苷酶是昆虫几丁质降解过程中的重要酶类,在不同的昆虫中都由多个基因编码。最新的研究发现该基因家族在褐飞虱中多达11个,可分为6个亚家族[7]。因此,研究不同亚家族的NAGs在生物学功能上的分化具有重要的科学意义。编码NAG的基因首次在烟草天蛾中报道[8],发现该基因主要在表皮和中肠组织高表达,且在蜕皮前的1—2 d表达量最高,推测可能参与几丁质降解过程且受蜕皮激素(20-hydroxyecdysone,20E)的诱导。之后在埃及伊蚊(Aedes aegypti)中也发现了NAGs的存在[18],主要存在于围食膜中,其活性会随着喂食人工合成的无蛋白质食物或血液而迅速增加。HOGENKAMP等[19]对赤拟谷盗(Tribolium castaneum)NAGs进行了研究,克隆了4条NAG序列,发现与TmNAG2、TmNAG3以及TmFDL相比,TmNAG1的mRNA水平表达量最高,在中肠和表皮组织均有分布。利用RNAi技术沉默TmNAG1后,赤拟谷盗的幼虫-幼虫、幼虫-蛹、蛹-成虫3个阶段蜕皮时都会出现死亡现象,表明该基因在昆虫蜕皮过程中起着关键作用。KOKUHO等[20]在家蚕(Bombyx mori)中发现两个NAGs基因,BmNAG1在蛹期高表达而BmNAG2在蛹期无可检测的表达,暗示NAG1和NAG2可能在不同时期发挥着重要的生物学功能;LIU等[9]利用RNAi技术沉默了亚洲玉米螟(Ostrinia furnacalis)的NAG1后也发现幼虫不能成功蜕至蛹期;XI等[7]利用RNAi技术对褐飞虱中11个Hexs的功能进行了研究,发现只有属于NAG1亚家族的NIHEX4会影响昆虫的蜕皮;RONG等[14]对NAGs进行的聚类分析结果表明,LmNAG1与其他昆虫的NAG1归为一个亚家族,利用RNAi技术沉默了该基因后飞蝗的发育受阻,不能顺利地蜕至下一龄期,表明该基因在飞蝗蜕皮发育过程中的重要性,推测LmNAG1蛋白可能具有水解以β-1,4糖苷键连接的几丁质寡糖的活性,为进一步阐明该蛋白的酶学特性,有必要对LmNAG1进行异质性表达和酶学特性展开深入的研究。目前,将NAG1进行异源表达、纯化以及酶学特性分析的工作开展较少。已有报道用杆状病毒表达系统获得了云杉卷叶蛾(Choristoneura fumiferana)的NAG1,酶学分析发现该蛋白可作用于p-nitrophenyl- β-D-GlcNAc[21],但同时用大肠杆菌表达系统表达出来的蛋白不具活性。LIU等[22]采用酵母真核表达系统异源表达了亚洲玉米螟的NAG1融合蛋白,并对其酶学特性进行了研究,包括最适pH和最适温度等,发现该酶可以作用于4MU-β-GlcNAc和(GlcNAc)2等以β-1,4糖苷键连接的几丁质寡糖。
Bac-to-Bac杆状病毒表达系统可以高效快速表达具活性的蛋白,被广泛应用于外源基因的过表达。本研究利用Bac-to-Bac杆状病毒表达系统,成功将LmNAG1进行了异源表达,在细胞裂解液上清中得到大量的重组蛋白,经Western blot检测,结果显示在67 kD处有一条清晰的特异性条带。利用在线ProtParam工具(http://web.expasy.org/protparam/)分析,该蛋白的理论分子量应该为70 kD左右,但由于该蛋白在翻译后可能存在有一些修饰等原因导致实际分子量比理论分子量小3 kD左右。YANG等[23]在亚洲玉米螟蜕皮液中分离纯化到OfNAG1的分子量为67 kD,并经分子筛处理,结果显示该蛋白在昆虫体内可形成二聚体形式。本文异源表达飞蝗LmNAG1蛋白,其是否在飞蝗内也形成二聚体形式尚有待深入研究。
为了得到高纯度的LmNAG1目的蛋白,首先利用Ni-NTA琼脂糖层析柱进行亲和层析(图3-A),结果显示,随着咪唑浓度的升高,大量目的蛋白被洗脱下来,在E9馏分中达到最高浓度,但从图中可见E9馏分的目的蛋白下方有一条杂蛋白未能成功去除。利用在线ProtParam工具预测的目的蛋白等电点为5.6左右,为得到纯度更高的目的蛋白,进一步利用阴离子交换柱Q对E9馏分进行了二次纯化,得到了较高纯度的E3馏分(图3-B),为进一步酶学特性的分析奠定基础。
本研究发现LmNAG1可作用于4MU-GlcNAc,且在pH 8.0,40℃时酶活性最高。在pH 6.0—8.0范围内以及40℃以下具有较高的稳定性。飞蝗体液的pH为7.0左右,表明LmNAG1在飞蝗体内拥有合适的pH环境。此外,飞蝗的最适生长温度为28—30℃,表明在飞蝗正常的生长条件下,可为LmNAG1提供良好的温度环境,合适的pH和温度条件满足了飞蝗生长发育中LmNAG1的需求。在亚洲玉米螟中的研究中发现OfNAG1的最适pH为7.0,最适温度为30℃[22];埃及伊蚊AgNAG1最适pH为7.0—8.0[18];家蚕BmNAG1最适pH为5.5[21]。由此可见,不同种昆虫的NAG1酶学特性不尽相同,可能是由于昆虫体液环境不同导致的结果。在LI等[24]的研究中指出飞蝗几丁质酶5(Chtinase,LmCHT5)主要作用于4MU-(GlcNAc)3等多聚形式的几丁质,而本研究中的LmNAG1作用于4MU-GlcNAc低聚形式的糖类,推测两者在飞蝗几丁质降解的过程中可发挥协同作用。有报道发现亚洲玉米螟OfCht5﹕OfNAG1在摩尔浓度比为9﹕1—15﹕1范围内降解胶状几丁质的效率最高,两者发挥协同作用[25]。YANG等[23]曾采用(GlcNAc)2等低聚物对亚洲玉米螟OfNAG1进行动力学参数测定,结果表明其Km值为(0.30±0.04)mmol·L-1,Kcat值为(934±79)s-1,本研究中得到的飞蝗LmNAG1的动力学参数与之很接近,表明飞蝗LmNAG1和亚洲玉米螟OfNAG1具有相似的酶学特性和生物学功能。
4 结论
成功构建了重组载体pFastBac-LmNAG1,转染至Sf9细胞得到重组病毒,大量感染Sf9细胞,提取蛋白并纯化,获得高纯度且具活性的LmNAG1蛋白。对其酶学特性进行分析表明,LmNAG1蛋白的最适pH为8.0,最适温度为40℃,可水解β-1,4糖苷键连接的几丁质寡糖,属几丁质外水解酶,与其他昆虫的NAG1具相似的生物学功能。The authors have declared that no competing interests exist.
