0 引言
【研究意义】飞蝗(Locusta migratoria)是一种重要的农业害虫,蝗灾的有效防治亦是保证农业安全生产的重要科学问题。目前,在飞蝗防治工作中仍以化学杀虫剂为主要手段,因长期大量使用造成一系列问题,如污染农业环境、对非靶标生物有负面影响以及导致害虫产生抗药性[1]等,研发用于飞蝗综合治理的环境友好型杀虫剂势在必行。海藻糖酶(trehalase)是一类昆虫能量代谢必不可少的酶,也是几丁质合成途径的第一个酶[2-3],因此海藻糖酶可作为设计新型杀虫剂的潜在靶标。【前人研究进展】海藻糖是昆虫血淋巴中主要的糖类物质,海藻糖酶可将一分子海藻糖分解为两分子葡萄糖,昆虫海藻糖酶根据是否存在跨膜结构,可分为两类:可溶性海藻糖酶(soluble trehalase,TreS或Tre1)与膜结合型海藻糖酶(membrane-bound trehalase,TreM或Tre2)[4]。可溶性海藻糖酶分解细胞内的海藻糖,而膜结合型海藻糖酶分解胞外(主要为食物中)的海藻糖[5]。第一个可溶性海藻糖酶基因于1992年在黄粉虫(Tenebrio molitor)中克隆获得[6],直到2005年才在家蚕(Bombyx mori)中获得第一个膜结合型海藻糖酶基因[7]。目前的研究表明,多数昆虫体内都存在1个膜结合型和1个可溶性海藻糖酶基因,仅少数昆虫如异色瓢虫(Harmonia axyridis)[8]、褐飞虱(Nilaparvata lugens)[9]中发现多个可溶性海藻糖酶基因。海藻糖为昆虫体内贮存能量的重要物质,已有研究表明,海藻糖酶能够通过调节昆虫体内海藻糖的浓度抵抗低温、干燥和农药等逆境胁迫。如在异色瓢虫中,温度逐渐降低时海藻糖酶的活性受到抑制,其中可溶性海藻糖酶4基因的mRNA表达显著下调[8]。在干燥条件下嗜眠摇蚊(Polypedilum vanderplanki)通过降低海藻糖酶的活性,使昆虫体内积累大量海藻糖,以保护昆虫应对干燥环境[10]。同时海藻糖酶也是几丁质合成通路中的第一个酶,在几丁质代谢过程中发挥着关键作用[3]。CHEN等[11]利用RNAi技术分别将甜菜夜蛾(Spodoptera exigua)可溶性和膜结合型海藻糖酶基因表达沉默后,可抑制几丁质合成酶1和2基因的表达,从而导致表皮和中肠几丁质的合成减少最终引起昆虫死亡;ZHAO等[9]研究褐飞虱2个可溶性和1个膜结合型海藻糖酶基因的功能时,发现分别注射每个海藻糖酶基因的dsRNA后,昆虫的死亡率达到14.16%—31.78%,且几丁质合成酶和几丁质酶等多个几丁质代谢通路的基因表达相应下调。【本研究切入点】关于昆虫海藻糖酶基因的已有研究大都集中在完全变态昆虫,而飞蝗是典型的渐变态昆虫,目前尚未在飞蝗中开展海藻糖酶基因的分子特性及功能研究。【拟解决的关键问题】搜索飞蝗转录组和基因组数据库,获得海藻糖酶基因LmTres cDNA序列,采用RT-qPCR技术研究LmTres在飞蝗不同组织部位和发育时期的mRNA表达特性,运用RNA干扰技术分析LmTres在飞蝗发育过程中的作用,丰富昆虫海藻糖酶基因的研究内容,为基于RNAi的害虫防治提供基础数据。1 材料与方法
试验于2012—2014年在山西大学应用生物学研究所完成。1.1 材料
供试昆虫:飞蝗虫卵购买自山西晋源北邵飞蝗养殖公司,置于温度为(30±2)℃,相对湿度40%±10%,光照14 h、黑暗10 h的人工气候箱内进行孵化,孵化的飞蝗若虫给予新鲜小麦幼苗和麦麸饲喂。饲喂至5龄若虫后,选择2 h内的飞蝗进行试验。主要试剂:RNAisoTM Plus、RNase-free DNase I、M-MLV Reverse Transcriptase购于TaKaRa试剂公司;SYBR Premix Ex Taq购于TOYOBO试剂公司;2×Taq PCR MasterMix购于TIANGEN试剂公司;T7 RiboMAXTM Express RNAi System购于Promega试剂公司。
1.2 飞蝗海藻糖酶基因及其编码蛋白质特性分析
1.2.1 飞蝗海藻糖酶基因cDNA序列搜索及特性分析 搜索笔者课题组构建的飞蝗转录组数据库获得3个海藻糖酶基因cDNA全长序列和1个cDNA片段,将部分cDNA片段输入飞蝗基因组数据库中获得其全长序列。使用ExPaSy网站上的相关软件计算分子量及等电点。运用TMHMM和SignalP软件预测4个海藻糖酶是否具有跨膜域和信号肽。1.2.2 飞蝗海藻糖酶系统发育分析 使用GENEDOC软件对飞蝗4个海藻糖基因氨基酸序列进行多位点比对,并标示出海藻糖酶标签序列PGGRFrEyYyWDtY和qWDyPNaWpP及甘氨酸富集区GGGGEY;利用ClustalW软件对NCBI已登录的昆虫以及部分细菌海藻糖酶基因全长氨基酸序列全长进行比对(表1)。使用MEGA7软件中的NJ法构建系统进化树。
Table 1
表1
表1用于构建海藻糖酶系统进化树的生物类群及海藻糖酶基因的GenBank登录号
Table 1Organisms and GenBank accession numbers of trehalase genes used in the phylogenetic tree construction
| 生物类群 Organisms | 目 Order | 物种 Species | 基因名称 Gene name | GenBank登录号 GenBank accession number | 参考文献 Reference |
|---|---|---|---|---|---|
| 昆虫 Insects | 双翅目 Diptera | 埃及伊蚊 Aedes aegypti 致倦库蚊 Culex quinquefasciatus 黑腹果蝇 Drosophila melanogaster | AaTreM CqTreM DmTreM | XM_001660243l XP_001847934 DQ864060l | |
鞘翅目Coleoptera | 拟果蝇 Drosophila simulans 赤拟谷盗 Tribolium castaneum 黄粉虫 Tenebrio molitor | DsTreM TcTreS, TcTreM TmTreS | DQ8640751 XM_968826l, XM_967517l D11338 | 文献[6] Reference [6] | |
| 鳞翅目 Lepidoptera | 草地贪夜蛾 Spodoptera frugiperda 甜菜夜蛾 Spodoptera exigua 斜纹夜蛾 Spodoptera litura 家蚕 Bombyx mori 黑脉金斑蝶 Danaus plexippus 亚洲玉米螟 Ostrinia furnacalis | SfTreS, SfTreM SeTreS, SeTreM SlTreS, SlTreM BmTreS, BmTreM DpTreS, DpTreM OfTreS, OfTreM | DQ447188l, EU872435l EU427311l, EU106080l ADA63846, ADA63845 D86212l, NM_001043445l EHJ77355, EHJ67296 EF426724l, EF426723l | 文献[11-12] Reference [11-12] 文献[13] Reference [13] 文献[10,14] Reference [10,14] | |
| 膜翅目 Hymenoptera | 云南小蜜蜂 Apis florea 西方蜜蜂 Apis mellifera 熊蜂 Bombus impatiens 熊蜂王 Bombus terrestris 苜蓿切叶蜂 Megachile rotundata 瘤姬蜂 Pimpla hypochondriaca | AfTreM AmTreS1 AmTreM BiTreS, BiTreM BtTreS, BtTreM MrTreS PhTreS | XP_003696950 XM_393963l, NM_001112671l XP_003491166, XP_003490073 XP_003400853, XP_003393687 XP_003705482 AJ459958l | 文献[15-16] Reference [15-16] | |
| 同翅目 Homoptera | 大豆蚜 Aphis glycines 豌豆蚜 Acyrthosiphon pisum 灰飞虱 Laodelphax striatella 褐飞虱 Nilaparvata lugens | AgTreS ApTreS LsTreS, LsTreM NlTreS, NlTreM | AFJ00065 XP_001950264 AFL03409, AFL03410 ACN85420, ACN85421 | 文献[17] Reference [17] 文献[18] Reference [18] 文献[9] Reference [9] | |
| 直翅目Orthoptera | 飞蝗 Locusta migratoria | LmTreS1, LmTreS2 LmTreTreM-like, LmTreM | KX371564, FJ795020, KX371565, KX371563 | 文献[19] Reference [19] | |
| 细菌 Bacteria | 柯氏柠檬酸杆菌 Citrobacter koseri | CkTre | YP_001452785 | ||
| 大肠杆菌 Escherichia coli | EcTre | ZP_06653159 | |||
| 沙门氏菌 Salmonella typhimurium | StTre | ZP_09722139 | |||
| 铜绿假单胞菌 Pseudomonas aeruginosa | PaTre | NP_251106 |
新窗口打开
1.3 5龄飞蝗若虫不同组织及发育日龄海藻糖酶基因的mRNA表达
1.3.1 样品的收集 解剖5龄第2天飞蝗若虫的体壁、前肠、中肠、后肠、胃盲囊、马氏管、脂肪体、肌肉和气管,进行不同组织部位基因的表达分析;选择5龄第1天至第7天若虫的肌肉、马氏管、中后肠、体壁以及整虫,进行不同发育日龄的基因表达分析。以上所有样品均取3个生物学重复,每个生物学重复至少3头若虫。所有样品在体视显微镜下解剖后速冻于液氮中,-80℃保存备用。1.3.2 RT-qPCR表达引物的设计 根据飞蝗4个海藻糖酶基因和几丁质合成关键基因LmUAP1(GenBank accession number JX484802)和LmCHS1(GenBank accession number GU067730)的核苷酸序列,以β-actin为内参基因,运用Primer 3.0软件设计特异性的表达引物,引物由上海英潍捷基公司合成,具体的引物信息见表2。
Table 2
表2
表2所用RT-qPCR和RNAi的引物信息
Table 2Primers used for RT-qPCR and RNAi analysis
| 引物用途 Application of primers | 基因名称 Gene name | 引物名称 Primer name | 引物序列 Primer sequence (5'-3') | 产物大小 Product size (bp) |
|---|---|---|---|---|
| RT-qPCR | LmTreM LmTreS1 LmTreS2 LmTreM-like LmUAP1 LmCHS1 β-actin | TreMF TreMR TreS1F TreS1R TreS2F TreS2R TreMLF TreMLR UAP1F UAP1R CHS1F CHS1R β-actinF β-actinR | TCTCGGCACACTGGCTATAGG GCTTTCTCTGAGTTCTGGCTGAA GGGCTCCAGCATCATTAAGTTT CCAGTCTTCTTCAGGCCCATAA ACTGGGACACCTACTGGATCTTG GTTGCGAGCGCTCTACGTAGT CGCTCACAGCCTCCACTACTT GACCATCCAATGCTGAAACTCTT TACGGGACCGTAAGGTGTTGG CCACATTCTGCATTTTTGCTTATAC CTTGAGCCAATTGGTTTGGT TGAGTTCTGTGGATGCAAGG CGAAGCACAGTCAAAGAGAGGTA GCTTCAGTCAAGAGAACAGGATG | 98 100 150 120 139 121 156 |
| RNAi | LmTreM LmTreS1 LmTreS2 LmTreM-like GFP | dsTreMF dsTreMR dsTreS1F dsTreS1R dsTreS2F dsTreS2R dsTreMLF dsTreMLF dsGFPF dsGFPR | TAATACGACTCACTATAGGGTGTGGCATGATGAAGTTGGT TAATACGACTCACTATAGGGCAAGCGATCCAAAATAACGC TAATACGACTCACTATAGGGGAGTTCCAGTTCTGGATGCG TAATACGACTCACTATAGGGGATGCCTTCTTCGTCATTCC TAATACGACTCACTATAGGGAAGCCAATGAGTGGTTGGAC TAATACGACTCACTATAGGGATTTGTCCATCCAAAGCCAG TAATACGACTCACTATAGGGGTGGAAGGAGGCAGTAACCA TAATACGACTCACTATAGGGATTTGTCCAACCAAACCCAA TAATACGACTCACTATAGGGGTGGAGAGGGTGAAGG TAATACGACTCACTATAGGGGGGCAGATTGTGTGGAC | 516 472 528 527 712 |
新窗口打开
1.3.3 总RNA提取、cDNA合成及RT-qPCR RNAisoTM Plus提取上述样品总RNA,RNase free-DNAase I去除所提取总RNA中的DNA,1.5%的琼脂糖凝胶电泳检测RNA的质量,用酶标仪进行定量,按照M-MLV Reverse Transcriptase说明书将1.5 µg的总RNA合成cDNA。 在Applied Biosystems 7300 Real-Time PCR system(Applied Biosystems,USA)上进行RT-qPCR,PCR反应体系按照SYBR Premix Ex Taq说明书进行配置,每个样品3次技术重复,并进行熔解曲线分析以保证扩增条带的特异性。
1.3.4 数据处理与分析 分别将不同组织部位或发育日龄中最低表达量的数值视为1,其他组织部位或发育日龄的表达量以相对于最低表达量的倍数进行分析。试验结果以平均数±标准差表示。采用SPSS中的Tukey’s HSD对试验结果进行差异显著性分析,柱形图上不同字母代表基因表达差异显著(P<0.05)。
1.4 飞蝗海藻糖酶基因生物学功能分析
1.4.1 飞蝗海藻糖酶基因dsRNA引物的设计及体外合成 在E-RNAi网站设计飞蝗4个海藻糖酶基因和GFP的dsRNA引物,引物信息见表2。分别以含有LmTreM、LmTreS1、LmTreS2、LmTreM-like和GFP的质粒DNA为模板,通过PCR反应获得用于体外转录dsRNA的模板。PCR反应体系及反应程序按照2×Taq PCR MasterMix说明书进行。1.5%琼脂糖凝胶电泳检测PCR产物的单一性,按照Gel Extraction Kit说明书对DNA产物进行回收纯化。以上述纯化产物为模板,参照T7 RiboMAXTM Express RNAi System试剂盒说明书进行dsRNA合成,酶标仪 上进行dsRNA定量至终浓度为2 μg·μL-1,保存至-80℃备用。1.4.2 dsRNA的注射 分别选取5龄第2天飞蝗若虫进行LmTreM、LmTreS1、LmTreS2、LmTreM-like的dsRNA注射,同时注射dsGFP作为对照组。采用微量注射器(宁波三爱仪器厂)分别将上述dsRNA从飞蝗第2和3腹节连接处注入体腔,注射量为每头10 μg,每个基因设置3个生物学重复,每个重复30头若虫。注射完毕后,将所有试虫放置于人工气候箱中饲养。
1.4.3 沉默效率检测及表型观察 分别收集注射上述基因dsRNA 48 h后的整虫样本,提取RNA,反转录为cDNA,采用RT-qPCR方法对海藻糖酶基因的沉默效果和UDP-N-乙酰葡糖胺焦磷酸化酶1基因(LmUAP1)、几丁质合成酶1基因(LmCHS1)的表达进行检测,3个生物学重复,每组用虫3头,具体操作与1.3.4的检测方法相同,其余试虫用来观察表型。
2 结果
2.1 飞蝗海藻糖酶基因及其编码蛋白质特性分析
将搜索获得的4个海藻糖酶基因cDNA全长序列进行blast分析,结果显示4个海藻糖酶均具有海藻糖酶特有的2个标签序列PGGRFrEyYyWDtY和qWDyPNaWpP以及1个甘氨酸富集区GGGGEY(图1)。使用ExPaSy网站上的相关软件计算分子量及等电点,表明飞蝗4个海藻糖酶的相对分子量在62.8—69.9 kD,其pI均为酸性(表3)。TMHMM分析表明1个海藻糖酶具有典型的跨膜结构,命名为膜结合型海藻糖酶LmTreM,2个海藻糖酶没有跨膜结构,分别将其命名为可溶性海藻糖酶LmTreS1和LmTreS2,1个海藻糖酶存在类跨膜结构,软件分析结果显示其概率为0.59(概率>0.6即可预测为跨膜结构),故暂将其命名为类膜结合型海藻糖酶LmTreM-like。SignalP预测发现只有LmTreM-like具有信号肽。GENEDOC分析表明4个海藻糖酶氨基酸的一致度在47%—65%,其中LmTreM和LmTreM-like氨基酸的一致度最高达65%(表4)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1飞蝗4个海藻糖酶基因氨基酸序列的多位点比对
单下划线标示为海藻糖酶的两个标签序列;双下划线标示为海藻糖酶的甘氨酸富集区;箭头所示为LmTre2的信号肽;方框所示为LmTreM的跨膜结构域
-->Fig. 1The pairwise alignment of amino acid sequences of four trehalase genes in L. migratoria
Trehalase two signature regions and the glycine-rich region were indicated by the underline and double underline. The arrow represented the signal peptide in LmTre2. Putative transmembrane region was boxed in LmTreM
-->
Table 3
表3
表3飞蝗海藻糖酶基因编码蛋白的特性
Table 3Characteristics of trehalase genes and their coding proteins in L. migratoria
| 基因名称 Gene name | GenBank登录号 GenBank accession number | 氨基酸数 Number of amino acids | 分子量 MW (kD) | 等电点 pI | 跨膜域 TMH | 信号肽 Signal peptide |
|---|---|---|---|---|---|---|
| LmTreM | KX371563 | 599 | 69.9 | 5.7 | 539-561 | 无No |
| LmTreS1 | KX371564 | 551 | 62.8 | 6.0 | 无 No | 无No |
| LmTreS2 | FJ795020 | 561 | 65.5 | 6.2 | 无No | 无No |
| LmTreM-like | KX371565 | 598 | 69.1 | 5.1 | 无No | 1-20 |
新窗口打开
Table 4
表4
表4飞蝗4个海藻糖酶基因氨基酸一致度分析
Table 4Percentage identities of amino acid residues among the four trehalases proteins in L. migratoria
| LmTreM | LmTreS1 | LmTreS2 | LmTreM-like | |
|---|---|---|---|---|
| LmTreM | 47% | 51% | 65% | |
| LmTreS1 | 49% | 47% | ||
| LmTreS2 | 51% | |||
| LmTreM-like |
新窗口打开
2.2 海藻糖酶系统进化树分析
根据已知昆虫和部分细菌海藻糖酶基因氨基酸全长序列构建系统进化树(图2),结果显示LmTreM和LmTreM-like与其他昆虫膜结合型海藻糖酶优先聚在一支;LmTreS1和LmTreS2与大豆蚜、豌豆蚜、褐飞虱、灰飞虱等不完全变态昆虫可溶性海藻糖酶聚为一支,表明其亲缘关系较近,而与全变态昆虫可溶型海藻糖酶相距较远。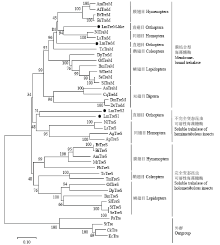 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2根据已知昆虫和部分细菌海藻糖酶氨基酸序列构建的系统发育树
-->Fig. 2Phylogenetic analysis of the amino acid sequences of known trehalases from insects and some bacteria
-->
2.3 飞蝗4个海藻糖酶基因的表达
2.3.1 在不同组织部位的表达 飞蝗LmTreM在肌肉中特异性表达,而在其他组织中的表达较低;LmTreS1在马氏管表达最高,其次是中肠和后肠,在其他组织部位表达较低;LmTreS2主要在体壁中表达,其次是脂肪体、肌肉和气管;LmTreM-like在不同组织部位中的表达相对均衡(图3)。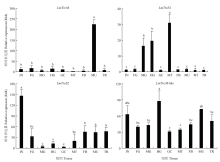 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图34个海藻糖酶基因在5龄飞蝗不同组织部位中的mRNA表达
IN:体壁 Integument;FG:前肠 Foregut;MG:中肠 Midgut;HG:后肠 Hindgut;GC:胃盲囊 Gastric caeca;MT:马氏管 Malpighian tubules;FB:脂肪体 Fat body;MU:肌肉 Muscle;TR:气管 Trachea。图中数值为平均数±标准差,柱形图上不同字母代表基因表达差异显著(P<0.05, Tukey’s HSD检验)。下同 Each value represents mean±SD, different letters indicated significant differences (P<0.05, Tukey’s HSD test). The same as below
-->Fig. 3The mRNA expression of four trehalase genes in different tissues of the 5th-instar nymphs of L. migratoria
-->
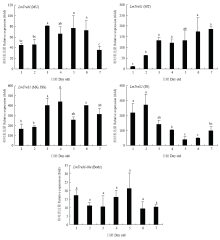
2.3.2 在不同发育时期表达 由不同组织表达结果可知LmTreM、LmTreS1和LmTreS2分别在肌肉、马氏管和中后肠、体壁(LmTreS2)中高表达,而LmTreM-like在各组织的表达相对均衡,因此解剖5龄若虫每一天的上述组织或整虫提取RNA进行RT-qPCR分析。结果表明LmTreM在5龄1—2 d表达较低,3—6 d表达比较高,到第7天表达又有所下降;LmTres1在在马氏管和中后肠的表达量随日龄增加逐渐上升,第3—7天保持稳定高表达;LmTreS2在1—3 d表达量比较高,之后表达量逐渐降低;LmTreM-like在5龄发育过程中稳定表达,没有显著差异(图4)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图44个海藻糖酶基因在5龄飞蝗各发育时期中的mRNA表达
MU:肌肉 Muscle;MT:马氏管 Malpighian tubules;MG:中肠 Midgut;HG:后肠 Hindgut;IN:体壁 Integument;Body:整虫
-->Fig. 4The mRNA expression of four trehalase genes during the development of the 5th-instar of L. migratoria
-->
2.4 飞蝗海藻糖酶基因生物学功能
分别将LmTreM、LmTreS1、LmTreS2与LmTreM-like的dsRNA注射至5龄第2天的飞蝗若虫,48 h后收集整虫样品提取RNA,利用RT-qPCR技术检测4个海藻糖酶基因的沉默效率和几丁质合成关键基因LmUAP1和LmCHS1的表达,结果表明各基因的表达均被有效沉默,且无交叉干扰现象,LmUAP1和LmCHS1的表达也无显著变化,注射各基因的dsRNA后5龄若虫均可顺利蜕皮至成虫(图5、图6)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5RT-qPCR检测4个海藻糖酶基因的沉默效率
dsGFP为注射了GFP双链RNA的对照组,dsLmTreM、dsLmTreS1、dsLmTreS2、dsLmTreM-like分别代表注射了飞蝗4个海藻糖酶基因双链RNA的试验组 dsGFP was the control injected with dsRNA of GFP, dsLmTreM, dsLmTreS1, dsLmTreS2 and dsLmTreM-like were the treatments injected with dsRNA of four trehalase genes of L. migratoria, respectively。
-->Fig. 5The silencing efficiency of four trehalase genes by RT-qPCR
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6注射海藻糖酶基因dsRNA后对几丁质合成关键基因LmUAP1和LmCHS1表达量的影响
-->Fig. 6Effects on the expression of LmUAP1 and LmCHS1 genes involved in chitin synthesis after injected with trehalase dsRNAs
-->
3 讨论
根据是否具有跨膜结构可将昆虫海藻糖酶分为膜结合型和可溶性海藻糖酶两类[20]。笔者课题组之前已报道飞蝗1个可溶性海藻糖酶基因的分子特性[19],本研究发现飞蝗还存在另外3个海藻糖酶基因,分别命名为LmTreM、LmTreS1、LmTreS2和LmTreM-like,LmTreS2即为之前报道的海藻糖酶。LmTreM-like与LmTreM氨基酸的一致度最高达65%,而与LmTreS1和LmTreS2的氨基酸一致度仅为47%和51%。然而运用TMHMM软件分析表明该酶仅具有类跨膜域结构,概率为0.59(概率>0.6即可表明有典型的跨膜结构),推测LmTreM-like末端存在的类跨膜结构使其与膜结合型海藻糖酶具有较近的亲缘关系。本研究采用RT-qPCR技术对4个海藻糖酶基因在5龄飞蝗不同组织和发育日龄的表达进行了分析,结果表明4个海藻糖酶基因在不同组织部位的表达差异显著。LmTreM在肌肉中特异性表达,并且在5龄蜕皮前后表达较低而龄期中间表达较高,可能与飞蝗在蜕皮前后运动减少而生长发育阶段运动较活跃的生理现象相关,WEGENER等[21]发现飞蝗肌肉中膜结合型海藻糖活性占比达95%,注射海藻糖酶抑制剂后能够影响飞蝗的活动能力并减少取食,这与本文中LmTreM主要在肌肉表达相符,推测膜结合型海藻糖酶主要为昆虫的飞行运动提供能量。LmTreS1主要在马氏管和中后肠表达,马氏管是昆虫排泄和渗透调节的主要器官,而中后肠为主要的消化器官,推测该基因主要参与消化代谢及废物排泄;LmTreS2主要在体壁中表达,且在蜕皮后的1—3 d内表达量相对较高,之后表达量逐渐降低[19],这与飞蝗几丁质合成关键基因UDP-N-乙酰氨基葡萄糖焦磷酸化酶1基因(LmUAP1)[22]和几丁质合成酶1基因(LmCHS1)的变化规律相似[23]。笔者课题组已利用RNAi技术证实LmUAP1和LmCHS1均参与了飞蝗表皮几丁质合成,因此推测LmTreS2可能与飞蝗新表皮几丁质合成需要大量海藻糖酶有关。这与在甜菜夜蛾中发现可溶性海藻糖酶基因SeTre-1主要在体壁和马氏管中高表达结果相一致,利用RNAi技术发现该基因表达沉默后,主要影响昆虫表皮中几丁质的合成[11-12]。而飞蝗LmTreM-like在各个组织部位和发育时期中的分布则比较均衡。
本研究采用RNAi技术研究飞蝗4个海藻糖酶基因的生物学功能,分别将4个海藻糖酶基因dsRNA注射至5龄若虫后,发现沉默效率均在60%以上,4个基因之间无交叉干扰,但任一基因的表达沉默后并未影响几丁质合成关键基因LmUAP1和LmCHS1的表达,5龄飞蝗可正常蜕皮至成虫。海藻糖酶是昆虫能量代谢必不可少的一个酶,受蜕皮激素20E的调控,如在绿盲蝽(Apolygus lucorum)中用几丁质合成抑制剂氟铃脲处理昆虫或注射dsEcR后可溶性海藻糖酶AlTre-1的表达及酶活性显著降低,造成昆虫发育迟缓及体重降低等表型[24-25]。海藻糖酶也是几丁质合成过程中第一个酶, ZHAO等利用RNAi技术阐明了甜菜夜蛾和褐飞虱中海藻糖酶基因在几丁质合成过程中的功能,结果表明分别抑制各个海藻糖酶基因的表达后,几丁质合成酶等基因也相应下调,最终导致昆虫死亡[9,11]。本研究结果与甜菜夜蛾及褐飞虱等昆虫的结果有区别,表明不同昆虫之间存在差异。飞蝗体内有4个海藻糖酶基因,推测沉默其中任一个基因后,其他海藻糖酶基因能够弥补这个海藻糖酶基因的缺失,因此单独干扰某一基因并不影响5龄飞蝗正常蜕皮至成虫。今后将同时干扰4个基因的表达,观察飞蝗生长发育情况,以深入揭示飞蝗海藻糖酶基因的分子功能。
4 结论
飞蝗具有1个膜结合型、1个类膜结合型和2个可溶性海藻糖酶基因,这4个海藻糖酶基因具有不同的组织和发育表达特性,任一基因的表达下调并不影响5龄飞蝗蜕皮至成虫。The authors have declared that no competing interests exist.
