0 引言
【研究意义】中国盐渍化土壤分布广泛,总面积高达两亿亩。由于环境恶化和不合理耕作等原因,盐渍化土壤面积仍不断增加。近年来,由于粮食压力的增大和可用耕地面积的持续减少,盐渍化土壤成为中国耕地的重要后备土地资源。但是土壤盐渍化严重影响作物生长进程和产量水平,大大限制了盐渍化土壤的快速改良和有效利用[1]。大豆是重要的粮食作物和油料作物,中国大豆五大主产区均存在不同程度的土壤盐渍化问题。大豆属于中度耐盐作物,但是盐害胁迫下大豆产量受到很大影响[2]。中国蕴藏着大量的大豆种质资源以及丰富的优异等位变异[3],利用传统育种或现代分子育种手段选育新的耐盐大豆品种可以实现大豆在盐碱地上规模化种植。因此,研究盐胁迫下大豆生理变化,对于理解大豆的耐盐机制、鉴定耐盐种质资源、促进盐渍土地的有效利用和实现大豆高产稳产具有重要的理论意义和实践价值。【前人研究进展】前人研究发现植物吸收运输Na+的过程是将Na+从介质通过根部细胞质膜上的离子通道和转运蛋白进入根系,然后将Na+从中柱细胞中泵入木质部,再从木质部运输到地上部组织[4]。植物地上部为代谢活跃部位,对Na+含量敏感,其耐盐特性体现在有效保持地上部活跃部位较低的Na+水平。植物既能从细胞水平还能从整株水平上进行调控Na+含量,减少向地上部的运输。NHX1是一种位于液泡膜上的Na+/H+逆向转运蛋白,能够将细胞质中过量的Na+存储液泡中,将拟南芥AtNHX1进行同源或异源过表达后均能提高植物的耐盐性[5-6]。AtSOS1是根部表皮细胞质膜上的一种Na+/H+逆向转运蛋白,参与细胞中Na+外排[7]。大豆GmNcl1与拟南芥CHXs家族基因亲缘关系很近,盐胁迫下该基因诱导表达上调[8]。AtCHX21是在根部内皮层的阳离子/H+转运蛋白,能够将Na+从内皮层细胞运输到根系的中柱中,最终将Na+加载到木质部[9]。图位克隆的大豆GmSALT3编码一种定位在内质网的阳离子/H+转运蛋白,主要在根部中柱细胞中表达,在控制Na+向地上部运输中发挥重要作用[10-11]。过量的Na+进入植株体内造成原生盐离子毒害和渗透胁迫以及盐离子导致的营养亏缺的次生盐害。光合作用是植物进行生命活动的能量源泉,在众多被盐胁迫影响的代谢中,光合作用被认为是对盐逆境胁迫最为敏感的生理过程。有研究表明盐离子过量积累导致植株叶片的光合机构受损导致光合速率下降[12]。而Na+过量造成其他营养元素亏缺同样也会对光合作用产生影响[13]。对高粱的研究发现,耐盐高粱在盐胁迫下能有效保护叶片光合机构维持较高的光合速率,增强对盐胁迫的适应性[14]。【本研究切入点】前人对大豆盐胁迫的响应及耐盐机制的研究多以野生大豆为对象,其中薛忠财等[15]发现野生大豆能够通过某种机制控制叶片中Na+过量积累来维持叶片的正常光合作用从而达到耐盐的目的。目前关于耐盐栽培大豆和盐敏感栽培大豆对盐胁迫生理及分子响应机制的差异研究较少,尤其是盐胁迫下光合特性与离子组分以及相互作用机制的差异仍不明确。【拟解决的关键问题】本研究选取2个耐盐栽培大豆(Y8D6008、Y8D6013)和2个盐敏感栽培大豆(Y8D6132、Y8D6136)为试验材料,利用水培方式从离子含量、光合参数以及Na+动态平衡相关基因表达变化入手,旨在了解耐盐栽培大豆的抗盐生理及分子机制,揭示Na+与其他离子及光合相关指标之间的关系,为大豆耐盐机制的研究、耐盐品种的选育提供有力的理论依据,也为盐渍化土地的有效开发利用奠定理论基础。1 材料与方法
1.1 供试材料
选用耐盐材料Y8D6008和Y8D6013及盐敏感材料Y8D6132和Y8D6136为供试材料,均由南京农业大学喻德跃教授赠予(表1)。4个大豆材料是从191份栽培大豆经NaCl胁迫后筛选鉴定而出。Table 1
表1
表1大豆材料的名称、地理来源、类型及耐盐特性
Table 1Name, geographical origin, type, and salt tolerance characteristic of four cultivars
| 编号 Number | 品种名称 Name of variety | 地理来源 Geographical origin | 类型 Type | 耐盐特性 Salt tolerance characteristic |
|---|---|---|---|---|
| Y8D6008 | 夏邑太平紫花豆Xiayitaipingzihuadou | 河南 Henan | 地方品种 Landrace | 耐 Tolerance |
| Y8D6013 | 清远小青豆Qingyuanxiaoqingdou | 广东 Guangdong | 地方品种 Landrace | 耐 Tolerance |
| Y8D6132 | 邢阳灰黄豆Xingyanghuihuangdou | 安徽 Anhui | 地方品种 Landrace | 敏 Sensitive |
| Y8D6136 | 南农89-30 Nannong89-30 | 江苏 Jiangsu | 育成品种 Improved | 敏 Sensitive |
新窗口打开
1.2 试验设计
每个材料分别选取大小一致、籽粒饱满、种皮完整的种子,消毒催芽后播种于装满蛭石的花盆中,将萌发一周的大豆材料转移到含有1/2×Hoagland营养液的水培箱,待大豆幼苗生长到第一片复叶完全展开时,选取长势相同的大豆幼苗分为两组,分别放在含有不同浓度NaCl的1/2×Hoagland营养液中培养。一组以不加盐的1/2×Hoagland营养液作为对照;另一组进行NaCl处理,参照HAMWIEH等[16]方法略有改动,即,将幼苗放在含有50 mmol·L-1 NaCl 1/2× Hoagland营养液中处理一天,接着再用100 mmol·L-1 NaCl处理一天,最后将盐浓度提高到150 mmol·L-1进行处理一周,对两组大豆幼苗进行调查取样用于下一步试验。以上试验均在光照、温度与湿度可控的温室内开展试验,试验条件为光照时间16 h,光强约600 μmol·m-2·s-1,昼夜温度28℃/18℃,相对湿度65%—85%。本文所提到的性状相对值为胁迫环境下某性状表型值与对照环境下某性状表型值的比率,计算公式为:某性状相对值=某一性状盐胁迫时表型值/对照环境表型值[17]。1.3 SPAD与光合气体交换参数的测定
NaCl处理7 d后,用叶绿素含量测定仪(SPAD-502,日本)测定每个材料功能叶片的SPAD值,每个叶片测定6次,每个材料测定5株,取平均值。用CIRAS-2型便携式光合仪测定每个材料的净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2 concentration,Ci)和蒸腾速率(transpiration rate,E)。同样选取每个材料的功能叶片进行测定,每个材料每个处理重复5次。测定时的光强、CO2浓度均由测定仪器进行自动控制。
1.4 生物量及离子含量测定
每个材料每个处理选取3株大豆幼苗,用蒸馏水冲洗5次,将大豆幼苗分为根、茎和叶片三部分后,在105℃烘箱中杀青30 min,于75℃烘干至恒重,准确称取3个组织的干重。将根系的重量作为地下部生物量,将叶片与茎的重量总和作为地上部生物量(shoot dry weight, SDW)。然后分别称取叶片和根系约0.1 g粉末干样,转移至消化管中,加入8 mL ddH2O和2 mL HNO3,然后使用微波消解系统(Milestone Ethos)消煮20 min,冷却至室温后,用ddH2O定容至25 mL。利用感耦合等离子体发射光谱仪(Perkin Elmer Optima 2100DV ICP-OES system)测定每个样品的离子含量。以不加样品的空白样为对照,每组处理3个重复。1.5 实时荧光定量PCR分析
大豆幼苗在150 mmol·L-1 NaCl处理一周后,分别取每个大豆品种的根系冻存于-80℃用于提取RNA。依照Promega RNA提取试剂说明书提取总RNA,参照 PrimeScriptTM RT reagent Kit(TaKaRa公司)试剂盒说明书进行反转录获得cDNA。参与大豆植株体内Na+动态平衡的相关基因实时荧光定量PCR引物见表2,并以大豆组成型表达的ActinII作为内参基因,引物序列为F:5′-ATCTTGACTGAGCGTGGTT ATTCC-3′,R:5′-GCTGGTCCTGGCTGTCTCC-3′。利用ROCHE LightCycler® 96实时荧光定量PCR仪,按照TaKaRa试剂盒SYBR Premix ExtaqTM说明设定反应体系,扩增条件为95℃ 5 min;95℃ 15 s,58℃ 1 min,45个循环。Table 2
表2
表2Na+动态平衡关键基因的实时荧光定量PCR引物
Table 2Gene-specific primers of key components involved in Na+ homeostasis used in RT-PCR analysis
| 基因名称 Gene name | 引物序列 Primer sequence (5'-3') | 参考文献 Reference |
|---|---|---|
| GmSALT3 | F:TCCTTGACGCTTGGAGTGTT | [10] |
| R: CGGTTGATGAAGGGAAAAC | ||
| GmNcl1 | F: TATGGTGGCTGGATTGGC | [8] |
| R: TCGTTGACCTTGTCGTGCTT | ||
| GmSOS1 | F: TTGTGCTGCATTTCTTCGAG | [7] |
| R: CGTGCTTCTTCTCCTTCCAC | ||
| GmNHX1 | F: TATCGTATGCTGCTTCTGCCTGT | / |
| R: AATTTTGCCAATTCTGCAATGTC | ||
| GmAVP1 | F: TTTCTTTGTACCAATATACCCTCT | / |
| R: TGATTCATAATTAAATTACGAATT | ||
| GmCIPK1 | F: CGCCTGAAGTGATAGCGAAAAA | / |
| R: CATCCTGAAAGGGTAAAAAGCC |
新窗口打开
1.6 数据统计
采用SPSS17.0进行数据处理及统计分析,并使用Excel进行作图。2 结果
2.1 NaCl胁迫下不同大豆品种的表型差异比较
与对照相比,经过150 mmol·L-1 NaCl处理一周后,4个大豆材料均出现盐害胁迫症状,生长受到明显抑制(图1)。由图2可以看出150 mmol·L-1 NaCl处理7 d后,除Y8D6013的地上部外,其余大豆品种地上部生物量均显著降低(P<0.05),且Y8D6136的地上部干重降低幅度最高(67.75%)。2个盐敏感大豆的地上部干重减少幅度均高于2个耐盐材料;并且150 mmol·L-1 NaCl处理下,4个材料根系的干重也均显著降低(图2)。由此可见,150 mmol·L-1 NaCl胁迫显著抑制大豆幼苗生物量积累。盐胁迫下不同材料根冠比值也发生显著变化,耐盐大豆的根冠比显著降低,而盐敏感材料的根冠比显著上升,说明盐胁迫改变大豆生物量的分配格局,盐敏感大豆将地上部的干物质更多的运输到地下部(图2)。由此可见盐敏感大豆幼苗受到盐胁迫伤害的程度更严重。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同大豆品种在NaCl处理一周后的植物表型特征
-->Fig.1Phenotypes of soybean varieties under NaCl after seven days treatment
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2NaCl胁迫对大豆生物量积累和根冠比值的影响
-->Fig.2Effect of NaCl on biomass accumulation and the root shoot ratio of soybean seedlings柱形图上不同小写字母表示不同材料以及不同处理间的差异达到显著水平(P < 0.05)。下同Different small letters on the histograms mean the difference among the data represented by the histograms is significant at P < 0.05. The same as below
-->
2.2 NaCl胁迫下Na+离子含量及Na+动态平衡相关基因的表达
2.2.1 Na+含量变化 经盐胁迫处理后,大豆植株叶片中Na+含量急剧增加,Y8D6008、Y8D6013、Y8D6132和Y8D6136的叶片中Na+含量分别为对照叶片Na+含量的47.53、51.17、200.63和129.37倍。通过不同品种之间的比较,发现Y8D6132和Y8D6136的叶片Na+含量显著高于Y8D6008和Y8D6013叶片的Na+含量。对大豆根系中Na+含量分析发现,盐胁迫下4种材料的根系Na+含量均显著增加,但耐盐大豆与盐敏感材料的根系Na+含量之间并没有显著差异(图3)。对4种材料的相对Na+含量比较发现,耐盐材料根系Na+含量的增加倍数均高于盐敏感材料,而叶片Na+含量变化规律相反。不同组织的Na+比较发现盐敏感材料叶片中的Na+含量均显著高于根系Na+含量。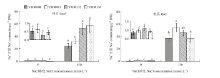 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3NaCl胁迫对大豆幼苗叶片及根系中Na+的影响
-->Fig. 3Effects of 150 mmol·L-1 NaCl concentrations on Na+ content in leaf and root of four soybean varieties seedlings小图为对照环境下不同大豆材料Na+的情况The small figures show the Na+ content in leaf and root of four soybean varieties seedlings under control condition
-->
2.2.2 参与Na+动态平衡的相关基因表达变化 挑选6个参与大豆植株体内Na+动态平衡相关基因,根据所编码蛋白的功能将这6个基因分为离子转运蛋白基因(GmSOS1、GmNcl1、GmSALT3和GmNHX1)、信号转导相关基因(GmCIPK1)及与Na+转运能量相关的基因(GmAVP1),通过定量表达分析,发现不论在对照环境还是盐胁迫条件下4种大豆材料的GmSALT3表达量较低。盐胁迫后,GmSALT3在Y8D6013中表达量上调,而在其他3种材料中表达量显著下调。NaCl处理后,GmNcl1在4种大豆品种中的表达量均显著上调,但在Y8D6008和Y8D6013中上调幅度较小,而在Y8D6132和Y8D6136中的表达量分别上调了15.64和11.02倍(图4)。4个材料的GmSOS1均受盐胁迫诱导显著上调,但是在不同材料中的上调幅度基本一致。GmNHX1在盐胁迫处理下表达量微弱上调,而GmAVP1和GmCIPK1在不同材料中表现出各不相同的表达模式(图4)。
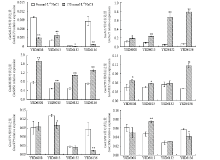 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4Na+动态平衡相关基因在盐胁迫下的相对表达模式
-->Fig. 4The relative expression of key components involved in Na+ homeostasis of four soybean varieties in 150 mmol·L-1NaCl treatments*和**分别表示在0.05和0.01水平上差异显著* and ** indicate significance at the 0.05, and 0.01 levels, respectively
-->
2.3 NaCl胁迫下不同大豆品种K+、Ca2+和磷含量(P)
由图5-A可以看出,在盐胁迫处理后,4种大豆品种的K+含量与Na+变化的规律相反,不论叶片还是根系K+均显著下降。其中,盐敏感材料Y8D6132下降幅度最大,即Y8D6132的相对K+含量(盐胁迫时K+含量占正常环境K+含量的比率)最小,其中,叶片中K+为对照的47.00%,根系中K+为对照的17.09%。其次是Y8D6136的叶片中K+为对照的59.50%,根系中K+为对照的25.97%,而耐盐材料叶片和根系的相对K+含量均高于盐敏感材料叶片和根系的相对K+含量。对不同组织的K+含量分析发现,2种环境下不同品种的叶片和根系中K+含量具有相同规律,即叶片>根系,不同材料的根系和叶片之间K+差异均达到显著水平。在盐胁迫处理后,4种大豆材料根中K+含量下降幅度均高于相应材料的叶片K+含量下降幅度。
经盐胁迫处理后,4种材料叶片中Ca2+含量显著下降,其中,Y8D6132降低幅度最大,与对照相比,Ca2+含量降低了80.26%(图5-C)。盐胁迫后,根系中Ca2+含量呈现下降趋势,Y8D6008和Y8D6132根系中Ca2+含量显著下降,而Y8D6013和Y8D6136根系中Ca2+含量变化并没有达到显著水平。不同组织之间比较发现,对照环境下,4种材料的Ca2+主要分布在叶片,但是盐胁迫处理后Ca2+含量在根部分布比重增加(图5-D)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5NaCl胁迫对大豆幼苗叶片及根系中K+、Ca2+和P含量的影响
-->Fig. 5Effects of 150 mmol·L-1NaCl concentrations on K+, Ca2+ and P content in leaf and root of four soybean varieties seedlings
-->
150 mmol·L-1 NaCl胁迫后,盐敏感大豆Y8D6132与Y8D6136叶片和根系中的P含量均显著下降,而耐盐大豆Y8D6008和Y8D6013叶片P有所增加,但差异不显著,根系中P在胁迫后显著增加(P < 0.05,图5-F)。
2.4 NaCl胁迫下不同大豆品种的叶绿素(SPAD)及光合作用的气体交换参数变化
利用叶绿素含量测定仪测定每个材料在不同处理下的SPAD值,发现盐敏感大豆Y8D6132和Y8D6136叶绿素含量显著降低。Y8D6008的叶绿素含量并没有明显变化,而Y8D6013叶绿素含量虽然降低为对照组叶绿素含量的74.93%,但是相对SPAD值高于盐敏感材料(图6)。与对照环境相比,盐胁迫使4种大豆材料叶片的
净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(E)均显著降低(图6)。经过7 d 150 mmol·L-1 NaCl胁迫后,Y8D6132的净光合速率降低到仅为对照的4.47%,Y8D6136降低了81.27%。而Y8D6008和Y8D6013在盐胁迫下净光合速率变化也达到显著水平,但是2种材料的Pn均显著高于盐敏感大豆的Pn。盐胁迫使得盐敏感材料Y8D6132和Y8D6136的Gs和E均显著下降,并且下降幅度远大于耐盐材料。对胞间CO2浓度(Ci)分析发现,受盐胁迫后,Y8D6008和Y8D6013的Ci显著降低,说明耐盐大豆材料光合速率降低主要原因是盐胁迫引起渗透胁迫从而导致气孔关闭。而盐敏感材料的Ci不但没有降低,反而上升趋势,其中Y8D6132的Ci比对照的提高了39.58%,而且盐敏感大豆的叶绿素受胁迫降低程度均高于耐盐大豆,由此可见,非气孔限制可能是导致盐敏感大豆光合速率降低主要因子。而Y8D6008和Y8D6013在150 mmol·L-1 NaCl盐胁迫处理条件下光合参数受抑制的程度明显小于盐敏感材料,表现出较好的耐盐性。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同大豆品种盐胁迫下的SPAD变化
-->Fig. 6Variation of SPAD in four soybean varieties under the stress of 150 mmol·L-1 NaCl
-->
K+、Ca2+和P是植物生长发育所必须的矿质元素,参与植物光合作用,适量的Na+对植物生长有一定益处,能够参与气孔调节和渗透调节等生理活动,过量Na+抑制光合作用。根据相关性分析结果,可以看出本研究中4种大豆品种的相对净光合速率与相对K+含量及P含量呈显著正相关,而与相对Na+含量呈现负相关(表3)。
3 讨论
3.1 盐胁迫下GmNcl1可能影响大豆耐盐特性
前人研究表明植株积累过量的Na+对叶片造成严重伤害,另外由于叶片含有较高Na+浓度使得根部水Table 3
表3
表3不同大豆品种的性状之间相关性
Table 3Sample correlation coefficients between different traits of four soybean varieties seedlings
| 性状 Trait | 相对K+含量 Rea-K+ | 相对Ca2+含量 Re-Ca2+ | 相对P含量 Re-P | 相对地上生物量 Re-SDW | 相对SPAD Re-SPAD | 相对净光合速率 Re-Pn |
|---|---|---|---|---|---|---|
| 相对Na+含量 Re-Na+ | -0.99* | -0.54 | -0.95* | -0.87 | -0.95* | -0.97* |
| 0.02 | 0.46 | 0.05 | 0.13 | 0.04 | 0.03 | |
| 相对K+含量 Re-K+ | 1 | 0.44 | 0.97* | 0.93 | 0.9 | 0.96* |
| 0.56 | 0.03 | 0.06 | 0.09 | 0.03 | ||
| 相对Ca2含量 Re-Ca2+ | 1 | 0.25 | 0.1 | 0.67 | 0.36 | |
| 0.75 | 0.9 | 0.33 | 0.64 | |||
| 相对P含量 Re-P | 1 | 0.96* | 0.86 | 0.98* | ||
| 0.04 | 0.14 | 0.01 | ||||
| 相对地上部 Re-SDW | 1 | 0.71 | 0.91 | |||
| 0.29 | 0.09 | |||||
| 相对SPAD Re-SPAD | 1 | 0.93 | ||||
| 0.07 |
新窗口打开
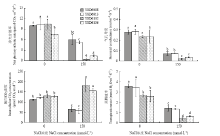 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7盐胁迫下不同大豆品种Pn、Gs、Ci和E的变化
-->Fig. 7Impacts of NaCl stress on Pn, Gs, Ci and E of four soybean varieties seedlings
-->
势增高,不利于根系吸收水分[18]。刘光宇等[19]和姜静涵等[20]研究发现大豆叶片Na+含量与耐盐性有关。因此,避免Na+在叶片中过量积累对大豆抗盐性具非常重要作用。本研究结果显示150 mmol·L-1 NaCl处理后,盐敏感品种叶片Na+积累量均显著高于耐盐品种,并且盐敏感材料叶片中的Na+含量均大于根系,这与前人研究结果一致。根系中Na+通过中柱细胞泵入木质部后再运输到地上部组织。前人通过图位克隆得到的GmSALT3是一个非常重要的大豆耐盐基因,NaCl处理后,该基因在耐盐大豆材料(铁峰8号)中大量表达,在盐敏感大豆材料中不表达。GmSALT3在控制Na+向地上部运输中发挥作用,但是并不直接参与控制盐分向地上部运输中[10]。本研究发现GmSALT3在4种材料中的表达均较低,并且盐胁迫后有的材料表达上调有的表达下调。这说明本研究中耐盐大豆可能存在与GmSALT3不同的耐盐基因。对GmSOS1、GmNHX1、GmCIPK1以及GmAVP1表达模式进行分析,发现这些基因与叶片Na+含量并不存在关联性。有意思的是GmNcl1受盐胁迫诱导表达上调,并且在盐敏感大豆中上调倍数高于耐盐大豆,该结果与赫卫等[8]研究结果一致。赫卫等[8]还发现GmNcl1由6个位点组成的不同单倍型能高效区分耐盐和盐敏感品种。综合前人研究及本研究结果,推测GmNcl1可能与本研究大豆品种的耐盐特性有一定关联性,但是GmNcl1表达强度的差异是否影响到基因功能,对此还需要进一步研究。
3.2 Na+过量积累影响大豆植株其他离子含量
Na+和K+具有相似的水合离子半径,盐胁迫下大量的Na+通过竞争植物细胞的K+通道蛋白的结合位点来降低植物体内的K+的吸收和运输[21],相关性分析显示相对Na+含量与相对K+含量呈显著负相关,说明盐胁迫下本研究的4种大豆品种的Na+对K+表现出明显的拮抗作用。150 mmol·L-1 NaCl处理后,耐盐大豆材料叶片相对K+含量均高于盐敏感大豆,说明耐盐大豆的叶片对K+保持加强的吸收能力,以保证足够K+参与地上部的代谢。Ca2+水平与植物耐盐性有重要的关联性[22]。盐胁迫下4种大豆叶片中Ca2+含量显著降低,这与大多数的研究结果一致。但本研究耐盐材料与盐敏感材料之间受到盐胁迫后Ca2+响应情况并没有规律性变化,而是表现出不同材料有不同的响应,这可能是由于不同基因型品种之间的遗传多样性导致适应胁迫的机制不同,对燕麦的盐胁迫响应的研究中也有类似的发现[23]。不同作物对磷肥与盐分相互作用的响应机制非常复杂。有研究发现NaCl抑制作物对磷素的吸收和运输[24-25],但也有研究表明盐胁迫能促进玉米的根系对磷的吸收[26]。另外还有研究发现提高磷素水平可以一定程度增强植物的耐盐性或缓解盐胁迫[27-28]。本研究显示,150 mmol·L-1 NaCl处理后盐敏感大豆无论叶片还是根系中P含量均显著下降,而耐盐大豆叶片P含量没有显著降低,根系中P含量增加显著。这说明盐胁迫下耐盐大豆保持P水平不降低甚至升高,可能是其具有较强耐盐性的原因之一。
3.3 NaCl胁迫抑制大豆光合作用
光合作用被认为是对盐逆境胁迫最为敏感的生理过程。本研究显示150 mmol·L-1 NaCl 胁迫7 d后,除了Ci,4种大豆的净光合速率及其他光合特征参数均显著下降,盐敏感大豆受抑制程度均高于耐盐大豆。相关性分析显示相对净光合速率与相对叶片Na+含量相关性达到显著水平。由此可见,Na+在叶片中过量积累是导致叶片净光合速率下降的一个主要因素。钾能够维持叶绿素合成运转并增强叶肉细胞光合活性[29]。有研究发现由于Na+过量而造成其他营养元素亏缺同样也会对光合作用产生影响[13] 。本研究显示盐胁迫耐盐大豆能尽量将体内有限的K+优先向叶片分配,保证耐盐大豆叶片具有较高的光合速率。磷是构成叶绿体被膜和类囊体膜的基本元素。另外,植物细胞内的磷浓度下降导致光合磷酸化水平降低,ATP和NADPH生成减少,光合速率降低[30]。本研究盐胁迫下耐盐大豆相对P含量和相对光合速率均高于盐敏感大豆。相关性分析显示盐胁迫后相对P含量与相对净光合速率之间具有显著正相关性。由此可见盐胁迫下积累过量的Na+离子及由此引起的K+和P营养亏缺均对光合作用产生严重影响。4 结论
150 mmol·L-1NaCl胁迫条件下,盐敏感大豆的地上部生物量、SPAD、净光合速率、气孔导度和蒸腾速率受抑制程度显著显著高于耐盐品种,盐胁迫导致耐盐品种光合速率下降主要因素可能是气孔限制,而盐敏感品种的光合速率下降主要因素是非气孔限制。盐胁迫下,耐盐大豆叶片中Na+含量显著低于盐敏感大豆,K+和P元素变化幅度均小于盐敏感大豆,相关分析表明净光合速率变化幅度与叶片中Na+、K+和P含量变化幅度的相关性达到显著水平。盐胁迫后盐敏感大豆的Na+通道蛋白基因GmNcl1表达量上调倍数低于耐盐大豆。综合分析认为,与盐敏感大豆相比,耐盐大豆在盐胁迫环境下减少Na+在叶片中积累,保持相对较高的K+和P含量,并维持相对较高的光合速率,这可能是耐盐大豆比盐敏感大豆具有较强耐盐特性的因素之一。另外Na+动态平衡相关基因GmNcl1可能与大豆耐盐特性有一定关联性。致谢:本研究大豆材料为南京农业大学国家大豆改良中心喻德跃教授提供,在此表示感谢。
The authors have declared that no competing interests exist.
