0 引言
【研究意义】乳腺做为牛、羊等哺乳动物合成分泌乳汁的主要器官,其基因表达调控机制一直是畜牧工作者进行科学研究的重要内容。BIONAZ等采集奶牛乳腺组织分析基因表达谱 [1],发现固醇调节元件结合蛋白1(Sterol-regulatory element binding protein1,SREBP1)作为一种转录因子,是乳腺中脂肪合成代谢基因表达调控网络的中心,其他研究发现 一些营养因素可以影响SREBP1蛋白的活性和脂肪合成酶基因的表达[2-3]。因此研究SREBP1及脂肪合成酶基因在乳腺上皮细胞中的表达调控机制,可以为阐明营养元素影响乳腺脂肪合成的机制提供理论基础。【前人研究进展】早期在生产中发现对奶牛饲喂油脂会造成奶牛的乳脂率下降,形成生产上低脂乳症(milk fat depression, MFD)的现象[4],后来发现奶牛在发生MFD时,不仅乳脂肪含量与组成发生变化,而且乳腺组织的脂肪合成关键酶的基因表达也受到抑制[4-6],进一步研究发现在降低脂肪合成酶基因表达的同时也能够影响SREBP1基因mRNA的表达[3,7]。SREBP1作为重要的核转录因子,主要调控细胞内的胆固醇浓度和脂类的稳态 [8-10]。对于SREBP1调控靶基因的促转录功能,通过采用CHIP-chip和CHIP-seq的研究,在人和小鼠全基因组上已发现上百个可能受SREBP1调控的靶基因,其中主要包括硬脂酰辅酶A去饱和酶(stearoyl-coenzyme A desaturase,SCD)等脂肪合成酶基因[11-13]。SCD是催化饱和脂肪酸脱氢形成不饱和脂肪酸的关键酶,在奶牛中主要存在SCD1和SCD5两种亚型 [14],并且SCD1在奶牛乳腺基因表达谱中所占的比例远远超过其他脂肪合成酶基因[1]。已有多个研究表明SCD1和SREBP1基因的核酸多态性均与乳脂肪性状相关[15-16]。【本研究切入点】目前在细胞上研究SREBP1与靶基因的转录调控机制多是采用间接研究模式,在培养细胞中加入诱导SREBP1的刺激因素(如胰岛素/葡萄糖),通过引起SREBP1及其靶基因mRNA的表达变化来进行推测[17],而这些基因表达变化是SREBP1直接调控还是由于代谢通路的其他因子引起的,目前还不十分清楚[18]。还有研究采用表达SREBP1成熟核蛋白来研究其转录调控作用[19],但对于SREBP1全长蛋白在乳腺上皮细胞的转录调控机制还缺乏了解,特别是关于奶牛SREBP1在乳腺上皮细胞中调控SCD1基因转录的研究还未见报道。【拟解决的关键问题】因此本研究结合前期试验建立的含不同调控元件奶牛SCD1基因启动子[20],通过克隆表达奶牛SREBP1蛋白,在奶牛乳腺上皮细胞中研究SREBP1对于SCD1基因启动子的转录调控作用,有助于阐明SREBP1对于靶基因的转录调控机制。1 材料与方法
相关试验在2014年1月至2015年4月在河南农业大学农业部动物生化与营养重点实验室完成。1.1 材料与仪器
奶牛乳腺组织于2014年1月采自郑州市屠宰场,乳腺上皮细胞为实验室保存,4个不同长度pGL3- SCD1/SCD2/SCD3/SCD4荧光素酶报告基因表达载体为实验室构建,所用试剂AxyPrep DNA Gel Extraction Kit 试剂盒购自Axygen 公司,ClonExpress Multis kit 试剂盒购自Vazyme公司,Lipofectamine2000购自Invitrogen公司,Star XL扩增酶购自Takala公司,双荧光素酶检测试剂盒购自Promega公司,DMEM培养基购自Hyclone公司,无血清培养基Opti-mem购自Gibco公司,标签蛋白抗体c-myc Antibody(9E10)购自Santa Cruz公司,荧光二抗Alexa Fluor® 488 Donkey Anti-Mouse IgG (H+L)购自Invitrogen公司,细胞核染料DAPI、抗荧光封片淬灭液购自碧云天,细胞培养板购自Corning公司,引物合成及测序由上海生工完成。二氧化碳培养箱和Fluroskan Ascent FL荧光和化学发光检测仪购自Thermo公司,激光共聚焦显微镜LSM 5 PASCAL购自Carl Zeiss公司。1.2 方法
1.2.1 奶牛SREBP1基因的克隆 采用TRIZOL提取乳腺组织的RNA,反转录成cDNA,根据NCBI公布的奶牛SREBP1基因序列(NM_001113302.1),设计引物时在SREBP1序列ATG后加入c-myc序列(GAACAAAAACTCATCTCAGAAGAGGATCTG)作为标签蛋白,采用分段克隆PCR方法对奶牛SREBP1基因进行克隆,具体引物序列见表1。将SREBP1总共分为四段分别进行扩增,同时PCR扩增pcDNA3.1+序列作为载体序列,分别对目的基因1、2、3、4各片段纯化、电泳后定量。Table 1
表 1
表 1引物序列
Table 1The sequences of primer
| 引物 Primers | 序列(5′-3′) Sequences | 产物长度 Size |
|---|---|---|
| VF | CTCGAGTCTAGAGGGCCCGT | 5.4 kb |
| VR | GATGAGTTTTTGTTCCATGGTGGCAAGCTTAAGTTTAAACGCTAGCCA | |
| 1F | CCATGGAACAAAAACTCATCTCAGAAGAGGATCTGGACGAGCCACCCTTCAAC | 1170 bp |
| 1R | TGAGCTTCTGGTTGCTGTGCT | |
| 2F | AGCACAGCAACCAGAAGCTCA | 1116 bp |
| 2R | GAGCACTGCTCAGGAAGAAGC | |
| 3F | GCTTCTTCCTGAGCAGTGCTC | 363 bp |
| 3R | TGATGGAGAAGCTGCAGGTAAGA | |
| 4F | TACCTGCAGCTTCTCCATCAGC | 911 bp |
| 4R | AAACGGGCCCTCTAGACTCGAGCTAGCTGGAGGTCACAGTGGTCC |
新窗口打开
1.2.2 pcDNA3.1-SREBP1载体的构建及鉴定 采用重组酶Exnase Multis对各片段与载体进行重组环化,重组反应体系:5×CE Multis Buffer 4 μL,vector 108 ng,4个回收片段,Exnase Multis 2 μL,同时做无酶的空白对照,在37℃水浴30 min,置于冰水浴中反应5 min。取反应产物10 μL,加入到感受态细胞中进行转化,获得克隆后挑取单菌落扩增,提取质粒进行分别采用HindⅢ、XhoI双酶切和HindⅢ、XbaI双酶切鉴定,鉴定正确的质粒送测序公司进行测序。
1.2.3 SREBP1基因mRNA在乳腺上皮细胞中的超表达 将培养好的奶牛乳腺上皮细胞经胰酶消化后,按比例分散培养在12孔细胞培养板中,放入37℃、5% CO2培养箱培养,到细胞达到80%的融合度时,弃去培养基,采用转染试剂(Lipofectamine 2000)转染pcDNA3.1-SREBP1质粒6 h后,更换新鲜培养基,同时以pcDNA3.1空载体作为对照组,转染48 h后提取细胞RNA,反转录成cDNA,采用荧光定量PCR引物(F-CCAGCTGACAGCTCCATTGA,R-TGCGCGC CACAAGGA)检测SREBP1基因mRNA的表达,同时检测奶牛EIF3K基因(F-CCAGGCCCACCAAGA AGAA,R- TTATACCTTCCAGGAGGTCCATGT)作为内参基因[21],计算SREBP1基因的mRNA表达差异倍数。
1.2.4 SREBP1蛋白在乳腺上皮细胞的定位 在24孔板中加入细胞爬片,接种乳腺上皮细胞,细胞培养过夜后,转染pcDNA3.1-SREBP1质粒,培养24 h后用预冷的PBS洗3遍,4%多聚甲醛固定10 min,PBS洗3遍,透化剂(0.2%Triton100)作用15 min,封闭液(90%PBS+10%胎牛血清)封闭1 h;弃封闭液,用一抗c-MYC Antibody(9E10)(1﹕500)4 ℃过夜孵育;PBS洗3遍,加入荧光标记二抗Alexa Fluor® 488 Donkey Anti-Mouse IgG(H+L)(1﹕1 000)室温避光孵育1 h;然后采用DAPI染色液(500µg∙mL-1)对于细胞核染色8 min,PBS洗3遍,滴加抗荧光封片淬灭液,封片,晾干放4℃,在激光共聚焦显微镜下观察SREBP1蛋白亚细胞定位。
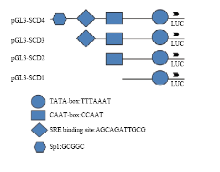
1.2.5 SREBP1蛋白对含不同调控元件SCD1启动子的转录调控作用 培养乳腺上皮细胞,以pGL3-Basic荧光素酶空载体作为对照,转染实验室前期构建的4个含有不同调控元件的奶牛SCD1基因启动子载体[20],分别是pGL3-SCD1(212bp,序列中有TATA-box元件)、pGL3-SCD2(380bp,有CAAT-box元件)、pGL3-SCD3(416 bp,有SRE元件)和pGL3-SCD4(760 bp,有SRE、Sp1元件)(图1),同时分别转染1.0 µg pcDNA3.1-SREBP1质粒作为处理因素,作用24 h后收集细胞加入裂解液,采用荧光和化学发光检测仪进行荧光素酶活性检测,采用萤火虫荧光素酶活性/海肾荧光素酶活性计算启动子活性,结合调控元件分析SREBP1处理对于启动子活性的影响。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1含不同调控元件的奶牛SCD1启动子结构
-->Fig. 1The structure of bovine SCD1 promoter with different regulatory elements
-->
1.2.6 SREBP1调控SCD1基因启动子转录的剂量关系 培养乳腺上皮细胞,接种12孔细胞培养板后,转染1.0 µg pGL3-SCD2、pGL3-SCD3启动子载体,同时分别转染0.25、0.5、1.0µg的pcDNA3.1-SREBP1质粒作为处理因素,作用24 h后收集细胞,加入裂解液,进行荧光素酶活性检测并计算启动子相对活性,分析不同剂量SREBP1的处理对于启动子活性的影响。
1.2.7 数据统计 试验中每个处理中重复4次,试验数据采用SPSS10.0软件进行统计学分析,**P<0.01,***P<0.001。
2 结果
2.1 SREBP1基因的克隆
对SREBP1基因采用分段克隆的方法,分别获得大小约5 400 bp 的pcDNA3.1载体片段和4个不同长度的目的基因片段(图2),将各个片段切胶回收后进行基因重组获得连接产物,将连接产物转化感受态细胞进行阳性克隆筛选,提取阳性细菌质粒后进行酶切鉴定。分别采用HindIII、XhoI双酶切,获得3个片段,片段长度分别为5 356、3 057和390 bp,采用HindIII、Xbal双酶切,获得2个片段,分别为5 350和3 453 bp(图3),最后经测序验证后发现,克隆的序列与NCBI公布的标准序列相比,除在1 509位有一个无义突变外,其他序列均与标准序列相一致,加上标签蛋白myc序列,整个表达序列长度达到3 510 bp。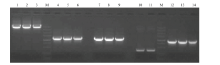 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2奶牛SREBP1基因的克隆
-->Fig. 2The clone of bovine SREBP1
-->
M:DL5000 DNA相对分子质量标准;1-3.pcDNA3.1载体片段;4-6.目的基因片段1;7-9. 目的基因片段2;10-11. 目的基因片段3;12-14. 目的基因片段4
M:DL5000 DNA marker;1-3. The products of pcDNA3.1 vector; 4-6. The products of SREBP1 fragment 1;7-9. The products of SREBP1 fragment 2;10-11. Tthe products of SREBP1 fragment 3;12~14. The products of SREBP1 fragment 4
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3pcDNA3.1-SREBP1质粒酶切鉴定图
-->Fig. 3The restriction enzyme digestion of pcDNA3.1-SREBP1M1. DL5000DNA相对分子质量标准; M2. DL15000DNA相对分子质量标准; 1.原质粒; 2. HindⅢ、XhoI双酶切产物;3.HindⅢ、Xbal双酶切产物;M1. DL5000DNA marker; M2. DL15000DNA marker;1.SREBP1-3.1; 2. pcDNA3.1-SREBP1 digested by HindⅢ / XhoI; 3. pcDNA3.1-SREBP1 digested by HindⅢ / Xbal
-->
2.2 SREBP1在乳腺上皮细胞中的超表达
将pcDNA3.1-SREBP1质粒转染乳腺上皮细胞后48h收集细胞,采用荧光定量PCR检测SREBP1基因的表达丰度,结果发现,与转染空载体的对照相比,SREBP1基因的mRNA表达显著升高(图4),比对照组增加了130.4倍(P<0.001),表明载体转染后在奶牛乳腺上皮细胞中能够高效表达SREBP1基因的mRNA。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4SREBP1基因mRNA在乳腺上皮细胞中的表达丰度
-->Fig. 4The mRNA expression of SREBP1 in mammary epithelial cell (n=4)Congtrol: 转染pcDNA3.1空载体;SREBP1:转染pcDNA3.1-SREBP1载体Congtrol: Transfection of pcDNA3.1 empty vector, SREBP1:Transfection of pcDNA3.1-SREBP1vector. ***P<0.001
-->
2.3 SREBP1蛋白在乳腺上皮细胞中的定位
将pcDNA3.1-SREBP1载体转染乳腺上皮细胞后,采用激光共聚焦显微镜观察发现(图5),进行免疫荧光标记的SREBP1发出绿色荧光,细胞核经DAPI染色后发出蓝色荧光,共定位发现绿色和蓝色融合形成一种青色荧光定位在细胞核位置,表明SREBP1作为转录因子能够转运到乳腺上皮细胞核中进行表达。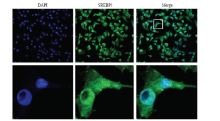 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5SREBP1蛋白在乳腺上皮细胞的表达定位
-->Fig. 5The localization of SREBP1 in mammary epithelial cellDAPI:细胞核染色;SREBP1:免疫荧光标记;Merge:共定位DAPI: nuclear staining, SREBP1: immunofluorescence labeling, Merge: colocalization
-->
2.4 SREBP1蛋白对于不同SCD1启动子的调控作用
将含不同调控元件的SCD1基因启动子pGL3- SCD1、SCD2、SCD3和SCD4转染细胞后,同时转染SREBP1质粒进行处理,检测启动子活性发现(图6),对照组basic启动子活性为2.32,在SREBP1刺激后启动子活性降低到1.29(P<0.01),与此类似,SCD1和SCD2启动子进行SREBP1处理后,荧光值均显著降低(P<0.01),而对SCD3、SCD4启动子进行SREBP1处理后,启动子活性均有显著增加。其中SCD3启动子活性由59.92增加到124.37,增加了1.0倍(P<0.001),SCD4进行SREBP1处理后,启动子活性由83.55增加到145.48,增加了0.7倍(P<0.001),表明SREBP1蛋白表达后,显著增加了SCD3、SCD4启动子的活性,其中对于SCD3启动子的活性促进最为明显。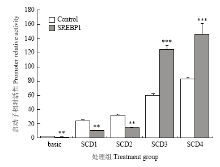 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6SREBP1对不同SCD1启动子活性的调控
-->Fig. 6The regulation of different SCD1 promoter activities by SREBP1Control: 转染pcDNA3.1空载体;SREBP1:转染pcDNA3.1-SREBP1载体Control: Transfection of pcDNA3.1 empty vector, SREBP1:Transfection of pcDNA3.1-SREBP1vector (n=4,**P<0.01,***P<0.001)
-->
2.5 SREBP1调控SCD基因启动子转录的量效关系
在转染0.25、0.5、1.0 μg的SREBP1质粒后,pGL3-SCD2启动子的活性呈现持续下降的趋势(图7),从19.90降低到10.31,而pGL3- SCD3启动子的活性随着质粒含量的增加则呈现上升趋势,其活性值从59.81分别增加到70.76、101.48和108.43(P<0.001),表明SREBP1能够剂量依赖性的增强pGL3- SCD3启动子的活性。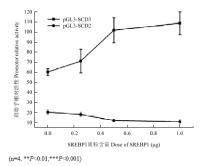 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7不同含量SREBP1对pGL3-SCD2、3启动子活性的调控
-->Fig. 7The regulation of pGL3-SCD2 and SCD3 promoter activities by different doses of SREBP1
-->
3 讨论
固醇调节元件结合蛋白(SREBP)属于“碱性螺旋-环-螺旋亮氨酸拉链”转录因子家族,其中SREBP1蛋白结构域一般分为3部分,包括480个氨基酸的N-端,80个氨基酸的跨膜结构域和590个氨基酸的C-端[22-23]。本研究中荷斯坦奶牛SREBP1基因的编码区全长3 440 bp,加上标签蛋白序列后整个基因长度在3 510 bp左右。由于SREBP1基因序列中含有复杂的二级结构,为提高克隆的准确性和效率,本研究采用分段克隆、基因重组的方法,得到了完整的SREBP1基因编码区序列,表明此分段克隆重组的方法对于长片段的基因克隆具有较好的效果。经过细胞转染和荧光定量PCR检测发现,SREBP1基因的mRNA有显著表达(图4),表明载体构建成功。SREBP1作为在内质网合成的蛋白质,首先合成无活性的前体(大约1 150个AA),然后通过与SCAP的相互作用后进入到高尔基体进行水解活化,暴露出NH2-末端活性结构域形成入核蛋白(大约500个AA),进入到细胞核内与靶基因启动子结合调控转录[24]。因此本研究采用激光共聚焦对表达的SREBP1蛋白进行亚细胞定位后,发现SREBP1能够在细胞核中表达(图5),这说明构建的SREBP1质粒在细胞内表达全长蛋白后能够水解活化形成入核蛋白,转运到细胞核内发挥功能。
对于在乳腺上皮细胞中SREBP1与靶基因的研究发现,SREBP1通过激活PⅢ启动子来调节乙酰辅酶A羧化酶基因的转录[25]。MA等在乳腺上皮细胞中通过构建SREBP1的siRNA抑制载体,能够降低SCD、ACC和FAS等多种脂肪酸合成酶基因mRNA的表达[26]。本研究采用不同调控元件的SCD1启动子,通过在乳腺上皮细胞表达SREBP1后发现pGL3- SCD1-2启动子的活性显著降低,而pGL3-SCD3-4启动子的活性显著增加(图6)。研究表明SREBPs 自身是非常低效的转录因子, 只有接近结合位点时才能刺激靶基因的表达[27],而pGL3-SCD3、4比pGL3-SCD1、2在结构上主要多出了一个SRE调控元件(图1),表明SRE调控元件可能对于SREBP1调控SCD1基因转录具有重要作用。ZULKIFLI在HEK细胞中采用表达人SREBP1-c成熟核蛋白来调控羊SCD基因启动子的转录,发现去除羊SCD基因启动子的SRE元件显著降低了启动子活性,其结果与本研究一致[19]。为了进一步验证SRE调控元件的作用,试验又采用不同浓度的SREBP1刺激pGL3- SCD2、pGL3-SCD3启动子,结果发现pGL3-SCD3启动子的活性增加与SREBP1的浓度呈现剂量依赖性,结合pGL3-SCD3与pGL3-SCD2启动子结构上相比只有36bp的差异(其中含有SRE调控元件),说明SREBP1可以通过与SRE元件结合促进SCD1基因转录。
启动子上与转录因子结合的位点具有特定模式, 称为模体,一般长度在5—20 bp范围内。转录因子在细胞内可以同时调控多个基因,而在不同基因上的结合位点并不完全相同。研究认为SREBP1结合的经典模体为(5′-TCACNCCAC-3′)/E-和(5′-CANNTG-3′)两种[13,18]。本研究中SRE调控元件含有的模体为5′-AGCAGATTGCG-3′(图1),与经典的SREBP1模体序列并不相符。TABOR 等在HepG2细胞上研究小鼠SREBP1a与鼠SCD基因启动子的关系,发现了与本研究一致的SRE新模体(5′-AGCAGATTG CG-3′)对于启动子活性至关重要,而经典模体反而对启动子活性没有显著影响[28],ZULKIFLI比对人、猪、鼠、羊的SCD1基因启动子序列后发现此模体在不同物种间是高度保守的[19]。这些结果说明SREBP1可能通过与SCD启动子上(5′-AGCAGAT TGCG-3′)模体的结合,发挥了转录因子的促转录作用。SEO等在小鼠组织中曾经发现了1 个新的SREBP1模体,并认为是经典模体的一个功能变体[12],因此本研究中发现的SREBP1模体序列可能是SCD1基因所特有的一个功能变体,这还需要进一步的研究证实。
4 结论
本研究通过克隆构建奶牛固醇调节元件结合蛋白1真核表达载体,发现固醇调节元件结合蛋白1能够定位在乳腺上皮细胞核中,并且固醇调节元件结合蛋白1可以与SRE调控元件结合促进SCD1基因启动子的转录。(责任编辑 林鉴非)
The authors have declared that no competing interests exist.
