0 引言
【研究意义】水稻细菌性基腐病是由玉米狄克氏菌(Dickeya zeae,异名Erwinia chrysanthemi pv. zeae)引起的水稻重要细菌病害之一[1]。D. zeae已成为世界性重要植物病原细菌,发生范围不断扩大[2-3]。该病原菌相关致病因子主要包括胞外酶、胞外多糖、毒素和hrp基因簇。细菌的鞭毛是重要的运动器官,然而,迄今有关D. zeae的鞭毛系统、flhDC和fliA基因功能及其调控机理尚不清楚。明确这些鞭毛基因的功能,有利于进一步了解D. zeae的致病性调控机理,同时,对于完善植物病原细菌的致病性综合调控网络和开发新型药物作用靶标以及制定病害防控策略均具有重要意义。【前人研究进展】细菌的鞭毛是重要的运动器官,它不仅在对环境适应、营养寻找、躲避不良因素伤害等过程中具有重要功能,而且在趋化性、黏附、定殖、生物膜形成和毒性因子产生等过程中也发挥着重要作用[4]。已有研究表明,超过50个基因参与了细菌鞭毛的生物合成以及细菌的运动,它们成簇排列共同构成鞭毛生物合成的级联调控系统[5]。早期研究比较清楚的周生鞭毛病原菌代表大肠杆菌(Escherichia coli)或沙门氏菌(Salmonella typhimurium),其鞭毛基因操纵子通常被分为3个转录调节等级,即级别Ⅰ、级别Ⅱ和级别Ⅲ,根据基因表达的先后顺序,相应地分为早期、中期和晚期,其基因表达受到精细的调控[6]。flhDC操纵子编码调控细菌鞭毛基因表达的主调控因子FlhDC,由flhD和flhC组成,位于鞭毛调控系统的最高一级,其编码产物FlhD和FlhC共同组成FlhD4-FlhC2异六聚体结构,属于转录激活蛋白,激活第二等级基因的转录[7-8],而由编码调控蛋白FliA(σ28)、鞭毛基体和钩状体等成分的基因则组成第二等级,负责Ⅲ级基因如鞭毛素蛋白FliC、鞭毛钩相关蛋白、马达蛋白和趋化蛋白等的转录表达[9-10]。细菌的鞭毛除了作为运动器官之外,还有许多其他重要的功能,如黏附、生物膜形成和病原菌的侵入等[11-14]。在一些病原细菌中,毒性因子向胞外分泌,必须依赖于鞭毛分泌装置[15-16],细菌胞外部分的鞭毛是一个类似于III型分泌系统(TTSS)的分泌装置,某些毒性因子是由鞭毛的转运系统来分泌的[17-18]。【本研究切入点】然而,上述以大肠杆菌为代表的鞭毛系统在周生鞭毛中并不都适用,甚至不适用于所有的大肠杆菌,而在D. zeae中有关鞭毛系统的基因功能尚未见报道。【拟解决的关键问题】从D. zeae基因组中寻找分析flhDC和fliA,用同源重组无痕基因敲除的方法构建缺失突变株,qRT-PCR方法分析D. zeae鞭毛基因表达和调控层次,并测定野生菌与突变体的运动性、致病酶、毒素、致病力等表型,分析鞭毛调控基因flhDC和fliA在该细菌中的功能。1 材料与方法
试验于2013年在华南农业大学农学院植物细菌研究室完成。1.1 供试材料
1.1.1 供试菌株、质粒及培养条件 本研究所用菌株和质粒见表1,其中载体质粒pKNG101和pRK2013由上海交通大学陈功友教授惠赠,D. zeae强致病力菌株EC1及其他菌株均由华南农业大学植物细菌研究室保存提供。D. zeae野生菌EC1及其突变菌培养于LB或MM培养基[19]中,适宜生长温度为30℃;大肠杆菌培养用LB培养基,适宜生长温度为37℃。培养基中相应抗生素浓度为利福平(Rif)50 μg·mL-1,硫酸链霉毒(Sm)50 μg·mL-1,卡那霉素(Km)50 μg·mL-1。水稻品种特籼13是基腐病感病寄主,烟草品种为K326,种植于温室,马铃薯购自附近超市。Table 1
表1
表1本研究所用的菌株、质粒
Table 1Bacterial strains and plasmids used in this study
| 菌株、质粒Strains, plasmids | 相关特征Relevant characteristics | 来源Source |
|---|---|---|
| 水稻基腐病菌D. zeae | ||
| EC1 | Wild type, RifR | 实验室保存Lab stock |
| ΔflhDC | flhDC knock-out mutant of EC1 | 本研究This study |
| ΔfliA | fliA knock-out mutant of EC1 | 本研究This study |
| 大肠杆菌E. coli | ||
| K12 CC118 | gyrA, recA, λ pir, host of pKNG101 | 上海交通大学Shanghai Jiao Tong University |
| DH5α | deoR, recA, endA, hsdR, supE, thi, gyrA, relA | 实验室保存Lab stock |
| 质粒Plasmids | ||
| pKNG101 | SmR, SacB, mobRK2, oriR6K (pir-minus) | 上海交通大学Shanghai Jiao Tong University |
| pRK2013 | Tra+, Mob-, ColE1-replicon, KanR, SpeR | 上海交通大学Shanghai Jiao Tong University |
| pKNG-ΔflhDC | flhDC knock-out fragment ligated on pKNG101 | 本研究This study |
| pKNG-ΔfliA | fliA knock-out fragment ligated on pKNG101 | 本研究This study |
新窗口打开
1.1.2 主要试剂及引物 PrimerSTARTM HS DNA Polymerase、Taq DNA Polymerase、T4 DNA Ligase、限制性内切酶Spe I、Bam HI、D2000 DNA Ladder Marker、Star Prep Plasmid Miniprep Kit、Universal DNA Purification Kit、DNA Fragment Purification Kit、PrimeScriptTM RT Master Mix(for Real Time)和SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)均购自TaKaRa公司;SV Total RNA Isolation System、RQ1 RNase-Free DNase购自Promega公司。所有引物合成和测序由上海英骏生物技术有限公司完成,引物见表2。
Table 2
表2
表2本研究所用引物及其序列
Table 2Primers used for genes knocking out and qRT-PCR
| 引物Primer | 序列Sequences (5′-3′) | 产物大小Size (bp) | 用途 Application |
|---|---|---|---|
| flhDC-U-F | CGGGATCCAAGATGGTCGCAGAAGTAGG | 531 | Fragement flanking the left of flhDC |
| flhDC-U-R | CCACAAAATCGCCATCAGGCATTCCCATCCCGACAGACT | ||
| flhDC-D-F | GTCTGTCGGGATGGGAATGCCTGATGGCGATTTTGTGG | 660 | Fragement flanking the right of flhDC |
| flhDC-D-R | CGGACTAGTCCAAACGCAGGCAAACCATC | ||
| flhDC-CX-F | GAGAGCATCAGGAATGGATG | 1413 | For detection and sequencing of flhDC gene deletion |
| flhDC-CX-R | TCGCATGGGCAATCATCATG | ||
| fliA-U-F | CGGGATCCTGTTTATCTCAGCGGCAGTG | 694 | Fragement flanking the left of fliA |
| fliA-U-R | GCACGCAGACGCTTTATCGCGGTATACAGTTCGCTCACAG | ||
| fliA-D-F | CTGTGAGCGAACTGTATACCGCGATAAAGCGTCTGCGTGC | 405 | Fragement flanking the right of fliA |
| fliA-D-R | CGGACTAGTTGTCGCACTTCTGTCTGCTC | ||
| fliA-CX-F | AATGAGCCTGTTGGTCGTGC | 1485 | For detection and sequencing of fliA gene deletion |
| fliA-CX-R | AGGGCACTGCGGTATGTGTT | ||
| 16SrDNA-qF | GCAACGCGAAGAACCTTACCT | 94 | For qRT-PCR |
| 16SrDNA-qR | GCCATGCAGCACCTGTCT | ||
| flhD-qF | CAGCTATGTTCCGGTTGGGTAT | 96 | For qRT-PCR |
| flhD-qR | GCTGATTGGTTTCGGCTAGTTTG | ||
| flhC-qF | GGTGTTGAAGCGGTTATCAAGG | 117 | For qRT-PCR |
| flhC-qF | GCTATCGACAAAGCGTACCAGT | ||
| fliA-qF | GGCCCAAACCCTGAACATCT | 94 | For qRT-PCR |
| fliA-qR | TTCCCGCCACTCATCGTAAG | ||
| fliC-qF | GGTGCAGACTGCTGAAGGT | 105 | For qRT-PCR |
| fliC-qR | CGGTCAAGAGAACCGTTGGTATC |
新窗口打开
1.2 基因缺失突变体的构建
利用两次同源重组的方法构建基因缺失突变体。以D. zeae野生型菌株EC1基因组DNA为模板,分别利用引物flhDC-U-F、flhDC-U-R以及flhDC-D-F、flhDC-D-R扩增得到flhDC的上、下游片段;再以flhDC-U-F和flhDC-D-R为引物对,以上、下游片段 1﹕1比例为模板PCR扩增得到缺失flhDC的融合片段,双酶切纯化后连接到自杀性载体pKNG101上,45 s热击转入的E. coli K12 CC118感受态细胞中,筛选得到阳性重组质粒pKNG-ΔflhDC。三亲结合方法将重组质粒、辅助质粒pRK2013以及受体菌EC1共培养12 h,将混合液涂布于含硫酸链霉素Sm但不含蔗糖的MM平板上培养48 h进行第1次同源重组,获得的单交换子稀释涂布于不含硫酸链霉素Sm但含10%蔗糖的MM平板上再培养48 h进行第2次同源重组,挑取双交换子进行PCR和测序验证,获得正确的突变体ΔflhDC。用相同的方法构建突变体ΔfliA。1.3 细菌运动性、生物膜形成能力、毒素和胞外酶活性测定
按照SHEN等[20]的方法测定细菌的运动性;按照YAP等[21]的方法测定细菌生物膜的形成能力;按照ZHOU等[22]的方法测定细菌产生毒素的能力;按照CHATTERJEE等[23]的方法分别测定细菌产生的果胶酶、纤维素酶和蛋白酶活性。1.4 细菌对水稻种子萌发影响
各取50粒水稻种子于50 mL的灭菌离心管中,分别加入25 mL培养至OD600=0.5的待测菌液,室温静置5 h,弃去菌液,用无菌水冲洗种子3次,置于垫有滤纸(无菌水湿润)的培养皿中,30℃保湿培养,以LB空白培养液为对照(CK),每处理3个重复,4 d后测量胚根与胚芽的长度。1.5 烟草过敏反应和水稻致病性测定
接种细菌培养和菌液准备:将野生菌和突变菌分别用含有相应抗生素的LB 30℃下培养12—24 h,离心收集菌体,调节菌体浓度至OD600约为0.5,备用,以空白LB为对照(CK)。其中烟草过敏性反应(HR)测定是采用无菌注射器将菌液注入烟草叶片,24 h观察HR;水稻致病性测定采用菌液灌根法接种,先用灭菌的针头刺伤水稻茎基部,然后往盆里各倒入20 mL的菌液,每个菌株接种共9株水稻,3次重复,48 h后开始观察水稻症状。
1.6 flhDC和fliA的转录调控分析
采用试剂盒SV Total RNA Isolation System的方法提取细菌的RNA,经琼脂糖凝胶电泳和核酸分析仪检测质量,RQ1 RNase-Free DNase去除基因组DNA,然后按照反转录试剂盒为PrimeScriptTM RT Master Mix(for Real Time)的方法合成cDNA。以EC1、ΔflhDC和ΔfliA的cDNA为模板进行实时定量PCR反应,采用SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒,试验仪器Thermal Cycler Dice® Real Time System(TaKaRa Code:TP800),以16SrDNA为内参,检测野生型和突变体鞭毛相关基因的转录表达。2 结果
2.1 flhDC、fliA基因缺失突变体构建及验证
通过融合PCR获得缺失目的基因的融合片段,连接在质粒pKNG101上,获得了重组质粒pKNG- ΔflhDC和pKNG-ΔfliA。三亲转化方法将重组质粒分别导入野生型菌株EC1发生双交换后,以双交换子的菌落DNA为模板,分别以flhDC-U-F和flhDC- D-R、fliA-U-F和fliA-D-R进行PCR,ΔflhDC和ΔfliA分别扩增出大小为1 191、1 099 bp的条带,而EC1中对应扩增出2 123、1 762 bp的条带(结果未显示),再将扩展片段送上海英骏生物技术有限公司测序验证,获得了正确的基因缺失突变体ΔflhDC和ΔfliA。2.2 ΔflhDC和ΔfliA的运动性、生物膜形成能力、毒素和胞外酶活性
分别对野生菌和突变菌株进行了运动性、毒素和胞外酶活性测定。结果表明,ΔflhDC和ΔfliA在半固体培养基上的泳动能力明显减弱(图1-A),形成生物膜的能力显著降低(图1-B),但EC1、ΔflhDC和ΔfliA都产生毒素(图1-C),并且果胶酶(图1-D)、蛋白酶(图1-E)和纤维素酶(图1-F)的产生能力在不同菌株之间均无明显差异。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1EC1、ΔflhDC和ΔfliA菌株的运动性、生物膜、毒素和胞外酶活性测定
-->Fig. 1Determination of mobility, biofilm, toxin, and extracellular enzymes of EC1, ΔflhDC and ΔfliA strains
-->
2.3 基因缺失突变均降低对水稻种子的抑制作用
水稻基腐病菌具有抑制水稻种子萌发生根的作用[1],本研究显示,野生菌株EC1对水稻种子萌发具有很强的抑制作用,其处理后种子萌发基本上不长根,而突变体ΔflhDC和ΔfliA则显著降低了对水稻种子萌发的抑制作用,其处理后水稻种子萌发的根、芽长度与对照CK基本相似(图2),表明flhDC和fliA具有影响水稻种子萌发的作用。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2EC1、ΔflhDC和ΔfliA对水稻种子萌发的影响
-->Fig. 2The inhibition on rice seed germination by EC1, ΔflhDC and ΔfliA
-->
2.4 ΔflhDC和ΔfliA对烟草的过敏反应和水稻的致病力
HR测定结果显示,ΔflhDC、ΔfliA同野生型菌株EC1一样,能够在烟草上激发HR反应(图3)。然而,水稻苗期灌根接种的结果显示,接种野生菌株EC1的水稻茎基部出现大面积的黑褐色病斑,且病部腐烂程度较严重,而接种突变体的水稻植株只在针刺部位的周围产生水渍褐斑,且腐烂程度轻微(图4),说明ΔflhDC、ΔfliA突变体显著降低了对水稻的致病力。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3EC1、ΔflhDC和ΔfliA的烟草过敏性反应
-->Fig. 3Hypersensitive response of EC1, ΔflhDC and ΔfliA on tobacco
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4EC1、ΔflhDC和ΔfliA接种水稻1周后症状
-->Fig. 4Symptoms on rice plant after one week inoculation by EC1, ΔflhDC and ΔfliA
-->
2.5 ΔflhDC和ΔfliA中下游基因表达调控分析
琼脂糖凝胶电泳(未显示)和核酸定量检测结果(A260/A280为2.0左右,A260/A230>2.0)表明,所提取的细菌总RNA质量高,可用于后续相对表达量分析。相对定量基因表达结果显示,flhDC基因缺失突变后,细菌的flhD和flhC不能转录,但fliA和fliC的表达量明显下降;然而,在突变体菌株ΔfliA中,flhD、flhC和fliA等3个基因均不能转录,fliC表达明显下调(图5)。推测编码鞭毛特异性σ28因子fliA也许通过影响flhDC,从而调节flhD、flhC和fliC。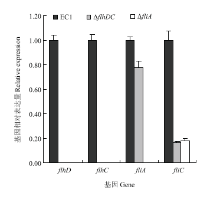 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5qRT-PCR检测ΔflhDC和ΔfliA 中的flhD、flhC、fliA及fliC的相对表达量
-->Fig. 5Relative expression of flhD, flhC, fliA and fliC in ΔflhDC and ΔfliA by qRT-PCR
-->
3 讨论
鞭毛是细菌的重要组成结构,也是动植物病原细菌重要的毒性因子[24-25]。大量研究表明,鞭毛的有无对细菌的运动性和生物膜形成有至关重要的作用。王瑶等[26]研究证实了假结核耶尔森氏菌(Yersinia pseudotuberculosis)的flhDC对细菌运动性和第二级调控基因fliA的调控作用,发现了FlhDC具有调控细菌运动性和生物膜形成的功能。本研究中水稻基腐病菌flhDC、fliA基因突变体同样引起细菌的运动性减弱,生物膜减少等表型的变化,其原因可能由于细菌鞭毛的破坏所引起的生物学表型的变化。然而,有些不运动的细菌也能形成很强的生物膜,在大肠杆菌K-12菌株中,鞭毛的运动性对黏附的起始和生物膜的发育并不是必需的[27]。对于D. zeae,是其运动性本身还是鞭毛的有无对生物膜的影响,有待于进一步研究。不少研究证明,鞭毛基因家族是细菌潜在的致病因子[28]。在根癌土壤杆菌(Agrobacterium tumefaciens)中,失去鞭毛的突变体在向日葵上的致病力减弱[29];在类鼻疽伯克氏菌(Burkholderia pseudomallei)强毒株KHW中研究发现,fliC缺失突变株没有鞭毛,在半固体培养基上无运动性,且毒力显著减弱[30]。本研究发现,突变体ΔflhDC和ΔfliA对水稻的致病力减弱、且运动性和生物膜形成的能力,相对野生菌也表现明显地减弱,但相关致病因子,如毒素、果胶酶、蛋白酶和纤维素酶等活性却与野生型菌株差异不显著,并能引起烟草HR,因此,笔者认为水稻基腐病菌的致病力降低可能由于flhDC与fliA的基因突变导致鞭毛的缺失,影响细菌的运动性和黏附性,从而影响病原菌的早期侵染,还需进一步验证。
细菌的鞭毛具有非常复杂的结构,由很多基因参与其合成调控。已知参与E. coli鞭毛合成的基因就有50多个,成簇排列共同构成鞭毛生物合成的级联调控系统[5];参与水稻黄单胞菌(Xanthomonas oryzae pv. oryzae)鞭毛组装与调控的基因位于一个由60个基因组成的鞭毛基因簇中,fleQ作为一个主要的调控因子,与σ54协同作用调控细菌鞭毛的合成或运动性[31-32]。前人研究发现,表达鞭毛特异性因子σ28的基因fliA具有非常重要的作用,在它的控制下,晚期基因能够表达从而组装后一阶段的鞭毛结构,σ28不仅对晚期基因表达是必需的,它的过量表达还能够增强所有中期基因的表达,而在缺少fliA时,flhDC操纵子能够自我抑制[7,33]。另据研究表明,σ28也能够激活自身启动子[34],因此,环境信号刺激flhDC操纵子表达产生的σ28能够激活flhDC操纵子的进一步表达而产生更多的包括σ28在内的中期基因的表达,而过量的σ28在转录晚期基因的同时又刺激flhDC操纵子及中期基因的表达,这就形成了完整的循环[34]。本研究中,flhDC基因缺失突变后细菌的flhD和flhC不能转录,fliA和fliC表达下调;但fliA基因缺失突变后,flhD、flhC和fliA均不能转录,fliC表达下调。由此,笔者推测编码鞭毛特异性σ28因子fliA也许通过影响flhDC操纵子,从而调节flhD、flhC、fliC及下游基因,与缺少fliA时,flhDC操纵子能够自我抑制[7,34]的结果相符,但flhDC、fliA对其他鞭毛基因的影响,还需进一步研究验证。
4 结论
调控细菌鞭毛基因表达的主调控因子flhDC操纵子,以及表达鞭毛特异性因子σ28基因fliA,是细菌鞭毛系统基因簇的重要组分。flhDC和fliA显著影响水稻基腐病菌的运动性、生物膜形成能力和对水稻种子萌发的功能,在该病菌的致病性中起重要作用。The authors have declared that no competing interests exist.
