0 引言
【研究意义】蜜蜂是一种真社会性昆虫,其内部具有一套十分完整的信息交流系统,保证群体与个体能够正常生长、发育与繁衍[1]。研究蜜蜂蜂群内部的信息交流机制是深入探索其社会性的重要内容,也可为人类及其他动物的社会性研究提供科学借鉴。【前人研究进展】蜜蜂的信息交流主要分为舞蹈语言系统与化学语言系统。其中蜜蜂信息素是蜂群内社会管理、婚飞交尾、个体交流以及报警防卫等主要交流媒介[2-6]。例如,蜂王利用反式-9-氧代-2-癸烯酸((2E)- 9-oxodecenoic acid)等9种蜂王信息素来引起工蜂的侍从行为、雄蜂的追逐行为以及参与蜂群的社会管理[7-9];工蜂利用牻牛儿醇(geraniol)、橙花醛(neral)和金合欢醇(farnesol)信息素招引处女王与工蜂回巢,招引本群的工蜂结团,以及招引其他工蜂前来采集[10-11];而蜜蜂幼虫利用甲基棕榈酸酯(methyl palmitate)与甲基油酸酯(methyl oleate)等10种表皮信息素可以诱导工蜂封盖幼虫巢房行为与刺激工蜂出巢采集等[12]。在正常蜂群中,哺育蜂每天需要饲喂大量幼虫以保证整个蜂群的正常繁衍。HE等[13]研究表明工蜂幼虫利用信息素E-β-罗勒烯(E-β-ocimene,C10H16)向其哺育蜂乞求食物,并发现了该饥饿信息素(hunger pheromone)的生物合成通路。然而,蜂群中含有蜂王、工蜂与雄蜂,称为三型蜂,它们在发育过程中所需的食物存在明显差异。蜂王幼虫在5 d饲喂期均食用蜂王浆,而工蜂与雄蜂幼虫在1—3日龄时采食工蜂浆与雄蜂浆,4—5日龄采食蜂蜜与花粉混合而成的蜂粮[14]。有研究表明蜂王浆与工蜂浆及雄蜂浆成分不同,且即使是同一类型的蜜蜂幼虫,每天采食的王浆在成分与数量上也存在显著差异[14-17]。【本研究切入点】蜂王与雄蜂幼虫如何进行乞食,其乞食信息素成分是否有所不同?哺育蜂又是如何区分三型蜂幼虫以及其日龄,并饲喂以不同成分的食物的?针对上述问题,利用Needle trap与气质联用技术,分析鉴定蜂王与雄蜂幼虫的饥饿信息素,并利用RNA-Seq技术分析鉴定蜂王与雄蜂幼虫饥饿信息素的生物合成通路。【拟解决的关键问题】通过分析鉴定蜂王与雄蜂幼虫的饥饿信息素,并对比两者之间的饥饿信息素差异,从而深入探索蜂群内蜜蜂幼虫的乞食行为及哺育蜂的饲喂行为机制。1 材料与方法
信息素鉴定试验于2014年4—6月在南京中医药大学完成,转录组测序试验于2014年4—7月在北京百迈克生物科技有限公司完成。1.1 供试昆虫
信息素鉴定试验使用3个西方蜜蜂(Apis mellifera)种群,饲养于南京中医药大学(32.6°N,118.56 °E)。RNA-Seq试验使用西方蜜蜂3个种群,饲养于江西农业大学蜜蜂研究所(28.46°N,115.49 °E)。试验蜜蜂蜂群参照西方蜜蜂的营养标准进行饲养[18]。1.2 气质联用标准曲线的建立
利用捕集针(Needle trap)系统(德国PAS科技公司)与气质联用仪(安捷伦公司,7890A/5975C)结合来鉴定并精确定量蜜蜂饥饿信息素,在试验前首先建立了标准曲线。从Sigma公司购得内标物1-壬烯(CAS:124-11-8,C9H18,纯度>99.5%)与标准物E-β-罗勒烯(CAS:13877-91-3,C10H16,纯度>90%)。将2 μL的1-壬烯配入20 mL的无水乙醇(南京化学试剂股份有限公司,分析纯)中,并分为6组,每组分别加入0、1、2、4、8和16 μL的E-β-罗勒烯,振荡搅匀。用移液枪从各组中选取2 μL溶液,并迅速移入20 mL采样瓶中,封盖后立即放入35℃培养箱(扬州三发电子有限公司,SHP-250)中放置45 min。然后利用捕集针从采样瓶中吸取10 mL气体,注入气质联用仪进行分析。结果表明DB-5与VOC的标准曲线R2值为0.9916与0.9926,均>0.99,符合气质联用一般的曲线标准[19]。1.3 幼虫样品的采集
利用免移虫产卵技术[20-21],控王产卵12 h,并将卵移到王台中进行培育蜂王,在2日龄与4日龄幼虫期取蜂王幼虫,做进一步试验分析;利用同群已婚飞交尾的成年蜂王,在预先准备好的雄蜂巢脾上控王产卵12 h。控王产卵时,将蜂王用隔王栅隔离在单一的雄蜂巢脾上,并放在蜜蜂平箱群所有巢脾的最内侧,使其产卵。在雄蜂幼虫发育到2日龄与4日龄幼虫期,采集样品进行试验。信息素鉴定试验中,利用移虫针在30℃室温条件下采集20只2日龄蜂王或雄蜂幼虫,立即放入20 mL采样瓶中,并迅速加入2 μL 1-壬烯内标溶液(v﹕v=1﹕10 000)。在35℃的培养箱中放置45 min,作为饥饿幼虫组;另外采集20只幼虫,放入之前已经铺好2日龄蜂王浆或雄蜂浆的采样瓶中,使每只幼虫横躺在王浆表面,加入内标后放置到培养箱45 min,作为饲喂组;最后采集2日龄蜂王浆或雄蜂浆到采样瓶中,作为对照组。饥饿45 min后,利用捕集针从采样瓶中采集10 mL气体,并注入气质联用仪进行分析。每个样品采集时间严格控制在5 min内。每组样品采集12个平行样,其中6个样品由DVB、PDMS与CAR1000捕集针采集,剩余6个样品由脂肪酸型捕集针采集。由于4日龄工蜂个体较大,每个样品只采集10只幼虫。
分别取2日龄与4日龄蜂王、雄蜂幼虫,进行饥饿与饲喂处理45 min,然后立即液氮冷冻,用于RNA-Seq试验。
1.4 Needle Trap与GC-MS分析
利用捕集针(Needle trap)技术与气质联用系统分析鉴定蜂王与雄蜂幼虫饥饿信息素。将捕集针一头插入密闭的20 mL采样瓶,一头连接采集器,从采样瓶中抽取气体。本试验利用20 MPa的压强以5 mL·min-1的速度从采样瓶中采集10 mL气体。采集时将采样瓶放入35℃的温控装置中恒温采集。捕集针为极性(DVB、PDMS与CAR1000)与非极性(脂肪酸)两种,分别配对DB-5(长度30 m,直径25 μm)与VOC柱子(长度30 m,直径25 μm)分离柱。采集好的捕集针立即注入安捷伦公司生产的7890A/5975C型气质联用仪。通过摸索,按如下最佳程序进样分析:进样口温度为250℃;柱温程序为35℃保持2 min,然后以8℃·min-1的速度从35℃上升至250℃,最后250℃保持5 min。离子源为电子轰击源(electron impact ionization,EI),流动相为氦气。氦气气压保持6.7776 psi。获得的化学物质离子图谱采用NIST32I数据库进行比对,最终鉴定出捕集针中所吸附的挥发性化学物质。在进样时取一个1 mL容量的无菌注射器,从气质联用仪中抽取1 mL氦气,然后与采集完样品的捕集针相连,并手动插入气质联用仪的进样口,30 s内将1 mL氦气缓缓注入气质联用仪。该处理可使捕集针中的化学物质完全洗脱,进入气质联用仪分析。
1.5 RNA-Seq
采集蜂王与雄蜂2日龄与4日龄幼虫的饥饿组与饲喂组幼虫,进行RNA-Seq测序,获得饥饿信息素的生物合成通路与调控基因。按标准TRlzol Reagent方法提取RNA(Life technologies,California,USA),用于RNA-Seq测序分析。利用3群西方蜂群,每个试验组含有3个生物学重复。首先,利用TRlzol法提取样品的总RNA,再通过NEBNext Poly(A) mRNA磁性分离技术(NEB,E7490)分离出所需的mRNA。将mRNA反转录为cDNA,并连接到Illumina上构建上机文库。制备好的文库用1.8%琼脂糖凝胶电泳进行检测文库插入片段大小,然后用Library Quantification Kit-Illumina GA Universal (Kapa,KK4824)进行qPCR定量。检测合格的文库在illuminacbot上进行簇的生成,最后用Illumina HiSeqTM 2500进行测序。
为了保证测序结果的高度准确性,去除了未知碱基比率>5%的reads,只保留测序错误率<1%的reads(Q20>98%)。然后利用Tophat2软件[22]将所获得的所有clean reads与蜜蜂基因组(OGSv3.2)进行比对。比对后的各个基因对应的reads在cufflinks软件[23]中对其表达量水平进行估计,并以FPKM值来记录每个基因的表达量。最后,利用DESeq差异分析与Q-value统计方法来比对饥饿组与饲喂组之间基因的reads数,最终获得差异表达基因。当FDR值<0.05且lg2≥1.5时,即为基因表达存在显著差异[24]。使用BLAST软件对提取的基因序列与nr、SwissProt、GO、COG与KEGG数据库进行比对,获得各基因的注释信息。
1.6 数据统计方法
气质联用实验所获得的数据全部利用“ANOVA or ANCOVA”在Statview 5.01(SAS Institute,Cary,NC,USA)软件中进行比较分析。2 结果
2.1 蜂王与雄蜂幼虫饥饿信息素鉴定
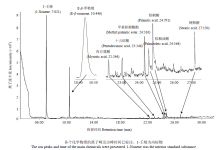
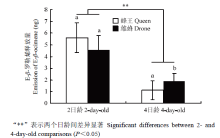
通过Needle trap与气质联用系统分析,从2日龄与4日龄的雄蜂幼虫中获得了9个化学物质:E-β-罗勒烯(E-β-ocimene)、肉豆蔻酸(myristic acid)、棕榈酸(palmitic acid)、甲基棕榈酸脂(methyl palmitic ester)、硬脂酸(stearic acid)、棕榈油酸(palmitoleic acid)、十五烷酸(pentadecanoic acid)、乙酸(acetic acid)、乙酸乙酯(ethyl acetate),与其对应标准物的离子图谱匹配率均高于78%(表1、图1、图2)。在蜂王幼虫中,除了发现这9种化学物质,还发现了一种特殊的化学物质,即2-庚酮(2-haptanone)(表1)。同时,图3表明,E-β-罗勒烯是雄蜂与蜂王幼虫中唯一在饥饿组中的释放量显著高于饲喂组的信息素,且在蜂王浆中未测到任何E-β-罗勒烯,表明蜂王与雄蜂幼虫饥饿信息素为E-β-罗勒烯。在饥饿幼虫组对比中,2日龄的蜂王与雄蜂幼虫E-β-罗勒烯含量没有差异,而4日龄组对比中,蜂王幼虫的E-β-罗勒烯含量显著低于雄蜂幼虫组。值得注意的是,2日龄饥饿幼虫组E-β-罗勒烯释放量显著高于4日龄饥饿幼虫组(图4)。Table 1
表1
表1气质联用所测单只西方蜜蜂蜂王与雄蜂幼虫释放的化学物质及含量
Table 1Ten chemicals detected in each treatment by Needle trap and GC-MS from one queen or drone larva of A. mellifera
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图12日龄西方蜜蜂蜂王饲喂组幼虫VOC色谱柱气质联用总离子图
-->Fig. 1Total ion chromatogram of chemicals from 2-day-old fed queen larvae of A. mellifera by using VOC chromatographic column
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图22日龄西方蜜蜂蜂王饥饿组幼虫DB-5色谱柱气质联用总离子图
-->Fig. 2Total ion chromatogram of chemicals from 2-day-old starving queen larvae of A. mellifera by using DB-5 chromatographic column
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图32日龄(A)与4日龄(B)西方蜜蜂蜂王与雄蜂幼虫E-β-罗勒烯单只幼虫释放量
-->Fig. 3Emission of E-β-ocimene from a 2- and 4-day-old queen and drone larva of A. mellifera
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4西方蜜蜂蜂王与雄蜂饥饿组幼虫E-β-罗勒烯含量对比
-->Fig. 4Comparison of E-β-ocimene from a queen and drone larva of A. mellifera
-->
2.2 蜂王与雄蜂幼虫饥饿组与饲喂组差异表达基因
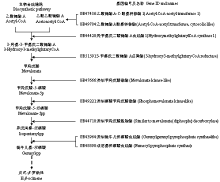
2日龄蜂王幼虫饥饿组与饲喂组差异基因为6个,4日龄对比组为287个;2日龄雄蜂幼虫饥饿组与饲喂组差异基因为8个,4日龄对比组为0个。这些差异基因中,未发现任何基因与幼虫的信息素合成相关。蜂王幼虫与雄蜂幼虫具有一条从头合成E-β-罗勒烯的生物合成通路(图5),表明E-β-罗勒烯在幼虫体内由乙酰辅酶A经甲羟戊酸途径合成,这与工蜂幼虫E-β-罗勒烯的生物合成通路相同[13]。参与该通路的9个基因在饥饿组与饲喂组中均表达差异不显著(表2)。
Table 2
表2
表2蜂王与雄蜂幼虫E-β-罗勒烯合成通路基因基因表达
Table 2The expression of E-β-ocimene biosynthetic pathway genes between fed and starving larvae in queen and drone larvae
| 基因编号 Gene ID | 饲喂幼虫组vs饥饿幼虫组 Fed larvae vs starving larvae | FDR值 FDR value | lg2 FC值 lg2 FC value | 基因注释 Annotation | |
|---|---|---|---|---|---|
| 幼虫组别 Larval groups | 日龄Day-old | ||||
| GB47436 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.088 | Acetyl-CoA-C-acetyl transferase 1 [A. mellifera] |
| 4 | 0.067 | 0.470 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.009 | ||
| 4 | 1 | -0.129 | |||
| GB49784 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.107 | Acetyl-CoA acetyl transferase, cytosolic-like [A. mellifera] |
| 4 | 0.954 | -0.026 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.054 | ||
| 4 | 1 | -0.205 | |||
| GB44420 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.185 | PREDICTED: Hydroxymethylglutaryl-CoA synthase 1[A. mellifera] |
| 4 | 0.422 | -0.253 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.105 | ||
| 4 | 1 | 0.039 | |||
| GB51591 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.006 | PREDICTED: 3-hydroxy-3-methylglutaryl-coenzyme A reductase[A. mellifera] |
| 4 | 0.459 | -0.210 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.010 | ||
| 4 | 1 | 0.031 | |||
| GB47666 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.116 | PREDICTED: Mevalonate kinase-like [A. mellifera] |
| 4 | 0.137 | 0.428 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | 0.050 | ||
| 4 | 1 | -0.259 | |||
| GB49221 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.071 | PREDICTED: phosphomevalonate kinase-like [A. mellifera] |
| 4 | 0.192 | -0.506 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.191 | ||
| 4 | 1 | -0.028 | |||
| GB44718 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.042 | Similar to mevalonate (diphospho) decarboxylase [A. mellifera] |
| 4 | 0.998 | 0.010 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.129 | ||
| 4 | 1 | -0.028 | |||
| GB48898 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.062 | PREDICTED: Farnesyl pyrophosphate synthase [A. mellifera] |
| 4 | 0.447 | 0.201 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | 0.083 | ||
| 4 | 1 | -0.001 | |||
| GB43964 | 蜂王幼虫对比组 Queen larval comparison | 2 | 1 | -0.037 | PREDICTED: Geranylgeranyl pyrophosphate synthase-like [A. mellifera] |
| 4 | 0.268 | 0.397 | |||
| 雄蜂幼虫对比组 Drone larval comparison | 2 | 1 | -0.150 | ||
| 4 | 1 | -0.097 | |||
新窗口打开
3 讨论
信息素是蜜蜂幼虫与成年蜂之间的重要交流方式[12,25]。本研究鉴定分析出蜂王与雄蜂幼虫饥饿信息素的主要成分为E-β-罗勒烯,这与工蜂幼虫饥饿信息素成分相同[13]。前人研究表明,蜂王幼虫采食5 d蜂王浆,而雄蜂幼虫采食3 d雄蜂浆,后2 d采食蜂粮。即使在1—3日龄,蜂王浆与雄蜂浆成分也不同[14]。图4表明2日龄时蜂王与雄蜂幼虫释放的罗勒烯并无显著差异。那么哺育蜂是如何在黑暗的蜂箱中分辨出蜂王与雄蜂幼虫,并饲喂其所需的各种食物的?有研究表明,蜂王在产卵过程中,先利用其触角与前足丈量巢房的大小,再进行产受精卵或未受精卵[26]。因此,推测哺育蜂也可能利用相似的测量来分辨巢房大小,进而饲喂不同食物。有趣的是,蜂王幼虫含有独特的2-庚酮这类物质。该信息素是工蜂上颚腺分泌的标记信息素,主要用于标记蜂巢的巢门方向与采集的花朵上,同时也可作为标记敌人的报警信息素[27-29]。因此,哺育蜂也可能利用2-庚酮标记需要饲喂的蜂王幼虫,从而引导其他哺育蜂对蜂王幼虫进行准确定位与饲喂。本试验表明2日龄蜂王与雄蜂幼虫释放E-β-罗勒烯量均显著高于与其4日龄幼虫,这与前人在不同日龄工蜂幼虫中测得的E-β-罗勒烯量相一致[13,30]。哺育蜂是否可通过感知E-β-罗勒烯不同释放量来区分幼虫的日龄,仍需进一步研究。蜂王4日龄幼虫E-β-罗勒烯释放量显著低于4日龄雄蜂幼虫,这可能是由于蜂王幼虫采食蜂王浆且个体较大,其耐饿性较强,从而在饥饿处理状态下E-β-罗勒烯释放量较低。
蜂王幼虫与雄蜂幼虫的E-β-罗勒烯由乙酰辅酶A与乙酰乙酰辅酶A通过甲羟戊酸途径合成(图5)。这一单萜生物合成途径是一条十分保守的途径,在其他昆虫与植物中均发现了相似的合成途径与同源基因[31-32]。因此,蜜蜂幼虫通过该生物合成通路从头合成E-β-罗勒烯,然而饥饿幼虫组的E-β-罗勒烯通路相关基因的表达量与其饲喂组并无显著差异。这可能是E-β-罗勒烯的合成量只有几纳克,其基因表达量较低,不能直观地从基因表达中表现出来。同时,饲喂幼虫也释放E-β-罗勒烯,从而减小了与饥饿组的基因表达差异。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5蜂王与雄蜂幼虫E-β-罗勒烯的生物合成通路
-->Fig. 5The biosynthetic pathway for E-β-ocimene in queen and drone larvae
-->
4 结论
利用Needle trap与气质联用技术分析鉴定出了蜜蜂蜂王与雄蜂幼虫的饥饿信息素为E-β-罗勒烯,并且利用RNA-Seq技术证实在幼虫体内通过甲羟戊酸途径从头合成该信息素。蜂王具有一种特有的信息素——2-庚酮。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
