 ,1, 李亚子1, 吴涵1, 赵丹
,1, 李亚子1, 吴涵1, 赵丹 ,1, 郭巍
,1, 郭巍 ,1,2, 郭晓昌1
,1,2, 郭晓昌1Cloning, Expression and Functional Analysis of SeDuox from Spodoptera exigua
FU ChaoRan ,1, LI YaZi1, WU Han1, ZHAO Dan
,1, LI YaZi1, WU Han1, ZHAO Dan ,1, GUO Wei
,1, GUO Wei ,1,2, GUO XiaoChang1
,1,2, GUO XiaoChang1通讯作者:
责任编辑: 岳梅
收稿日期:2021-01-4接受日期:2021-02-7
| 基金资助: |
Received:2021-01-4Accepted:2021-02-7
作者简介 About authors
付超然,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2222KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
付超然, 李亚子, 吴涵, 赵丹, 郭巍, 郭晓昌. 甜菜夜蛾双重氧化酶基因SeDuox的克隆、表达及功能分析. 中国农业科学, 2021, 54(18): 3881-3891 doi:10.3864/j.issn.0578-1752.2021.18.008
FU ChaoRan, LI YaZi, WU Han, ZHAO Dan, GUO Wei, GUO XiaoChang.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】甜菜夜蛾(Spodoptera exigua)属鳞翅目(Lepidoptera)夜蛾科(Noctuidae),是一种世界性分布的多食性重要农业害虫,农业生产中通常采用化学防治,以及以苏云金杆菌(Bacillus thuringiensis,Bt)为代表的生物制剂等进行防治[1]。近年来利用免疫系统对昆虫进行生物防治的概念逐渐被提出,因此研究甜菜夜蛾的肠道免疫系统对其进行生物防控具有重要意义。Duox-ROS系统是昆虫调节肠道微生物动态平衡的重要免疫机制,然而,甜菜夜蛾双重氧化酶(SeDuox)的生物学功能及其对病原微生物的免疫响应尚不清楚。以甜菜夜蛾为研究对象,研究SeDuox在宿主肠道免疫调控中的作用,以及Bt对昆虫免疫基因的影响,可为甜菜夜蛾的综合防控提供新的思路和作用靶标。【前人研究进展】昆虫是世界上种类最丰富、数量庞大且分布广泛的动物[2],在生命过程接触到很多病原体,主要通过昆虫摄食进入体内,昆虫通常依靠先天性免疫系统或肠道免疫系统抵御病原微生物的入侵[3,4,5],肠道是昆虫机体免疫反应的第一场所[6]。同时,昆虫肠道上栖息着大量有利于宿主生长发育繁殖等功能的肠道共生微生物[7,8]。昆虫具有独特的肠道免疫防御系统,防御肠道病原微生物的同时又能维持肠道共生菌动态平衡,主要包括物理屏障、Imd信号通路产生的抗菌肽AMP以及Duox介导的活性氧(ROS)系统[9,10]。其中,Duox介导产生的ROS具有杀菌活性,是昆虫肠道上皮细胞中重要的杀灭病原微生物的效应分子[11,12,13]。Duox作为烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶家族成员之一,其功能比较保守[14]。Duox属于跨膜蛋白,通常包括铁还原酶结构域(Ferric)、烟酰胺腺嘌呤二核苷酸结构域(NAD)、N-端钙离子结合域(EFH)、黄素腺嘌呤二核苷酸结构域(FAD)和过氧化物酶结构域[15]。目前,在果蝇、冈比亚按蚊(Anopheles gambiae)等昆虫中证明Duox-ROS系统在维持肠道微生物稳态中发挥重要作用。HA等研究发现双重氧化酶敲除型Duox-KD果蝇,在肠道感染条件下不能诱导产生ROS,病原微生物不能被有效清除,说明在果蝇肠道上皮细胞中杀灭病原微生物的效应分子ROS是由Duox介导产生的,从而维持果蝇肠道微生物动态平衡[12,13]。当橘小实蝇(Bactrocera dorsalis)取食病原菌和肠道共生菌后,导致BdDuox表达量和ROS水平显著上调,利用RNAi沉默BdDuox表达,致使肠道细菌群落稳态紊乱,表明BdDuox在橘小实蝇肠道免疫调控中发挥了重要作用[16]。家蚕(Bombyx mori)感染家蚕微孢子虫后能够诱导基因持续上调表达,同时细胞内ROS含量增加,说明BmDuox可能参与宿主肠上皮对家蚕微孢子虫的免疫反应[17]。WEI等研究发现,球孢白僵菌(Beauveria bassiana)通过体壁侵染斯氏按蚊(Anopheles stephens)后,肠道细菌数量显著增多,造成蚊虫肠道菌群失衡,并显著抑制中肠Duox和抗菌肽相关基因的表达[18]。最新研究发现,Bt可以激活小菜蛾(Plutella xylostella)Toll、IMD、JNK等多条免疫信号通路[19]。细菌分泌的尿嘧啶可以激活Duox介导产生ROS,然而与宿主长期协同进化的肠道共生菌丧失分泌尿嘧啶的能力,只有外来病原微生物才可以分泌尿嘧啶,宿主可能是通过此方式将肠道共生菌和病原菌区分开来,以此维持其肠道微生物群落稳态平衡[20]。【本研究切入点】双重氧化酶(Duox)在一些昆虫肠道免疫中发挥重要作用,但其在甜菜夜蛾肠道免疫调控中的作用机理,以及Bt与肠道免疫基因的相互作用关系尚未明确。【拟解决的关键问题】以甜菜夜蛾为研究对象,通过基因克隆获得SeDuox全长基因并进行序列分析,利用实时荧光定量PCR(RT-qPCR)方法进行SeDuox时空表达分析。RNAi技术沉默SeDuox,研究SeDuox生物学功能及其对肠道菌群的调控作用,并分析Bt GS36对SeDuox及抗菌肽相关基因的表达调控,以期明确SeDuox在宿主肠道免疫调控中的作用,为甜菜夜蛾绿色防控提供理论指导。1 材料与方法
试验于2018年11月至2020年11月在河北农业大学昆虫分子生物学实验室完成。1.1 材料
供试甜菜夜蛾为河北农业大学害虫生物防治实验室人工饲养。饲养条件:温度(26±1)℃,培养箱内的培养相对湿度保持在(65±15)%,光周期为14L﹕10D。Trans1-T1感受态细胞购于TransGen公司;大肠杆菌(Escherichia coli)DH5α感受态细胞购于TaKaRa公司;大肠杆菌DH10Bac感受态细胞购于Invitrogen公司;Bt GS36由本实验室保存。pEASY-Blunt克隆载体购于TransGen公司;pFastBacTM HTA购自Invitrogen公司。
草地贪夜蛾(Spodoptera frugiperda)细胞系(Sf9)由本实验室保存。
1.2 RNA的提取与cDNA的合成
利用RNA提取试剂盒(TIAGEN公司)提取甜菜夜蛾不同发育时期(卵、1—5龄幼虫、雄蛹、雌蛹)及4龄幼虫不同组织(围食膜、血淋巴、脂肪体、马氏管、中肠和表皮)的总RNA,琼脂糖凝胶电泳(TIAGEN公司)和微量分光光度计(Eppendorf公司)检测RNA的质量和浓度。利用反转录试剂盒获得cDNA。1.3 SeDuox全长基因的克隆
根据甜菜夜蛾中肠转录组数据库获得SeDuox全长基因序列,利用DNAMAN V6.0软件设计基因特异引物SeDuox-F和SeDuox-R,引物序列见表1。以甜菜夜蛾幼虫中肠cDNA为模板进行PCR扩增,琼脂糖凝胶电泳检测,PCR产物纯化回收后连接到pEASY-Blunt克隆载体并转入Trans1-T1感受态细胞,经过PCR和酶切鉴定获得的阳性克隆质粒送到华大公司(BGI)测序。Table 1
表1
表1引物信息
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence |
|---|---|
| SeDuox-F | GGTTCAACAATAGAGCTTACCC |
| SeDuox-R | TGACTTGCTCGCATGCGGACAT |
| SeDuox-OM-F | CGGATCCGCCAGAAGTGTACTACGAGAAGC |
| SeDuox-OM-R | CGGAATTCGTTGCCCTCGAAGTAGTCATAG |
| SeActin-F | CTACCTCACGCCATTCTC |
| SeActin-R | AACCTGAGTCTTTGTGTACCTCC |
| SeqPCR-F | CGTATACTAATGGACCAGGTTTTCG |
| SeqPCR-R | AACCTGAGTCTTTGTGTACCTCC |
| dsSeDuox-T7-F | TAATACGACTCACTATAGGCCGCCATACTACTGA GAGAC |
| dsSeDuox-T7-R | TAATACGACTCACTATAGGGATGACCCGTGGATT CTAAC |
| dsSeDuox-F | CCGCCATACTACTGAGAGAC |
| dsSeDuox-R | GATGACCCGTGGATTCTAAC |
| dsGFP-T7-F | TAATACGACTCACTATAGGCCACAAGTTCAGCGT GT |
| dsGFP-T7-R | TAATACGACTCACTATAGGAGTTCACCTTGATGC CG |
| dsGFP-F | CCACAAGTTCAGCGTGT |
| dsGFP-R | AGTTCACCTTGATGCCG |
| 16S-F | TCCTACGGGAGGCAGCAGT |
| 16S-R | GGACTACCAGGGTATCTAATCCTGTT |
| Attacin-F | GGACTGACCGTGATGAAGG |
| Attacin-R | CGTTGTGGTTGTCGTTGTG |
| Definsin-F | GACTTGGACGCGAAATTGA |
| Definsin-R | TGGTAGACAATGCTCCTGG |
| PGRP-F | CACTCGAACTTGCAATACGG |
| PGRP-R | ACCAATCACGAACGAGGACC |
| Es-F | CCCTTATTGTTAGTTGCCATCATT |
| Es-R | ACTCGTTGTACTTCCCATTGT |
| Bc-F | GCCCTGGTATGTATATTGGATCTAC |
| Bc-R | GGTCATAATAACTTCTACAGCAGGA |
| 下划线分别表示酶切位点和T7 RNA聚合酶启动子 Restriction enzyme cutting site and T7 RNA polymerase promoter are underlined | |
新窗口打开|下载CSV
1.4 SeDuox序列分析
对SeDuox序列进行生物信息学分析,通过DNAMAN V6.0软件预测开放阅读框、 编码氨基酸、 蛋白分子量和等电点等; 通过NetNGlyc1.0 Server(1.5 SeDuox-OM片段的克隆与细胞表达
SeDuox为多次跨膜蛋白,针对膜外部分SeDuox-OM(第31—589位氨基酸)进行基因克隆与细胞表达。根据SeDuox-OM序列设计带有酶切位点的扩增引物,分别在其上游与下游加入BamH I和EcoR I酶切位点,引物名称为SeDuox-OM-F和SeDuox- OM-R,引物序列见表1。利用上述引物,以纯化的SeDuox的PCR产物为模板进行PCR扩增。按照Bac- to-Bac® Baculovirus Expression Systems(Invitrogen公司)说明书,利用Bac to Bac 昆虫杆状表达系统在昆虫细胞Sf9中表达SeDuox-OM蛋白。1.6 SeDuox时空表达分析
采用RT-qPCR方法分析甜菜夜蛾不同发育时期和不同组织中SeDuox的转录水平。所用内参基因和目的基因的引物名称分别为SeActin-F和SeActin-R,SeqPCR-F和SeqPCR-R,引物序列见表1。以cDNA为模板,进行RT-qPCR。PCR反应体系(20 μL):SYBR Premix Ex TaqTM 10 μL,目的基因cDNA 1 μL,上下游引物各1 μL,加ddH2O补足体系至20 μL。每个样品进行3次生物学重复。2ΔΔCt法分析SeDuox的相对表达量,计算公式:2ΔΔCt=2-[(Ct目的基因-Ct内参基因)]处理组-[(Ct目的基因-Ct内参基因)]对照组。
利用SPSS软件进行差异显著性分析(t-test,n=3,P<0.01或0.05)。
1.7 SeDuox的RNAi效应
以甜菜夜蛾幼虫中肠cDNA为模板,利用T7 Ribo MAXTM Express RNAi System(Promega)试剂盒合成SeDuox双链RNA(dsSeDuox),绿色荧光蛋白(GFP)为对照,分别以dsSeDuox-T7-F和dsSeDuox-R,dsSeDuox-F和dsSeDuox-T7-R;dsGFP-T7-F和dsGFP-R,dsGFP-F和dsGFP-T7-R为引物PCR扩增获得合成dsRNA的正、反向模板,引物序列见表1,经1.2%琼脂糖凝胶电泳和微量分光光度计检测dsRNA纯度和浓度。选取甜菜夜蛾4龄1 d幼虫为试验对象,用微量注射器将2 μL dsSeDuox(8 μg·μL-1)从幼虫第4—5腹节处缓慢注入至血腔内,注入方向与虫体血淋巴流动方向一致,以注射dsGFP为对照。注射完成后,幼虫于正常条件饲养,分别于48 h和72 h时解剖甜菜夜蛾幼虫中肠组织,提取总RNA,反转录合成cDNA,RT-qPCR检测SeDuox基因沉默情况,反应体系及分析方法同1.6。1.8 SeDuox RNAi对肠道菌群密度的影响
解剖注射dsSeDuox后48、72 h的甜菜夜蛾幼虫含内容物的肠道组织,利用血液/细胞/组织基因组DNA提取试剂盒(TIAGEN公司)提取肠道细菌总DNA,RT-qPCR检测SeDuox干扰后肠道细菌总量、肠道有益菌蒙氏肠球菌(Enterococcus mundtii)及肠道潜在致病菌蜡样芽孢杆菌(Bacillus cereus)总量变化,引物名称分别为16S-F和16S-R,Es-F和Es-R,Bc-F和Bc-R,引物序列见表1,反应体系及分析方法同1.6。1.9 Bt GS36对SeDuox及抗菌肽基因的表达调控
选取对甜菜夜蛾高活性的Bt GS36菌株,利用RT-qPCR方法分析甜菜夜蛾幼虫对Bt的免疫响应。将Bt GS36接种于LB液体培养基,37℃,220 r/min过夜培养。第2天将过夜培养的Bt GS36按1﹕100的比例接种于1/2 LB液体培养基,30℃,220 r/min,38 h时,收集孢晶混合物,保存于-80℃冰箱备用。将100 μL Bt GS36菌液(180 μg·mL-1)均匀涂布于饲料表面,自然风干后,将经过12 h饥饿处理的甜菜夜蛾3龄1 d幼虫放在饲料上。每个处理设置3个生物学重复,每个重复15头试虫,以表面涂布清水的饲料为对照。每隔12 h解剖收集甜菜夜蛾肠道,RT-qPCR分析SeDuox及抗菌肽基因表达量的变化,抗菌肽基因引物为Attacin-F和Attacin-R,Definsin-F和Definsin-R,PGRP-F和PGRP-R,引物序列见表1,反应体系及分析方法同1.6。
2 结果
2.1 SeDuox序列分析
SeDuox(GenBank登录号:MN966681)开放阅读框为4 497 bp,编码1 498个氨基酸,预测蛋白分子量为171.62 kD,等电点为8.81。NetOGlyc 3.1 Server和NetNGlyc1.0 Server预测有12个O-糖基化位点(60TRKT、63TPAS、66SYAD、84TLSK、165SPNS、212TKRV、571SKLP、1121SDFR、1425SRTS、1427TSMF、1428SMFT、1431TGLK),6个N-糖基化位点(101NRTA、198NGSL、540NSTS、569NASK、743NLTQ、1483NRTR)(图1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1SeDuox编码氨基酸序列分析
黑色实线标注的为SeDuox蛋白的信号肽序列,长方形标注为跨膜区,绿色波浪线标注为过氧化物酶结构域,短虚线标注为N-端钙离子结合域,双虚线标注为铁还原酶结构域,双实线标注为黄素腺嘌呤二核苷酸结构域,长虚线标注为烟酰胺腺嘌呤二核苷酸结构域,红色箭头标注为O-糖基化位点,黑色箭头标注为N-糖基化位点
Fig. 1Analysis of amino acid sequence of SeDuox
The signal peptide sequence of SeDuox protein is marked with black solid line, the transmembrane region is labeled with rectangle, the peroxidase domain is labeled with green wavy line, the N-terminal calcium binding domain (EFH) is labeled with short dashed line, the iron reductase binding domain (Ferric) is labeled with double dashed line, the flavin adenie dinucleotide binding domain (FAD) is labeled with double solid line, the nicotinamide adenine dinucleotide binding domain (NAD) is labeled with long dashed line, the O-glycosylation site is marked with the red arrow, and the N-glycosylation site is marked with the black arrow
TMHMM和SMART在线软件预测SeDuox蛋白包括3个跨膜区,含有过氧化物酶结构域、N-端钙离子结合域、铁还原酶结构域、黄素腺嘌呤二核苷酸结构域、烟酰胺腺嘌呤二核苷酸结构域(图2)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2SeDuox蛋白跨膜结构预测和蛋白结构分析
Fig. 2The prediction of transmembrane domain and the domain analysis of the SeDuox
2.2 SeDuox系统发育分析
通过NCBI Blast分析比对可知SeDuox氨基酸序列与近缘物种草地贪夜蛾(GenBank登录号:XP_035439968.1)和斜纹夜蛾(Spodoptera litura)(GenBank登录号:XP_022813998.1)Duox氨基酸序列相似性最高,分别为91.31%和91.51%。从NCBI数据库中下载22种昆虫的Duox氨基酸序列,利用ClustalX软件与SeDuox的氨基酸序列进行同源性比对,MEGA_X软件构建系统发育树(图3)发现SeDuox与斜纹夜蛾、草地贪夜蛾的Duox相似度最高,表明Duox在这几种昆虫中同源性较高,亲缘关系较近。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3甜菜夜蛾与其他昆虫Duox氨基酸序列的系统发育树
Duox物种来源及GenBank登录号Duox species origin and GenBank accession number:Sf:Spodoptera frugiperda草地贪夜蛾 (XP_035439968.1);Sl:Spodoptera litura斜纹夜蛾 (XP_022813998.1);Ha:Helicoverpa armigera 棉铃虫 (XP_021185531.1);Tn:Trichoplusia ni粉纹夜蛾 (XP_026735041.1);Ap:Arctia plantaginis木虎蛾 (CAB3261519.1);Ms:Manduca sexta烟草天蛾 (XP_030030662.1);Of:Ostrinia furnacalis亚洲玉米螟 (XP_028176585.1);At:Amyelois transitella脐橙螟 (XP_013185963.1);Cs:Chilo suppressalis二化螟 (RVE45365.1);Pm:Papilio machaon金凤蝶 (KPJ08497.1);Bm:Bombyx mandarina野桑蚕 (XP_028039402.1);Vt:Vanessa tameamea夏威夷红蛱蝶 (XP_026499659.1);Hm:Heliconius melpomene红带袖蝶 (QDR50917.1);Pr:Pieris rapae菜青虫 (XP_022113852.1);Px:Plutella xylostella小菜蛾 (XP_011558844.1);Dp:Danaus plexippus大红斑蝶 (QDQ16881.1);Pp:Papilio polytes玉带凤蝶 (XP_013145053.1);Cf:Ctenocephalides felis猫蚤 (XP_026480513.1);Aa:Anopheles albimanus淡色按蚊 (XP_035781425.1);Md:Musca domestica家蝇 (XP_005191214.1);Nv:Nicrophorus vespilloides胡蜂 (XP_017784905.1);Zn:Zootermopsis nevadensis湿木白蚁 (XP_021932850.1)
Fig. 3Phylogenetic tree of Duox amino acid sequence of S. exigua and other insects
2.3 SeDuox及SeDuox-OM的克隆与细胞表达
PCR扩增获得SeDuox及其膜外编码基因SeDuox- OM(第31—589位氨基酸),大小分别为4 497和1 677 bp(图4-A、4-B)。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4SeDuox及SeDuox-OM的PCR扩增
A-M:λ-EcoT14 I digest;A-1:SeDuox PCR产物PCR product of SeDuox;B-M:DL2000;B-1:SeDuox-OM PCR产物PCR product of SeDuox-OM
Fig. 4PCR amplification of SeDuox and SeDuox-OM
构建的重组质粒pFastBacTMHTA-SeDuox-OM,经双酶切鉴定载体片段和基因片段大小分别为4 856和1 677 bp(图5-A)。将鉴定正确的重组质粒pFastBacTM HTA-SeDuox-OM转化至DH10 Bac感受态细胞中,挑取单克隆,经PCR鉴定,获得条带大小为4 107 bp,表明重组病毒Bacmid-SeDuox-OM构建成功(图5-B)。鉴定正确的Bacmid-SeDuox-OM经纯化后,利用脂质体转染法转染昆虫细胞Sf9。取转染后72 h的P3病毒上清进行Western blot鉴定。结果表明重组病毒Bacmid-SeDuox-OM成功转染昆虫Sf9细胞,并表达SeDuox-OM蛋白,分子量约为80 kD(图5-C)。
图5
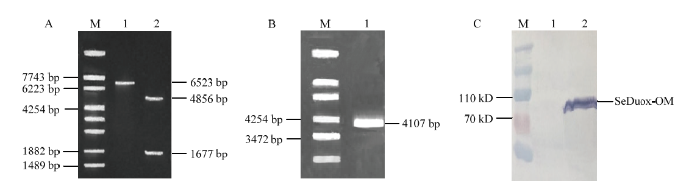 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5重组蛋白SeDuox-OM在昆虫细胞Sf9中的表达
M:λ-EcoT14 I digest;A-1:pFastBacTM HTA-SeDuox-OM重组质粒单酶切 (EcoR I) Enzyme analysis of pFastBacTM HTA-SeDuox-OM recombinant plasmid with EcoR I;A-2:pFastBacTM HTA-SeDuox-OM重组质粒双酶切 (EcoR I & BamH I) Enzyme analysis of pFastBacTM HTA-SeDuox-OM recombinant plasmid with EcoR I & BamH I;B-1:重组Bacmid DNA质粒Recombinant Bacmid DNA plasmid;C-M:蛋白预染Marker Protein predyeing Marker;C-1:未感染病毒的Sf9细胞上清The supernatant of Sf9 cells uninfected with virus;C-2:感染病毒的Sf9细胞上清The supernatant of Sf9 cells infected with virus
Fig. 5Expression of recombinant protein SeDuox-OM in Sf9 cells
2.4 SeDuox表达模式分析
利用RT-qPCR分析SeDuox在甜菜夜蛾4龄幼虫不同组织(围食膜、马氏管、表皮、血淋巴、脂肪体、中肠)和不同发育时期(卵、1—5龄幼虫、雌蛹、雄蛹)的表达水平,结果显示,SeDuox在甜菜夜蛾各组织中均有表达,其中在围食膜和中肠表达量较高(图6-A)。不同发育时期中在卵期表达量最高,1龄幼虫期表达量最低,之后随着龄期增长呈先升高后降低的趋势(图6-B)。图6
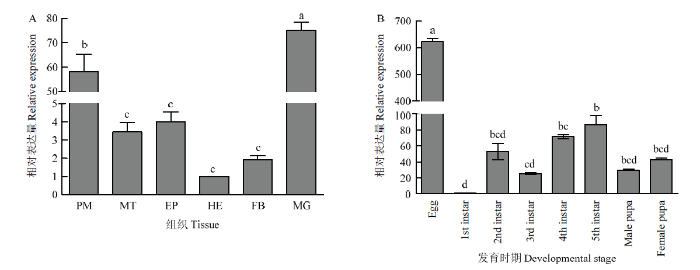 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6SeDuox在甜菜夜蛾不同组织及发育时期的表达
PM:围食膜Peritrophic membrane;MT:马氏管Malpighian tubule;EP:表皮Epidermis;HE:血淋巴Hemolymph;FB:脂肪体Fat body;MG:中肠Midgut;Egg:卵;1st-5th instar:1—5龄幼虫;Male/female pupa:雄/雌蛹
数据代
Fig. 6mRNA expression of SeDuox in different tissues and developmental stages of S. exigua
2.5 SeDuox的RNAi效应
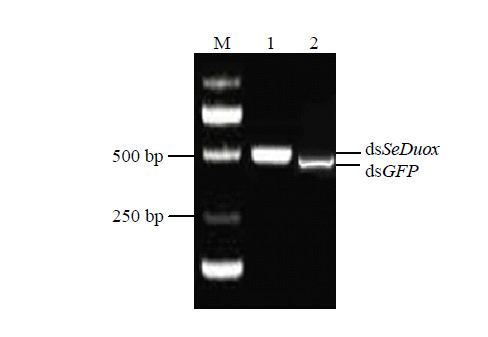
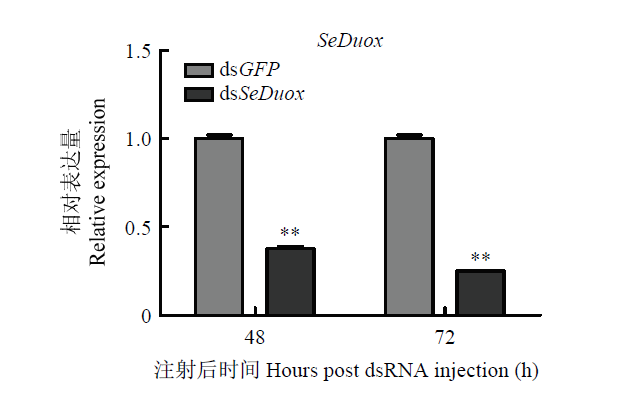
根据试剂盒说明书合成dsSeDuox和dsGFP,利用微量分光光度计检测dsSeDuox和dsGFP的浓度。用1.2%的琼脂糖凝胶电泳进行检测,电泳结果显示dsSeDuox和dsGFP条带大小分别为453和420 bp(图7),可以用于后续试验。向甜菜夜蛾4龄幼虫体内注射dsRNA进行SeDuox基因沉默,相比于dsGFP对照组,甜菜夜蛾被注射dsRNA后的48 h和72 h,SeDuox表达量分别下调了62.08%和74.94%(图8),实现了 SeDuox的沉默。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7甜菜夜蛾dsSeDuox及dsGFP电泳鉴定
M: DL2000; 1: dsRNA-SeDuox; 2: dsRNA-GFP
Fig. 7Electrophoresis detection of dsSeDuox and dsGFP of S. exigua
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8RNAi引起的SeDuox基因沉默效率
数据代
Fig. 8Silencing efficiency of SeDuox induced by RNAi
Data are representative of three independent experiments (mean±SE), *P<0.05, **P<0.01with a Student’s t-test. The same as
2.6 SeDuox基因沉默对肠道菌群的影响
注射dsSeDuox 48 h和72 h,甜菜夜蛾幼虫肠道细菌菌群密度显著高于dsGFP对照组,分别为对照组的55.46倍和7.30倍(图9-A),其中蒙氏肠球菌密度显著降低,48 h和72 h时分别下调了78.99%和75.07%,而蜡样芽孢杆菌密度在72 h时上调了43.75%(图9-B、9-C),推测SeDuox在维持甜菜夜蛾肠道微生物菌群稳态中起重要作用。图9
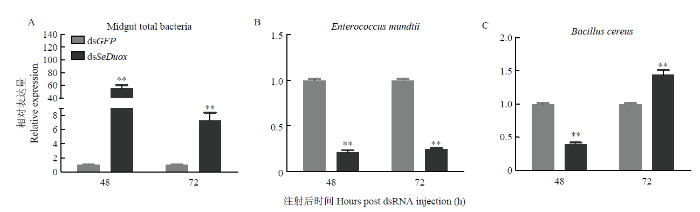 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9SeDuox基因沉默对肠道菌群的影响
A:注射dsSeDuox和dsGFP后的不同时间点,肠道总细菌菌群密度的动态变化The total gut bacterial load at different time points after injecting dsSeDuox and dsGFP;B:注射dsSeDuox和dsGFP后的不同时间点,蒙氏肠球菌总量的动态变化The load of Enterococcus mundtii at different time points after injecting dsSeDuox and dsGFP;C:注射dsSeDuox和dsGFP后的不同时间点,蜡样芽孢杆菌总量的动态变化The load of Bacillus cereus at different time points after injecting dsSeDuox and dsGFP
Fig. 9Effects of SeDuox gene silencing on intestinal flora
2.7 Bt GS36对SeDuox及抗菌肽基因表达的影响
RT-qPCR分析Bt GS36对SeDuox及抗菌肽相关基因表达量的影响。结果显示,与对照组相比,取食Bt GS36 48 h时,甜菜夜蛾幼虫肠道SeDuox的表达量显著增加,之后表达量逐渐降低,而抗菌肽相关基因表达量相对较低,表明此时宿主主要通过提高SeDuox的表达水平产生肠道免疫响应从而抵抗苏云金杆菌的侵染(图10-A);取食Bt GS36后分析不同时间点抗菌肽基因表达水平,结果显示,12 h和24 h时,Attacin表达量显著增加;36 h时,Defensin表达量显著增加;72 h和96 h,PGRP表达量显著增加(图10-B、10-C、10-D)。结果表明,甜菜夜蛾取食Bt GS36后,SeDuox与抗菌肽基因协同作用,调控宿主肠道免疫系统从而抵御苏云金杆菌的侵染。图10
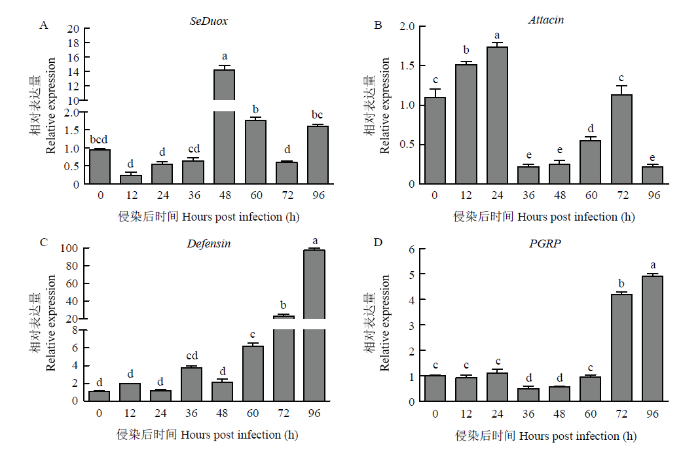 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10Bt GS36对甜菜夜蛾肠道SeDuox及相关抗菌肽基因表达量的影响
Fig. 10Effects of Bt GS36 on the expression of SeDuox and antimicrobial peptides of S. exigua
3 讨论
昆虫肠道上皮细胞为了防御外来致病菌而同时不影响肠道共生菌的稳定,其必须在免疫应激和免疫耐受之间保持一种稳态平衡,及时地响应肠道微生物群落的变化[21]。已有研究证明,由双重氧化酶Duox介导产生的ROS在昆虫肠道免疫中发挥重要作用[12]。而昆虫中Duox蛋白的研究多数关于黑腹果蝇(Drosophila melanogaster)、橘小实蝇等[16,17],SeDuox在甜菜夜蛾肠道中的生物学功能尚不清楚。本研究克隆了SeDuox,其开放阅读框为4 497 bp,编码1 498个氨基酸。利用NCBI Blast分析比对可知SeDuox与鳞翅目昆虫斜纹夜蛾、草地贪夜蛾的相似性较高,主要包括过氧化物酶结构域、烟酰胺腺嘌呤二核苷酸结构域、N-端钙离子结合域、铁还原酶结构域和黄素腺嘌呤二核苷酸结构域,与家蚕、橘小实蝇等多种物种相似,系统发育分析结果也表明Duox在不同物种间十分保守,推测其可能具有保守的生物学功能。本研究实现了SeDuox-OM蛋白在昆虫细胞中成功表达,后续可对该蛋白进行功能研究。通过对SeDuox表达模式分析,SeDuox在围食膜和中肠中高表达,表明SeDuox可能在甜菜夜蛾肠道免疫中发挥了重要作用;SeDuox从卵期到蛹期均有表达,表明其参与甜菜夜蛾整个生活史。已有研究证明,在果蝇的肠道上皮细胞中,Duox介导产生ROS作为第一道防线,起着防御主导作用[12];斑马鱼(Brachydanio rerio var)上皮细胞Duox活化产生H2O2来清除致病菌的侵染[22];敲除Duox的果蝇,其肠道菌落稳态失衡[20];橘小实蝇BdDuox的敲除导致宿主肠道细菌总量增加,而肠道共生菌肠球菌的相对丰度降低[16]。本研究利用RNAi技术探究SeDuox的功能,发现SeDuox的沉默可导致甜菜夜蛾肠道菌群载量上调,肠道潜在致病菌蜡样芽孢杆菌总量上调,肠道共生菌蒙氏肠球菌总量下降,肠道微生物的失调可能引起昆虫死亡。Bt是重要的杀虫微生物,广泛用于害虫防治,2006年,BRODERICK等研究表明昆虫肠道微生物是Bt杀虫活性所必需[23],消除昆虫肠道微生物后可降低昆虫免疫反应,从而显著降低Bt的敏感性[24],也有研究者提出不同观点,认为Bt的杀虫活性与肠道细菌无关[25]。由于肠道微生物与宿主昆虫之间有着复杂又密切的关系,Bt杀虫过程中三者如何相互作用,以及宿主免疫系统如何起调控作用尚未明确。有研究报道甜菜夜蛾幼虫取食Bt Vip3毒素后,包括AMP在内的大多数免疫应答基因显著上调,并干扰宿主的肠道微生物群,由此产生的失调反过来又刺激AMP的表达和Duox产生ROS[26,27]。棉铃虫取食Bt SY80后,在特定的时期,其中肠HaDuox表达水平显著增加[28]。本研究发现甜菜夜蛾摄入Bt GS36后,SeDuox与抗菌肽基因协同作用调控宿主肠道免疫系统从而抵御Bt的侵染,推测SeDuox在抵御昆虫肠道病原物侵入前期发挥重要作用,维持肠道免疫系统稳态和菌群平衡。
4 结论
甜菜夜蛾SeDuox为跨膜蛋白,具有典型的过氧化物酶结构域,其在昆虫中具有高度进化保守性。SeDuox在肠道免疫及肠道细菌调控中具有重要作用,可能与抗菌肽基因协同作用进行宿主的免疫调控以抵抗苏云金杆菌的侵染。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/brv.2007.82.issue-3URL [本文引用: 1]
DOI:10.1038/35066006URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1126/science.1212782URL [本文引用: 1]
[本文引用: 1]
DOI:10.1126/science.1117311URL [本文引用: 1]
DOI:10.1016/j.dci.2009.11.010URL [本文引用: 1]
DOI:10.1152/ajpgi.00198.2004URL [本文引用: 1]
DOI:10.1016/j.devcel.2004.11.007URL [本文引用: 4]
DOI:10.1016/j.devcel.2008.12.015URL [本文引用: 2]
DOI:10.1074/jbc.R400024200URL [本文引用: 1]
DOI:10.1016/j.it.2010.05.003URL [本文引用: 1]
DOI:10.1038/ismej.2015.202URL [本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
DOI:10.1016/j.dci.2020.103661URL [本文引用: 1]
DOI:10.1016/j.cell.2013.04.009URL [本文引用: 2]
DOI:10.1038/nmicrobiol.2017.20URL [本文引用: 1]
DOI:10.1038/nature08119URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/emi.2009.11.issue-10URL [本文引用: 1]
DOI:10.1016/j.jinsphys.2017.01.020URL [本文引用: 1]
[本文引用: 1]
DOI:10.1371/journal.pone.0039192URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
