 ,, 袁平丽, 龚成胜, 赵胜杰, 朱红菊, 路绪强, 何楠, 杨东东, 刘文革
,, 袁平丽, 龚成胜, 赵胜杰, 朱红菊, 路绪强, 何楠, 杨东东, 刘文革 ,中国农业科学院郑州果树研究所,郑州 450009
,中国农业科学院郑州果树研究所,郑州 450009Genetic Analysis and Gene Mapping of Canary Yellow in Watermelon Flesh
DIAO WeiNan ,, YUAN PingLi, GONG ChengSheng, ZHAO ShengJie, ZHU HongJu, LU XuQiang, HE Nan, YANG DongDong, LIU WenGe
,, YUAN PingLi, GONG ChengSheng, ZHAO ShengJie, ZHU HongJu, LU XuQiang, HE Nan, YANG DongDong, LIU WenGe ,Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009
,Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-11-2接受日期:2020-12-29
| 基金资助: |
Received:2020-11-2Accepted:2020-12-29
作者简介 About authors
刁卫楠,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2220KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刁卫楠, 袁平丽, 龚成胜, 赵胜杰, 朱红菊, 路绪强, 何楠, 杨东东, 刘文革. 西瓜果肉柠檬黄色的遗传分析和基因定位. 中国农业科学, 2021, 54(18): 3945-3958 doi:10.3864/j.issn.0578-1752.2021.18.013
DIAO WeiNan, YUAN PingLi, GONG ChengSheng, ZHAO ShengJie, ZHU HongJu, LU XuQiang, HE Nan, YANG DongDong, LIU WenGe.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】西瓜(Citrullus lanatus)原产于非洲,为一年生蔓生藤本植物,属葫芦科西瓜属,具有较高的营养价值,深受人们喜爱。我国是西瓜生产和消费大国,西瓜在我国蔬菜生产中占据重要地位,我国的西瓜育种产业发展迅速,自20世纪50年代至今,西瓜品种已经实现了至少5次品种更新换代[1]。西瓜果肉颜色是西瓜重要的农艺性状,决定西瓜的外观品质。西瓜果肉中含有丰富的类胡萝卜素,类胡萝卜素组分和含量的不同导致西瓜果肉颜色的多样化(如白色、粉红色、红色、柠檬黄色、橙色等)[2]。类胡萝卜素是动物体内维生素A的主要来源,饮食中摄入类胡萝卜素,可作为自由基清除剂,预防多种退行性疾病、心血管疾病、癌症和其他疾病[3]。西瓜果肉颜色和色素含量是影响果实营养品质和消费者接受程度的重要因素之一,定位调控西瓜果肉颜色形成的关键基因,对进一步明确关键基因的调控机理及西瓜新品种培育具有重要的理论意义。【前人研究进展】果肉颜色是园艺植物果实重要的外观及品质评价性状,许多园艺植物果肉颜色的形成都与类胡萝卜素的种类和含量有关,如番茄和柑橘中都含有丰富的类胡萝卜素。目前高等植物中类胡萝卜素的合成代谢已经非常明确,主要在质体中通过类异戊二烯途径合成[4]。番茄中八氢番茄红素脱氢酶(PDS)、ζ-胡萝卜素脱氢酶(ZDS)和八氢番茄红素合成酶(PSY)均与果肉番茄红素的积累相关,PDS、ZDS、PSY1的高表达和番茄红素的积累密切相关[5,6]。在柑橘类果实葡萄柚中发现,LCYB 2是导致红肉和白肉葡萄柚表型差异的关键影响因素[7]。除类胡萝卜素代谢途径基因外,还有大量转录因子与类胡萝卜素的合成代谢相关,如MADS-box家族的RIN转录因子能够通过促进番茄果实的成熟影响果肉中类胡萝卜素的积累,进而调控番茄果肉颜色[8]。MYB家族的MYB 7和MYB 68转录因子分别与猕猴桃和柑橘果肉中类胡萝卜素的积累有关[9,10]。西瓜果肉颜色也与类胡萝卜素密切相关。研究表明,红瓤西瓜中主要含有番茄红素,且在成熟期含量最高,橙黄瓤西瓜中则以β-胡萝卜素为主,而黄瓤西瓜中主要含有紫黄质和叶黄素,且类胡萝卜素总量偏少,仅为红瓤或橙黄瓤西瓜中的1%—2%[11,12]。关于西瓜果肉不同颜色的遗传规律已有报道,果实柠檬黄色(C)被认为是除白色(Wf)以外其他颜色(红色、粉色、橙色、淡黄色)的显性基因,Wf对黄色(B)具有上位性;粉红色(Y)对橙色(y0)和淡黄色(y)为显性,橙色(y0)对淡黄色(y)为显性,柠檬黄色(C)对Y具有上位性[13,14,15,16]。BANG等[17]通过对亮黄与红瓤西瓜中番茄红素环化酶(LCYB)的cDNA全长序列进行比较,发现其编码区存在3个单核苷酸多态性(SNP)位点,其中SNP-Phe226导致了一种氨基酸替换。利用基于该SNP开发的CAPS标记可以正确的对西瓜红瓤和黄瓤群体进行基因分型,因此,LCYB可能是控制西瓜果肉亮黄或红色的遗传因子。豆峻岭等[18]通过对无籽西瓜果实发育过程中番茄红素合成代谢酶基因表达的分析,发现LCYB在控制果肉颜色发育中具有重要作用;BRANHAM等[19]以橙黄肉西瓜‘NY0016’为母本材料,与其他不同瓤色西瓜品系进行杂交,在1号染色体上定位到1个与β-胡萝卜素相关的主效位点,为通过标记辅助育种培育富含β-胡萝卜素的红瓤西瓜杂种提供了机会。果肉颜色的形成是一个复杂的过程,在园艺植物果实中,类胡萝卜素的合成场所被认为是有色体,有色体具有多种形态,如球状、结晶状、膜状、纤维状和管状等[20]。ZHANG等[21]通过透射电镜观察到在西瓜成熟果实中,红色果肉中塌陷的有色体释放出大量的色素小球,而在白色果肉中存在极少的色素体,并在西瓜果肉中鉴定到一种在有色体发育过程中起重要作用的Pi转运蛋白ClPHT4;2。近年来,随着测序技术的发展,如BSA-seq技术等在越来越多的物种中得到应用,如马铃薯[22]、草莓[23]、西瓜[24]等,为以后进行更深入的研究提供了强有力的技术手段。目前西瓜果肉颜色的研究多集中在遗传规律及类胡萝卜素代谢合成基因方面,对于相关转录因子及有色体等方面的研究仍需进一步深入。【本研究切入点】目前对西瓜果肉颜色的研究多集中在相关遗传规律及控制西瓜红色果肉的调控基因(如LCYB)上,对于控制西瓜果肉柠檬黄色的相关研究存在一定的不足。【拟解决的关键问题】本试验分别以白色果肉西瓜‘冰糖脆’和柠檬黄色果肉西瓜‘喜华’以及白色果肉西瓜‘萨省奶油瓜’和柠檬黄色果肉西瓜‘新金兰选’两组材料为亲本构建两个六世代群体,通过亲本果实不同发育时期果肉中的类胡萝卜素种类和含量测定、群体遗传分析及利用BSA-seq分析进行基因定位等工作的开展,找出与西瓜果肉柠檬黄色相关的调控基因,为西瓜新品种选育及分子标记辅助育种奠定基础。1 材料与方法
试验于2019年春季在中国农业科学院新乡试验基地进行。1.1 试验材料
本研究选用‘冰糖脆’(Ⅰ P1,白色果肉)和‘喜华’(Ⅰ P2,柠檬黄色果肉)为第一组亲本材料,‘萨省奶油瓜’(Ⅱ P1,白色果肉)和‘新金兰选’(Ⅱ P2,柠檬黄色果肉)为第二组亲本材料,分别通过亲本杂交后自交获得F2分离群体,通过F1与亲本分别杂交得到Ⅰ BC1P1、Ⅱ BC1P1、Ⅰ BC1P2、Ⅱ BC1P2回交群体。利用这两组瓤色材料分别构建两个六世代群体,Ⅰ F2(156株)、Ⅱ F2(343株)、Ⅰ BC1P1(51株)、Ⅰ BC1P2(104株)、Ⅱ BC1P1(81株)、Ⅱ BC1P2(77株)种植于2019年春季。材料全部种植于中国农业科学院新乡综合试验基地,4份材料均来自于中国农业科学院郑州果树研究所多倍体西瓜课题组。材料以南瓜为砧木进行嫁接育苗,移栽定植行间距1.5 m,株间距0.8 m,双蔓整枝,选择第二雌花节位进行自交授粉,西瓜雌花、雄花在开花前1 d下午进行套帽,在次日上午8:00—10:00进行人工授粉,挂牌标记授粉日期。田间灌溉、施肥、病虫害防治等栽培管理方式一致。在果实发育过程中分别对授粉后10、18、26和34 d的果实进行取样,挑选3个长势一致且无机械损伤的果实进行纵切取样2份,分别用于RNA提取和色素测定,迅速在液氮中冷冻后保存于-80℃冰箱,待用。1.2 试验方法
1.2.1 类胡萝卜素提取与检测 参考李明月等[25]的方法进行类胡萝卜素提取,称取冷冻干燥后成熟西瓜果肉粉末0.5—1.0 g于50 mL离心管中,加15 mL类胡萝卜素提取液(正己烷﹕丙酮﹕无水乙醇=2﹕1﹕1),涡旋振荡混匀;磨样机剧烈振荡6 min后4 000 r/min离心10 min,转移上清至另一50 mL离心管,沉淀继续用15 mL色素提取液重复提取两次至无色(共提取3次,上清转移至同一离心管中);合并上清液,上清液在50 mL的分液漏斗中用饱和NaCl(10%)水溶液反复洗3次至中性,弃下层(水层);将上清液分批次转移至10 mL离心管中,真空浓缩干。真空浓缩后用2 mL MTBE(含0.1% BHT)复溶,再加2 mL 10% KOH-甲醇溶液(含0.01% BHT),避光条件下皂化10 h;皂化结束后加4 mL饱和NaCl水溶液和2 mL MTBE(含0.01% BHT)使其更好地分层,弃水层,再加3次5 mL饱和NaCl水溶液洗至中性;将剩下的色素上清液分批次转移至2 mL离心管中,真空浓缩至干并保存于-80℃冰箱用于HPLC检测。将保存于-80℃的样品加300 μL MTBE(含0.01% BHT)溶解后,13 000 r/min离心30 min,过0.22 μm有机滤膜,转移到进样瓶中,用于高效液相色谱检测;用乙腈﹕甲醇=3﹕1(A相,含0.01% BHT)和100% MTBE(B相,含0.01% BHT)洗脱类胡萝卜素;流动相配好后放超声仪中,超声30 min,除去气泡。检测时流速为1 mL∙min-1,进样量5 µL;洗脱梯度为0 min:A-B(95﹕5);0—10 min:A-B(95﹕5);10—19 min:A-B(86﹕14);19—35 min:A-B(75﹕25);35—47 min:A-B(50﹕50);47—50 min:A-B(95﹕5)。样品中的类胡萝卜素通过YMC C30类胡萝卜素柱(4.6 mm×150 mm,3 µm,YMC,Wilmington,NC,USA)和Waters 2695高效液相色谱仪进行检测和定量,该液相色谱仪配备有2489 UV/Vis检测器、717 plus自动进样器、Empower 3色谱管理软件,色谱柱检测柱温为30℃。用于类胡萝卜素提取和检测的各种有机试剂均为色谱级试剂(≥99.9%)。
1.2.2 西瓜果肉颜色性状的鉴定与统计 在果实成熟期,对亲本及群体单株西瓜果肉颜色进行调查统计并拍照记录。果肉颜色主要通过3个人在相同视觉角度下进行肉眼鉴定。本研究亲本材料果肉颜色为白色和柠檬黄色,后代分离群体果肉颜色性状为非柠檬黄色(白色+淡黄色)和柠檬黄色,根据表型鉴定结果,统计果肉颜色性状分离比,并进行卡方检验,以明确瓤色性状在各群体中的分离情况。
1.2.3 DNA提取和混池构建 试验采用BSA-seq建库,在两个F2分离群体中各选择30株与亲本果肉颜色相同的白色和柠檬黄色果肉植株,对4个亲本材料及筛选出的F2极端性状单株的基因组DNA进行提取,基因组DNA提取采用改良CTAB法。一个BSA-seq包括两个亲本池和2个F2极端性状混池(白色和柠檬黄色果肉),本研究共构建了两个BSA-seq群体:BSA-seq Ⅰ和BSA-seq Ⅱ。在北京百迈克生物有限公司进行建库和测序,试验流程按照Illumina公司提供的标准protocol执行,包括样品检测、文库构建、文库质量检测、上机测序。
1.2.4 关联分析与候选基因挖掘 重测序数据经质控及过滤后,利用bwa软件将测序reads重新定位到西瓜参考基因组‘97103’V2版本进行比对。利用GATK、SnpEff等工具对得到的SNP、InDel进行检测和注释,然后进行关联分析。通过ED法(欧氏距离算法)和SNP-index进行SNP关联分析,通过ED法和InDel-index进行InDel关联分析,综合各种关联分析结果取交集获得控制目标性状的候选区段。应用BLAST[26]软件对候选区间内的编码基因进行多个数据库(GO[27]、KEGG[28]、COG[29])的深度注释。通过详细的注释,快速筛选候选基因,初步获得控制西瓜果肉颜色的候选基因。
1.2.5 实时荧光定量PCR 根据葫芦科网站‘97103’V2基因组数据库(http://cucurbitgenomics.org/ organism/21)中的相关基因序列,在NCBI网站中的Primer-blast程序中设计所需引物,由河南尚亚生物技术有限公司合成。引物序列、基因登录号见表1。利用南京诺唯赞生物科技股份有限公司的HiScript® III RT SupperMix for qPCR(+gDNA wiper)反转录试剂盒及Universal SYBR® qPCR Master Mix试剂盒进行qRT-PCR反应。以CIACT为内参基因[30],采用2-△△ct法计算相对表达量。每组试验设3个生物学重复。
Table 1
表1
表1实时荧光定量PCR引物
Table 1
| 引物名称 Primer name | 引物序列 Sequence of primer | 葫芦科基因组数据库登录号 Cucurbits genomics database accession No. |
|---|---|---|
| G1 | F: TTGCTGGATTCTTTGCAGCAT R: GCTGCTCGTCTCAATTCCAC | Cla97C06G121680 |
| G2 | F: CAGGGCAGAGTTTGATGGCT R: CTTCTGATGTGCGTCCTGGT | Cla97C06G121700 |
| G3 | F: GGCAATGGAAATATGACAGTGCT R: GTGCTTGTACACAGGGACCA | Cla97C06G121890 |
| G4 | F: TACATCGGGTCGTTGAGAAGAA R: GCGTCGCATATGTTCCAAGA | Cla97C06G121910 |
| G5 | F: TCAATTCAGTCTGGGTGCTG R: TATCCAACACTCCACCCTTGC | Cla97C06G122090 |
| G6 | F: ACTCTGCAAGGAGAAATGGCA R: AATTAACGATGGCACTGGCG | Cla97C06G122110 |
| CIACT | F: CCTACAACTCAATTATGAAGTGTG R: GAAATCCACATCTGCTGGAAGGTG | Cla97C02G026960 |
新窗口打开|下载CSV
2 结果
2.1 西瓜果实发育过程中的果肉颜色变化
试验材料果实各个发育时期的果肉颜色变化如图1所示,随着果实的发育,果实不断膨大,果肉颜色不断变化,‘喜华’和‘新金兰选’果实发育过程中果肉柠檬黄色不断加深,在成熟期形成了独特的柠檬黄色;‘冰糖脆’和‘萨省奶油瓜’果实发育过程中果肉颜色在种子部位有些许发黄,但整体颜色为白色。图1
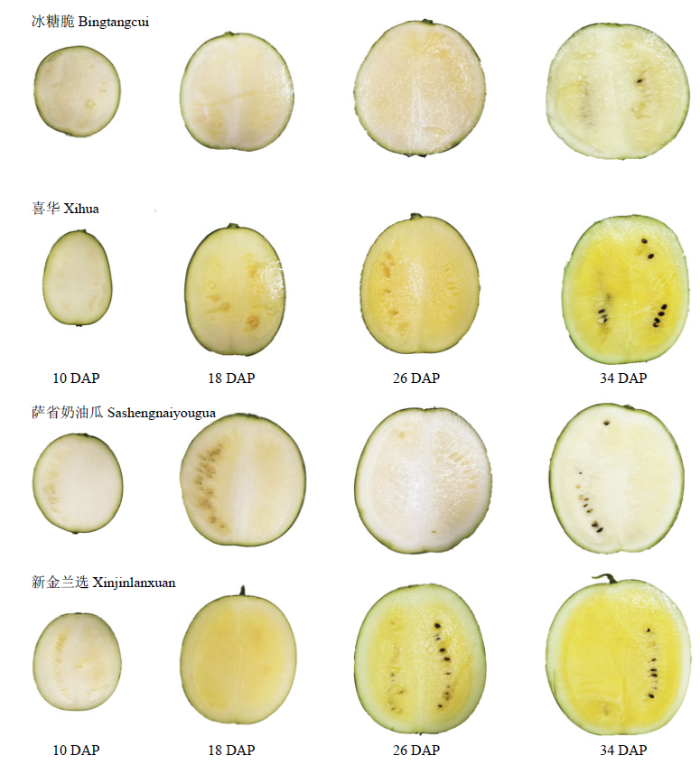 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1西瓜果实发育过程中的果肉颜色变化
DAP:授粉后天数
Fig. 1Changes of flesh color during fruit development of watermelon
DAP: Days after pollination
2.2 果实发育过程中的类胡萝卜素种类和含量测定
2.2.1 西瓜白色和柠檬黄色果肉中紫黄质含量 利用HPLC对两种瓤色果肉中的类胡萝卜素组分和含量进行测定(图2)。结果表明,授粉后10 d(10 DAP)的西瓜白色和柠檬黄色果肉中均可检测到紫黄质存在,含量分别为(3.14±1)和(3.11±1)μg·g-1 DW,且紫黄质含量无明显差异。随着果实的发育,白色果肉西瓜材料成熟期的果实中紫黄质含量能够达到(10.96±4)μg·g-1 DW,柠檬黄色果肉中紫黄质含量能够达到(22.84 ±2)μg·g-1 DW。图2
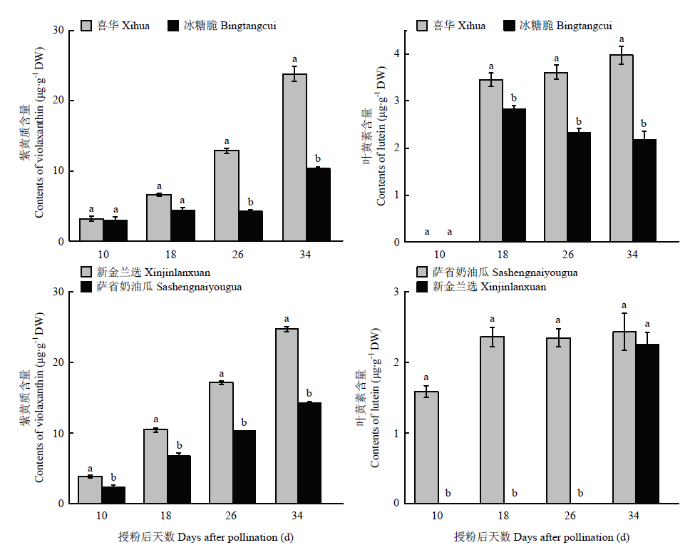 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2西瓜白色和柠檬黄色果肉果实发育过程中类胡萝卜素的组分和含量
不同小写字母表示同一发育时期不同颜色果肉中的色素含量差异显著(P<0.05)。下同
Fig. 2Carotenoids compositions and contents in white and canary yellow fleshed watermelon fruits during fruit ripening
Different lowercase letters indicate significantly different of pigment content in different color flesh (P<0.05). The same as below
2.2.2 西瓜白色和柠檬黄色果肉中叶黄素含量 10 DAP时,仅在柠檬黄色果肉材料‘新金兰选’中检测到叶黄素(1.02 μg·g-1 DW),18 DAP时在两种瓤色材料中均检测到叶黄素含量为(2.27±1)μg·g-1 DW。随着果实的发育,白色果肉中叶黄素含量能够达到(2.23±1)μg·g-1 DW,柠檬黄色果肉中叶黄素含量为(3.97±1)μg·g-1 DW。
综上所述,在两组西瓜白色和柠檬黄色果肉材料中都主要积累紫黄质和叶黄素,且紫黄质含量在这两种瓤色西瓜果肉中占主要地位;在同一颜色西瓜果肉中,紫黄质含量是叶黄素含量的5—7倍。此外,西瓜柠檬黄色果肉中紫黄质含量是西瓜白色果肉的2倍左右,叶黄素含量在柠檬黄色和白色果肉中的积累量均不高,但是柠檬黄色果肉中的叶黄素含量显著高于白色果肉。
2.3 西瓜果肉颜色的遗传分析
西瓜果肉颜色田间表型各世代分离鉴定统计如表2,两个F1群体中西瓜果肉颜色均表现为非柠檬黄色,在两个F2后代分离群体中,西瓜非柠檬黄色与柠檬黄色果肉分离比例经卡方检验均符合3﹕1的孟德尔分离比例(χ2=0.13及χ2=0.02<χ20.05=3.841),Ⅰ BC1P1、Ⅱ BC1P1群体中西瓜果肉颜色全为非柠檬黄色,Ⅰ BC1P2、Ⅱ BC1P2群体中西瓜果肉非柠檬黄色和柠檬黄色的分离比符合1﹕1的理论比(χ2=0.62及χ2=0.03<χ20.05=3.841)。遗传规律分析表明,西瓜果肉柠檬黄色对白色为隐性性状。Table 2
表2
表2两个六世代分离群体的果肉颜色表型统计
Table 2
| 世代 Generation | 植株总数 Number of total plants | 非柠檬黄色果肉 Non-canary yellow flesh | 柠檬黄色果肉 Canary yellow flesh | 非柠檬黄色果肉﹕柠檬黄色果肉 Non-canary yellow flesh﹕Canary yellow flesh | 卡方值 χ2 value |
|---|---|---|---|---|---|
| Ⅰ P1 冰糖脆×Ⅰ P2 喜华 Ⅰ P1 Bingtangcui×Ⅰ P2 Xihua | |||||
| Ⅰ P1 | 8 | 8 | - | ||
| Ⅰ P2 | 8 | - | 8 | ||
| Ⅰ F1 | 10 | 10 | - | ||
| Ⅰ F2 | 156 | 115 | 41 | 2.80:1 | 0.13 |
| Ⅰ BC1P1 | 51 | 51 | - | ||
| Ⅰ BC1P2 | 104 | 56 | 48 | 1.16:1 | 0.62 |
| Ⅱ P1 萨省奶油瓜×Ⅱ P2 新金兰选 Ⅱ P1 Sashengnaiyougua×Ⅱ P2 Xinjinlanxuan | |||||
| Ⅱ P1 | 10 | 10 | - | ||
| Ⅱ P2 | 8 | - | 8 | ||
| Ⅱ F1 | 10 | 10 | - | ||
| Ⅱ F2 | 343 | 256 | 87 | 2.94:1 | 0.02 |
| Ⅱ BC1P1 | 81 | 81 | - | ||
| Ⅱ BC1P2 | 77 | 39 | 38 | 1.02:1 | 0.03 |
新窗口打开|下载CSV
2.4 西瓜果肉颜色的基因定位
2.4.1 Illumina HiSeq测序结果 两个BSA-seq群体各获得130.90 Gb数据量,过滤后得到的Clean Bases为129.73 Gb,Q30达到80%,平均每个样品测序深度76.31X。样品与参考基因组平均比对效率为98.84%,平均覆盖深度为36.62X,基因组覆盖度为99.73%(至少一个碱基覆盖)。测序结果表明数据合格,可以继续后续基因定位工作。2.4.2 BSA-seq Ⅰ SNP和InDel关联分析 分别利用ED和SNP-index关联算法对BSA-seq Ⅰ数据进行分析(图3),对利用两种算法得到的候选区段取交集,SNP关联分析得到一个长度为2.3 Mb的区间,在参考基因组上的位置为Chr 06(23.09—25.16 Mb,25.25—25.48 Mb)。InDel关联分析得到一个长度为0.61Mb的区间,在参考基因组上的位置为Chr 06(24.00—24.61 Mb)。对SNP和InDel的关联区域取交集,最终共得1个与性状相关的候选区域,在参考基因组上的位置为Chr 06(24.00—24.61 Mb),总长度为0.61 Mb,在关联区域内通过多个数据库比对共注释到70个基因,其中非同义突变基因8个,移码突变基因1个。
图3
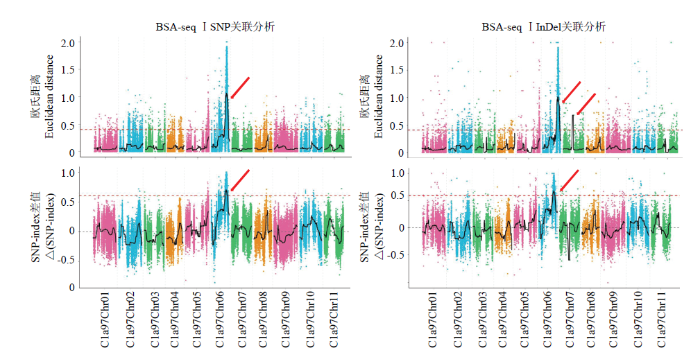 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3BSA-seq Ⅰ基于SNP和InDel的ED和△(SNP-index)关联分析图
红色箭头指向关联到的染色体区域。下同
Fig. 3ED and △(SNP-index)correlation analysis chart based on SNP and InDel of BSA-seq Ⅰ
The red arrow points to the associated chromosome region. The same as below
2.4.3 BSA-seq Ⅱ SNP和InDel关联分析 采用与BSA-seq Ⅰ数据相同的分析方法对BSA-seq Ⅱ数据分别进行SNP和InDel关联分析(图4)。SNP关联分析得到一个2.78 Mb大小的区间,在参考基因组上的位置为Chr 06(23.55—26.33 Mb);InDel关联分析得到一个大小为2.53 Mb的区间,在参考基因组上的位置为Chr 06(23.80—26.33 Mb)。对SNP和InDel的关联区域取交集,最终共得1个与性状相关的候选区域,在参考基因组上的位置为Chr 06(23.80—26.33 Mb),长度为2.53 Mb。关联区域内共注释到基因264个,其中非同义突变基因16个,移码突变基因1个。
图4
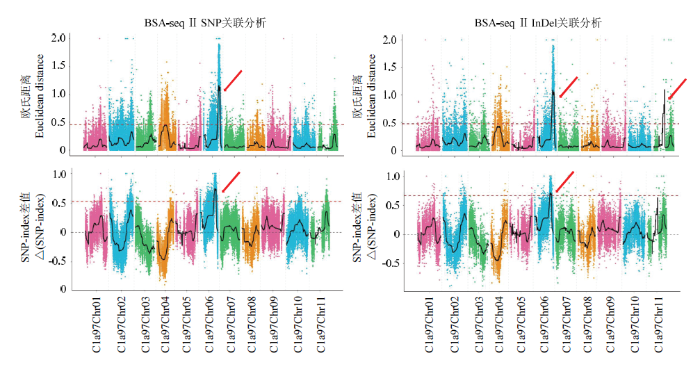 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4BSA-seq Ⅱ 基于SNP和InDel的ED和△(SNP-index)关联分析图
Fig. 4ED and △(SNP-index)correlation analysis chart based on SNP and InDel of BSA-seq Ⅱ
2.4.4 两个BSA-seq结果分析 通过SNP和InDel关联分析最终获得1个与性状相关的候选区域,定位在6号染色体24.00—24.61 Mb处,BSA-seq Ⅱ通过SNP和InDel关联分析最终获得1个与性状相关的候选区域,定位在6号染色体23.80—26.33 Mb处。
由两个BSA-seq结果可知(表3),这两个候选区间存在包含关系,BSA-seq Ⅱ分析得到的候选区段包含BSA-seq Ⅰ分析中的候选区段。综合BSA-Seq结果及两个回交群体遗传规律分析,可以初步判断这两个BSA-seq分析定位的应是同一个与西瓜果肉颜色形成有关的基因。因此,根据两个BSA-seq分析结果将控制西瓜果肉柠檬黄色的主效位点定位于6号染色体24.00—24.61 Mb处,总长度为0.61 Mb(即BSA-seq Ⅰ分析关联区域),注释到的基因见表4。
Table 3
表3
表3BSA-seqⅠ和BSA-seq Ⅱ关联区域信息统计表
Table 3
| BSA测序 BSA-seq | 染色体 Chromosome_ID | 开始 Start | 结束 End | 大小 Size (Mb) | 基因数目 Gene numbers |
|---|---|---|---|---|---|
| BSA-seq Ⅰ | Cla97Chr06 | 24000000 | 24610000 | 0.610 | 70 |
| BSA-seq Ⅱ | Cla97Chr06 | 23800000 | 26330000 | 2.530 | 264 |
新窗口打开|下载CSV
Table 4
表4
表4候选区间内的功能基因注释结果统计
Table 4
| 功能注释数据库 Annotated database | 注释基因数目 Annotated gene numbers | 存在非同义突变 的基因数 Number of genes with nonsynonymous mutations | 存在移码突变的 基因数 Number of genes with frameshift mutations |
|---|---|---|---|
| NT | 69 | 8 | 1 |
| NR | 54 | 6 | 1 |
| trEMBL | 54 | 6 | 1 |
| SwissProt | 35 | 5 | 1 |
| GO | 30 | 2 | 1 |
| KEGG | 15 | 2 | 1 |
| COG | 20 | 1 | 0 |
| 合计 Total | 70 | 8 | 1 |
新窗口打开|下载CSV
2.5 候选区域的基因功能注释
通过KEGG、GO、COG等多个数据库对候选区间内的编码基因进行深度注释,通过详细的注释,快速筛选基因,获得与目标性状相关的基因。根据参考基因组注释结果共得到6个与西瓜果肉颜色形成有关的基因(表5)。Cla97C06G121680在西瓜参考基因组中被注释为APO protein 2,是一种与光系统Ⅰ积累相关的叶绿体编码蛋白。Cla97C06G121700被注释为核酸相关蛋白及叶绿体(Nucleoid-associated protein,chloroplastic),是一种与叶绿体有关的核酸相关蛋白,数据库BLAST结果表明,该基因与拟南芥中STIC 2同源。Cla97C06G121890的注释结果为四肽重复序列(TPR)样超家族蛋白亚型1(Tetratricopeptide repeat (TPR)-like superfamily protein isoform 1),通过基因注释及同源性比较发现,该基因与叶绿体大小有关。Cla97C06G121680、Cla97C06G121700和Cla97C06G121890等3个基因都与叶绿体发育相关,而有色体可以由叶绿体转化而来[31],因此,这3个基因可能通过影响有色体的形成进而影响西瓜果肉颜色。Cla97C06G121910是一种响应乙烯合成的AP2转录因子,与果实成熟密切相关,而西瓜果肉颜色随着果实的成熟不断发生变化,该转录因子通过影响西瓜果实成熟进而影响果肉中类胡萝卜素的积累。Cla97C06G122090的注释结果为tetraspanin-8-like,具有跨膜转运作用,在植物发育中具有重要作用;Cla97C06G122110注释信息为WAT1相关蛋白(Wall are thin 1-WAT1-related protein),属于WAT1类基因,具有跨膜转运活性。拟南芥中WAT1参与植物次生细胞壁的发生并且具有促进生长素运输的能力,尤其是具有植物液泡膜的生长素转运体功能[32]。这两个基因可能在色素组分的跨膜转运中起作用。因此,推测这6个基因与西瓜果肉颜色的形成有关,其中Cla97C06G122110是非同义突变基因。Table 5
表5
表5候选基因功能注释结果
Table 5
| 基因Gene ID | 基因注释 Gene annotation |
|---|---|
| Cla97C06G121680 | APO蛋白2 APO protein 2 |
| Cla97C06G121700 | 核酸相关蛋白,叶绿体 Nucleoid-associated protein, chloroplastic |
| Cla97C06G121890 | TPR类超家族蛋白亚型1 Tetratricopeptide repeat (TPR) like superfamily protein isoform 1 |
| Cla97C06G121910 | AP2类乙烯响应转录因子家族 AP2 like ethylene-responsive transcription factor family |
| Cla97C06G122090 | TET 8 Tetraspanin-8-like |
| Cla97C06G122110 | WAT 1相关蛋白 Wall are thin 1-WAT 1 related protein |
新窗口打开|下载CSV
2.6 果实发育过程中6个候选基因在西瓜白色和柠檬黄色果肉中的表达
筛选出的6个候选基因在4份材料4个发育时期的相对表达量如图5所示。根据荧光定量结果,各个基因在果实不同发育时期表现出不同的表达模式。APO protein 2(Cla97C06G121680)在西瓜柠檬黄色果肉(‘喜华’和‘新金兰选’)中的表达量总趋势为先升后降,在26 DAP时表达量最高,显著高于白色果肉(‘冰糖脆’和‘萨省奶油瓜’)中的表达量;Nucleoid- associated protein,chloroplastic(Cla97C06G121700)在柠檬黄色果肉中的表达随着果实成熟不断升高,34 DAP时在柠檬黄色果肉中的表达量显著高于白色果肉;Tetratricopeptide repeat (TPR)-like superfamily protein isoform 1(Cla97C06G121890)在西瓜柠檬黄色果肉中的表达量在26 DAP时最高,从18 DAP后,该基因在柠檬黄色果肉中的表达量显著高于在白色果肉中的表达;AP2-like ethylene-responsive transcription factor family(Cla97C06G121910)在各个发育时期西瓜柠檬黄色果肉中的表达量显著高于白色果肉;tetraspanin-8-like(Cla97C06G122090)在10—26 DAP的白色果肉材料中的表达量显著高于柠檬黄色果肉,且白色果肉中的表达量在26 DAP时达到最高,随后下降;Wall are thin 1-WAT1-related protein(Cla97C06G122110)在4种材料不同发育时期中的表达无明显规律。图5
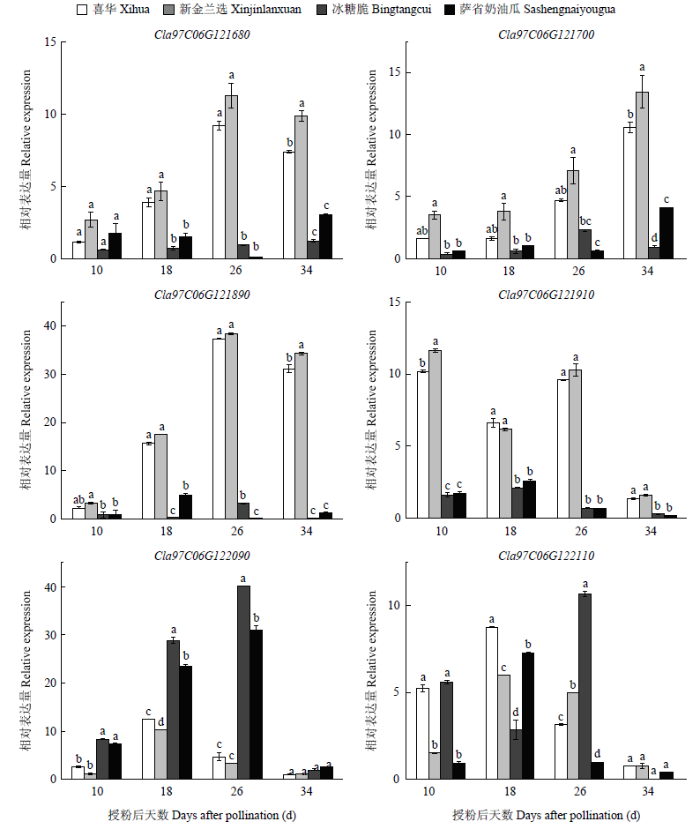 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5果实发育过程中6个候选基因在西瓜白色和柠檬黄色果肉中的相对表达量
Fig. 5Relative gene expression of six candidate genes in white and canary yellow fleshed watermelon during fruits development
根据6个候选基因在两组材料中的相对表达量可对候选基因进行进一步筛选,Cla97C06G122110即Wall are thin 1-WAT1-related protein在两组瓤色材料中的表达量无明显规律,因此不考虑该基因作为候选基因,最终确定5个候选基因。
3 讨论
类胡萝卜素是一类重要的天然色素,在高等植物中,类胡萝卜素的主要存在形式有β-胡萝卜素、叶黄素、番茄红素、β-隐黄质、八氢番茄红素、六氢番茄红素等,在果实颜色及花瓣呈色方面占据重要地位,番茄、柑橘、菊花、百合等果实和花卉中丰富的类胡萝卜素导致了植物的颜色多样化[33]。柑橘类果实是富含类胡萝卜素的水果,不同品种的柑橘果实中的类胡萝卜素成分表现出很大的多样性,且在果实各个部位积累的含量各不相同[34]。刘庆[35]通过对黄肉‘暗柳’橙及其红肉突变体‘红暗柳’橙成熟果实中的色素组成研究发现,黄肉橙中主要积累叶黄素、β-隐黄素和紫黄质,红肉橙中主要积累番茄红素。研究表明番茄果实中至少含有12种类胡萝卜素,在其成熟果实中主要有番茄红素、β-胡萝卜素和叶黄素,其中番茄红素占主导地位[36]。CAO等[37]对白肉桃‘Hujing’和黄肉桃‘Jinli’中的类胡萝卜素含量进行研究发现黄肉桃中的类胡萝卜素含量远高于白肉桃,且主要积累叶黄素、玉米黄素、β-隐黄质和β-胡萝卜素。西瓜果肉颜色主要与类胡萝卜素组分和含量的差异有关。TADMOR等[38]发现红瓤西瓜果肉中主要含有番茄红素,橙黄瓤品种‘NY162003’中含有大量β-胡萝卜素及少量的番茄红素;LIU等[11]发现在黄色果肉中主要含紫黄质和叶黄素,这与本研究柠檬黄色果肉材料中的类胡萝卜素组分相符。本研究对两个西瓜白色果肉材料(‘冰糖脆’和‘萨省奶油瓜’)不同发育时期果肉中的类胡萝卜素组分和含量进行了测定,发现西瓜白色果肉中积累的类胡萝卜素组分与柠檬黄色果肉相同,主要是紫黄质和叶黄素。根据色素含量测定结果发现,在同一瓤色西瓜果肉中,紫黄质含量显著高于叶黄素含量,表明紫黄质在西瓜白色和柠檬黄色果肉中占有主要地位。在西瓜果实发育的各个时期,西瓜柠檬黄色果肉中紫黄质含量约是白色果肉中的2倍,叶黄素含量也明显高于白色果肉。因此,推测西瓜果肉柠檬黄色的形成是紫黄质和叶黄素共同积累的结果,当这两种色素积累达到一定量时,就会导致果实颜色变黄,但是积累量的多少以及相关调控机制有待进一步研究。目前高等植物中类胡萝卜素相关代谢合成途径已经比较清晰明确,在很多研究中发现其受到类胡萝卜素相关合成基因和酶的直接调控,此外也受到转录因子和环境等因子的调控。本研究构建了两个BSA-seq群体,分别利用2种算法对测序得到的高质量SNP和InDel进行关联分析,并综合两种关联分析的结果获得最终的候选区段,结果发现两个BSA-seq群体得到的关联结果区域存在包含关系,因此对两个BSA-seq结果再取交集,最终得到6号染色体24.00—24.61 Mb,总长度0.61 Mb的区域。本研究利用两组瓤色材料作为亲本构建了两个BSA-seq群体对调控西瓜果肉柠檬黄色的基因进行分析,增加了试验结果的可信度。
候选区域内共有70个具有注释信息的基因,根据相关注释信息及同源性分析共筛选出6个的候选基因。对这6个基因进行进一步分析发现,Cla97C06G121680为APO protein 2,属于APO蛋白家族,是一类与光系统Ⅰ的积累相关的叶绿体蛋白编码基因。该家族有4个特定的基因群(APO1—APO4),水稻和拟南芥中的APO2均被定位在叶绿中,拟南芥中APO家族蛋白能够干扰叶绿体或类囊体膜的发育[39];Cla97C06G121700为叶绿体相关蛋白,在拟南芥中与STIC2同源,STIC2与叶绿体类囊体的生物发生相关[40]。Cla97C06G121890为TPR类基因,与拟南芥中REC基因同源,在猴面花中发现一个基因(RCP2),该基因编码一个与拟南芥叶绿体覆盖率降低(REC)蛋白同源的TPR蛋白,猴面花中的RCP2被证明在猴面花的有色体发育和类胡萝卜素合成中是必需的,且证明通过下调RCP2可以降低猴面花叶片叶绿素和类胡萝卜素的含量以及叶绿体的覆盖率[41]。这3个基因与叶绿体生物发生或类囊体的结构相关,而有色体作为在果实中合成和积累大量类胡萝卜素的主要场所被认为主要来源于已有的叶绿体或其他非光合质体,在许多花果发育中,叶绿体转化为有色体,影响类胡萝卜素的积累[42]。因此,推测这3个基因参与西瓜果肉颜色形成。Cla97C06G121910属于AP2/ERF转录因子家族,AP2亚家族与乙烯反应元件结合蛋白和RAV亚家族共同构成AP/ERF超家族,在乙烯反应和病原菌抗性等多种过程中发挥重要作用。在番茄中发现一个最接近的AP2同源物AP2a在果实成熟过程中起着关键作用,AP2a在乙烯合成中除了负调控作用外,还具有正的成熟调节作用,导致一些与成熟相关的基因下调,如胡萝卜素合成途径基因,从而间接影响果实颜色[43]。Cla97C06G122090即Tetraspanin-8 like,具有跨膜转运作用,且能够与其他物质结合影响膜的结构和功能[44],从而会对色素分子的转运产生影响,进而影响果肉颜色。综上所述,推测以上5个基因与西瓜果肉柠檬黄色的形成有关,在IGV中对这5个基因在4份材料中的相关突变进行研究,未发现编码区和启动子发生变异,因此推测是由于一个或几个基因的表达量差异造成西瓜果肉颜色的不同,但是这些基因的表达量是由哪些因子进行调控的仍需进一步深入研究。
本研究主要对控制西瓜果肉颜色(白色和柠檬黄色)的基因进行初步定位并对候选基因进行预测,为进一步确定西瓜果肉颜色的相关调控基因奠定了基础。下一步可开发与目标性状紧密连锁的分子标记,在子代(如F2分离群体)中筛选重组单株,逐步缩小候选区段,精准定位目标基因。
4 结论
在西瓜白色和柠檬黄色果肉中主要含有紫黄质和叶黄素,且在两组试验材料中的积累量具有明显差异,即不同含量的色素造成果肉颜色的变化。遗传分析表明西瓜果肉柠檬黄色对白色为隐性性状。利用两个BSA-seq群体分析将调控西瓜果肉柠檬黄色形成的一个主效位点定位于6号染色体24.00—24.61 Mb处,总长度为0.61 Mb,结合基因注释及荧光定量分析获得Cla97C06G121680、Cla97C06G121700、Cla97C06G121890、Cla97C06G122090、Cla97C06G121910共5个与西瓜果肉柠檬黄色形成相关的候选基因。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf052066pURL [本文引用: 1]
DOI:10.3390/nu6020466URL [本文引用: 1]
DOI:10.1006/abbi.2000.2170URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.113.224733URL [本文引用: 1]
DOI:10.1111/ppl.2011.141.issue-1URL [本文引用: 1]
DOI:10.1002/jsfa.2017.97.issue-3URL [本文引用: 1]
DOI:10.1111/nph.15362URL [本文引用: 1]
DOI:10.1111/nph.2017.216.issue-1URL [本文引用: 1]
DOI:10.1007/s10068-012-0068-3URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.21273/JASHS.135.4.362URL [本文引用: 1]
DOI:10.1270/jsbbs1951.13.235URL [本文引用: 1]
DOI:10.1093/oxfordjournals.jhered.a105364URL [本文引用: 1]
DOI:10.1007/s11032-006-9076-4URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11032-017-0747-0URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/nph.2017.213.issue-3URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/jxb/ery096URL [本文引用: 1]
DOI:10.1007/s00122-018-3050-5URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/nar/25.17.3389URL [本文引用: 1]
[本文引用: 1]
DOI:10.1093/nar/gkh063URL [本文引用: 1]
DOI:10.1093/nar/28.1.33URL [本文引用: 1]
DOI:10.1371/journal.pone.0090612URL [本文引用: 1]
DOI:10.1016/j.abb.2013.07.002URL [本文引用: 1]
DOI:10.1038/ncomms3625URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf060702tURL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1007/s13197-012-0918-2URL [本文引用: 1]
DOI:10.1016/j.foodchem.2016.07.085URL [本文引用: 1]
DOI:10.1016/j.foodres.2004.07.011URL [本文引用: 1]
DOI:10.1105/tpc.104.024935URL [本文引用: 1]
DOI:10.1105/tpc.16.00962URL [本文引用: 1]
DOI:10.1105/tpc.19.00755URL [本文引用: 1]
DOI:10.1073/pnas.2004405117URL [本文引用: 1]
DOI:10.1105/tpc.110.081273URL [本文引用: 1]
DOI:10.1016/j.molp.2020.07.016URL [本文引用: 1]
