 ,, 孙天歌, 张迎春, 陈丽华, 张新宇, 李艳军
,, 孙天歌, 张迎春, 陈丽华, 张新宇, 李艳军 ,, 孙杰石河子大学农学院,新疆石河子 832003
,, 孙杰石河子大学农学院,新疆石河子 832003Identification of Xylosidase Genes from Verticillium dahliae and Functional Analysis Based on HIGS Technology
ZHANG XiaoXue ,, SUN TianGe, ZHANG YingChun, CHEN LiHua, ZHANG XinYu, LI YanJun
,, SUN TianGe, ZHANG YingChun, CHEN LiHua, ZHANG XinYu, LI YanJun ,, SUN JieCollege of Agriculture, Shihezi University, Shihezi 832003, Xinjiang
,, SUN JieCollege of Agriculture, Shihezi University, Shihezi 832003, Xinjiang通讯作者:
责任编辑: 岳梅
收稿日期:2020-11-9接受日期:2020-12-18
| 基金资助: |
Received:2020-11-9Accepted:2020-12-18
作者简介 About authors
张小雪,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1961KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张小雪, 孙天歌, 张迎春, 陈丽华, 张新宇, 李艳军, 孙杰. 大丽轮枝菌木糖苷酶基因的鉴定及基于HIGS技术的功能分析[J]. 中国农业科学, 2021, 54(15): 3219-3231 doi:10.3864/j.issn.0578-1752.2021.15.007
ZHANG XiaoXue, SUN TianGe, ZHANG YingChun, CHEN LiHua, ZHANG XinYu, LI YanJun, SUN Jie.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】我国是世界上主要的棉花生产和消费国,新疆是最大的植棉省区,已连续25年保持单产、总产和调出量全国第一。2019年新疆棉花播种面积254.05万公顷,皮棉产量500.2万吨,分别占全国的76.1%和84.9%,棉花产业已成为新疆的重要经济支柱和农民收入的主要来源。棉花黄萎病是一种土传性维管束真菌病害[1],严重影响棉花的产量和纤维品质[2]。我国棉区的黄萎病主要是由大丽轮枝菌(Verticillium dahliae)引起[3]。大丽轮枝菌入侵寄主后,其菌丝体大量生长阻碍植物木质部对营养物质的运输[4],同时产生水解酶和毒素等物质作用于寄主,最终导致植株死亡[1,5]。由于大丽轮枝菌具有稳定存在的微菌核结构以及多变的生理型,棉花黄萎病至今难以防治。挖掘大丽轮枝菌致病相关基因并进行功能验证,对揭示大丽轮枝菌的致病分子机制以及制定更好的棉花黄萎病防治策略具有重要意义。【前人研究进展】近年来,随着大丽轮枝菌全基因组测序的完成和生物信息学工具的发展,其致病相关基因的挖掘及功能研究已取得较大进展[6,7,8,9,10],但由于大丽轮枝菌致病机制非常复杂,其研究仍处于探索阶段。大丽轮枝菌入侵过程中会产生胞外分泌蛋白,其中含有大量的植物细胞壁降解酶,能够降解寄主植物的细胞壁多糖以达到入侵和定殖的目的[1,5,11]。植物细胞壁的横向结构主要由半纤维素和木质素结合而成。木聚糖是半纤维素的主要成分,最高可占细胞干重的35%,是植物中第二丰富的生物聚合物,仅次于纤维素。木聚糖的降解在大丽轮枝菌的致病过程中发挥重要作用[12]。木聚糖酶和木糖苷酶是降解木聚糖的关键酶,前者将木聚糖降解成小片段,后者则利用外切的性质将小片段水解释放木糖[13,14]。已有多种病原菌分泌的木聚糖酶被发现与其致病力密切相关[15,16],然而木糖苷酶与致病力的关系尚不清楚。依据木糖苷酶水解的糖苷键不同,可分为β-木糖苷酶和α-木糖苷酶两种类型。依据氨基酸序列相似性,在Carbohydrate Active Enzymes数据库(CAZy,1 材料与方法
试验于2019—2020年在石河子大学完成。1.1 供试材料及处理
供试材料为陆地棉(Gossypium hirsutum)新陆早8号(感病品种)、中植棉2号(耐病品种)和海岛棉(Gossypium barbadense)海7124(抗病品种),均由石河子大学棉花研究所提供。大丽轮枝菌强致病菌株Vd991由石河子大学绿洲生态农业重点实验室保存。1.1.1 棉苗的种植 将棉种在温水中浸泡8—12 h后,在28℃恒温培养箱中催芽,挑选发芽整齐一致的种子均匀种植在霍格兰营养液中,每盆种植18棵棉苗,每3 d添加一次霍格兰营养液使总体积保持5 L,培养30 d后收集根系分泌物。先用滤纸对每盆中液体进行过滤,再用细菌过滤器(直径0.22 μm)进行过滤,然后在冷冻干燥机中将过滤后的溶液浓缩至1 L,放置在4℃冰箱备用。另外,挑选发芽整齐一致的种子均匀种在等体积混合的营养土与蛭石中,培养温度26℃,相对湿度80%,光周期16 h光照/8 h黑暗,待植株长出2片真叶后用于农杆菌的注射和大丽轮枝菌的胁迫处理。
1.1.2 大丽轮枝菌样本的制备 挑取PDA培养基上生长10 d左右的菌块接种于200 mL查氏液体培养基中,26℃、150 r/min振荡培养5—7 d,分装入50 mL离心管中,12 000 r/min收集Vd991菌体。每份称取0.5 g菌体,分别加入10 mL根系分泌物,培养0、6、12、24和48 h后收集菌体,设置3次生物学重复,共收集45份菌体。
1.2 方法
1.2.1 木糖苷酶基因的鉴定及亚细胞定位预测 从大丽轮枝菌数据(1.2.2 木糖苷酶基因的生物信息学分析 利用SMART在线软件预测木糖苷酶基因蛋白信号肽和结构域,利用DOG2.0软件绘制蛋白的结构域图。以13个木糖苷酶基因蛋白序列的主结构域为探针序列,利用NCBI Blast P(
1.2.3 大丽轮枝菌总RNA的提取及cDNA第一链的合成 利用Fungal RNA Kit(OMEGA)提取大丽轮枝菌样本总RNA,用DNase Ⅰ消解DNA后,利用1.0%琼脂糖凝胶电泳检测RNA的完整性,利用NanoDrop 2000 DNA浓度测定仪测定RNA的浓度和OD260 nm/ OD280 nm值。用MMLV反转录酶合成cDNA第一链,保存于-20℃冰箱备用。
1.2.4 木糖苷酶基因的表达分析 依据进化树分类结果及实验室前期转录组数据[21],从GH3、GH31和GH43 3个糖苷水解酶家族中挑选6个基因(VdxyL3、VdxyL4、VdxyL6、VdxyL8、VdxyL10和VdxyL12),其中VdxyL6来自GH3家族,VdxyL3和VdxyL10来自GH43家族,VdxyL4、VdxyL8和VdxyL12来自GH31家族。设计这6个木糖苷酶基因的特异性引物(表1),以培养0、6、12、24和48 h大丽轮枝菌的cDNA为模板,利用qRT-PCR对基因的表达模式进行分析,大丽轮枝菌微管蛋白基因作为内参基因。qRT-PCR反应在美国罗氏 LightCycler® 480系统上进行,反应参数:94℃ 1 min;94℃ 15 s,58℃ 20 s,72℃ 20 s;40次循环,所有反应设置3次重复,按照 2-ΔΔCT法计算基因的相对表达量。
Table 1
表1
表1引物序列
Table 1
| 基因名称 Gene name | 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) | 用途 Purpose |
|---|---|---|---|
| VdxyL3 (VDAG_01866) | VdxyL3-F1 | GGAATTCCTGGGCCTCTTCGCTCTATG | PCR |
| VdxyL3-R1 | GGGTACCACAGCACTGAGACCAGCATC | PCR | |
| VdxyL3-F | CGGAAACATTCACCTCCCCA | qRT-PCR | |
| VdxyL3-R | GGCGTAAGCCTCGAAAGCAT | qRT-PCR | |
| VdxyL4 (VDAG_04702) | VdxyL4-F | CAGCGCCATTGAAATCGAGG | qRT-PCR |
| VdxyL4-R | GGATTATTCCAGAGAAACCC | qRT-PCR | |
| VdxyL6 (VDAG_09393) | VdxyL6-F | CTCAACGCCAGCTTCTACGT | qRT-PCR |
| VdxyL6-R | CGTCGGGATCGTAGCGTAAA | qRT-PCR | |
| VdxyL8 (VDAG_05579) | VdxyL8-F | TAAGACCATTGAGAGCCGCG | qRT-PCR |
| VdxyL8-R | AGTTAACGTCGTGCCCTTGT | qRT-PCR | |
| VdxyL10 (VDAG_09302) | VdxyL10-F | CGCCAAACCCACTTCTCCTA | qRT-PCR |
| VdxyL10-R | TAGGACGACTCGGAGCTCAT | qRT-PCR | |
| VdxyL12 (VDAG_02226) | VdxyL12-F | CGATCTGCTGCTTGAGGAGT | qRT-PCR |
| VdxyL12-R | AGGTCGAGGAATGGCTGTTG | qRT-PCR | |
| Tubulin | Tubulin-F | TCCACCTTCGTCGGTAACTC | qRT-PCR |
| Tubulin-R | GCCTCCTCCTCGTACTCCTC | qRT-PCR | |
| Ve-ITS1 | Ve-ITS1-F | AAAGTTTTAATGGTTCGCTAAGA | qRT-PCR |
| ST-VE1 | ST-VE1-R | CTTGGTCATTTAGAGGAAGTAA | qRT-PCR |
| GhUBQ7 | GhUBQ7-F | GAAGGCATTCCACCTGACCAAC | qRT-PCR |
| GhUBQ7-R | CTTGACCTTCTTCTTCTTGTGCTTG | qRT-PCR |
新窗口打开|下载CSV
1.2.5 基于HIGS技术的VdxyL3基因沉默 木糖苷酶基因VdxyL3干扰片段的克隆:根据NCBI网站Primer3-Blast在线设计VdxyL3的特异引物VdxyL3-F/R,在上下游引物中分别引入EcoR I和Kpn I酶切位点(表1),以大丽轮枝菌cDNA为模板扩增VdxyL3的干扰片段。PCR反应体系(20 μL):ddH2O 13.2 μL,10×Ex Taq Buffer 2 μL,dNTP Mix(2.5 mmol·L-1)1.6 μL,cDNA模板1 μL;上游引物VdxyL3-F1(10 μmol·L-1)1 μL,下游引物VdxyL3-R1(10 μmol·L-1)1 μL,Ex Taq(5 U·μL-1)0.2 μL。扩增条件:94℃ 3 min;94℃ 30 s,58℃ 30 s,72℃ 45 s,29次循环;72℃ 10 min。PCR产物经电泳检测回收后,连接至pMD19-T simple载体转化DH5α感受态细胞,挑取阳性克隆送至深圳华大基因科技有限公司测序,获得T-VdxyL3重组质粒。
HIGS载体的构建:提取pTRV2空载体质粒和T-VdxyL3重组质粒,分别用EcoR I和Kpn I进行双酶切,回收pTRV2载体线性化片段和VdxyL3干扰片段,采用T4 DNA连接酶连接回收的两个片段,连接产物转化大肠杆菌感受态细胞,挑取单菌落摇培后提取质粒,利用PCR和双酶切对重组质粒pTRV2-VdxyL3进行鉴定。
棉花的注射及侵染:用电击转化法将pTRV1、pTRV2-VdxyL3、空载体pTRV2-00和对照载体pTRV2-GhCHLI(该基因突变使叶片失绿)分别转化农杆菌GV3101。待棉苗两片子叶平展时,挑取含pTRV1、pTRV2-00、pTRV2-VdxyL3和pTRV2-GhCHLI的农杆菌单菌落加入30 mL LB液体培养基(卡那霉素50 mg·L-1,利福平25 mg·L-1)中,28℃、200 r/min过夜培养。将摇培的菌液放入4℃离心机5 000 r/min离心10 min收集菌体,加入孢子悬浮液(10 mmol·L-1 MgCl2、10 mmol·L-1 MES(2-(N-吗啡啉)乙磺酸)和200 pmol·L-1 AS(乙酰丁香酮),重悬后将菌液的浓度调至OD600=0.8。将准备好的含pTRV2-GhCHLI、pTRV2-VdxyL3和pTRV2-00的重悬液分别与含pTRV1的重悬液按照1﹕1的比例混合,室温静置3 h后注射棉花。用1 mL无针头注射器采用压迫法注射生长10 d的棉苗,将菌液注入展平的子叶中,使菌液充满整个子叶。含pTRV2-00和pTRV2-VdxyL3的重悬液分别注射80棵棉苗,将注射后的棉花放置于22—25℃条件下暗培养12 h,然后恢复至正常光照培养。
1.2.6 抗病性鉴定 大丽轮枝菌孢子悬浮液的制备:挑取PDA培养基上生长10 d左右的菌块接种于200 mL查氏液体培养基中,26℃、150 r/min振荡培养5—7 d,用灭菌的纱布过滤菌液后获得孢子悬浮液,在显微镜下用血球计数板计数,将孢子悬浮液调至1.0×107 cfu/mL。
病情指数调查:注射农杆菌菌液后7—10 d,待pTRV2-GhCHLI处理的棉苗真叶完全呈现黄白色时,制备浓度为1×107 cfu/mL的大丽轮枝菌孢子悬浮液,采用伤根法侵染棉花感病品种新陆早8号,每株接种20 mL孢子悬浮液。选取20株pTRV2-00处理过的棉苗作为水处理对照(Mock)。侵染15—30 d后,对新陆早8号的感病情况进行统计[22]。
真菌生物量检测:接Vd991后14 d,分别采集pTRV2-00和pTRV2-VdxyL3处理棉株的茎,提取总DNA(CTAB法),利用棉花内参基因GhUBQ7(DQ116441.1)和黄萎病特异引物ITS1-F和ST-Ve1- R[23]进行qRT-PCR,测定其中大丽轮枝菌的生物量。
目标基因表达量检测:采用EASYspinPlus植物RNA提取试剂盒(Aidlab,北京,中国)提取接菌后14 d棉株茎的总RNA,反转录为cDNA,以Tubulin为内参基因,VdxyL3-F和VdxyL3-R为引物,利用qRT-PCR对VdxyL3的表达量进行分析。
大丽轮枝菌恢复培养:接菌后14 d,随机选取pTRV2-00和pTRV2-VdxyL3处理棉苗各10株,用于大丽轮枝菌的恢复试验。从暴露于蛭石表面的茎基部切断植株,向上每隔2 cm取一个茎段,每个植株取3段。将茎段放入75%酒精浸泡30 s,然后在0.1%的升汞溶液中浸泡消毒5 min,无菌水冲洗3—5次,将处理的茎段均匀摆放在PDA平板上,25℃培养7—10 d。待大丽轮枝菌菌落长出后,观察菌落的生长情况。
2 结果
2.1 大丽轮枝菌木糖苷酶基因的鉴定
通过大丽轮枝菌基因组数据库的搜索结合在线工具SMART结构域分析,共鉴定出13个木糖苷酶基因,定名为VdxyL1—VdxyL13(表2)。这些木糖苷酶基因的编码序列(coding sequence,CDS)长度为1 461— 2 544 bp,编码的氨基酸为335—834个,蛋白质分子量介于38.78—90.97 kD,理论等电点介于4.67—5.89。亚细胞定位预测发现这些基因大多是细胞膜外的蛋白质,部分定位于细胞质、膜结合的溶酶体、细胞核或膜结合高尔基体上。13个基因中包含4个木糖苷酶/阿拉伯糖苷酶基因(VdxyL2、VdxyL3、VdxyL11、VdxyL13),1个β-葡糖苷酶/β-木糖苷酶(VdxyL7),5个β-木糖苷酶基因(VdxyL1、VdxyL5、VdxyL6、VdxyL9、VdxyL10)和3个α-木糖苷酶基因(VdxyL4、VdxyL8、VdxyL12)。Table 2
表2
表2大丽轮枝菌中木糖苷酶基因的鉴定
Table 2
| 基因名称 Gene name | 序列号 Sequence number | 编码序列 Coding sequence (bp) | 编码蛋白 Coding protein (aa) | 分子量 Molecular weight (kD) | 等电点 pI | 基因的描述 Gene description | 亚细胞定位预测 Subcellular location prediction |
|---|---|---|---|---|---|---|---|
| VdxyL1 | VDAG_01169 | 1786 | 558 | 62.33 | 5.16 | β-木糖苷酶β-xylosidase | 细胞膜外的蛋白质 Extracellular proteins |
| VdxyL2 | VDAG_02166 | 1804 | 571 | 65.15 | 4.97 | 木糖苷酶/阿拉伯糖苷酶 Xylosidase/arabinosidase | 细胞膜外的蛋白质 Extracellular proteins |
| VdxyL3 | VDAG_01866 | 2544 | 834 | 90.97 | 4.67 | 木糖苷酶/阿拉伯糖苷酶 Xylosidase/arabinosidase | 细胞膜外的蛋白质 Extracellular proteins |
| VdxyL4 | VDAG_04702 | 1089 | 335 | 38.78 | 5.31 | α-木糖苷酶α-xylosidase | 细胞质Cytoplasm |
| VdxyL5 | VDAG_07817 | 1611 | 512 | 56.13 | 5.04 | β-木糖苷酶β-xylosidase | 细胞膜外的蛋白质 Extracellular proteins |
| VdxyL6 | VDAG_09393 | 1943 | 609 | 67.13 | 4.88 | β-木糖苷酶β-xylosidase | 细胞膜外的蛋白质 Extracellular proteins |
| VdxyL7 | VDAG_03859 | 1881 | 572 | 62.66 | 5.89 | β-葡糖苷酶/β-木糖苷酶 β-glucosidase/β-xylosidase | 溶酶体Lysosome |
| VdxyL8 | VDAG_05579 | 2353 | 764 | 85.22 | 5.18 | α-木糖苷酶α-xylosidase | 溶酶体Lysosome |
| VdxyL9 | VDAG_06173 | 2020 | 488 | 54.44 | 5.96 | β-木糖苷酶β-xylosidase | 高尔基体Golgi apparatus |
| VdxyL10 | VDAG_09302 | 1614 | 537 | 60.70 | 5.68 | β-木糖苷酶β-xylosidase | 细胞质Cytoplasm |
| VdxyL11 | VDAG_00716 | 1841 | 533 | 59.45 | 5.28 | 木糖苷酶/阿拉伯糖苷酶 Xylosidase/arabinosidase | 细胞核Cell nucleus |
| VdxyL12 | VDAG_02226 | 1995 | 664 | 76.09 | 5.88 | α-木糖苷酶α-xylosidase | 细胞质Cytoplasm |
| VdxyL13 | VDAG_03628 | 1461 | 400 | 44.70 | 5.78 | 木糖苷酶/阿拉伯糖苷酶 Xylosidase/arabinosidase | 细胞膜外的蛋白质 Extracellular proteins |
新窗口打开|下载CSV
2.2 大丽轮枝菌木糖苷酶基因编码蛋白的结构域分析
利用SMART在线工具(图1
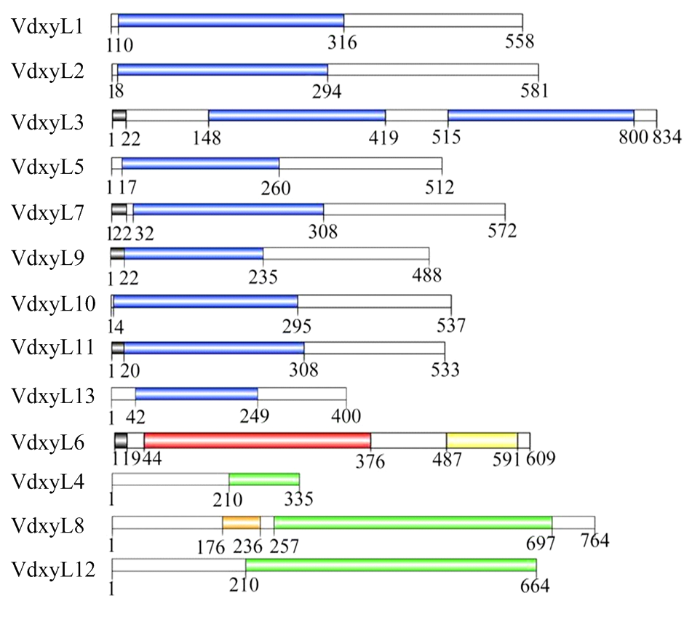 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1大丽轮枝菌木糖苷酶基因编码蛋白的结构域分析
黑色表示信号肽;蓝色表示Glyco_hydro 43结构域;绿色表示Glyco_hydro 31结构域;红色表示Glyco_hydro 3结构域;黄色表示Glyco_hydro 3_C结构域;橙色表示Gal_mutarotas_2结构域
Fig. 1Domains analysis of xylosidase proteins in V. dahliae
Black indicates the signal peptide; Blue indicates the Glyco_hydro 43 domain; Green indicates the Glyco_hydro 31 domain; Red indicates the Glyco_hydro 3 domain; Yellow indicates the Glyco_hydro 3_C domain; Orange indicates the Gal_mutarotas_2 domain
2.3 木糖苷酶基因多重序列比对及进化树的构建
通过在线软件NCBI中多序列比对查找并选取其他物种中12个木糖苷酶基因编码的蛋白序列,其中XP 018236340.1(尖镰孢)、RMZ44074.1(黄曲霉)、TFL04453.1(细翼蕨)、TDZ59664.1(三叶炭疽菌)、TEA21443.1(紫苏炭疽菌)和THX71209.1(出芽短梗霉菌)属于糖苷水解酶43家族;CVK94262.1(芒果镰孢)和CVL11996.1(层出镰孢)属于糖苷水解酶3家族;RKK75644.1(尖镰孢)、KPM38392.1(新蜜环菌)、XP 003721488.1(稻瘟病菌)和XP 028469785.1(碱性钠酵母菌)属于糖苷水解酶31家族;将12个木糖苷酶基因与大丽轮枝菌13个木糖苷酶基因编码的蛋白进行系统进化树分析(图2),25个蛋白被清晰地分成3组。VdxyL1、VdxyL2、VdxyL3、VdxyL5、VdxyL7、VdxyL9、VdxyL10、VdxyL11和VdxyL13与其他物种中43家族成员聚为一类;VdxyL6与其他物种中3家族成员聚为一类;VdxyL4、VdxyL12、VdxyL8与其他物种中31家族成员聚为一类;该结果与结构域预测结果一致,表明大丽轮枝菌13个木糖苷酶基因中,包括9个糖苷水解酶43家族成员,1个糖苷水解酶3家族成员和3个31家族成员。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2大丽轮枝菌和其他物种中木糖苷酶基因编码蛋白的进化树分析
红色表示Glyco_hydro 3家族;紫色表示Glyco_hydro 31家族;蓝色表示Glyco_hydro 43家族
Fig. 2Phylogenetic tree analysis of xylosidase proteins in V. dahliae and other species
Red indicates the Glyco_hydro 3 family; Purple indicates the Glyco_hydro 31 family, Blue indicates the Glyco_hydro 43 family
2.4 木糖苷酶基因结构分析
利用在线软件GSDS对13个木糖苷酶基因结构进行分析,结果如图3所示,VdxyL9和VdxyL11含有5个外显子和4个内含子;VdxyL13含有4个外显子和3个内含子;VdxyL1、VdxyL7和VdxyL6含有3个外显子和2个内含子;VdxyL2、VdxyL4、VdxyL8、VdxyL3和VdxyL5含有2个外显子和1个内含子;VdxyL12和VdxyL10含有1个外显子,无内含子。图3
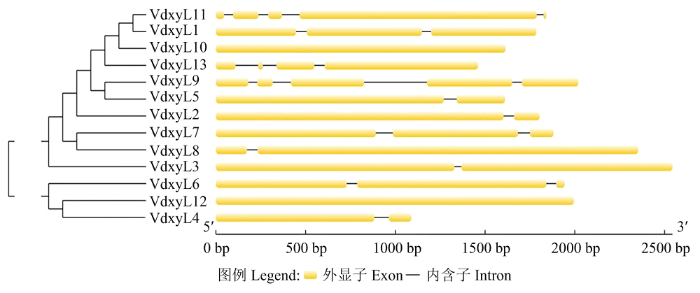 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3大丽轮枝菌木糖苷酶基因结构分析
Fig. 3Structure analysis of xylosidase genes in V. dahliae
2.5 大丽轮枝菌木糖苷酶基因染色体分布
大丽轮枝菌共有8条染色体,13个木糖苷酶基因分布在6条染色体上。Chr02、Chr03和Chr07上分别含有3个木糖苷酶基因,Chr02上分布的基因为VdxyL5、VdxyL8和VdxyL11,Chr03上分布的基因为VdxyL4、VdxyL7和VdxyL13,Chr07上分布的基因为VdxyL2、VdxyL3和VdxyL12。Chr04上分布2个基因VdxyL10和VdxyL6。Chr01和Chr08上各含有一个木糖苷酶基因,分别为VdxyL1和VdxyL9(图4)。根据200 kb核苷酸中含3个以上基因为1个基因簇的定义,木糖苷酶基因没有形成基因簇。图4
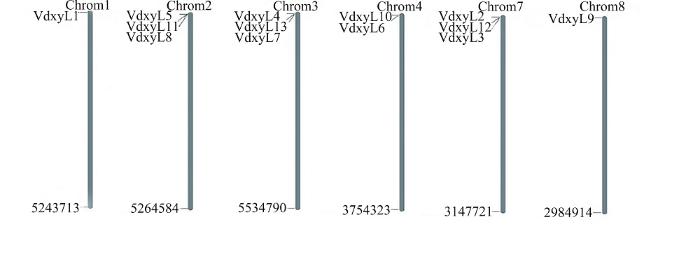 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4大丽轮枝菌木糖苷酶基因在染色体上的分布
Fig. 4Chromosomal distribution of xylosidase genes in V. dahliae
2.6 木糖苷酶基因在根系分泌物诱导下的表达分析
qRT-PCR结果发现6个基因均受到根系分泌物的诱导,在一种或多种根系分泌物中培养6 h或12 h后,表达量均明显升高,然后降低。VdxyL3在海7124根系分泌物诱导6 h的表达量明显高于其他样本,表明该基因的表达明显受海岛棉根系分泌物的诱导。VdxyL4、VdxyL6、VdxyL8、VdxyL10和VdxyL12在耐病品种(中植棉2号)根系分泌物诱导6 h样本中的表达量明显高于其他样本,其中VdxyL4的表达仅受到耐病品种根系分泌物的诱导,VdxyL6的表达也受感病陆地棉品种(新陆早8号)根系分泌物的诱导,VdxyL8、VdxyL10和VdxyL12受3种不同抗/感品种根系分泌物的诱导(图5)。该研究结果表明大丽轮枝菌木糖苷酶基因在响应棉花根系分泌物的过程中可能发挥着重要作用。根据qRT-PCR结果结合实验室前期转录组数据,选取VdxyL3用于进一步的功能研究。图5
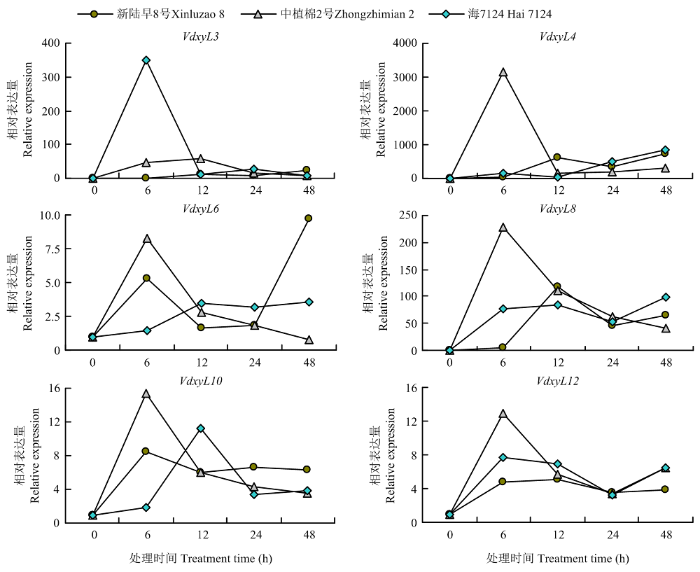 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5木糖苷酶基因在不同棉花品种根系分泌物培养的大丽轮枝菌中表达模式
Fig. 5The expression pattern of xylosidase genes in V. dahliae induced by root exudates from different cotton varieties
2.7 HIGS沉默效果检测
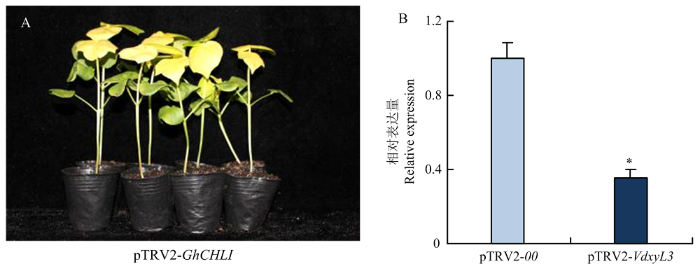
选取VdxyL3进行HIGS沉默研究。将注射pTRV2-00的棉花作为阴性对照,注射pTRV2-GhCHLI的棉花为阳性对照。注射10 d后,pTRV2-GhCHLI处理植株真叶出现黄化现象(图6-A),表明HIGS体系可以成功抑制目标基因表达。制备浓度为1.0× 107 cfu/mL大丽轮枝菌孢子悬浮液,采用伤根法侵染棉花。接菌14 d后,采集pTRV2-00和pTRV2-VdxyL3处理的棉花茎,提取RNA并反转录为cDNA,以VdxyL3-F/R为引物,利用qRT-PCR分析VdxyL3的表达水平,结果发现pTRV2-VdxyL3处理的棉花茎中的表达量明显低于pTRV2-00(图6-B),表明pTRV2-VdxyL3处理棉株中大丽轮枝菌VdxyL3的表达成功受到抑制。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6HIGS沉默效果检测
A:注射pTRV2-GhCHLI 10 d后感病品种新陆早8号的表型;B:qRT-PCR 检测VdxyL3在pTRV2-00 和pTRV2-VdxyL3处理植株中的表达量。从接菌14 d后植株茎秆中提取棉花总RNA。Tubulin为内参基因
Fig. 6Detection of HIGS silencing effect
A: Phenotypes of susceptible variety Xinluzao 8 after 10 days of injection with pTRV2-GhCHLI;B:qRT-PCR analysis of VdxyL3 expression in the pTRV2-00 and pTRV2-VdxyL3 treated plants. Total RNA was isolated from stems at 14 dpi. Tubulin was used as the control
2.8 病情调查
接菌后14 d和21 d,分别对pTRV2-00和pTRV2-VdxyL3处理植株的发病情况进行调查。接菌后14 d,pTRV2-00处理植株出现轻微的叶片黄化现象,而pTRV2-VdxyL3处理植株呈现明显的黄化和萎蔫现象;接菌后21 d,pTRV2-00处理植株叶片出现明显的黄化、萎蔫和脱落现象,而pTRV2-VdxyL3处理植株发病严重,叶片脱落较多(图7-A)。两种处理植株的正常生长均受到影响,但pTRV2-VdxyL3处理植株的株高略矮于pTRV2-00 处理植株(图7-B)。病情指数调查发现pTRV2-VdxyL3处理植株在接菌14 d和21 d的病情指数(33.3和83.9)均显著高于pTRV2-00植株14 d和21 d(21.7和66.1)(图 7-C)。剖杆试验发现pTRV2-VdxyL3处理植株褐化程度明显较高(图7-D)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7HIGS处理棉株的病情调查
A:pTRV2-00和pTRV2-VdxyL3植株接种大丽轮枝菌14 d和21 d表型;B:接种大丽轮枝菌14 d后pTRV2-00和pTRV2-VdxyL3处理植株的株高;C:pTRV2-00和pTRV2-VdxyL3植株接种大丽轮枝菌14 d和 21 d病情指数统计;D:pTRV2-00和pTRV2-VdxyL3植株接种大丽轮枝菌14 d后茎秆的表型
Fig. 7Disease investigation on cotton plants treated with HIGS
A: Disease symptom of the pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 and 21 dpi;B:Plant height of the pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 dpi;C:Disease index of the pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 and 21 dpi;D: Disease symptom in stems of the pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 dpi
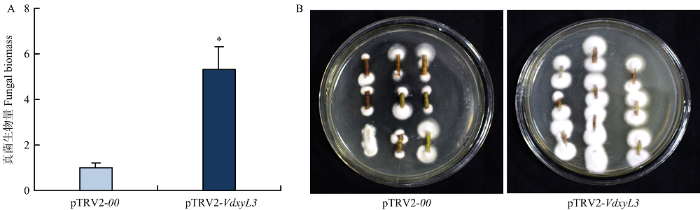
2.9 大丽轮枝菌恢复培养和真菌相对生物量检测
接菌后14 d,分别采集pTRV2-00和pTRV2-VdxyL3处理棉株的茎,提取总DNA,利用qRT-PCR检测真菌生物量。同时,收取pTRV2-00和pTRV2-VdxyL3处理棉苗的茎用于大丽轮枝菌的恢复试验。大丽轮枝菌恢复培养和真菌生物量检测发现pTRV2-VdxyL3处理植株茎中的真菌生物量显著多于pTRV2-00处理植株(图8-A、8-B),表明抑制VdxyL3的表达增强了大丽轮枝菌的致病力。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8HIGS处理棉株的大丽轮枝菌恢复试验和相对含量检测
A:接种大丽轮枝菌14 d后pTRV2-00和pTRV2-VdxyL3 处理植株茎秆中病原菌相对含量测定;B:接种大丽轮枝菌14 d后pTRV2-00和pTRV2-VdxyL3处理植株茎秆大丽轮枝菌恢复培养。将茎秆置于PDA培养基,25℃培养箱中培养7 d后拍照
Fig. 8Recovery experiment and relative content detection of V. dahliae in cotton plants treated with HIGS
A:Quantification of the relative fungal biomass in stems of the pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 dpi;B:Fungal isolation in the stem sections from pTRV2-00 and pTRV2-VdxyL3 treated plants at 14 dpi. Stems were plated on PDA medium. Photos were taken at 7 dpi of culture at 25℃
3 讨论
木糖苷酶基因对于降解植物细胞壁中的木聚糖至关重要,筛选大丽轮枝菌致病相关木糖苷酶基因,可为防治由该菌引起的植物黄萎病提供理论依据。木糖苷酶基因属于糖苷水解酶(glycoside hydrolases,GH)家族,该家族编码的酶能够以内切或外切的方式水解含糖化合物中的糖苷键。根据CAZy数据库依据氨基酸序列相似性对于糖苷水解家族的分类,共有168个公认的家族(GH1-168)。本研究从大丽轮枝菌中鉴定了13个木糖苷酶基因,它们分别属于GH3、GH31和GH43家族。真菌的β-木糖苷酶大都属于GH3家族糖苷水解酶[24]。与前人研究不同,本研究13个基因中大多数(VdxyL1、VdxyL2、VdxyL3、VdxyL5、VdxyL7、VdxyL9、VdxyL10、VdxyL11和VdxyL13)属于GH43家族,仅有1个(VdxyL6)属于GH3家族。有的β-木糖苷酶是双功能酶,具有双重酶催化活性[25,26],本研究中VdxyL2、VdxyL3、VdxyL11和VdxyL13具有β-木糖苷酶和阿拉伯糖苷酶双重酶活性,VdxyL7具有β-葡糖苷酶/β-木糖苷酶活性。α-木糖苷酶在低聚木糖的末端还原端催化末端未经取代的木糖甙水解,13个基因中包括3个α-木糖苷酶基因(VdxyL4、VdxyL8和VdxyL12),均属于GH31家族成员。了解宿主与病原体的相互作用对于黄萎病的防控具有重要意义。在这个病理系统中,病害循环始于大丽轮枝菌微菌核对宿主根系分泌物刺激的响应和萌发[27]。感病品种根系分泌物促进大丽轮枝菌的生长,而抗病品种根系分泌物抑制其生长[28,29]。EI-BEBANY等[27]研究发现,感病马铃薯品种根系分泌物诱导后大丽轮枝菌中差异基因的数量多于中抗品种根系分泌物诱导后的数量,高侵染力病原菌中受感病品种根系分泌物诱导表达的基因被认为与致病相关;ZHANG等[21]研究发现,感病棉花品种根系分泌物诱导后大丽轮枝菌中差异基因的数量明显多于耐病和抗病品种根系分泌物诱导后的数量,一些编码水解酶和跨膜转运蛋白的基因受感病品种根系分泌物诱导后明显上调,被认为与致病相关;XU等[9]研究表明,VdRGS1受棉花根诱导后表达量明显上调,敲除和回补试验发现该基因在大丽轮枝菌的产孢、菌丝体的发育、微菌核的形成和致病过程中发挥着重要作用,该基因HIGS沉默棉株的抗病性明显增强。上述研究表明棉花根系分泌物能够影响大丽轮枝菌中基因的表达,受其诱导表达的基因在大丽轮枝菌致病及宿主-病原体互作过程中可能发挥着重要的作用。本研究利用qRT-PCR对不同抗/感棉花品种根系分泌物诱导后大丽轮枝菌中6个木糖苷酶基因的表达量变化进行了分析,发现其表达均受根系分泌物的诱导,因此可将其作为研究大丽轮枝菌致病及宿主-病原体互作机制的候选基因。
大丽轮枝菌的致病分子机制非常复杂,近年来其致病相关基因的研究取得了阶段性的进展。大丽轮枝菌致病相关基因包括效应因子和细胞壁降解酶相关基因,如Vd2LysM[30]、VdSCP7[8]、VdSNF1[31]和VdSSP1[32]等;生长-致病相关基因,如VdSge1[33]、VdCYC8[34]、VdPR1[35]和VdThit[36]等。尽管认为大丽轮枝菌分泌蛋白中的细胞壁降解酶能够参与植物细胞壁的降解,促进病原菌的定殖,但相关基因的鉴定及功能研究仅有少量报道。如果胶代谢相关基因VdPL3.1和VdPL3.3被敲除后,大丽轮枝菌的致病力降低[37]。调控果胶酶和半乳糖酶活性的VdSNF1被敲除后,大丽轮枝菌的致病力降低[31]。毒力因子VdSSP1与植物细胞壁降解有关,该基因的缺失突变体致病力降低[32]。赵玉兰等[38]利用HIGS技术快速筛选获得了4个细胞壁降解相关基因,转化4个靶标基因的烟草以及混合注射的烟草病情指数均降低,抗病性增强。上述研究表明将编码细胞壁降解酶的基因敲除或沉默导致大丽轮枝菌的致病力降低。本研究利用HIGS技术沉默VdxyL3后大丽轮枝菌的致病力明显增强,导致处理棉株的病情指数明显增高,这与前人细胞壁降解酶基因的功能研究结果不一致[31-32,37-38],推测VdxyL3可能参与诱导植物体内的抗性机制,增强植株的抗性,而该基因的沉默表达导致植株抗病性减弱。鉴于大丽轮枝菌致病分子机制的复杂性,VdxyL3的具体作用机制有待进一步研究。
4 结论
利用生物信息学方法从大丽轮枝菌基因组数据库中鉴定出13个木糖苷酶基因,包括9个糖苷水解酶43家族成员,1个3家族成员和3个31家族成员。6个木糖苷酶基因的表达均受到棉花根系分泌物的诱导,暗示其在大丽轮枝菌致病及宿主-病原体互作过程中可能发挥着重要的作用。通过HIGS技术对木糖苷酶基因VdxyL3在大丽轮枝菌侵染过程中的功能进行分析,发现当VdxyL3被干扰后,转化棉株的病情指数增高,抗病性减弱,表明VdxyL3与大丽轮枝菌的致病性相关。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1146/annurev-phyto-080508-081748URL [本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1094/Phyto-78-1174URL [本文引用: 1]
DOI:10.1111/mpp.2006.7.issue-2URL [本文引用: 2]
DOI:10.1111/1462-2920.13695URL [本文引用: 1]
DOI:10.7554/eLife.34902URL [本文引用: 1]
DOI:10.1111/nph.2017.215.issue-1URL [本文引用: 2]
DOI:10.1111/pbi.2018.16.issue-9URL [本文引用: 2]
DOI:10.21769/BioProtoc.2133 [本文引用: 1]
DOI:10.1094/MPMI-22-2-0115URL [本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1021/acs.jafc.5b01259URL [本文引用: 1]
DOI:10.1016/j.procbio.2014.05.020URL [本文引用: 1]
DOI:10.1111/mmi.2011.81.issue-4URL [本文引用: 1]
DOI:10.1094/MPMI-19-0025URL [本文引用: 1]
DOI:10.1016/j.carbpol.2006.12.011URL [本文引用: 1]
DOI:10.1111/jam.2007.103.issue-6URL [本文引用: 1]
DOI:10.1007/s12010-015-1908-4URL [本文引用: 1]
DOI:10.1186/s13568-016-0202-3URL [本文引用: 1]
DOI:10.1186/s12864-020-6448-9URL [本文引用: 3]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1093/jxb/ern306URL [本文引用: 1]
DOI:10.1016/j.foodchem.2013.10.062URL [本文引用: 1]
DOI:10.1016/j.bbapap.2007.06.010URL [本文引用: 1]
DOI:10.1074/jbc.M210627200URL [本文引用: 1]
DOI:10.1016/j.envexpbot.2011.03.012URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/mpp.2017.18.issue-4URL [本文引用: 1]
DOI:10.1094/MPMI-09-09-0217URL [本文引用: 3]
DOI:10.1016/j.gene.2013.06.089URL [本文引用: 3]
DOI:10.1094/MPMI-08-12-0198-RURL [本文引用: 1]
DOI:10.1371/journal.pone.0144020URL [本文引用: 1]
DOI:10.1371/journal.pone.0166000URL [本文引用: 1]
DOI:10.1094/MPMI-03-16-0057-RURL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
