 , 张钰石, 段留生, 张明才
, 张钰石, 段留生, 张明才 , 李召虎
, 李召虎*通讯作者(Corresponding author): 张明才, E-mail:zmc1214@163.com, Tel: 010-62733049 第一作者联系方式: E-mail:hao_ling2011@163.com
收稿日期:2017-02-23 接受日期:2017-05-10网络出版日期:2017-05-23基金:
摘要
关键词:玉米; ZmBRI1; 转基因植株; 油菜素内酯; ABA
Cloning, Expression and Functional Analysis of Brassinosteroid Receptor Gene ( ZmBRI1) from Zea maysL.
HAO Ling
 , ZHANG Yu-Shi, DUAN Liu-Sheng, ZHANG Ming-Cai
, ZHANG Yu-Shi, DUAN Liu-Sheng, ZHANG Ming-Cai , LI Zhao-Hu
, LI Zhao-HuFund:
Abstract
Keyword:Maize; ZmBRI1; Transgenic plant; Brassinosteroid; ABA
Show Figures
Show Figures













油菜素内酯(brassinosteroid, BR)属于甾族化合物, 是一种天然的植物激素, 在植物根的发育、种子休眠和萌发、叶片的形态建成、种子的发育和成熟、花器官的分化、生物和非生物胁迫以及光形态建成和衰老等生理过程中发挥重要的调控作用[1, 2, 3]。在BR信号传导过程中, BR被膜受体BRI1识别, 通过BRI1的磷酸化和去磷酸化传递BR信号[4, 5]。在单子叶作物水稻和小麦中, 通过对BRI1基因表达的调控, 使株型更加紧凑, 提高了作物对光的利用率, 促进了灌浆, 使作物在高密度下有更大的生产潜力[6, 7, 8, 9]; 在双子叶植物豌豆、棉花、拟南芥、番茄中, BRI1基因的突变体表现出了与BR合成突变体相似的表型, 如植株矮化、雄穗育性降低、叶和花畸形等, 过量表达该基因可以使叶片变大, 开花提前等[10, 11, 12]。
在拟南芥中, 过量表达玉米的ZmDWF4基因可以恢复拟南芥dwf4突变体的表型[13]; 相反, 玉米的ZmDWF1基因被敲除后, 由于茎伸长受阻, 出现了严重的矮化[14]。在玉米中, 通过转座子诱变和化学诱变, 获得了编码C-5α 还原酶和C-6氧化酶基因的突变体na1和brd1。该突变体节间几乎无伸长, 叶片和花畸形, 雄穗育性降低, 部分转化成了雌穗[15]; Kir等[16]利用RNA干扰技术研究发现, zmbri1-RNAi玉米突变体的株高降低, 叶片深绿、卷曲, 且向上直立, 叶耳形成受阻。由此可知, BR在玉米生长发育中具有重要的调控作用, 但BR信号在玉米中的调控作用有待进一步研究。因此, 本研究利用同源克隆的方法, 从玉米中获得了ZmBRI1基因, 并转化拟南芥的野生型Ws和BR不敏感突变体bri1-5验证其功能。通过分析转基因株系对油菜素内酯(brassinolide, BL)、BR合成抑制剂丙环唑(propiconazole, Pcz)、ABA等的响应, 研究了ZmBRI1基因在响应BR和ABA激素信号中的作用, 为揭示BR在玉米生长发育过程中调控机制以及与ABA的互作机制提供了依据。
1 材料与方法1.1 试验材料与试剂玉米自交系B73, 由中国农业大学李建生教授实验室提供; 野生型拟南芥Wassilewskija (Ws)及其Ws生态型EMS诱变突变体bri1-5, 拟南芥材料由爱荷华州立大学尹延海教授提供。大肠杆菌DH5a菌株, 购于康为世纪生物科技有限公司; Agrobacterium tumefaciens GV3101菌株, 为本实验室保存。农杆菌pMD-18T载体购于宝生物工程大连有限公司TaKaRa; 超表达载体pCAMBIA1300由中国农业大学巩志忠教授实验室在该载体上添加Super启动子后提供。
NEB限制性内切酶和荧光定量试剂购于宝生物工程大连有限公司TaKaRa; M-MLV反转录试剂盒、T4连接酶、Oligo(dT)18购于Promega; 质粒DNA提取试剂盒和DNA回收试剂购于北京天根生化科技有限公司; RNA提取试剂购于华越洋生物科技有限公司; 普通dNTP mix、DNA marker购于康为世纪生物科技有限公司; 油菜素内酯(brassinolide, BL)、丙环唑(propiconazole, Pcz)等购于西格玛奥德里奇(上海)贸易有限公司Sigma-Aldrich。其他试剂均为进口或国产分析纯试剂。
1.2 材料培养将适量干燥的拟南芥种子分装于1.5 mL的离心管中, 用NaClO溶液消毒10 min (0.5% NaClO + 0.01% Trion X-100), 灭菌蒸馏水冲洗5~7次, 点播于MS培养基上, 4℃低温春化3 d, 于光照培养室中培养。培养条件为16 h光照/8 h黑暗, 温度为22℃, 光照强度50 µ mol m-2 s-1, 空气相对湿度70%~80%。
BL对根长的抑制试验: 配置含0、0.05和1.00 µ mol L-1 BL的1/2MS培养基, 将要比较的株系播种于同一个培养皿。每个处理3个重复, 春化3 d后, 转移到温室中, 垂直光照培养。生长7 d, 进行数据统计和照相。
BR的抑制剂丙环唑(Pcz)对下胚轴的抑制试验:配置含0 µ mol L-1 Pcz和1.0 µ mol L-1 Pcz的1/2MS培养基, 将要比较的株系播种于同一个培养皿。每个处理设置3个重复, 春化3 d后, 转移到温室中, 黑暗垂直培养。生长7 d, 进行数据统计和照相。
ABA抑制种子萌发和根长的试验: 配置含0 µ mol L-1 ABA和0.75 µ mol L-1 ABA的1/2MS培养基, 将要比较的株系播种于同一个培养皿。每个处理3个重复, 春化3 d后, 转移到温室中, 光照培养。3 d时, 开始统计发芽率。6 d时, 照相; 拟南芥的种子在1/2MS培养基上萌发3 d, 根长约为0.5~1.0 cm时, 移到含10 µ mol L-1 ABA的1/2MS培养基上垂直培养5 d, 测量根长。
ABA响应基因的表达水平: 拟南芥在光下生长6 d, 挑选表型一致的幼苗, 转移至含有100 µ mol L-1 ABA 的液体1/2MS中, 处理3 h取样, 提取总的RNA, 反转录, 测定相关基因RD29A、RD29B、RAB18和ABA信号的转录因子ABI5的表达(表1)。
表1
Table 1
表1(Table 1)
| 表1 qRT-PCR引物 Table 1 Primers used for qRT-PCR |
1.3 RNA的提取和Real-time PCR分析采用华越洋生物公司的植物总RNA提取试剂盒提取总RNA, 按照Promega的M-MLV反转录试剂盒说明书的要求合成cDNA。使用TaKaRa的Real-time PCR (SYBR)试剂盒, 荧光定量PCR仪(ABI7500)进行Real-time PCR反应。分别以基因ZmACTIN (J01238.1)和 AtACT2 (NM_001338358.1)为内参(表1)。15 μ L反应体系含2× SYBR Premix Ex Taq 7.5 μ L、50× ROX Reference Dye II 0.3 μ L、正向引物和反向引物各(10 µ mol L-1) 0.3 μ L、cDNA模板(40 ng μ L-1) 1.5 μ L、ddH2O 5.1 μ L。采用两步法反应程序, 95℃ 5 min; 95℃ 10 s, 60℃ 34 s, 40个循环。根据各样品特定的荧光阈值下的Ct值, 采用2-Δ Δ Ct法计算基因在不同样品中的相对表达量。
1.4 ZmBRI1基因的生物信息学分析在NCBI (National Center for Biotechnology Information)中, 下载拟南芥、水稻等作物中已知的BRI1基因的氨基酸序列。利用CLUSTALW和Rooted phylogenetic tree (http://www.genome.jp/tools/clustalw/)构建生物进化树; 利用RasMol/PyMOL软件进行蛋白的二级结构预测和三维结构的分析。
1.5 ZmBRI1基因克隆和表达载体构建设计ZmBRI1基因的引物ZmBRI1-F (Kpn I): 5′ -GGGGTACCATGGAATCTCCGGGGCTGGT-3′ 和ZmBRI1-R (Xba I): 5′ -GCTCTAGAGTCCTTCTCCTC CTTGTCTTCTTTCAG-3′ , 以玉米自交系B73的cDNA为模板扩增ZmBRI1基因的开放阅读框。采用酶切重组技术将测序正确的目的基因构建到带有CaMV 35S启动子的pCAMBIA1300载体上。
1.6 拟南芥转化及转基因纯合植株的获得采用农杆菌浸花法进行ZmBRI1基因的拟南芥遗传转化[17], 分别转入野生型Ws和突变体bri1-5中, 将收获的T0拟南芥种子播种于含潮霉素(50 mg L-1)抗性的MS培养板中进行筛选, 选取阳性植株, 收取T1拟南芥的种子。对T1拟南芥种子再次筛选, 挑选符合3:1比例的植株, 收取T2拟南芥的种子。对T2拟南芥种子进行筛选, 挑选纯合的T3种子进行功能分析。本研究挑选了2个转突变体bri1-5的转基因株系ZmBRI1-4和ZmBRI1-6, 2个转野生型Ws的转基因株系OE1和OE2, 做后续实验。
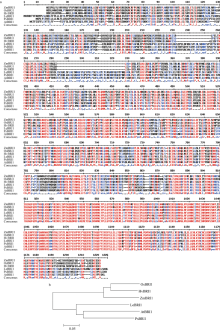
2 结果与分析2.1 玉米ZmBRI1基因的序列鉴定和蛋白结构分析 利用同源克隆技术, 获得长度约4.0 kb左右的片段, 经测序拼接, 该基因含有一个长度为3369 bp, 编码1122个氨基酸的完整的ORF。该基因在玉米B73测序数据库中, 位于第8染色体, 基因号为GRMZM2G048294。另外, 在第5染色体上还有一个与之相似度可达到95%的同源序列, 该基因的GenBank注册号为KP099562。对拟南芥AtBRI1、水稻OsBRI1、大麦HvBRI1、豌豆PsBRI1、番茄LeBRI1与玉米ZmBRI1氨基酸序列同源比对和系统发育树分析表明, 玉米ZmBRI1氨基酸序列和拟南芥AtBRI1的氨基酸一致性和相似性分别为54%和69%; 与水稻OsBRI1的氨基酸一致性和相似性分别为80%和88%, 有较近的亲缘关系(图1)。用RasMol 2.7.2.1软件预测蛋白的二级和三级结构, 由图3可以看出, ZmBRI1蛋白由α -螺旋、β -片层和不规则卷曲交替组成, 包括33.42%的α -螺旋和16.31% β -片层结构, 以及50.27%的不规则卷曲。N-端有一个α -螺旋, 属于信号肽的一部分, 可能参与了蛋白的跨膜运输和定位。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 ZmBRI1蛋白的同源比对分析(a)和系统进化树(b)Fig. 1 Homology analysis (a) and phylogenetic tree (b) of ZmBRI1 protein |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 ZmBRI1蛋白的结构预测(a) ZmBRI1蛋白的二级结构, 蓝色区域为α -螺旋, 红色区域为β -片层; (b) ZmBRI1蛋白的三级结构, 红色部分为α -螺旋, 黄色部分为β -片层。Fig. 2 Predicted structure of ZmBRI1 protein(a) Secondary structure of the ZmBRI1 protein. Helices and sheets were, respectively, indicated with blue and red vertical lines; (b) Tertiary structure of the ZmBRI1 protein. Helices and sheets were, respectively, indicated with red and yellow colors. |
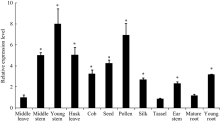
2.2 ZmBRI1蛋白的亚细胞定位和在玉米各组织中的表达图3表明, 对照载体(空载体35S::GFP)转化的拟南芥, 其荧光遍布整个细胞区域; 重组载体(35S:: ZmBRI1-GFP)转化的拟南芥, 其荧光主要分布在细胞膜上。因此, ZmBRI1蛋白是一个质膜定位的蛋白。图4表明, ZmBRI1基因在玉米的各个组织器官中都有表达, 其中在幼嫩的组织中表达较高。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 ZmBRI1蛋白的亚细胞定位示意图A: 转GFP基因(对照)的拟南芥细胞成像; B: 转ZmBRI1基因的拟南芥根细胞成像。(a) GFP绿色荧光; (b)膜定位marker FM4-64红色荧光; (c)明场图像; (d)重叠图像。Fig. 3 Subcellular localization of ZmBRI1 proteinA: Protein localization of control GFP fluorescence in young root cells; B: Protein localization of control ZmBRI1-GFP fluorescence in young root cells. (a) GFP green fluorescence; (b) Membrane localization maker FM4-64 red fluorescence; (c) Bright field image; (d) Overlap image. |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 ZmBRI1基因在玉米各个组织部位的表达从玉米各个部位中提取总RNA, 进行RT-qPCR分析。表中所给数据为3个重复的平均值和标准差, 对照为中部叶(* P < 0.05)。Fig. 4 Expression of ZmBRI1 gene in maizeTotal RNA was extracted from those young seedlings, and RT-qPCR analysis was performed. Error bars show SD from three independent RNA extractions. Asterisks indicate significant differences compared to the middle leave (* P < 0.05). |
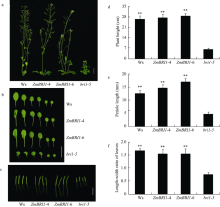
2.3 ZmBRI1基因的表达修复了突变体bri1-5的表型和BR信号通路由图5可知, ZmBRI1转基因株系基本上修复了突变体bri1-5的表型, 主要表现在以下几个方面: 突变体bri1-5植株矮小, 转基因株系ZmBRI1-4和ZmBRI1-6的株高显著高于突变体bri1-5, 与野生型Ws的株高无显著差异; ZmBRI1-4和ZmBRI1-6与突变体bri1-5相比, 叶片显著变大, 叶柄显著变长, 叶片形态和野生型Ws相似; ZmBRI1-4和ZmBRI1-6与突变体bri1-5相比, 果荚和果柄显著变长, 果荚大小和野生型Ws相似。由此可知, 过表达ZmBRI1基因, 可以在一定程度上修复突变体bri1-5的表型。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 ZmBRI1转基因拟南芥的表型(a)生长6周植株的表型, Bar=2 cm; (b)生长4周植株的叶片形态, Bar=2 cm; (c)生长4周的果荚大小, Bar=1 cm; (d)对a植株高度的统计; (e)对b叶柄长度的统计; (f)对b叶片长宽比的统计(每组数据20株苗, 3次重复, * * P < 0.01)。Fig. 5 Phenotype of ZmBRI1 transgenic lines(a) Phenotype comparison of 6-week-old plants. Bar=2 cm; (b) Leaf phenotypes of 4-week-old plants. Bar=2 cm; (c) Silique morphology comparison among the wide-type (Ws), bri1-5 mutant and two transgenic lines (ZmBRI1-4 and ZmBRI1-6) from 4-week-old plants. Bar=1 cm. (d) Plant height statistics of transgenic lines; statistical analysis of leaf measurements: (e) the petiole length and (f) length-width ratio of the rosette leaves. Averages and standard deviations were calculated from 20 seedlings of three independent experiments. Asterisks indicate significant differences compared to the bri1-5 mutant (* * P < 0.01). |
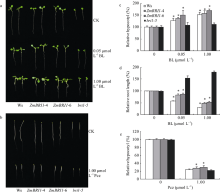
从图6的a、c和d看出, 在1/2MS培养基上, 转基因株系ZmBRI1-4和ZmBRI1-6的子叶、根长和下胚轴的长度显著大于突变体bri1-5, 且与野生型的表型基本一致, 即在突变体bri1-5中过表达ZmBRI1基因, 可以恢复突变体的表型; 在含有0.05 µ mol L-1 BL的1/2MS培养基上, 转基因株系ZmBRI1-4和ZmBRI1-6的根长分别为对照的83%和86%, 下胚轴分别为对照的136%和150%, 突变体bri1-5的根长和下胚轴分别为对照的155%和108%; 在含有1 µ mol L-1 BL的1/2MS培养基上, 转基因株系ZmBRI1-4和ZmBRI1-6的根长分别为对照的48%和53%, 下胚轴分别为对照的157%和170%, 突变体bri1-5的根长和下胚轴分别为对照的180%和110%, BR对突变体bri1-5根的生长起促进作用, 对下胚轴的生长无显著影响, 但在突变体bri1-5中超表达ZmBRI1基因, 转基因株系ZmBRI1-4和ZmBRI1-6对BR的响应和野生型Ws一致, 即ZmBRI1基因的表达恢复了突变体bri1-5对BR的响应; 从图6的b和e可以看出, 无论在1/2MS培养基上, 还是在含有1 µ mol L-1 Pcz的1/2MS培养基上, 转基因株系ZmBRI1-4和ZmBRI1-6的下胚轴的长度显著大于突变体bri1-5, 即在突变体bri1-5中超表达ZmBRI1基因, 可以恢复突变体的暗形态建成和对Pcz的抗性。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 BL和Pcz对ZmBRI1转基因拟南芥根长和下胚轴的影响(a) BL对根长和下胚轴的影响; (b) Pcz对下胚轴的影响; (c) BL处理下胚轴相对长度的统计; (d) BL处理根相对长度的统计; (e) Pcz处理下胚轴相对长度的统计(每组数据20株苗, 3次重复, * P < 0.05; * * P < 0.01)。Fig. 6 Effects of BL and Pcz on root and hypocotyl of ZmBRI1 transgenic lines(a) Effects of BL on root and hypocotyl; (b) Effects of Pcz on hypocotyl (c) Relative hypocotyl statistics under treatment with different concentrations of BL; (d) Relative root length statistics under treatment with different concentrations of BL; (e) Relative hypocotyl statistics under Pcz treatment. Averages and standard deviations were calculated from 20 seedlings of three independent experiments. Asterisks indicate significant differences compared to thebri1-5 mutant (* P < 0.05; * * P < 0.01). |
从图7可以看出, 转基因株系ZmBRI1-4和ZmBRI1-6与突变体bri1-5相比, DWF4和CPD基因的表达量下降, 即在突变体bri1-5中超表达ZmBRI1基因, 恢复了突变体bri1-5的BR信号传导。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 ZmBRI1转基因株系中CPD和DWF4的表达水平从拟南芥幼苗中提取总RNA, 进行RT-qPCR分析。表中数据为3个重复的平均值和标准差, 对照为突变体bri1-5 (* P < 0.05)。Fig. 7 Expression of the BR-related marker genes CPDand DWF4in ZmBRI1 transgenic linesTotal RNA was extracted from those young seedlings, and RT-qPCR analysis was performed. Error bars show SD from three independent RNA extractions. Asterisks indicate significant differences compared to thebri1-5 mutant (* P < 0.05). |
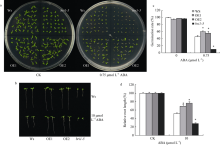
2.4 ZmBRI1基因的表达降低了拟南芥对ABA的敏感性从图8a和c可以看出, 在1/2MS培养基上, 各个株系的发芽率都接近100%, 但在含有0.75 µ mol L-1 ABA的1/2MS培养基上, 转基因株系OE1和OE2的发芽率分别为46%和54%, 野生型Ws的发芽率为32%, 转基因株系的发芽率显著高于野生型, 即在野生型Ws中超表达ZmBRI1基因, 可以在一定程度上降低拟南芥对ABA的敏感性, 提高种子的发芽率。从图8b和d可以看出, 在含ABA的1/2MS培养基上, 野生型根受抑制的程度显著高于转基因株系OE1和OE2, 即在野生型Ws中过表达ZmBRI1基因, 可以在一定程度上降低拟南芥对ABA的敏感性, 促进根系的生长。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 ABA对ZmBRI1转基因拟南芥种子萌发和根长的影响(a) ABA对ZmBRI1转基因拟南芥种子萌发的影响; (b)种子生长4 d的发芽率统计, 每组数据40粒种子; (c) ABA对ZmBRI1转基因拟南芥根长的影响; (d)根相对长度的统计, 每组数据20株苗。表中数据为3组重复的平均值和标准差, 对照为Ws (* P < 0.05)。Fig. 8 Effects of ABA on seed germination and root length in ZmBRI1overexpression lines(a) Effects of ABA on seed germination in ZmBRI1 overexpression lines; (b) Effects of ABA on root length in ZmBRI1overexpression lines; (c) Germination rate of transgenic lines at 4 d after stratification on 1/2MS medium supplemented with 0 or 0.75 µ mol L-1 ABA; (d) The relative root length statistics of 8-day-old light-grown seedlings with or without 10 µ mol L-1 ABA. Averages and standard deviations were calculated from 20 seedlings of three independent experiments. Asterisks indicate significant differences compared to Ws (* P < 0.05). |
从图9发现, 在1/2MS培养基中, 转基因株系OE1和OE2与野生型Ws相比, ABA响应基因RD29A、RD29B、ABI5和RAB18的表达无显著差异。但是, 在含有100 µ mol L-1 ABA的1/2MS培养基中, ABA响应基因的表达水平在各个株系中显著提高。然而, 转基因株系OE1和OE2与野生型相比, ABA响应基因的表达都有一定程度的下调, 即在野生型Ws中超表达ZmBRI1基因, 可以在一定程度上抑制ABA下游基因的表达。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 ABA对ZmBRI1转基因拟南芥中RD29A、RD29B、ABI5和RAB18基因表达的影响从拟南芥幼苗中提取总RNA, 进行RT-qPCR分析。表中数据为3个重复的平均值和标准差, 对照为Ws (* P < 0.05)。Fig. 9 Effects of ABA on the expression of RD29A, RD29B, ABI5, and RAB18 in ZmBRI1 overexpression lines.Total RNA was extracted from those young seedlings, and RT-qPCR analysis was performed. Error bars show SD from three independent RNA extractions. Asterisks indicate significant differences compared to Ws (* P < 0.05). |
3 讨论油菜素内酯作为一种植物生长调节剂, 参与了植物的多种生物学过程, 在促进作物生长和提高作物的抗逆性方面发挥了重要的作用。如种子的休眠和萌发, 根的发育, 植物的形态建成, 生物和非生物胁迫等[1, 2, 3]。当油菜素内酯结合到受体蛋白BRI1的胞外区时, 会使BRI1和BAK1形成二聚体, 发生磷酸化, 并激活下游侧信号因子BSK1和CDG1, 磷酸化BSU1。BSU1会使BR的负调控因子BIN2发生磷酸化而失去活性, 使BZR2/ BES1被激活, 从而调控下游基因的表达[18]。
BR不仅能影响植物的营养生长和生殖生长, 对植物的形态建成也起着重要的作用。BR合成或信号传到突变体会严重损害植株叶片的形态。BRI1是油菜素内酯信号传导过程中与BR直接互作的受体蛋白, 该基因的突变会损害植株的正常生长。例如, 拟南芥的突变体bri1-5是一种油菜素内酯不敏感的弱突变体, 植株矮小, 叶片变小, 叶色深绿, 叶缘呈锯齿状, 且花期延迟, 种子变小[19]。本研究利用同源克隆的技术, 从玉米中克隆了一个油菜素内酯受体基因ZmBRI1, 该基因在幼嫩组织中表达较高, 表达的蛋白定位于细胞膜(图3和图4)。在突变体bri1-5中超表达ZmBRI1基因, 恢复了拟南芥的叶片形态、株高和果荚大小, 但互补株系的生育期仍晚于野生型Ws (图5)。由此说明, ZmBRI1基因和AtBRI1基因在功能上有很大的相似性, 但还有一定的差异。
在光照条件下, 外源油菜素内酯的浓度高于0.001 μ mol L-1时, 抑制根的生长, 促进下胚轴的生长[20]; 在黑暗条件下, 拟南芥幼苗的下胚轴会快速伸长, 但当植物体内BR的合成或信号传导受阻时, 就会抑制下胚轴的生长。丙环唑(Pcz)可以特异性抑制BR的合成, 使植物出现缺乏BR的特异表型[21]。在突变体bri1-5中过表达ZmBRI1基因, 恢复了突变体bri1-5对BL和Pcz的正常响应, 以及BR合成基因的表达水平(图6和图7)。由此可知, 过表达ZmBRI1对突变体bri1-5表型的恢复, 是由于对突变体bri1-5信号通路的修复, 该研究结果与Wang等[22]的研究结果一致。说明ZmBRI1基因与AtBRI1基因在感知BR信号时, 有着相同的功能。但要注意到, 互补株系对BL的敏感性仍旧低于野生型, 说明ZmBRI1基因和AtBRI1基因在功能上还存在一定的差异。
BR作为一种生长促进类激素, 也参与了多种逆境胁迫过程。在种子萌发过程中, ABA促进休眠, 抑制萌发, 而BR可以通过信号分子BIN2磷酸化ABI5, 对ABA产生拮抗作用[23]。本研究中, 在野生型Ws中过表达ZmBRI1基因, 抑制了ABA下游基因的表达, 降低了拟南芥对ABA的敏感性(图8和图9)。由此说明, ZmBRI1基因可间接或直接参与ABA的信号传导, 调控拟南芥对逆境的适应性, 该研究结果与Hu和Yu的研究结果一致[23]。
目前, 利用基因工程的手段改造BR合成和信号传导相关的基因, 可以改善株型, 促进灌浆, 提高作物产量。Wu等[24]发现在水稻中特异性表达玉米、拟南芥和水稻的DWF4基因, 可以促进种子灌浆, 提高产量; Morinaka等[6]通过对水稻BRI1基因相关突变体的筛选, 得到了一株BKD1突变体。该突变体在株高和分蘖方面和野生型无显著区别, 但叶夹角变小, 株型更紧凑, 使其在生产上具有更大的产量潜力。在玉米上, 利用RNA干扰技术研究了ZmBRI1和ZmDWF1在控制玉米株型方面的重要作用。RNA敲除突变体的玉米株高降低, 叶片深绿、卷曲, 且向上直立[14, 16]。但在玉米上的研究, 仅限于对表型的调控。未来, 利用基因工程的手段, 改善玉米种质资源, 获得理想株型, 使提高玉米产量和对逆境胁迫的适应性成为可能。
4 结论从玉米中克隆了一个油菜素内酯受体基因ZmBRI1, 该基因全长为3369 bp, 编码1122个氨基酸, 是一个膜定位蛋白。该基因在玉米各个组织中都有表达, 但在幼嫩的组织表达较高。过表达ZmBRI1基因修复了bri1-5突变体的表型, 特别是植株高度、叶片形态和果荚大小; 同时, 修复了BR的信号通路, 使DWF4和CPD基因的表达降低。此外, 在野生型拟南芥中过表达ZmBRI1基因, 降低了拟南芥对ABA的敏感性: 提高了ABA处理下种子的萌发率和根系生长, 下调了ABA响应基因RD29A、RD29B、ABI5和RAB18的表达。因此, ZmBRI1不仅参与了植物的形态建成和BR的信号传导, 而且参与了植物对ABA的响应。
The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] |
