 , 陈冉冉
, 陈冉冉
*通讯作者(Corresponding author): 朱延明, E-mail:ymzhu2001@neau.edu.cn, Tel: 18645035310;
**同等贡献(Contributed equally to this work) 第一作者联系方式: E-mail:zhupinghui@outlook.com, Tel: 15604601520
收稿日期:2016-12-03 接受日期:2017-05-10网络出版日期:2017-05-22基金:
摘要
关键词:野生大豆; GsWRKY15; 肇东苜蓿; 农杆菌; 耐碱性
Cloning of Gene GsWRKY15 Related to Alkaline Stress and Alkaline Tolerance of Transgenic Plants
ZHU Ping-Hui
 , CHEN Ran-Ran
, CHEN Ran-Ran
Fund:
Abstract
Keyword: Glycine soja; GsWRKY15; Zhaodong alfalfa; Agrobacterium tumefaciens; Alkaline tolerance
Show Figures
Show Figures













非生物胁迫严重制约着农业的发展, 其中土地盐碱化是限制粮食产量, 影响植物生长和分布的主要非生物环境因素。盐碱胁迫影响植物生长、发育、繁殖等过程进而导致作物减产或绝收。随着全球人口的不断增加, 粮食供需矛盾日益尖锐, 开发和利用盐碱地, 增加耕地面积, 提高盐碱地作物产量, 成为解决粮食问题的有效手段之一[1]。紫花苜蓿(Medicago sativa)素有“ 牧草之王” 的美称, 是我国重要的豆科植物, 具有产量高, 适应性广的特性, 是我国重要的饲料作物, 同时也是改良和利用盐碱化土地的重要作物之一[2]。因此培育具有耐盐碱特性的苜蓿新品种, 具有重要的现实意义[3]。
已有大量文献报道WRKY类转录因子在植物响应生物胁迫和非生物胁迫中扮演着重要角色[4]。例如, Li等[5]发现WRKY70作为茉莉酸、水杨酸介导的信号通路中的关键节点基因, 其表达被水杨酸激活并被茉莉酸抑制, 同时WRKY70是茉莉酸诱导基因的激活剂和水杨酸响应基因的阻遏物, 通过整合来自这些相互拮抗途径的信号能够提高植株的抗病性。Zhou等[6]通过超量表达GmWRKY13、GmWRKY21和GmWRKY54基因, 分析转基因拟南芥与非转基因拟南芥在非生物胁迫耐受性方面的不同; 发现GmWRKY21提高了拟南芥的耐冷性; GmWRKY54可能通过调节DREB2A和STZ/Zat10来响应盐和干旱胁迫; 而超表达GmWRKY21基因降低了拟南芥对盐和甘露醇的耐性, 同时抑制了拟南芥侧根的发生。因此, WRKY类转录因子在植物抵御各种逆境的过程中具十分重要的作用[7]。然而, WRKY类转录因子在植株耐碱方面的研究仍鲜有报道。
野生大豆(Glycine soja)具有很强的抗逆性和适应能力, 是我国宝贵的野生种质资源, 也是克隆耐逆基因、研究耐逆分子机制的理想材料[8]。目前通过生物技术的手段, 将野生大豆优良抗逆基因导入其他物种, 来创造优秀的新种质资源, 尤其是大豆和苜蓿, 它们与野生大豆的亲缘关系更近, 遗传物质更容易交流。已有研究结果表明采用生物技术手段, 利用野生大豆的优良抗逆性状培育优质高抗苜蓿新品种是可行的[9, 10, 11, 12, 13, 14]。因此, 实验室前期利用RNA-seq测序数据, 构建了野生大豆盐碱胁迫基因调控网络[15], 从中筛选出了碱胁迫应答关键基因GsWRKY15。本研究通过同源克隆的方法获得了GsWRKY15基因的CDS区全长序列, 并构建了由35S启动子调控的植物表达载体, 用以转化肇东苜蓿, 以期获得耐碱能力显著提高的转基因苜蓿新株系。本研究对于充分利用我国盐碱地资源, 提高苜蓿种植面积, 具有重要的研究价值和广泛的开发应用前景。
1 材料与方法1.1 试验材料耐盐碱东北野生大豆(Glycine soja) G07256、肇东苜蓿(Medicago sativa)种子由东北农业大学农业生物功能基因重点实验室保存; 大肠杆菌DH5α 、酵母菌株AH109、农杆菌EHA105、植物超量表达载体pCAMBIA330035Su由东北农业大学农业生物功能基因重点实验室构建保存; 胶回收和质粒小提试剂盒购自Transgene公司, 由哈尔滨英俊生物公司完成引物合成及测序。
1.2 GsWRKY15基因的克隆以TRIzol法[16]从野生大豆的根中提取总RNA, 并反转录成cDNA。通过同源克隆方法, 以目的基因在大豆中的同源基因Glyma05g20710序列为模板设计基因特异引物(5° -GGCTTAAUATGGCCGTGGAC CTC-3° 和5° -GGTTTAAUTCAAGACGATTCTAGAA TGAGATT-3° )。以稀释5倍的总cDNA为模板, 利用pfu DNA聚合酶进行PCR扩增[17]。根据PCR产物对照Marker的位置回收目的条带。
1.3 GsWRKY15基因的表达特异性分析对21 d龄的野生大豆幼苗进行碱胁迫(50 mmol L-1NaHCO3)处理, 分别在处理0、1、3、6、12和24 h后迅速剪取根尖部分; 此外, 选取2个月左右, 正处于生殖生长阶段的野生大豆的根、茎、胚、下胚轴、老叶、新叶、花和豆荚。提取总RNA, 并反转录成cDNA, 利用荧光定量PCR检测基因表达量。采用比较CT法(2-Δ Δ CT)定量分析, 以GAPDH (GenBank登录号为DQ355800)为内参基因, 设置3次独立生物学重复和3次技术重复, 数据取3次重复的平均值。参照文献[18]原始数据标准化处理的方法。
1.4 GsWRKY15基因对苜蓿的遗传转化利用USER技术[19, 20]将目的片段与pCAMBIA330035Su载体快速融合, 以Bar基因作为筛选标记基因, 采用冻融法将构建成功的植物表达载体转化到根癌农杆菌EHA105中。
参照盛慧等[21]方法, 稍作优化。对苜蓿子叶节进行2~3 d的预培养后, 用含有GsWRKY15基因的根癌农杆菌EHA105对子叶节进行侵染, 将侵染后的子叶节转移到共培养基中培养3~4 d, 再转移到含有100 mg L-1阿莫西林-克拉维酸钾的液体植物培养基中冲洗3~4次, 随后转移到具有草甘膦(0.5 mg L-1)筛选压力的除菌培养基上, 进行2周的除菌筛选培养, 待外植体分化出抗性不定芽。将其转入具有相同筛选压力的伸长除菌培养基上继代培养2周, 获得大量抗性不定芽, 当抗性芽伸长至3~4 cm高时, 将其从外植体基部剪下, 接种到生根培养基上培养。当植株根系生长至2~3 cm长时, 进行2~3 d的驯化。然后将抗性苗移栽到花盆中培养。
1.5 再生植株的分子生物学检测提取再生植株叶片DNA作为模板, 非转基因植株叶片DNA作为阴性对照的模板。利用Bar基因特异引物(5° -TGCACCATCGTCAACCACTACATCG-3° 和5° -CCAGCTGCCAGAAACCCACGTCATG-3° )对抗性植株进行PCR检测, PCR产物长度为450 bp。
以CTAB法提取PCR阳性植株的总DNA, 参照丁晓东等[22]方法。利用GsWRKY15基因特异性引物, 从植物表达载体上克隆探针。方法参照Mishra等[23]总DNA经过酶切后纯化、电泳、转移印记、固定、预杂交、杂交等步骤, 对PCR阳性植株进行Southern blot检测。
提取PCR阳性植株的总RNA, 以其为模板, 用内参基因GAPDH的特异性引物(5° -GACTGGTATG GCATTCCGTGT-3° 和5° -GCCCTCTGATTCCTCCTT G-3° )进行PCR扩增, 验证基因组DNA, 确定无污染后反转录成cDNA。以稀释5倍的苜蓿cDNA为模板, 用基因特异引物进行半定量RT-PCR检测。
1.6 碱胁迫下转基因苜蓿的表型分析方法参照王臻昱等[10], 稍作改进。通过扦插繁殖的方式获得转基因苜蓿扦插苗, 对扦插苗进行耐碱性分析。在苜蓿生长茂盛的季节, 以每2~3个节点剪为一段, 在稀释1:5000的生根粉溶液中浸泡2 h后, 插入蛭石、草炭土和珍珠岩(1:1:1)混合的基质中。白天用遮阳网覆盖降温、保湿, 早晚各喷灌一次, 每次0.5 h, 并保持湿度80%和温度26℃, 在温室中培养约2周至生根, 移栽到蛭石和珍珠岩(1:1)的混合基质中, 每2 d用1/8 Hoagland营养液浇灌一次。培养4周左右, 挑选生长健壮且状态一致的扦插苗进行碱胁迫处理, 用含有0、100和150 mmol L-1 NaHCO3营养液浇灌, 2周后观察照相并记录表型。
1.7 碱胁迫下转基因植株相关生理指标检测采用硫代巴比妥酸(TBA)比色法[24]测定丙二醛(MDA)含量; 利用电导率仪检测叶片的相对电导率[25], 测定相对质膜透性; 采用80%丙酮抽提比色法[26]测定叶片中叶绿素含量。所有生理指标均设置3次重复, 用SPSS13.0检验显著性, Microsoft Excel 2007制图。
1.8 转GsWRKY15苜蓿胁迫相关基因的表达模式分析 将非转基因和转基因苜蓿分别置于100 mmol L-1NaHCO3条件下处理0、1、3、6、12和24 h后, 剪取苜蓿叶片。参照1.2方法, 提取苜蓿叶片总RNA并反转录成cDNA。参照1.4方法, 选取胁迫相关基因H+-Ppase、NADP-ME、KIN1和RD29A, 分析其在非转基因和转基因苜蓿中的表达模式。
2 结果与分析2.1 GsWRKY15基因的筛选与克隆2.1.1 基于RNA-seq测序数据的GsWRKY15筛选
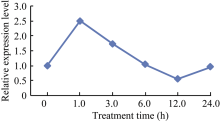
利用前期野生大豆盐碱胁迫RNA-seq测序数据, 从构建的碱胁迫基因调控网络中筛选得到碱胁迫下显著上调表达的GsWRKY15基因。由RNA-seq测序数据结果(图1)可以看出, 野生大豆根中GsWRKY15基因受碱胁迫诱导表达, 在碱胁迫下处理1 h时表达量最高。因此推测GsWRKY15可能在植物响应碱胁迫的过程中具关键作用。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 GsWRKY15基因在碱胁迫下RNA-seq测序数据分析Fig. 1 RNA-seq data analysis of GsWRKY15 gene expression patterns under alkaline stress |
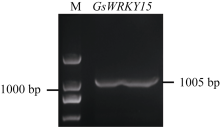
2.1.2 GsWRKY15基因的克隆 根据与GsWRKY15同源的大豆基因Glyma05g20710序列, 设计基因特异性引物, 以野生大豆cDNA为模板, 使用高保真酶Pfu DNA聚合酶进行PCR扩增。通过电泳结果(图2)及NCBI序列分析, 发现GsWRKY15基因大小为1005 bp, 编码335个氨基酸。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 GsWRKY15的克隆Fig. 2 Cloning GsWRKY15geneM: DL2000 marker. |
2.2 GsWRKY15基因的表达模式分析2.2.1 碱胁迫下GsWRKY15基因的表达模式分析
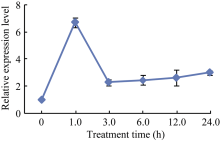
以荧光定量PCR验证GsWRKY15基因在50 mmol L-1 NaHCO3胁迫下野生大豆根中的表达特性表明, GsWRKY15基因受碱胁迫明显上调表达, 且在1 h时表达量最高(图3), 虽然表达量与RNA-seq数据有所不同, 但趋势是基本一致的, 说明该基因受碱胁迫诱导表达。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 GsWRKY15基因在碱胁迫下表达模式Fig. 3 GsWRKY15 gene expression pattern under alkaline stress |
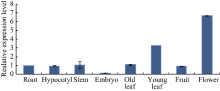
2.2.2 GsWRKY15基因的组织定位分析 荧光定量PCR分析表明, 该基因在野生大豆根、下胚轴、茎、老叶、幼叶、果实和花中均有表达, 且不同组织之间的表达量存在差异, 该基因在花中的表达量最高, 其次是幼叶, 在胚中的表达量最低(图4)。说明GsWRKY15基因在野生大豆各组织中的分布具有特异性, 其行使功能的主要部位可能在花和幼叶中。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 GsWRKY15基因的组织定位分析Fig. 4 Locating analysis of GsWRKY15 gene in different tissues |
2.3 GsWRKY15基因对苜蓿的遗传转化2.3.1 植物表达载体构建 将克隆得到的GsWRKY15基因插入由35S启动子调控的植物表达载体pCAMBIA330035Su, 成功构建植物超量表达载体(图5-A)。将构建的植物超量表达载体转入大肠杆菌DH5α , 挑取阳性克隆摇菌并提取质粒(图5-B), 送交公司测序。以测序结果正确的质粒, 利用冻融法转化根癌农杆菌EHA105。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 植物表达载体构建与转化农杆菌后菌落PCR鉴定M: DL2000 maker; +: 阳性对照; -: 阴性对照; 1~3: 菌落PCR产物。Fig. 5 Construction of plant expression vector and PCR identification of transformed agrobacteriumM: DL2000 maker; +: positive plasmid; -: negative control; 1-3: PCR products of bacterial colony. |
2.3.2 转基因苜蓿抗性植株的获得 采用农杆菌介导法将植物表达载体pCAMBIA330035Su- GsWRKY15转入苜蓿中。经过种子萌发、形成无菌苗、子叶节农杆菌共培养、抗性不定芽诱导及筛选、诱导生根等过程, 共获得39株抗性再生植株。
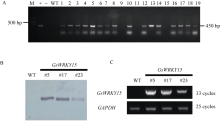
2.4 再生植株的分子生物学检测2.4.1 再生植株的PCR、Southern blot鉴定 对获得的转GsWRKY15基因的39株再生植株进行PCR检测。其中, 含有GsWRKY15基因的重组质粒作为阳性对照, 水和非转基因植株的DNA作为阴性对照(图6-A)。经PCR检测, 最终获得转GsWRKY15基因PCR阳性植株16株, 转化率为41.03%。Southern blot (图6-B)结果显示, #5、#17、#23株系为Southern blot阳性株系, 且均为单拷贝株系。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 再生植株的分子生物学鉴定A: 再生植株的PCR检测; B: PCR阳性植株的Southern blot鉴定; C: PCR阳性植株的RT-PCR检测。M: DL2000 marker; +: 阳性对照; -: 阴性对照; WT: 非转基因株系; 1~19: 部分转基因株系; #5, #17, #23: 转基因株系。Fig. 6 Molecular biological identification of regeneration plantsA: PCR identification of regeneration plants; B: Southern identification of PCR positive plants; C: RT-PCR identification of Southern blot positive plants. M: DL2000 marker; -: negative control; WT: non-transgenic plants; +: positive control; 1-19: partial transgenic lines; #5, #17, #23: transgenic lines. |
2.4.2 Southern blot阳性植株的RT-PCR鉴定
半定量RT-PCR方法对Southern blot阳性株系检测(图6-C)显示, GsWRKY15基因在#5、#17、#23转基因苜蓿中能够转录表达, 而非转基因株系中未检测到阳性信号。最终确定3株转基因株系。
2.5 转基因苜蓿的耐碱性生物学分析2.5.1 碱胁迫下转基因苜蓿的表型分析 选取RT-PCR阳性植株#5、#17转基因株系进行表型分析。对非转基因和转基因株系分别进行0、100和150 mmol L-1NaHCO3处理, 2周后发现, 未处理组中, 非转基因和转基因株系生长状况良好且相对一致(图7-A)。在100 mmol L-1 NaHCO3胁迫处理下, 转基因植株生长状况良好, 而非转基因株系苜蓿叶片逐渐萎蔫失绿(图7-B)。在150 mmol L-1 NaHCO3处理下, 转基因苜蓿受到影响较轻, 仍能正常生长, 而非转基因植株碱害较重, 生长发育受到抑制, 叶片萎蔫、失绿(图7-C), 说明转基因株系耐碱性明显好于非转基因株系。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 转基因苜蓿碱胁迫下的表型A、B和C分别为0、100和150 mmol L-1NaHCO3处理2周后的表型; WT: 非转基因对照; #5和#17: 转GsWRKY15基因株系。Fig. 7 Phenotype of transgenic alfalfa with GsWRKY15 under alkaline stressA, B, and C are phenotype of alfalfa treated with 0, 50, and 100 mmol L-1NaHCO3 for 14 days; WT: non-transgenic alfalfa; #5 and #17: transgenic alfalfa plants with GsWRKY15. |
在0、100和150 mmol L-1NaHCO3胁迫处理下, 所有株系的株高和根长随NaHCO3处理浓度的增高而下降, 但转基因株系#5、#17的下降幅度均小于非转基因株系(图8)。由此表明, GsWRKY15基因的超量表达, 提高了转基因苜蓿的耐碱性。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 碱胁迫对转GsWRKY15基因苜蓿株高和根长的影响* 表示在P< 0.05水平差异显著。Fig. 8 Changes of plant height and root length of transgenic alfalfa with GsWRKY15 under alkine stress* indicates significantly different at P< 0.05. |
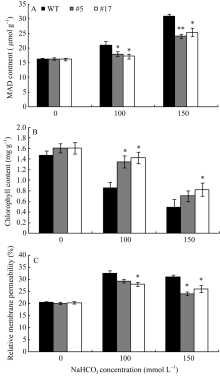
2.5.2 碱胁迫下转基因苜蓿的生理指标检测 图9-A显示, 转基因和非转基因株系的MDA含量随碱胁迫浓度的升高而增加, 但2个转GsWRKY15基因苜蓿株系的MDA含量增加幅度显著低于非转基因对照株系(P< 0.05), 从而说明超量表达GsWRKY15基因可降低碱胁迫对转基因苜蓿细胞膜的过氧化损伤, 转基因苜蓿耐碱性更高。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 碱胁迫下转基因植株的生理指标* * 和* 分别表示在P< 0.01和P< 0.05水平差异显著。A: 丙二醛含量; B: 叶绿素含量; C: 相对质膜透性。Fig. 9 Physiological indexes of transgenic plants under alkali stress* * and * indicate significantly different at P< 0.01 and P< 0.05, respectively. A: MAD content; B: chlorophyll content; C: relative membrane permeability. |
图9-B显示, 随着碱胁迫浓度的增加, 2个转GsWRKY15基因苜蓿株系和非转基因对照株系的叶绿素含量均随之降低, 但相同的碱胁迫浓度处理条件下, 转基因株系的叶绿素含量均高于非转基因株系, 在150 mmol L-1NaHCO3处理条件下最为明显, 2个转基因株系的叶绿素含量均显著高于非转基因对照株系(P< 0.05), 显然在碱胁迫条件下转GsWRKY15基因苜蓿株系的叶绿体受伤害的程度小, 具有更强的光合能力, 具有更高的耐碱性。
图9-C表明, 转基因和非转基因苜蓿的相对质膜透性均随着碱胁迫浓度的增加而增加, 但转基因植株相对质膜透性的增加幅度显著低于非转基因对照植株(P< 0.05), 说明在碱胁迫条件下, 转GsWRKY15基因株系细胞膜所受的损害较轻, 具有较高的耐碱能力。
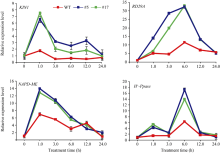
2.6 转基因苜蓿中胁迫相关基因的表达模式分析为了检验GsWRKY15基因在苜蓿中的超量表达是否影响了胁迫相关基因的表达, 从而使转基因苜蓿在生理水平上表现出耐碱特性, 对胁迫相关基因在转基因和非转基因苜蓿中的表达量进行了分析, 包括H+-Ppase、NADP-ME、KIN1、RD29A。通过荧光定量PCR分析发现, 转基因和非转基因植株中这4个基因都被碱胁迫诱导表达, 且具有相似的表达模式, 但转基因株系的表达量均高于非转基因植株(图10)。由此表明, GsWRKY15基因作为转录因子可能通过调节这些基因的转录来提高植株耐碱性。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 胁迫相关基因在转基因和非转基因苜蓿中的表达模式Fig. 10 Expression patterns of stress-responsive genes in transgenic and non-transgenic alfalfa |
3 讨论在以往的研究中得知WRKY类转录因子是一个庞大的基因家族, 不同的家族成员在功能上存在特异性, 可以响应不同的生物或非生物胁迫。目前, WRKY类转录因子的研究主要集中在拟南芥、水稻、小麦等植物中进行[27, 28, 29, 30], 而苜蓿中的研究较少。在与苜蓿近缘的野生大豆中已克隆到多个WRKY家族基因, Luo等[31]通过超量表达GsWRKY20, 降低了拟南芥叶片气孔密度, 及其离体叶片失水速率, 从而提高了转基因植株的干旱胁迫耐性。以上研究为我们探究该基因的功能提供了一定的理论基础。
土壤盐碱化是限制农业产量的重要因素之一, 而野生大豆具有较强耐盐碱能力, 是分析耐碱分子机制和确定胁迫相关基因的理想适材。实验室前期, 以野生大豆的根为样本, 通过RNA-seq数据确定了3380个基因能够响应碱胁迫应答[15]。我们从中筛选出GsWRKY15基因作为研究对象, 从RNA-seq数据(图1)和荧光定量PCR结果显示(图3), GsWRKY15基因在野生大豆根中的表达量能够迅速受碱胁迫诱导表达; 同时, 组织定位分析发现(图4), 在野生大豆中的表达具有组织特异性且在花中的表达量最高, 其次为幼叶。据此推测该基因可能在碱胁迫中发挥一定的作用, 其作用的部位可能是花和幼叶。
紫花苜蓿是我国最重要的豆科牧草之一, 对我国畜牧业有着重要的意义。然而, 土壤盐渍化正严重制约着紫花苜蓿的生长。因此, 培育出具有强耐逆性的苜蓿新品种具有重要的生产价值。针对上述研究结果, 本研究利用GsWRKY15基因转化肇东苜蓿, 期望能够提高苜蓿的耐碱性。本研究构建了植物表达载体pCAMBIA330035Su-GsWRKY15, 其筛选标记基因为Bar, Bar基因不仅可以作为筛选标记基因使用, 还具有农艺价值且是国家公认的安全性基因[32]; 通过PCR, Southern blot对再生植株进行分子生物学检测, 确定GsWRKY15基因已整合到苜蓿的基因组中(图6-A, B)。我们发现16株PCR阳性植株中, 仅有3株为Southern blot阳性植株; 这可能与外源基因的整合机制相关, 如染色体的重组, 异位等现象的发生致使目的基因片段丢失。通过RT-PCR检测, 最终确定GsWRKY15基因在转录水平上已成功表达(图6-C)。
当植物受到碱胁迫时, 最直接的伤害是由碱胁迫造成的生理干旱; 细胞内产生活性氧诱发氧化胁迫, 破坏质膜完整性、改变蛋白活性, 引起代谢失调; 随着时间的增长也会出现胞内离子稳态失衡, 发生离子毒害; 最终造成生理紊乱, 使植物的形态发育发生变化[33]。因此, 针对以上几点, 选择与其相关的生理指标进行评价, 更能说明转基因材料是否真正耐碱。本研究选取的评价指标包括反映植物生长抑制情况的株高、根长等形态指标; 反映植物光合作用及受伤害程度的叶绿素含量; 反映碱胁迫下质膜氧化损伤程度的丙二醛含量; 反映细胞膜完整性的相对质膜透性。结果显示, 超量表达GsWRKY15基因的苜蓿, 在碱胁迫条件下, 与非转基因株系相比其株高和根长受影响较小, 基本可以正常生长(图8)。由此可见, GsWRKY15在碱胁迫下能够减缓高浓度碱对苜蓿生长的损害。通过分析转GsWRKY15基因苜蓿相关的生理指标, 发现GsWRKY15能够减缓碱胁迫对苜蓿的生长抑制, 从而使转基因苜蓿在碱胁迫条件下仍能保持良好的生长状态。
此外, 为了探究超量表达GsWRKY15基因对提高苜蓿耐碱能力的分子机制, 我们对胁迫相关基因在转基因和非转基因苜蓿中的表达量分析发现, 转基因苜蓿中H+-Ppase、NADP-ME、KIN1、RD29A的表达量明显高于非转基因植株(图10)。KIN1、RD29A 基因在调节植物胞内生理过程中起到关键作用[37], 碱胁迫下KIN1、RD29A的诱导表达可能有助于减缓碱对植株的伤害。H+-Ppase、NADP-ME基因同样受碱胁迫诱导表达, 其功能在于调节胞内的pH值[34, 35]。H+-Ppase、NADP-ME基因的表达有助于植物细胞内的pH稳态, 提高植株的耐碱能力。因此, GsWRKY15基因可能通过调控H+-Ppase、NADP-ME、KIN1、RD29A的表达来降低碱胁迫对植株的伤害。
综上所述, 我们推断GsWRKY15基因的超量表达能够提高苜蓿的耐碱性。而GsWRKY15作为转录因子, 对其在异源植株体内的表达及行使其功能的机制, 还需通过进一步的实验来深入探究。
4 结论筛选出了一个在碱胁迫下明显上调表达的基因GsWRKY15, 该基因在野生大豆中的表达具有组织特异性。获得了超量表达的转GsWRKY15基因苜蓿, GsWRKY15提高了转基因苜蓿耐碱性。
The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] |
