
* 通讯作者(Corresponding author): 李云峰, E-mail: liyf1980@swu.edu.cn 收稿日期:2016-12-01 接受日期:2017-04-20网络出版日期:2017-04-27基金:
摘要
关键词:水稻; 颖花开放; 浆片; 基因定位
Characterization and Gene Mapping of sostenuto floret opening 1 (sfo1)Mutant in Rice ( Oryza sativa L.)
SHEN Ya-Lin, ZHUANG Hui, CHEN Huan, ZENG Xiao-Qin, LI Xiang-Ning, ZHANG Jun, ZHENG Hao, LING Ying-Hua, LI Yun-Feng

Fund:
Abstract
Keyword:Rice ( oryza sativa); floret opening; Lodicule; Gene mapping
Show Figures
Show Figures




水稻花器官(从外到内)依次由外稃/内稃、2枚浆片、6枚雄蕊和1个心皮组成。受精后浆片和雄蕊逐渐退化, 心皮发育成种子, 内外稃包裹在外。在大多数时候, 内外稃都钩合在一起将内轮花器官或种子包围保护起来, 唯一打开时间是在开花期。在开花期, 正常情况下每天上午9:00— 11:00左右有特定数量的颖花开放, 且每朵颖花只开放一次, 从内外稃打开(开颖)到最终闭合(闭颖)一般持续40~90 min。水稻开颖是其完成受精的必要条件, 而闭颖保护了受精后种子发育不受外界干扰。
水稻颖花开/闭颖分别由浆片的膨胀和萎缩推动。水稻浆片是第2轮花器官, 着生于外稃的内侧, 基部一侧与内稃基部边缘相连, 中部厚, 边缘薄, 形似肺状。开颖时, 随着自身细胞内淀粉等物质水解, 同时吸收来自小穗轴输入的可溶性糖, 导致浆片细胞内渗透物质浓度升高, 造成细胞水势降低, 细胞吸水导致浆片膨胀, 向外推开外稃, 同时向内挤压内稃, 从而使外稃和内稃的钩合松开并相互分开, 此时雄蕊花丝急速伸长, 花药伸出颖壳并开裂, 开始授粉[1]。开颖受多种因素诱导, 如CO2、温度、植物激素和其他因子 (比如摩擦稻穗、将稻穗从光照转移至黑暗条件、以及多种有机和无机酸处理等)[2]。而闭颖是由于浆片细胞吸水过度引起液泡膜破裂, 释放水解酶, 使其胞内细胞器膜质解离与自溶, 最终引起浆片萎缩, 使支撑外稃的压力消失, 外稃向内稃靠拢, 最终颖花闭合。
近年来关于水稻浆片发育的分子机制已有许多报道。浆片的特征发育主要由花器官特征发育调控模型(即ABCE模型)中的B功能基因OsMADS2、OsMADS4和OsMADS16决定, 它们都编码含MADS-box结构域的转录因子[3, 4, 5]; 另外2个MADS- box基因OsMADS6和OsMADS32也负责调控浆片特征的发育[6, 7]; 除MADS-box基因外, 编码C2H2锌指蛋白的STAMENLESS1 (SL1)基因也参与了浆片特征发育的调控[8]。这些基因都是调控浆片形态特征发育的, 它们的突变通常会导致浆片被转化为其他花器官, 从而导致浆片功能缺失, 不能正常介导开/闭颖。然而, 关于浆片在开/闭颖中生理过程的调控机制却鲜有报道。
本研究通过EMS诱变获得一个与水稻颖花开放相关的突变体, 其浆片膨胀促进开花的过程基本正常, 但开花后浆片失水萎缩过程极度缓慢, 从而导致内外稃持续开裂, 并最终无法闭合, 故将其命名为水稻颖花持续开放sostenuto floret opening 1 (sfo1)突变体。本研究中, 我们对sfo1突变体进行表型观察、遗传分析和基因定位, 为进一步研究开/闭颖中浆片生理过程的分子遗传机制奠定了基础。
1 材料与方法1.1 实验材料水稻sfo1突变体来源于籼稻保持系西农1B的EMS诱变群体, 经多代自交, 突变性状遗传稳定。将正常不育系材料56S (温敏型不育系)与sfo1杂交, 收获F1种子。同年在海南种植F1并收获种子。第2年种植获得F2群体, 将F1、F2群体用于遗传分析和基因定位。
1.2 形态和组织学分析在开花期, 选取合适的野生型和sfo1突变体花序于每天8:00左右(开颖前)标记预计将于当天开放的颖花, 12:00左右标记已于当天开放的颖花。根据标记结果, 分别选取开颖前大约1 h、开颖后10 min、开颖后1.5 h和开颖后48 h的颖花, 分别采用尼康SMZ1500体视镜和日立SU3500扫描电镜观察。对于扫描电镜观察使用冷冻样品观察法: 新鲜样品直接放在冷冻样品台上, 闭合样品仓门, 待样品仓门完全闭合后, 边抽真空边打开冷冻程序以降温, 待样品冷冻到-20℃时, 加压进行观察。
1.3 分子标记定位及连锁图谱构建以不育系材料56S与sfo1杂交的F2群体作为定位群体, 采用BSA法定位目标基因[9]。根据F2植株表型, 分别选取10株正常单株和10株突变单株, 剪取等量叶片, 构建正常基因池和突变基因池。以CTAB法提取亲本、基因池以及F2群体的隐性单株DNA[10]。参照http://www.gramene.org/microsat/的SSR引物序列, 由上海立菲生物技术有限公司合成。PCR总体系为15 μ L, 含1.5 μ L 10× PCR buffer、1 μ L 50 ng μ L-1 DNA模板、0.25 μ L 2.5 mmol L-1dNTPs、10.0 μ L ddH2O、10 μ mol L-1的前后引物各1.0 μ L、0.25 μ L 5 U μ L-1Taq DNA聚合酶。PCR程序为94℃预变性5 min; 94℃变性30 s, 55℃退火30 s, 72℃复性1 min, 35个循环; 72℃延伸10 min。PCR产物经10%非变性聚丙烯酰胺凝胶电泳, 快速银染后观察[11]。将具有不育系56S带型的单株标记为A, 具有sfo1带型的单株标记为B, 具有双亲带型的单株标记为H, 用MapMaker3.0分析数据和作图。
1.4 候选基因分析注释基因信息来源于网站http://www.gramene. org/和http://rice.plantbiology.msu.edu/。
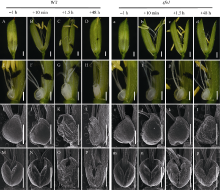
2 结果与分析2.1 sfo1开花期颖花的形态学分析在野生型中, 颖花开放前约1 h, 内外稃紧密闭合, 浆片较瘪, 但表面细胞光滑饱满(图1-A, E, I, M)。开颖后约10 min, 相对于开花前浆片明显膨胀, 表面细胞光滑饱满, 颖壳开裂, 雄蕊花丝伸长, 花药开裂并开始授粉(图1-B, F, J, N)。开花持续大约1.5 h后, 颖壳逐渐闭合, 浆片明显萎缩, 扫描电镜下可见其中下部细胞出现明显的塌陷(图1-C, G, K, O)。开花48 h后, 颖壳紧密闭合, 子房开始发育, 浆片完全萎缩, 结构破损, 在扫描电镜下已观察不到明显的细胞形态(图1-D, H, L, P)。所以, 在野生型中, 颖花的开放大约持续1.5~2.0 h, 内外稃开裂和闭合与浆片的膨胀和萎缩密切相关。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 野生型和sfo1突变体植株小花形态学观察 A~D: 依次是野生型植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的小花形态。a~d: 依次是sfo1突变体植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的小花形态。E~H: 依次是野生型植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片形态。e~h: 依次是sfo1突变体植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片形态。I~L: 依次是野生型植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片侧面形态。i~l: 依次是sfo1突变体植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片侧面形态。M~P: 依次是野生型植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片正面形态。m~p: 依次是sfo1突变体植株在开花前1 h、开花后10 min、开花后1.5 h、开花后48 h的颖花浆片正面形态。标尺为500 μ m。Fig. 1 Morphological observation of wild type (WT) and sfo1 mutant plant floret A-D successively show the wild-type florets at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; a-d successively show the sfo1 florets at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; E-H successively show the SEM microscopical structure of the wild-type lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; e-h successively show the SEM microscopical structure of the sfo1 lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; I-L successively show the SEM microscopical structure of wild-type lateral lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; i-l successively show the SEM microscopical structure of the sfo1lateral lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; M-P successively showed the SEM microscopical structure of the wild type frontal lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening; m-p successively show the SEM microscopical structure of thesfo1 frontal lodicule at one hour before opening, 10 minutes after opening, 1.5 hours after opening and 48 hours after opening. Bars=500 μ m. |
分别选取与野生型实验相同的4个时间点观察。在颖花开放前1 h, 突变体sfo1与野生型植株小花形态相似, 都表现为颖壳闭合, 浆片较瘪, 浆片表面细胞较饱满(图1-a, e, i, m)。颖花开放后约10 min, 颖壳开裂, 雄蕊花丝伸长, 花药开裂并开始授粉, 浆片相对于开花前明显膨胀, 表面细胞光滑饱满, 其小花和浆片的形态与野生型基本相同(图1-b, f, j, n)。颖花开放持续大约1.5 h后, sfo1突变体颖壳并未和野生型一样逐渐闭合而是表现为持续开裂, 进一步观察也未发现浆片明显萎缩, 相对于开花前依然膨大; 并且, 在扫描电镜下其表面细胞仍光滑饱满, 未表现明显塌陷(图1-c, g, k, o)。开放48 h后, sfo1突变体颖壳仍然未闭合, 虽然在扫描电镜下发现浆片的部分表面细胞出现了失水塌陷, 浆片整体也开始萎缩, 但是与野生型相比整体形态结构依然完整(图1-d, h, i, p)。这些结果表明sfo1突变体小花浆片失水塌陷过程缓慢, 阻止了开花后内外稃的再次闭合, 从而导致小花持续开放。
2.2 sfo1谷粒形态分析观察发现, 野生型谷粒结构完整, 内外稃紧密闭合(图2-A), 这有利于保护籽粒不被雨水及病虫侵害, 籽粒表面光滑, 形态饱满(图2-B)。而sfo1突变体谷粒结构虽然完整(图2-A), 但由于其内外稃在开花结束后仍持续开裂不能闭合, 导致籽粒在整个发育过程中都裸露在外; 这一方面导致子房发育异常, 从而形成了小而尖的籽粒(图2-A, B), 甚至有的子房发育失败而形成空瘪的种子(图2-A), 另一方面由于雨水的侵害, 导致部分籽粒腐烂变质(图2-B); 对杂交亲本56S和F2突变谷粒观察也得出一致的结论(图2-C, D)。这些结果表明, 开花期sfo1突变引起的内外稃持续开裂影响了其种子的正常发育和成熟, 最终导致突变体籽粒形态异常和霉变。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 sfo1突变体种子形态学观察 A: 野生型和sfo1突变体谷粒的比较; B: 野生型和sfo1突变体籽粒的比较; C: 杂交亲本56S和F2代群体谷粒的比较; D: 杂交亲本56S和F2代群体籽粒的比较。Fig. 2 Morphological observation of mutant seed A shows grains of wild type (WT) and sfo1 mutant; B shows seeds of wild type andsfo1 mutant; C shows grains of parent 56S and sfo1mutant in F2 populations; D shows seeds of parent 56S and sfo1mutant in F2 populations. |
2.3 sfo1突变体的遗传分析用不育系材料56S与sfo1杂交, F1表型正常, F2群体分离出明显的sfo1突变表型植株。F2群体总数为1304株, 其中正常植株1002株, 突变植株302株, 分离比为3.318∶ 1。经过卡平方检测, 分离比例符合3∶ 1。这些结果表明sfo1突变性状受1对隐性单基因控制。
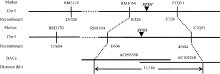
2.4 SFO1基因的精细定位选用约400对平均分布在水稻12条染色体上的SSR引物, 对56S、sfo1突变亲本进行多态性分析, 96对引物在两亲本之间呈现出多态性; 用这些多态性引物分析F2基因池, 发现位于第5染色体上的SSR标记RM3170、RM1054和IN/DEL标记ZTQ51在正常基因池和突变基因池之间呈现多态性(表1); 再用这3对标记筛选F2群体的163株突变单株, 发现重组子数分别为25、0和2, 初步将SFO1定位在RM3170和ZTQ51之间。为了更精确定位SFO1基因, 用这些引物筛选了全部302株突变株, 重组子数分别为37、1和4。最终将SFO1基因定位在RM1054和ZTQ51之间, 物理距离为113 kb (图3)。
表1
Table 1
表1(Table 1)
| 表1 用于基因定位的多态性引物 Table 1 Polymorphic markers for gene mapping |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 SFO1基因的精细定位Fig. 3 Map-based cloning of the SFO1 |
2.5 SFO1候选基因分析在SFO1定位区间内有2个重叠BAC克隆AC098598和AC105260。参照日本晴序列, 区间内有15个注释基因(http://www.gramene.org/和http:// rice.plantbiology.msu.edu/), 其中LOC_Os05g50850编码表达蛋白, LOC_Os05g50860、LOC_Os05g50870和LOC_Os05g50880编码转座子蛋白, LOC_ Os05g50890编码吲哚乙酸酰胺合成酶, LOC_ Os05g50900编码螺旋-环-螺旋DNA结合蛋白, LOC_Os05g50910编码超级大的G蛋白, LOC_ Os05g50920编码跨膜氨基酸转运蛋白, LOC_ Os05g50930是聚合酶σ 因子, LOC_Os05g50950编码PPR蛋白, LOC_Os05g50960编码多聚半乳糖醛酸酶, LOC_Os05g50970编码蛋白磷酸酶, LOC_ Os05g50980编码SET域蛋白, 另外2个基因LOC_ Os05g50940和LOC_Os05g50990编码假定蛋白。
3 讨论经典ABCE模型认为双子叶植物的四轮花器官萼片、花瓣、雄蕊和心皮特征发育分别受A+E、A+B+E、B+C+E和C+E四类基因的组合调控[12, 13, 14]。过去十多年的研究表明水稻等单子叶植物的花器官发育也基本符合ABCE发育模型, 其中浆片相当于双子叶植物的花瓣, 主要受B功能基因的调控[3, 4, 5]。水稻中B类基因主要包括OsMADS2、OsMADS4和OsMADS16。OsMADS16是浆片特征的主要决定基因[5], 在OsMADS16功能缺失突变体spw1-1中浆片和雄蕊分别转变为内稃边缘状器官和雌蕊[15], 另一个OsMADS16弱突变体cls中, 雄蕊发育正常, 但浆片伸长[16]。OSMADS2和OsMADS4是姊妹同源基因, OsMADS2调控浆片细胞分裂和导管分化[3], OsMADS4控制小花张开和雄蕊露出, 在OsMADS2 RNA干涉植株中, 浆片顶端明显伸长, 而OsMADS4 RNA干涉植株, 浆片并无显著变异, 但同时对OSMADS2和OsMADS4进行 RNA干涉, 其浆片突变成类内稃边缘状器官, 类似于spw1-1突变体浆片[4], 说明浆片分化发育需要OsMADS2和OsMADS4共同调控。这几个基因的突变体或RNAi植株都不能开颖, 主要是由于浆片的稃片化导致其正常膨胀和萎缩功能的丢失。另外OsMADS6、OsMADS32和SL1也参与了浆片的特征发育[6, 7, 8], 它们的突变体浆片均发生了稃片化或雄蕊/雌蕊化等特征改变, 但是由于这些突变体同时也表现颖壳的异常(它们的内外稃由于特征的改变本来就不能闭合), 所以无法判断浆片异常对开颖过程的影响。本研究中, sfo1突变体的浆片特征发育与野生型相比并没有明显的异常, 其吸水膨胀导致开颖的过程也完全正常, 主要的异常表现为小花开花后浆片失水萎缩缓慢, 导致内外稃不能闭合。sfo1浆片细胞持续膨胀的原因一方面可能是开花结束后诱导浆片细胞自溶的诱导因子缺失, 例如植物激素、水解酶等; 另一方面可能与浆片细胞自身的形态结构异常有关, 例如液泡膜、细胞壁的增厚, 维管束的堵塞等; 然而具体的分子机制, 还需进一步研究。另外, sfo1突变体总的来说表现出“ 开花时间延长” , 虽然由于它的颖花最终不闭合导致结实率降低, 但是“ 开花时间延长” 这个性状为将来通过分子设计改善杂交育种中亲本开花时间不同步的问题提供了依据, 将来如能成功实现“ 可控的开花时间” 将会很大程度地提高杂交制种的结实率。
本研究采用BSA法将目标基因SFO1定位在第5染色体SSR标记RM1054和ZTQ51之间, 物理距离为113 kb。预测基因有15个, 其中编码酶类基因4个、转座子基因3个、表达蛋白基因2个以及假定蛋白基因6个。其中LOC_Os05g50890编码吲哚乙酸酰胺合成酶, 其拟南芥同源基因AT2G46370编码一个茉莉酸酰胺合成酶, 是GH3蛋白质家族的一个成员。茉莉酸作为一种植物激素, 能诱导抗性基因表达, 气孔关闭, 在水稻中还能诱导颖花开裂[17]。预测基因LOC_Os05g50900编码一个螺旋-环-螺旋DNA结合蛋白, 在拟南芥中其同源基因FAMA促进气孔保卫细胞的分化而抑制分裂, 然而也有研究表明该转录因子可能与花序和种子发育有关[18]。因此, 我们将LOC_Os05g50890和LOC_Os05g50900作为SFO1的候选基因, 拟进行下一步的图位克隆和功能研究。
4 结论水稻sfo1突变体小花开颖后因浆片失水缓慢, 使开颖时间延长, 导致内外稃持续开裂不闭合, 表现出水稻持续开花的性状。该性状受1对隐性基因调控, 被精细定位在第5染色体的SSR标记RM1054和IN/DEL标记ZTQ51之间, 物理距离为113 kb。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] |
