 , 于太飞
, 于太飞 , 郑炜君
, 郑炜君
* 通讯作者(Corresponding authors): 郑炜君, E-mail: zhengweijun@nwsuaf.edu.cn; 柴守诚, E-mail: chaishoucheng@126.com 第一作者联系方式: E-mail: 13664207046@163.com
收稿日期:2016-12-20 接受日期:2017-04-20网络出版日期:2017-05-11基金:
摘要
关键词:大豆; 核因子Y; 表达模式; 启动子; 渗透胁迫
Soybean Transcription Factor Gene GmNF-YCa Enhances Osmotic Stress Tolerance of Transgenic Arabidopsis
LI Min
 , YU Tai-Fei
, YU Tai-Fei , ZHENG Wei-Jun
, ZHENG Wei-Jun
Fund:
Abstract
Keyword:Soybean; Nuclear Factor Y; Expression pattern; Promoter; Osmotic stress
Show Figures
Show Figures













病虫害等生物胁迫以及旱盐等非生物胁迫严重威胁着植物的生长, 影响着作物的产量和品质[1, 2]。由土壤水分缺失导致的渗透胁迫是其中主要胁迫之一。因此, 研究潜在的渗透胁迫分子机制有助于了解植物适应逆境的机制, 改善其产量和品质[3]。
植物在抵御环境胁迫的进化中形成许多分子机制, 包括增强胁迫保护基因的表达。转录因子在调节胁迫响应的功能基因中起着重要作用[1, 2]。核因子Y (NF-Y)转录因子家族就是其中之一。植物中的NF-Y家族是异源三聚体结构, 分别由A、B、C亚基组成[4]。亚基NF-YA能够与CCAAT结构域特异性结合[5]。NF-YB和NF-YC通过各自的组氨酸结构域形成紧密的二聚体。NF-Y通过二聚体与NF-YA互作来发挥其转录因子的作用[6]。NF-YA的氮末端和NF-YC的碳末端是由富含谷氨酰胺的疏水结构域构成, 是NF-Y复合体的转录激活域[7]。
在动物中, NF-Y复合体已经研究得较透彻。据报道, 在动物体内NF-Y能够激活发育相关的转录基因, 尤其是在细胞周期间[4, 8]。比如, NF-Y能够控制有丝分裂细胞周期蛋白的激活[9, 10]。另外, NF-Y在细胞增殖和早期发育中起着中心调控的作用。一项研究表明, 转基因鼠中NF-YA基因的失活导致发育早期发生胚致死现象[11]。与动物相比, NF-Y在植物中的研究甚少。动物体内, 一个NF-Y亚基是由一个基因编码的。而在植物体内, 一个NF-Y亚基是由一个基因家族编码的, 每个家族是由8~35个基因组成。在拟南芥中, NF-Y是由10个NF-YA、10个NF-YB以及9个NF-YC编码[12]。Stephenson等[13]通过计算分析整个DNA数据库发现, 小麦中有37个基因家族编码NF-Y (10个NF-YA、11个NF-YB和14个NF-YC)。植物基因组的一个显著性特征是由整个基因组复制或单个基因串联复制导致基因复制[14]。据报道, 许多种类的基因, 包括转录因子, 超过90%的数量增多是由整个基因组复制的结果[15]。例如, AtNF-YB6可能是蔷薇亚纲里的基因组按照一定的规律进化而来; MtNF-YB5可能是大豆基因组按照自然规律进化得到的[16]。
随着研究的深入, 人们发现NF-Y在植物中所起的作用越来越重要。研究表明, NF-Y家族中的一些基因在植物的各生长发育阶段起着关键的作用。Kumimoto等[17]证明NF-Y与植物的开花有关, 发现拟南芥AtNF-YB2与其亲缘关系极近的蛋白AtNF- YB3通过激活开花调节因子的表达来控制花期, 特别是在光诱导的条件下能够促进植物开花。另外, 在酵母中发现NF-YB亚基能够直接与CCAAT-box中的开花轨迹T启动子结合, 进而控制植物开花时间。LEC1 (LEAFY COTYLEDON 1)在拟南芥种子成熟的过程中起着重要的作用。Yamamoto等[18]发现拟南芥基因AtLEC1与NF-YC亚基结合后, 通过与种子中的ABRE特异结合因子互作, 激活下游基因转录, 说明NF-Y也参与植物种子的生长和发育。Stephenson等[13]通过试验验证了小麦基因TaNF-YB3在幼苗和叶子中受光调节显著, 能够上调与光合作用相关的基因。转基因小麦中转基因系的叶子叶绿素含量、光合作用速率和早期生长速率都有显著增加, 说明NF-Y与光合作用有关。据报道, NF-Y家族基因在提高抵御非生物胁迫能力方面也起着重要作用。Nelson等[19]通过对处理后的材料进行各胁迫相关参数的测量和计算, 发现AtNF-YB1和ZmNF-YB2能够提高转基因植物对干旱的耐性, 进而提高作物的产量。
大豆(Glycine max L.)是世界上种植面积最大的油料作物, 为人类和动物提供脂肪酸和蛋白, 对渗透胁迫比较敏感。本实验室在之前的研究中, 鉴定出7个大豆Di19基因[20], 其中GmDi19-5受干旱、过氧化物、ABA等胁迫诱导上调, GmDi19-5启动子在干旱、过氧化物、ABA等处理下能够增加GUS的活性[21]。为了进一步研究GmDi19-5的功能, 本实验室以pGBKT7-GmDi19-5为诱饵筛选大豆cDNA文库, 得到了一些可能与其互作的候选蛋白基因, 其中包括NF-Y家族成员, 命名为GmNF-YCa。本文旨在研究GmNF-YCa对渗透胁迫的响应及其功能, 为改良大豆抗逆性提供参考。
1 材料与方法1.1 实验材料大豆品种铁丰8号由中国农业科学院作物科学研究所邱丽娟研究员提供。以铁丰8号为材料建立大豆cDNA文库。本实验室在之前的研究中鉴定了7个大豆Di19基因, 其中GmDi19-5对非生物胁迫响应比较明显, 以pGBKT7-GmDi19-5为诱饵筛选大豆cDNA文库得到本文的GmNF-YCa基因。
1.2 植物材料的胁迫处理将大豆铁丰8号种植于蛭石中, 在培养室(23℃, 16 h光照和8 h黑暗)中生长10 d至2片叶时进行渗透胁迫处理。在甘露醇(200 mmol L-1)和蔗糖(8%)处理0、1、3、6、12、24和48 h时取样, 迅速冻于-80℃保存备用。
1.3 RNA的提取与表达模式分析利用植物总RNA提取试剂盒(天根, 北京)提取大豆样品, 用Prime Script RT reagent Kit with gDNA Eraser (TaKaRa, 大连)合成cDNA。以cDNA为模板, 大豆Actin基因(上游引物5'-CAGAGAAAGTGC CCAAATCATGT-3', 下游引物5'-TTGCATACAAGG AGAGAACAGCTT-3')作为内参, 设计GmNF-YCa特异引物(上游引物5'-CGTGAATCTCGAACACAT AAGAG-3', 下游引物5'-GGAAGAATTGATCGATG CAG-3'), 以SYBR Green染料法, 在Applied Biosystems 7500 Real-time PCR System上进行实时定量PCR。反应体总系为20 μ L, 含2× SuperReal Pre Mix Plus (含荧光染料)(天根, 北京) 10 μ L, 正向引物和反向引物各0.6 μ L, 50× ROX Reference Dye∆ 0.4 μ L, RNase-free ddH2O 8.4 μ L。所用程序为95℃预变性15 min, 95℃变性10 s, 60℃退火20 s, 72℃延伸30 s, 并收集荧光信号, 40个循环, 用2-∆ ∆ Ct法计算该基因表达量, 整理并分析数据[21]。
1.4 GmNF-YCa的生物信息学分析使用SWISS-MODEL在线软件(https://www. swissmodel.expasy.org/)预测GmNF-YCa蛋白的三级结构; 根据GmNF-YCa的氨基酸序列, 在NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi/)中Blast其同源序列, 使用在线软件PHYRE2 (http://www.sbg. bio.ic.ac.uk/phyre2/)及DNAMAN进行不同物种之间氨基酸同源比对; 为进一步研究NF-YC进化关系, 使用MEGA6软件绘制系统树; 从大豆基因组数据库Phytozome (http://phytozome.jgi.doe.gov/pz/portal. html)截取GmNF-YCa基因上游1300 bp作为启动子。利用植物顺式作用元件在线数据库PLACE (http:// www.dna.affrc.go.jp/PLACE/)和PlantCARE (plant cis-acting regulatory elements, http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)分析基因启动子, 预测顺式作用元件。使用在线软件The BAR and The Bio-Analytic Resource for Plant Biology (http:// bar.utoronto.ca/efpsoybean/)预测GmNF-YCa基因在大豆中的表达模式。
1.5 转基因拟南芥转化及纯合株系的获得所用拟南芥为哥伦比亚型CK。参考Beehtold等[22]的方法对基因GmNF-YCa遗传转化拟南芥, 将收获的T0代拟南芥种于含有潮霉素(700 μ L L-1)的MS培养基中, 筛选、扩繁至T2代获得转基因株系和同一时期的CK拟南芥种子。选取长势相同的, 两周龄的转基因拟南芥和非拟南芥(CK)幼苗, 提取RNA, 反转录合成cDNA。使用GmNF-YCa基因特异性引物和大豆Actin基因, 进行半定量RT-PCR, 反应总体系为20 μ L, 含2× Taq PCR Start Mix with Loading Dye (天根, 北京) 10 μ L, 上游引物和下游引物1 μ L, 模板1 μ L, ddH2O 7 μ L; 反应条件为95℃预变性3 min, 95℃变性15 s, 60℃退火15 s, 72℃延伸30 s, 35个循环, 72℃延伸10 min。选取表达量高的株系继续筛选、繁殖至T3纯合, 用于下一步的表型分析实验。
1.6 转基因拟南芥在蔗糖和甘露醇处理下的功能分析转基因拟南芥株系和CK经70%的酒精处理1 min后用水清洗3次; 于0.7% NaClO静置10 min, 用水洗去NaClO, 重复3次。将晾干的种子点于MS板上, MS板上分别添加4%、6%、8%的蔗糖和50、100和150 mmol L-1的甘露醇。其中, 没有添加任何处理的MS板作为对照。每个株系64粒种子, 重复3次。低温处理3 d后, 放于23℃的培养箱中(16 h光照, 8 h黑暗)。每隔12 h计数一次发芽率, 直至MS板上种子全部发芽。同时将MS板上长至5 d的转基因拟南芥和CK幼苗小心地转移至添加不同浓度处理(4%、6%、8%的蔗糖和50、100和150 mmol L-1的甘露醇)的MS板上, 垂直培养1周之后使用根系扫描仪(WINRHIZO proLA2400)分析其根长, 并统计鲜重, 试验重复3次。用方差分析确定转基因拟南芥和CK之间的表型差异。
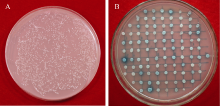
2 结果与分析2.1 GmNF-YCa基因的克隆为了进一步研究GmDi19-5的功能, 以pGBKT7- GmDi19-5为诱饵筛选大豆cDNA文库(图1), 得到了一些可能与其互作的候选蛋白基因, 包括GmNF-YCa。在大豆基因组数据库搜索发现, 大豆NF-YC家族有25个成员, 其中GmNF-YCa编码的氨基酸序列在第10~第70位氨基酸之间含有1个NF-YC基序, 属于NF-YC家族。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 GmDi19-5互作蛋白的筛选 A: 转化效率的检测; B: 在SD/Raf/Gal/X-gal上显蓝的阳性克隆。Fig. 1 Screening of interacting proteins with GmDi19-5 A: detection of conversion efficiency; B: positive clones on SD/Raf/Gal/X-gal plates. |
2.2GmNF-YCa基因的序列分析 对大豆基因组数据库分析发现, GmNF-YCa基因包含864 bp的开放阅读框(包括6个外显子和5个内含子, 外显子和内含子交替分布), 328 bp的5'非编码区, 276 bp的3'非编码区; 编码287个氨基酸, 分子量为31.6 kD, 等电点为5.07。氨基酸序列分析表明, GmNF-YCa为亲水性蛋白, 在开放阅读框内的前100个氨基酸中有一个跨膜结构域, 无信号肽。用SWISS-MODEL在线软件预测GmNF-YCa蛋白三级结构(图2), 为该蛋白三级结构的“ 飘带模型” 。建模所需的模板序列与目的序列的相似度达到60%, 说明预测结果接近实际结果。因此, GmNF-YCa蛋白是由无数个如图2所示的蛋白亚基按照一定的非共价键方式连接在一起, 经过各种修饰加工后具有其蛋白活性进而行使其调节功能。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 GmNF-YCa蛋白的三级结构预测Fig. 2 Tertiary structure prediction of GmNF-YCa |
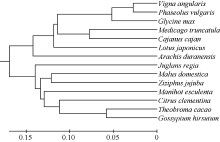
以GmNF-YCa蛋白为探针搜索NCBI数据库, 采用PHYRE2及DNAMAN进行氨基酸同源比对, 对该蛋白的氨基酸序列进行同源性分析发现(图3), 该蛋白与红豆、菜豆、金丝枣、苹果、蔓花生及陆地棉的相似度高达99.0%, 与苜蓿、百脉根、木豆、可可及克莱门柚的相似度达97.5%, 而与核桃和木薯的相似性也达到了96.0%, 说明NF-YC家族在进化过程中具有极高的保守性。进化树分析显示, GmNF-YCa与红豆的亲缘关系最近(图4)。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 物种间NF-YC保守域序列比对分析Fig. 3 Alignment of NF-YC motifs among various species |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 GmNF-YCa基因在不同物种中的系统发育分析 Vigna angularis: 红豆; Phaseolus vulgaris: 菜豆; Medicago truncatula: 苜蓿; Lotus japonicus: 百脉根; Cajanus cajan: 木豆; Arachis duranensis: 蔓花生; Theobroma cacao: 可可; Citrus clementina: 克莱门柚; Juglans regia: 核桃; Malus domestica: 苹果; Gossypium hirsutum: 陆地棉; Gossypium hirsutum: 金丝枣; Gossypium hirsutum: 木薯。Fig. 4 Phylogenetic analysis of GmNF-YCa gene in different plant species |
2.3GmNF-YCa启动子序列分析 为了研究GmNF-YCa基因的调控机制, 本研究对GmNF-YCa启动子进行分析。采用在线分析工具PLACE和PlantCARE对GmNF-YCa的启动子预测分析发现大量顺式作用元件。其中, 启动子的基本的调控元件TATA-Box位于起始密码子上游 -391 bp处, 增强子CAAT-Box位于起始密码子上游 -34、-322和-711 bp处; 另外, 该启动子还包括多种发育和胁迫响应元件, 如光响应元件ARE、Box 4、GATA-motif、Box I和ACE; ABA响应元件ABRE; 与分生组织表达有关的CAT-Box元件; 厌氧响应元件ACE等(图5和表1)。表明GmNF-YCa基因可能参与了ABA等胁迫响应、光反应过程以及大豆的伸长生长过程。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 启动子GmNF-YCa序列及预测的顺势作用元件Fig. 5 Predicted cis-acting elements of promoter GmNF-YCa |
表1
Table 1
表1(Table 1)
| 表1 启动子GmNF-YCa序列中的顺式作用元件及预测的功能 Table 1 The cis-acting elements and predicted function of promoter GmNF-YCa |
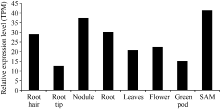
2.4GmNF-YCa组织特异性及表达模式分析 将GmNF-YCa的初始基因ID输到在线软件The BAR and the Bio-Analytic Resource for Plant Biology的相应方框内, 对GmNF-YCa进行组织特异性分析, 结果表明(图6), GmNF-YCa主要在根毛、根瘤、根、以及种子萌发期表达, 其中在种子萌发期表达量最高, 为41.28 TPM (transcripts per million); 在根尖表达量最低, 为12.50 TPM。这表明GmNF-YCa主要在根的部位以及萌发期表达, 可能与根吸收外界营养、渗透胁迫有关, 可能与根瘤的产生和生长有关。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 GmNF-YCa基因在不同大豆组织中的表达量Fig. 6 Expression levels ofGmNF-YCa gene in different soybean tissues TPM: transcripts per million. |
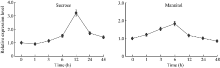
为了进一步解析渗透胁迫对GmNF-YCa基因表达的影响, 对10 d的大豆幼苗进行蔗糖和甘露醇胁迫处理, 进行实时荧光定量PCR检测GmNF-YCa在渗透胁迫下的表达量。如图7所示, 蔗糖和甘露醇胁迫处理对GmNF-YCa基因表达量都有影响, 但是表达方式不同。在蔗糖处理下, 表达量开始逐渐上升到12 h时达到峰值, 为处理前表达量的3倍, 之后GmNF-YCa基因表达量随着时间的增加逐渐下降; 而在甘露醇处理下, GmNF-YCa基因表达量逐渐上升, 至6 h时达最高值, 表达量提高了2倍。这些数据表明, GmNF-YCa基因受蔗糖和甘露醇的诱导表达。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 GmNF-YCa基因在渗透胁迫处理下的表达情况Fig. 7 Expression levels of GmNF-YCa gene under osmotic stresses |
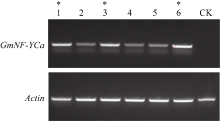
2.5 转基因拟南芥检测以及纯合株系的获得本试验使用半定量PCR对所有T2代株系的模板进行表达量检测(图8)。在内参Actin基因跑出条带亮度几乎相同的情况下, GmNF-YCa基因相对应的条带亮度的大小表明该基因在拟南芥中表达量的高低。本实验从6个株系中找到表达量比较高的3个株系1、3和6, 为方便下一步发芽试验, 分别命名为35S::GmNFYCa-1、35S::GmNFYCa-2和35S:: GmNFYCa-3。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 GmNFYCa转基因拟南芥株系的表达量检测Fig. 8 Expression level of GmNFYCain transgenic Arabidopsis |
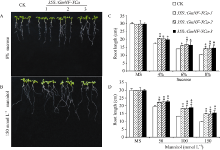
2.6GmNF-YCa在渗透胁迫下的发芽率 转基因拟南芥植株与对照拟南芥植株的发芽率在不同浓度的蔗糖(4%、6%和8%)和甘露醇(50、100和150 mmol L-1)处理中存在明显的差异。其中, 在对照MS板上, GmNF-YCa转基因与对照拟南芥在整个萌发过程中基本没有明显差异(图9-A)。经过处理的拟南芥的发芽时间比未处理的拟南芥的发芽时间要晚, 但是同一浓度的胁迫处理下, 转基因拟南芥的发芽率始终高于CK (图9-B和9-C), 且随着甘露醇和蔗糖处理的浓度的增加, 显著性升高。在4%、6%蔗糖和100 mmol L-1和150 mmol L-1甘露醇的处理下转基因拟南芥的发芽率高于CK且已达到极显著水平(图9-D和图9-E)。例如6%浓度的蔗糖处理下, 转基因拟南芥发芽率平均达到41.5%, 而对照组发芽率平均为31%; 100 mmol L-1甘露醇处理中, 转基因拟南芥发芽率90%左右, 而对照只有60%左右。说明GmNF-YCa的转基因提高了转基因拟南芥萌发期对渗透胁迫的耐性。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 转基因拟南芥植株在蔗糖和甘露醇条件下的发芽率分析 * 和* * 表示在5%和1%水平上差异显著。Fig. 9 Germination rate of transgenic Arabidopsis lines in sucrose and mannitol treatments * and * * denote significant difference at 5% and 1% probability levels, respectively. |
2.7 转基因拟南芥苗期在渗透胁迫下的表型转基因拟南芥在模拟渗透胁迫下的根长发育试验表明, 在正常MS培养基上, 转基因拟南芥根长与CK比较没有明显差别, 而在不同浓度蔗糖和甘露醇处理的根长有明显差异(图10)。在各胁迫处理下, 拟南芥根长小于未处理的拟南芥根长, 但是同一个培养基上转基因拟南芥的根长要高于CK (图10-A, B), 而有的已经达到显著水平(图10-C, D)。其中, 8%的蔗糖处理下的转基因拟南芥根长平均为14.4 cm, 而对照组拟南芥平均为10.4 cm; 150 mmol L-1的甘露醇处理下转基因拟南芥根长平均为15.2 cm, 而对照组拟南芥的根长仅为10.0 cm (图10-C, D)。以上结果表明在植物中GmNF-YCa基因的表达可以显著提高转基因拟南芥苗期的渗透胁迫耐性。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 转基因GmNF-YCa拟南芥植株在蔗糖和甘露醇条件下的根长试验分析 * 和* * 表示在5%和1%水平上差异显著。Fig. 10 Root primary length analysis under sucrose and mannitol conditions * and * * denote significant difference at 5% and 1% probability levels, respectively. |
3 讨论转录因子通过与启动子的顺式元件结合调节下游基因表达, 对植物各生长阶段以及逆境胁迫响应等具有重要作用[1, 2]。本研究中GmNF-YCa属于NF-YC亚家族。NF-YC亚家族在植物中是个庞大的家族, 在进化中, 保守域在各个物种、各个进化阶段都高度保守, 如本次试验中与苹果、核桃、克莱门柚等作物的相似度高达96%以上。
很多报道证明, NF-YC家族能够受光照的调节而影响开花。在植物中第1个被发现并克隆出的基因为拟南芥AtNF-YC2, 它是由光合作用基因AtpC通过酵母双杂交技术筛库得到的, 说明两者的互作与光照有关[23]。有试验证实, NF-YC通过与CO特异性结合影响植物的开花, 其中, CO能够激活相关转录因子来控制植物开花[24]。NF-YC还能够上调云杉花粉的生长[25]。5个小麦NF-YC基因(TaNFYC5、TaNF-YC8、TaNF-YC9、TaNF-YC11和TaNF-YC12)受光照的调节, 而TaNF-YC11与光合作用的基因共调节[26]。GmNF-YCa启动子顺式元件中光响应元件较多, 预测GmNF-YCa的功能可能与光照和植物开花有关, 但是具体的作用机制还要进一步探究。
渗透胁迫威胁着作物的生长和产量。NF-Y家族基因在渗透胁迫中起着极其重要的作用。大豆基因GmNF-YA3的转基因拟南芥能够提高抗旱能力, 并且在ABA处理下通过激活ABA相关表达基因提高对ABA的胁迫响应能力[27]。白杨基因PdNF-YB7转入拟南芥中也被发现具有抗旱能力[28]。通过逆境下相关参数如叶绿素的含量、气孔开度、叶表温度等的测量, 转基因ZmNF-YB2玉米在干旱的处理下能够提高作物的产量[19]。微列阵分析显示, 拟南芥基因AtNF-YA5通过介导相关基因的表达能够提高作物的抗旱能力[29]。而关于NF-YC亚家族的研究着重于生物钟等方面, 但抗逆相关的报道很少。一般情况下, NF-Y家族的3个亚家族都是结合为三聚体才能发挥其作用, 而NF-YA、NFYB已经报道在许多逆境中起着不同的作用。所以, NF-YC亚家族可能也与逆境胁迫相关。GmNF-YCa启动子顺式元件中含有在干旱和高盐胁迫条件下能够提高基因的表达的ABRE元件, 可猜测其与干旱、高盐等渗透胁迫有关。本试验用不同浓度的蔗糖和甘露醇胁迫处理模拟渗透胁迫, 转基因GmNF-YCa拟南芥植株的忍受胁迫能力都比对照高(图9和图10), 说明GmNF- YCa参与渗透胁迫响应, 而NF-YC亚家族在抗逆方面的作用仍需进一步研究。
4 结论通过酵母双杂交技术筛库获得了大豆GmDi19-5的互作候选蛋白基因GmNF-YCa, 该基因转化拟南芥后受蔗糖和甘露醇上调诱导表达; 在甘露醇和蔗糖处理下, 转基因拟南芥比CK发芽率高、根长和侧根伸长明显。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] |
