王金星1,2


1.山东大学生命科学学院, 山东省动物细胞与发育生物学重点实验室, 山东 济南 250100;
2.山东大学微生物技术国家重点实验室, 山东 济南 250100
收稿日期:2017-08-15;修回日期:2017-11-04;网络出版日期:2017-11-28
基金项目:国家自然科学基金(31630084,31472303)
*通信作者:王金星, Tel/Fax:+86-531-88364620;E-mail:jxwang@sdu.edu.cn
摘要:对虾等甲壳类动物体内存在2个菌群:肠道菌群和血淋巴菌群。肠道菌群的种类和数量较多,而血淋巴菌群较少。两种菌群均包含益生菌和致病菌,在宿主体内代谢、营养和免疫反应中发挥重要功能。肠道菌群动态平衡的调控主要通过双氧化酶产生的活性氧来完成;血淋巴菌群通过C-型凝集素调控的抗菌肽表达及酚氧化酶原激活系统来维持其动态平衡。阐明对虾等甲壳类体内菌群的组成、功能和动态平衡调控的机理,可以为对虾等经济甲壳类健康养殖的微生态制剂开发和疾病控制提供指导。
关键词: 体内菌群 动态平衡 活性氧 抗菌肽 甲壳类
The gut and hemolymph microbiotas of crustacean, composition, functions and homeostatic regulation
Jinxing Wang1,2


1.Shandong Provincial Key Laboratory of Animal Cells and Developmental Biology, School of Life Sciences, Shandong University, Jinan 250100, Shandong Province, China;
2.State Key Laboratory of Microbial Technology, Shandong University, Jinan 250100, Shandong Province, China
Received 15 August 2017; Revised 4 November 2017; Published online 28 November 2017
*Corresponding author: Wang Jinxing Tel/Fax: +86-531-88364620; E-mail:jxwang@sdu.edu.cn
Supported by the National Natural Science Foundation of China (31630084, 31472303)
Abstract: Two microbiotas were identified in shrimp and other crustaceans, gut and hemolymph microbiaotas. The microbe species and number of gut microbiota are much more than that in hemolymph microbiota. They all contain probiotic and pathogenic bacteria in the two microbiotas. The gut and hemolymph microbiaotas have important functions in host metabolism, nutrition and organic development and immune responses. Different regulation mechanisms were identified in shrimp for homeostasis of gut and hemolymph microbiaotas. The reactive oxygen species produced by dual oxidases is mainly involved in homeostatic regulation of gut microbiota; and antimicrobial peptides regulated by a C-type lectin and prophenoloxidase activating system are related to homeostatic regulation of hemolymph microbiota. The studies of composition, functions and homeostatic regulation of microbiotas in shrimp are beneficial for healthy aquaculture of shrimp and other economic crustaceans.
Key words: microbiota in vivo homeostatic regulation reactive oxygen species antimicrobial peptides crustacean
很多甲壳类包括对虾和蟹类都是重要的海水养殖经济动物。据2016年中国渔业统计年鉴的统计数据显示,2015年我国海产甲壳类养殖面积为314.22×107 m2,产量达143.49万t。我国对虾产量约占世界养殖总产量的40%左右,每年可创造超过数百亿元的产值[1]。对虾等甲壳类对环境条件敏感,且生长周期相对较长,因此其养殖易受病害侵袭。危害对虾养殖的病原主要有病毒、细菌、真菌、寄生虫等,其中以前两种病原的危害最大。例如自1992年起,爆发性流行的病毒性疾病白斑综合征等给对虾养殖业造成巨大损失,至今影响犹存;2009年以后的对虾早期死亡综合征/急性肝胰腺坏死综合征(early mortality syndrome/acute hepatopancreatic necrosis disease,EMS/AHPND) (主要由高致病力副溶血弧菌所释放的毒素引起),以及近年来又发现偷死病(viral covert mortality disease,VCMD) (偷死野田村病毒引起)也使对虾养殖业蒙受重大损失,特别是EMS/AHPND,得病后1周内的死亡率可达到100%。目前,对于病毒病,尤其是危害最大的白斑综合征(病原为白斑综合征病毒,white spot syndrome virus,WSSV)以及黄头病(由黄头病毒yellow head virus,YHV引起)等,尚无有效治疗方法;虽然细菌性疾病可使用抗生素治疗,但存在诱发耐药菌株和食品安全等问题。疫苗接种为近年来的新兴防治方法,但对于缺少适应性免疫的对虾来说还不太适用。由于养殖环境的脆弱,现在对虾养殖业面临的最大问题是新的病害不断涌现,即老的病害问题还没有完全解决,新的病害又会不断出现。因此需要从环境-病原-宿主不同层面开展系统及整合研究,才有可能找出一条适于对虾健康养殖之路。
近年来对虾先天免疫研究虽然取得了很大进展[2-3],勾勒出了对虾的免疫反应从模式识别、信号转导到效应分子的基本框架;病原传播、检测、致病机理等研究方面也取得了很大成绩;养殖环境的生态调控及微生物组成及分布也开展了相关研究;但如何将三者有机地联系起来,还缺乏一个桥梁。而对虾的体内菌群是连接环境与宿主的一个桥梁(图 1),因为体内菌群既与环境密切相关,又在对虾体内与宿主密切接触。不断积累的研究工作证明,对虾体内存在消化道和血淋巴2个微生物菌群[4],分别称为消化道菌群(gut microbiota,GM)和血淋巴菌群(hemolymph microbiota,HM)。健康对虾中这些微生物菌群都保持相对稳定,这时对虾的抗病力强,而打破菌群平衡以后对虾就会发病,即肠道和血淋巴菌群的变化与对虾疾病的发生密切相关。揭示对虾肠道菌群和血淋巴菌群的组成及结构,了解对虾正常情况和病原感染过程中肠道和血淋巴菌群结构的变化,不同环境对对虾体内菌群的影响,宿主免疫防御反应的静止与激活的分子调控机理,发现消化道和血淋巴免疫中的重要效应基因,最终阐明体内菌群动态平衡调控的分子机理,在理论上有望获得对动物血淋巴和肠道免疫的新的认识,丰富和完善无脊椎动物的先天免疫理论;在实践上有的放矢地控制病害的发生与流行,开发新的病害防治方法具有指导作用,对于解决困扰对虾养殖业的疾病防治具有重要的理论和实际意义。近年来对对虾等甲壳类动物体内菌群的组成及调控研究方面取得了一些进展。本文将从肠道菌群和血淋巴菌群2个方面进行简要综述。
 |
| 图 1 环境-病原-宿主与体内菌群的关系 Figure 1 The relationship between environment, host and pathogens with microbiota in vivo |
| 图选项 |
1 肠道菌群 肠道与微生物之间的相互作用属于非常复杂的原核生物与真核生物之间的相互作用。要搞清楚这种复杂的关系,需要先了解一下肠道的基本结构。
1.1 消化系统的结构 肠道是一种持续暴露于各种各样的外界生物和非生物因子的器官,这些外界因子不仅包括对其无害的食物来源的物质和共生微生物,还包括病原性细菌、病毒、真菌和寄生虫等。哺乳动物消化系统的肠道分化比较复杂,主要包括小肠和大肠等。小肠上皮由4种类型的细胞组成,包括柱状上皮细胞、帕内特细胞(或称潘氏细胞paneth cells)、内分泌细胞和杯状细胞(goblet cells)[5]。这些上皮细胞形成了一个物理屏障将宿主与外界环境分隔。其中潘氏细胞是小肠内一种少见的细胞,其功能类似于中性粒细胞。在细菌或细菌抗原侵犯机体时,潘氏细胞分泌一些抗菌肽分子如防御素到小肠管腔的绒毛[6-7],以利于维持胃肠道屏障。上皮细胞可以接受管腔抗原的刺激并将信号传递到不同类型的免疫反应细胞用以启动或终止免疫反应。昆虫的肠道在结构上与脊椎动物存在某些相似,并且都含有复杂的菌群。两者的肠道都是高度分室化的管状器官,管腔内层衬有单层上皮细胞,上皮细胞上具有围食膜(相当于高等动物的粘液)保护,作为防御微生物入侵的第一道物理防线[8]。
对虾的消化系统分为消化道和消化腺。消化道像昆虫一样分为前肠、中肠和后肠三部分,消化腺主要为肝胰腺。消化道前肠包括口腔、食道和胃(贲门胃和幽门胃),它们的内壁表面均有几丁质层覆盖。贲门胃呈长囊状,几丁质内壁的结构是磨碎食物的器官;幽门胃接于贲门胃之后,较窄小,是消化与过滤食物的场所。中肠是一条简单直管,前端与幽门胃相连。中肠的结构主要由围食膜、上皮细胞、基膜、肌肉和结缔组织等构成,上皮细胞为单层柱状上皮细胞,肠壁向腔内突出许多皱褶,内壁无几丁质层覆盖,但有围食膜保护。环肌层连续、纵肌成束分散排列于环肌远腔侧。中肠有前后盲囊,作为与前肠和后肠的分界。后肠即直肠,来源于外胚层。后肠后端开口于尾体节腹面,成纵裂缝状肛门。肠壁常凸出形成垫状隆脊,从前端纵延到后端。内壁覆有几丁质层。上皮细胞柱状,后肠壁环肌较发达,纵肌分布与中肠不同,前段和后段纵肌分别分布于环肌远腔侧和近腔侧[9]。肝胰腺是主要的消化腺,与中肠同源,是成对黄褐色大腺体,但多数愈合成一个块状腺体,位于胸部中后区、心脏的前方腹面,包围着大部分幽门胃和小部分中肠。肝胰腺由分支的肝管组成,初级肝管一对,其分支为次级肝管,后经多次分支以至成肝小管,各级管由结缔组织连结一起。外表包裹一层被膜,组成完整的肝胰腺。各级肝管虽有粗细之分,但肝管壁皆由单层柱状细胞组成[9]。
对虾的胚胎发育过程中,中肠与前肠、后肠的胚胎来源不同,而且肠道的组织结构也不尽相同,前肠和后肠都是外胚层来源,中肠来源于内胚层。在中肠中缺少几丁质层覆盖,其结构简单,同时是病原感染的首发部位,例如白斑综合征病毒(WSSV)已被证明主要通过口与消化道感染对虾[10]。最近的研究表明,胃部也是病原感染的重要部位[11]。
1.2 肠道菌群的组成 动物的肠道中存在大量的各种各样的微生物,例如在人的肠道中有1014个微生物细胞,大约500–1000种不同种类的细菌。其细胞总量几乎是人体自身细胞的10倍,其编码基因的数量是人体自身基因的100多倍[12-13]。实验室养殖果蝇肠道中发现1–30种细菌,其中多数为乳酸菌Lactobacillus和醋酸杆菌属Acetobacter的细菌[14]。这些肠道菌群包括有益的共生菌、非共生菌、食物携带的微生物以及致病菌等。这些微生物并不是孤立的,它们在肠道内组成了一个处于动态平衡的微生态系统[15]。在这个系统中,微生物与微生物、微生物与宿主之间存在着一种既相互共生又相互竞争的动态平衡且复杂的关系。在有利于宿主方面,微生物可以提供必要的营养因子,如维生素,提高人体从食物中获取营养的能力,补充人体基因组编码的有限的碳水化合物代谢酶,定居的微生物菌群形成了一个缓冲区可以限制致病菌进入[16]。而各种不同因素(食物改变、抗生素使用和病原菌侵入等)会导致菌群结构改变,破坏菌群组成的平衡,改变菌群代谢网络,造成生态失调,影响抑制肠道炎症的免疫调控网络,从而使宿主限制菌群入侵的能力下降,一些致病菌就会进入组织引起疾病,最后导致炎性肠病或其他疾病。通过对肠上皮细胞和干细胞进行功能研究,证明了曾经一度被认为是简单的物理屏障的肠上皮细胞(intestinal epithelial cells,IEC),是重要的保持肠道免疫动态平衡的细胞,在探测肠内微生物环境,识别抗原和共生微生物,以及调节抗原递呈细胞的功能、免疫细胞和淋巴细胞的功能等方面有重要作用[17-18]。
肠道是对虾体内重要的消化吸收器官,肠道内也寄居着数量庞大、结构复杂的菌群,与宿主相互依赖、相互制约,在长期的进化过程中形成独特的肠道微生物系统。虾类肠道菌群的组成受多种因素的影响,不同种类、不同阶段或者不同生长环境的虾类之间菌群既有其共性,也有差异性。对虾的肠道菌群的早期研究主要集中在肠道可培养细菌。Oxley等比较了野生和养殖对虾的肠道菌群,发现它们具有非常相似的细菌菌群,包括气单胞菌属Aeromonas、邻单胞菌属Plesiomonas、发光菌属Photobacterium、假交替单胞菌属Pseudoalteromonas、假单胞菌属Pseudomonas和弧菌属Vibrio[19]。这种在野生和养殖对虾中显著相似的肠道菌群的组成说明宿主中肠道微生物群落稳定的重要性。李可等采用分子生物学手段对实验室养殖条件下的南美白对虾肠道细菌的多样性进行了研究,鉴定出的细菌分别为希瓦氏菌属(Shewanella)、泛菌属(Pantoea)、Aranicola属、假单胞菌属(Pseudomonas)和弧菌属(Vibrio)[20]。李继秋等对同一养殖池中的感染白斑综合征病毒(WSSV)和未感染WSSV对虾的肠道
菌群进行了鉴定。发现两种对虾在肠道菌群组成、细菌数量上存在显著的差异,表明对虾肠道菌群组成和机体的健康状态密切相关[21]。宛立等在对虾肠道内分离出100多株菌,分属12个菌属。比例最大的为气单胞菌属(32/111)和发光杆菌属(19/111),在体外抑制大肠杆菌、金黄色葡萄球菌和弧菌等的生长[22]。最近,Xiong等采用16S rDNA测序方法对宁波地区养殖对虾在健康、亚健康和疾病条件下的肠道菌群的多样性变化进行了比较,从菌群多样性方面显示出明显差异[23]。发现对虾中主要细菌为变形菌门Proteobacteria (包括a-和g-变形菌)、拟杆菌门Bacteroidetes、浮门菌门Planctomycetes和放线菌门Actinobacteria,占到所有细菌的79%。另外厚壁菌门Firmicutes、梭杆菌门Fusobacteria和软壁菌门Tenericutes是次要菌群。近期还有人对泰国野生和养殖斑节对虾(Penaeus monodon)的肠道菌群进行了比较,在野生和养殖虾中均发现了5个门的细菌,包括放线菌门Actinobacteria、梭杆菌门Fusobacteria、变形菌门Proteobacteria、厚壁菌门Firmicutes和拟杆菌门Bacteroidetes,发现野生和养殖斑节对虾Peneaus monodon肠道菌群相似性达到97%[24]。我们对山东地区日本囊对虾Marsupenaeus japonicus的肠道菌进行了16S rRNA分析,结果显示其肠道菌群包括变形菌门Proteobacteria (a、b、g和e变形菌类)、拟杆菌门Bacteroidetes (拟杆菌类、黄杆菌类和鞘脂杆菌类)以及厚壁菌门等(未发表资料)。从上面的数据可以看出,虽然存在着一些细菌的共有类群,但不同地区对虾肠道菌群的组成也存在一定的差异。
1.3 肠道菌群的功能 在哺乳动物和人类中的研究表明,肠道菌群作为机体不可分割的“器官”,对宿主的生理活动有很大影响,其作用主要表现在生物屏障作用、促消化、营养吸收作用、免疫作用、抗肿瘤作用和在生长、发育及老化中的作用等。大量研究还表明肠道菌群与肥胖、糖尿病等多种疾病有关。
在对虾等甲壳类动物中肠道菌群的功能研究较少。归纳起来,主要表现在以下几个方面。
1.3.1 肠道菌群在对虾的食物消化吸收方面有重要功能:: 肠道细菌重要的代谢功能是能够发酵降解宿主本身不能消化分解的大分子植物多糖(抗性淀粉、纤维素和半纤维素等)及某些脂类物质,为宿主提供能量及细菌生长繁殖所需要的营养物质。例如肠道中的菌群可以产生不同的细胞外酶类,对对虾食物中主要成分起消化作用。有研究表明肠道中的菌群(主要包括弧菌和假交替单胞菌属)可以产生淀粉酶、脂肪酶/酯酶和几丁质酶等,都会对对虾食物的消化起着重要作用[25]。
1.3.2 在免疫防御中的功能表现在肠道菌群的稳定有助于提高对虾的抗病力:: 研究者通过比较斑节对虾Peneaus monodon和凡纳滨对虾Litopeneaus vannamei在弧菌感染条件下的成活率的不同,发现凡纳滨对虾对弧菌感染有较大抵抗力。进一步研究斑节对虾和凡纳滨对虾肠道菌群在病原菌胁迫下的动态变化,发现病原菌弧菌属的相对丰度在斑节对虾中较高,而在凡纳滨对虾肠道中菌群则相对稳定。说明菌群的稳定性可以抵抗病原菌的侵染,这可能与稳定菌群可以竞争性排斥病原菌有关[26]。李继秋等对同一养殖池中的感染白斑综合征病毒(WSSV)和未感染WSSV的对虾肠道菌群进行了鉴定。从感染WSSV的对虾肠道中分离到了弧菌属、气单胞菌属、海水球菌属、盐水球菌属、乳酸杆菌属等5个属的细菌,从未感染WSSV的对虾肠道中分离了弧菌属、气单胞菌属、盐水球菌属和乳酸杆菌属等4个属的细菌,其中未感染WSSV对虾肠道中弧菌和乳酸菌所占比例显著地高于感染WSSV对虾,而气单胞菌的比例显著地低于感染WSSV对虾。即两种对虾在肠道菌群组成、细菌数量上存在显著的差异,表明对虾肠道菌群组成和机体的健康状态密切相关[21]。另外,也可能像高等动物那样,对虾的肠道菌群对宿主肠道免疫细胞的激活也起着重要作用,并且具有重要的防止病原侵染的屏障作用,这还有待于进一步研究。
1.3.3 肠道菌群能够促进肠道等组织器官的生长和发育:: 对很多高等动物的研究都表明,无菌动物的肠道、免疫器官等的发育会受到很大影响。对虾中也有类似的报道,例如有人利用采用含嗜酸乳酸杆菌的饵料对南美白对虾饲养时进行试验,发现添加一定浓度嗜酸乳酸杆菌能有效提高南美白对虾的生长指标和免疫指标[27]。
1.4 肠道菌群的动态平衡调控 肠道菌群的功能及其动态平衡调控已成为一个新的研究热点领域。在哺乳动物、昆虫(特别是模式生物果蝇)中取得了很多重要的进展。肠道与微生物之间的相互作用属于一种非常复杂的原核生物与真核生物之间的相互作用。在肠道上皮先天免疫反应中,抗菌肽和活性氧(ROS)通过控制有益的共生菌和清除有害菌而参与调节肠道与微生物之间的动态平衡。
哺乳动物肠道上皮细胞可以接受管腔抗原的刺激并将信号传递到不同类型的免疫反应细胞用以启动或终止免疫反应。上皮细胞和免疫反应黏膜细胞相互调节和相互作用,导致了肠道免疫的动态平衡。研究中发现了大量的免疫调控分子参与其中,例如上皮细胞产生的胸腺基质淋巴蛋白(TSLP)限制树状细胞的炎症细胞因子的产生[28-29],而上皮细胞的增殖和分化要受到小肠T细胞产生的上皮细胞生长因子所控制[30]。在大量的免疫调控分子中,MicroRNA (miRNA)是一类在动物和植物细胞中发现的新的调控分子。研究发现这些小RNA分子在肠道细胞免疫动态平衡的建立中也具有重要作用[31]。
肠道粘膜建立和保持适当的免疫静止和免疫激活需要小肠上皮细胞和免疫反应粘膜细胞之间高度复杂的免疫调控系统。利用果蝇的研究表明,肠道上皮细胞具有清除感染微生物而耐受有益微生物的策略,为了达到这种耐受,在正常情况下,肠道上皮具有不同的负调控NF-kB信号通路从而抑制抗菌肽的表达,还可以负调控双氧化酶-活性氧系统(DUOX-ROS)而抑制活性氧的产生,因此使益生菌在体内存在。然而,在感染条件下,则可以激活NF-kB信号通路和DUOX-ROS系统,产生抗菌肽和活性氧而杀死病原菌[32]。进一步研究发现细菌来源的尿嘧啶可以调控ROS的产生,在果蝇肠道免疫的宿主与微生物相互作用中发挥重要作用,包括病原清除、共生菌保护、肠道细胞再生与病变及器官内的免疫通讯等[33-34]。双氧化酶(DUOX)的激活是果蝇抵抗肠道感染的重要防线。该酶的激活受磷脂酶C-β (PLCb)依赖的钙动员调控。而DUOX基因的表达是受MEKK1-p38丝裂原激活的蛋白激酶途径调控,细菌来源的尿嘧啶可作为激活DUOX通路的配体。最近的研究发现尿嘧啶刺激Hegehog信号,该信号上调钙黏蛋白(cadherin99C,Cad99C)的表达,Cad99C与PLC和蛋白激酶C诱导信号配体的形成,促进胞内钙离子动员而激活DUOX[35]。Cytokine/Jak/Stat信号途径也可以协调果蝇中肠的再生和微生物群落的动态平衡[36]。利用基因组范围的RNAi筛选,果蝇中参与肠道抗细菌感染免疫反应的大量基因被鉴定出来,证明了Jak-Stat信号途径控制肠中宿主抗菌免疫防御,通过调节干细胞增殖来形成表皮细胞动态平衡[37]。另外还有研究发现,在果蝇和人类的肠道等多种组织中转录因子FOXO可以不依赖于病原刺激调控的抗菌肽的表达[38]。
对虾肠道菌群的调控研究刚刚开始。在以往的研究中,研究者多通过注射病原感染对虾的方式观察免疫相关基因在对虾不同组织器官中的表达调控。而对虾在饲喂条件下肠道病原感染后引发的免疫反应目前报道还不多。有人用含有弧菌的水体浸浴对虾后,选择已知的15种免疫相关基因,研究它们在消化道内表达变化情况和消化道的组织学变化[39],发现病原菌只引起抗菌肽分子(如抗脂多糖因子ALF、甲壳肽Crustin和对虾素Penaeidin)在肠道表达很小的变化,但能诱导C-型凝集素、Tachylectin和围食膜蛋白等分子的高表达,其他基因的表达基本没有变化。组织学研究表明,弧菌感染可以破坏某些部位的中肠上皮。我们的工作表明当病原感染后,围食膜蛋白在胃和肠道中明显诱导表达,发夹结构域丝氨酸蛋白酶也在消化道内高表达[40-42]。最近,我们建立了径口感染弧菌的方法,鉴定了两种双氧化酶(DUOX1和DUOX2)在肠道菌动态平衡调控中的功能。经口感染弧菌后,肠道中两种双氧化酶均上调表达,且活性氧(ROS)水平升高。通过RNA干扰的方法敲低双氧化酶基因的表达,肠道中活性氧(ROS)水平下降,细菌数量升高。利用RNA干扰技术敲降双氧化酶的表达并感染病原菌后,对虾存活率明显下降。上述结果表明,能够产生ROS的双氧化酶在对虾肠道菌群的动态平衡调控中发挥重要作用[43]。并发现双氧化酶的表达水平受有丝分裂原活化蛋白激酶P38途径调控,并通过释放Ca2+,增强DUOXs的活性,使肠道产生ROS,调控肠道菌群的平衡(未发表资料)。对虾肠道中多余的活性氧是如何清除的?我们从日本囊对虾中克隆得到的一种过氧化氢酶,并命名为MjCAT[44]。经口感染弧菌后,肠道中MjCAT的表达量上调,酶活性升高,ROS含量在短时间内上调并很快恢复正常水平。当用RNAi方法将MjCAT基因表达敲低后发现,ROS水平升高,并能保持较长时间。同时,对虾肠道内的细菌数量与对照组相比明显降低。干扰MjCAT并感染病原菌,虽然细菌数不比对照高,但对虾存活率却显著降低。进一步观察MjCAT干扰后对虾肠道的组织结构,发现肠腔中绒毛受到了损伤。这些结果表明,MjCAT可以调节肠道中ROS水平并调控宿主肠道与微生物间的稳态平衡(图 2)。
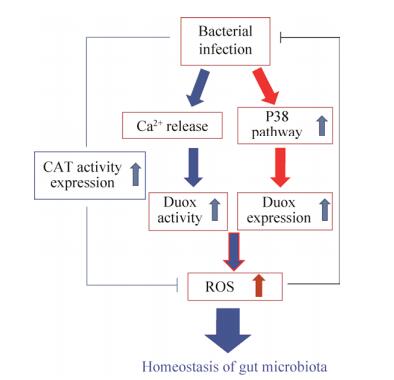 |
| 图 2 对虾肠道菌群动态平衡的调控机理 Figure 2 Homeostatic regulation of gut microbiota. Cat: Catalase; Duox: Dual oxidases; P38: p38 MAPK; ROS: Reactive oxygen species. |
| 图选项 |
2 血淋巴菌群 2.1 对虾循环系统与血淋巴 根据大多数教科书上的描述,对虾等甲壳类的循环系统为开管式循环。循环系统的血管不发达,体内循环的血淋巴,包括血淋巴细胞和血淋巴液,可以散布到对虾不同的组织器官。但最近的一些研究表明,十足类甲壳动物具有发育良好的心血管系统,被称为“不完全的闭管式”循环系统[45-46](图 3)。心脏有心孔,外部有围心窦。从心脏的前后端分别发出前大动脉和后大动脉,并通过小动脉将血淋巴送达不同的器官。虽然细小动脉的末端不联通毛细血管,但由纤维结缔组织构成的血窦形成较大的管道状,从而形成部分封闭的循环系统[47]。由于对虾等甲壳类缺少独立的淋巴循环系统,因此其循环系统内的液体与脊椎动物的血液不同,还包含其组织液,所以甲壳类的血液一般称为血淋巴。体内循环的血淋巴,包括血细胞和血淋巴液,其中含有蛋白质、糖类及Na+和CI?等离子。
 |
| 图 3 十足目甲壳类的不完全闭管式循环系统 Figure 3 The "incompletely closed" circulatory system of decapoda crustacean. A: Circulatory system of shrimp; B: Schematic diagram of circulatory system of shrimp (from reference[45]). |
| 图选项 |
对虾的血细胞在体液免疫和细胞免疫中发挥着重要的作用。虾类的细胞免疫包括细胞吞噬作用、细胞凋亡及细胞粘连、结节形成、包被作用和胞外诱捕网等。目前虾类等甲壳动物血细胞依据其形状和大小,可分为颗粒细胞(granular cell)、半颗粒细胞(semigranular cell)和透明细胞(hyaline cell)三种。颗粒细胞是最大的细胞类型,通常具有肾形的细胞核,细胞质内具有高电子密度的有隔膜的颗粒。颗粒细胞具有不同的染色特性,有些细胞是嗜酸性的,另一些细胞可能有微弱的嗜碱性,这种不同的性质与细胞的不同发育阶段有关还是与功能不同有关还不得而知[46]。半颗粒细胞较小,通常具有一个较大的位于细胞中央的细胞核,周围细胞质中具有不同大小和形状的颗粒,这类细胞一般着色较浅。透明细胞形状多样,胞质内没有或具有极少量颗粒。这种细胞类型存在与否还有争议,有人认为它们是不成熟的半颗粒或颗粒细胞的原血细胞[48]。关于血细胞的功能,在普通滨蟹Carcinus maenas、黄道蟹Cancer pagurus及Macropipus depurator酚氧化酶原系统主要存在于颗粒细胞,很少量的存在于半颗粒细胞[49],所以颗粒细胞与黑化作用有关。半颗粒细胞与包被作用有关[50]。关于哪一类血细胞具有吞噬功能还存在争论。在龙虾Homarus americanus、大螯虾Panulirus interruptus和羊蟹Loxorhynchus grandis中,颗粒细胞具有吞噬作用[46]。在普通滨蟹C. maenas中透明细胞具有吞噬作用[51],在对虾中颗粒细胞也具有吞噬作用[52]。
2.2 血淋巴菌群的组成 通常情况下,健康动物特别是脊椎动物的循环系统是无菌的。但越来越多的研究表明水生无脊椎动物血淋巴中栖居着一定数量的细菌。贝类中如太平洋牡蛎、偏顶蛤血淋巴中有细菌存在的报道(1.4×102–5.5×102 CFU/mL血淋巴)[53]。甲壳类中有很多重要的养殖动物,研究证明很多甲壳动物血淋巴中都有细菌存在,如290只蓝蟹(Callinectes sapidus)中80%的个体血淋巴中具有细菌[54],40%以上的健康小龙虾血淋巴中有细菌分布[55]。对虾血淋巴中报道有细菌栖居的有日本囊对虾[4, 56]、斑节对虾[57]和凡纳滨对虾[58]等,可培养细菌数量在10–103 CFU/mL血淋巴。我们曾对甲壳类的血淋巴菌群及其功能进行过综述,详见参考文献[4]。
我们最近对日本囊对虾可培养的血淋巴菌群和肠道菌群进行了分析,发现培养条件下的细菌数量在10–103 CFU/mL血淋巴。细菌种类包括某些条件致病菌如弧菌、单胞菌和席瓦氏菌等。可以看出,与肠道菌群相比,血淋巴菌群的数量和种类都相对较少。我们对对虾等甲壳类的血淋巴菌群及其动态平衡调控进行了综述,详见参考文献[4]。
2.3 血淋巴菌群的功能 像消化道菌群一样,血淋巴菌群的存在可能具有其生理功能:低剂量细菌的存在可能在某种程度上激活宿主的本底免疫系统,有利于提高对虾的免疫力;定居的微生物菌群建立了相对稳定的微生态系统,形成了一个缓冲区可以限制致病菌进入[4]。
2.4 血淋巴菌群动态平衡的调控 在健康对虾等甲壳类的血淋巴中存在菌群,但这些甲壳类本身并不发病,说明宿主体内具有保持血淋巴菌群稳定的机制。为了研究这些细菌群落的稳态是如何调控的,我们首先建立饲喂细菌的对虾感染模型,检测感染对虾相关免疫基因的表达,发现一种只在血细胞中高表达的C-型凝集素,命名为血细胞C-型凝集素(HeCL)。HeCL在正常健康对虾中高表达,而感染对虾中的表达模式没有明显变化。但是利用RNA干扰的方法敲降HeCL的表达,3 d内对虾的成活率明显下降。分析原因发现该对虾体内的细菌数目明显增加,说明大量增殖的细菌是对虾死亡的原因。研究发现这种HeCL可以结合细菌,但本身没有杀菌能力,为什么能够抑制血淋巴菌群的增殖呢?我们进一步干扰HeCL的表达,检测对虾体内抗菌肽(包括抗脂多糖因子、甲壳肽和溶菌酶)的表达,发现多种抗菌肽的表达明显下降,说明HeCL可以调控抗菌肽的表达。也就是说对虾是通过血淋巴中持续高表达的一种C-型凝集素识别血淋巴菌群,通过某种信号途径调控抗菌肽的表达,从而保持血淋巴菌群的动态平衡[56](图 4)。
 |
| 图 4 对虾血淋巴菌群的动态平衡调控 Figure 4 Homeostatic regulation of shrimp hemolymph microbiota. HeCL: Hemocyte C-type lectin; AMPs: Antimicrobial peptides. |
| 图选项 |
甲壳类的酚氧化酶原激活系统(prophenoloxidase activating system)是一种类似于脊椎动物补体系统的酶级联反应系统。该系统由酚氧化酶原(proPO)、酚氧化酶(phenoloxidase,PO)、丝氨酸蛋白酶(serine proteases,SPs)和丝氨酸蛋白酶抑制剂(serpins)等组成。当机体受到微生物感染时,该系统可以被激活,酚氧化酶将酪氨酸氧化为有毒性的醌类物质等,导致产生黑色素,通过黑化作用抑制和杀死入侵病原。Fagutao等利用RNA干扰技术敲低酚氧化酶原的表达,发现对虾血淋巴内的细菌数目明显增加,并且对虾的死亡率也增加[59]。该研究说明,酚氧化酶原激活系统在对虾血淋巴菌群动态平衡调控中也发挥重要作用。
综上,对虾的血淋巴菌群同时受到C-型凝集素调控的抗菌肽表达和酚氧化酶原激活系统的调控,以保持其动态平衡。
3 展望 肠道菌群及其功能和动态平衡调控研究在高等动物中取得了很大进展,但在无脊椎动物中的研究相对较少。血淋巴菌群在多种无脊椎动物中都有发现,但对其组成、功能及调控机理的研究国内外报道都很少。因此有许多问题值得进一步开展研究。就对虾等甲壳类肠道菌群来讲,前期工作多集中在肠道菌群的组成、与环境菌群的比较等研究。需要进一步加强对肠道菌群的功能,特别是宿主免疫系统对肠道菌群动态平衡调控的研究,包括宿主对肠道菌群的识别、参与肠道菌群调控的信号途径及调控的效应分子。关于血淋巴菌群的种类和调控机理还有很多问题有待阐明。例如宿主对血淋巴细菌识别的特异性,除了已发现HeCL之外,还有哪些模式识别受体参与对血淋巴菌群的识别,到底哪种信号途径调控血细胞抗菌肽的表达,并比较肠道菌群和血淋巴菌群调控机理的异同。还有肠道菌群和血淋巴菌群的关系,体内两个菌群的互作等都需要进一步研究。通过该研究可能发现能应用于对虾健康养殖的指示微生物菌群,阐明对虾肠道及血淋巴菌群动态平衡机理,为对虾的健康养殖提供理论指导,并为开发健康养殖的微生态制剂奠定基础。
References
| [1] | Fisheries Administration Bureau of the Ministry of Agriculture of China. 2016 China fishery statistical yearbook. Beijing: China Agriculture Press, 2016. (in Chinese) 中国农业部渔业渔政管理局. 2016中国渔业统计年鉴. 北京: 中国农业出版社, 2016. |
| [2] | Li FH, Xiang JH. Recent advances in researches on the innate immunity of shrimp in China. Developmental & Comparative Immunology, 2013, 39(1/2): 11-26. |
| [3] | Wang PH, Huang TZ, Zhang XB, He JG. Antiviral defense in shrimp:From innate immunity to viral infection. Antiviral Research, 2014, 108: 129-141. DOI:10.1016/j.antiviral.2014.05.013 |
| [4] | Wang XW, Wang JX. Crustacean hemolymph microbiota:Endemic, tightly controlled, and utilization expectable. Molecular Immunology, 2015, 68(2): 404-411. DOI:10.1016/j.molimm.2015.06.018 |
| [5] | van der Flier LG, Clevers H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annual Review of Physiology, 2009, 71: 241-260. DOI:10.1146/annurev.physiol.010908.163145 |
| [6] | Wilson CL, Ouellette AJ, Satchell DP, Ayabe T, López-Boado YS, Stratman JL, Hultgren SJ, Matrisian LM, Parks WC. Regulation of intestinal alpha-defensin activation by the metalloproteinase matrilysin in innate host defense. Science, 1999, 286(5437): 113-117. DOI:10.1126/science.286.5437.113 |
| [7] | Ayabe T, Satchell DP, Wilson CL, Parks WC, Selsted ME, Ouellette AJ. Secretion of microbicidalα-defensins by intestinal Paneth cells in response to bacteria. Nature Immunology, 2000, 1(2): 113-118. DOI:10.1038/77783 |
| [8] | Hegedus D, Erlandson M, Gillott C, Toprak U. New insights into peritrophic matrix synthesis, architecture, and function. Annual Review of Entomology, 2009, 54: 285-302. DOI:10.1146/annurev.ento.54.110807.090559 |
| [9] | Chen KZ, Bao Y, He WH. Studies on the anatomy and histology of the digestive system of the Penaeus orientalis (Crustacea, Decapoda). Journal of Shandong College of Oceanology, 1988, 18(1): 43-53. (in Chinese) 陈宽智, 鲍鹰, 何伟宏. 东方对虾消化系统解剖和组织学的研究. 山东海洋学院学报, 1988, 18(1): 43-53. |
| [10] | Shekhar MS, Lu YN. Application of nucleic-acid-based therapeutics for viral infections in shrimp aquaculture. Marine Biotechnology, 2009, 11(1): 1-9. DOI:10.1007/s10126-008-9155-0 |
| [11] | Wang XW, Xu YH, Xu JD, Zhao XF, Wang JX. Collaboration between a soluble C-type lectin and calreticulin facilitates white spot syndrome virus infection in shrimp. Journal of Immunology, 2014, 193(5): 2106-2117. DOI:10.4049/jimmunol.1400552 |
| [12] | Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA. Diversity of the human intestinal microbial flora. Science, 2005, 308(5728): 1635-1638. DOI:10.1126/science.1110591 |
| [13] | Qin JJ, Li RQ, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li JH, Xu JM, Li SC, Li DF, Cao JJ, Wang B, Liang HQ, Zheng HS, Xie YL, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu HM, Yu C, Li ST, Jian M, Zhou Y, Li YR, Zhang XQ, Li SG, Qin N, Yang HM, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J, MetaHIT Consortium, Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [14] | Chandler JA, Lang JM, Bhatnagar S, Eisen JA, Kopp A. Bacterial communities of diverse Drosophila species:ecological context of a host-microbe model system. PLoS Genetics, 2011, 7(9): e1002272. DOI:10.1371/journal.pgen.1002272 |
| [15] | Hooper LV, Gordon JI. Commensal host-bacterial relationships in the gut. Science, 2001, 292(5519): 1115-1118. DOI:10.1126/science.1058709 |
| [16] | Maynard CL, Elson CO, Hatton RD, Weaver CT. Reciprocal interactions of the intestinal microbiota and immune system. Nature, 2012, 489(7415): 231-241. DOI:10.1038/nature11551 |
| [17] | Artis D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nature Reviews Immunology, 2008, 8(6): 411-420. DOI:10.1038/nri2316 |
| [18] | Sano T, Huang W, Hall JA, Yang Y, Chen A, Gavzy SJ, Lee JY, Ziel JW, Miraldi ER, Domingos AI, Bonneau R, Littman DR. An IL-23R/IL-22 circuit regulates epithelial serum amyloid A to promote local effector Th17 responses. Cell, 2015, 163(2): 381-393. DOI:10.1016/j.cell.2015.08.061 |
| [19] | Oxley APA, Shipton W, Owens L, McKay D. Bacterial flora from the gut of the wild and cultured banana prawn, Penaeus merguiensis. Journal of Applied Microbiology, 2002, 93(2): 214-223. DOI:10.1046/j.1365-2672.2002.01673.x |
| [20] | Li K, Zheng TL, Tian Y, Yuan JJ. Bacterial community structure in intestine of the white shrimp, Litopenaeus vannamei. Acta Microbiologica Sinica, 2007, 47(4): 649-653. (in Chinese) 李可, 郑天凌, 田蕴, 袁建军. 南美白对虾肠道微生物群落的分子分析. 微生物学报, 2007, 47(4): 649-653. |
| [21] | Li JQ, Tan BP, Mai KS. Study on the relationships between white spot syndrome virus outbreak in cultured shrimp (Penaeus vannamei) and the composition of aerobic heterotrophic bacterium communities in shrimp intestine. Journal of Shanghai Fisheries University, 2006, 15(1): 109-113. (in Chinese) 李继秋, 谭北平, 麦康森. 白斑综合征病毒与凡纳滨对虾肠道菌群区系之间关系的初步研究. 上海水产大学学报, 2006, 15(1): 109-113. |
| [22] | Wan L, Wang JQ, Yang SY, Wang NB. Antibacterial activity of intestinal bacterial in Prawn (Litepenaeus vannamei). Fisheries Science, 2006, 25(2): 62-64. (in Chinese) 宛立, 王吉桥, 杨世勇, 王年斌. 健康养殖南美白对虾肠道细菌的抗菌活性. 水产科学, 2006, 25(2): 62-64. |
| [23] | Xiong JB, Wang K, Wu JF, Qiuqian LL, Yang KJ, Qian YX, Zhang DM. Changes in intestinal bacterial communities are closely associated with shrimp disease severity. Applied Microbiology and Biotechnology, 2015, 99(6): 6911-6919. |
| [24] | Rungrassamee W, Klanchui A, Maibunkaew S, Chaiyapechara S, Jiravanichpaisal P, Karoonuthaisiri N. Characterization of intestinal bacteria in wild and domesticated adult black tiger shrimp (Penaeus monodon). PLoS One, 2014, 9(3): e91853. DOI:10.1371/journal.pone.0091853 |
| [25] | Tzuc JT, Escalante DR, Rojas Herrera R, Gaxiola Cortés G, Ortiz ML. Microbiota from Litopenaeus vannamei:digestive tract microbial community of Pacific white shrimp (Litopenaeus vannamei). Springerplus, 2014, 3: 280. DOI:10.1186/2193-1801-3-280 |
| [26] | Rungrassamee W, Klanchui A, Maibunkaew S, Karoonuthaisiri N. Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure. Journal of Invertebrate Pathology, 2016, 133: 12-19. DOI:10.1016/j.jip.2015.11.004 |
| [27] | Li WF, Yang SY, Qi YL, Lin QC, He SQ, Wang B. Effects of probiotic bacterium on the growth performance and immunity of Litopenaeus vannamei. Hubei Agricultural Sciences, 2016, 55(2): 437-440. (in Chinese) 李文芬, 杨思毅, 齐延林, 林庆聪, 何思齐, 汪波. 益生菌对南美白对虾生长和免疫力的影响. 湖北农业科学, 2016, 55(2): 437-440. |
| [28] | Rimoldi M, Chieppa M, Salucci V, Avogadri F, Sonzogni A, Sampietro GM, Nespoli A, Viale G, Allavena P, Rescigno M. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells. Nature Immunology, 2015, 16(3): 326. |
| [29] | Rimoldi M, Chieppa M, Salucci V, Avogadri F, Sonzogni A, Sampietro GM, Nespoli A, Viale G, Allavena P, Rescigno M. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells. Nature Immunology, 2005, 6(5): 507-514. DOI:10.1038/ni1192 |
| [30] | Dahan S, Roth-Walter F, Arnaboldi P, Agarwal S, Mayer L. Epithelia:lymphocyte interactions in the gut. Immunological Reviews, 2007, 215(1): 243-253. DOI:10.1111/j.1600-065X.2006.00484.x |
| [31] | Biton M, Levin A, Slyper M, Alkalay I, Horwitz E, Mor H, Kredo-Russo S, Avnit-Sagi T, Cojocaru G, Zreik F, Bentwich Z, Poy MN, Artis D, Walker MD, Hornstein E, Pikarsky E, Ben-Neriah Y. Epithelial microRNAs regulate gut mucosal immunity via epithelium-T cell crosstalk. Nature Immunology, 2011, 12(3): 239-246. DOI:10.1038/ni.1994 |
| [32] | Ryu JH, Ha EM, Lee WJ. Innate immunity and gut-microbe mutualism in Drosophila. Developmental & Comparative Immunology, 2010, 34(4): 369-376. |
| [33] | You H, Lee WJ, Lee WJ. Homeostasis between gut-associated microorganisms and the immune system in Drosophila. Current Opinion in Immunology, 2014, 30: 48-53. DOI:10.1016/j.coi.2014.06.006 |
| [34] | Lee KA, Kim SH, Kim EK, Ha EM, You H, Kim B, Kim MJ, Kwon Y, Ryu JH, Lee WJ. Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila. Cell, 2013, 153(4): 797-811. DOI:10.1016/j.cell.2013.04.009 |
| [35] | Lee KA, Kim B, You H, Lee WJ. Uracil-induced signaling pathways for DUOX-dependent gut immunity. Fly, 2015, 9(3): 115-120. DOI:10.1080/19336934.2015.1126011 |
| [36] | Jiang HQ, Patel PH, Kohlmaier A, Grenley MO, McEwen DG, Edgar BA. Cytokine/Jak/Stat signaling mediates regeneration and homeostasis in the Drosophila midgut. Cell, 2009, 137(7): 1343-1355. DOI:10.1016/j.cell.2009.05.014 |
| [37] | Cronin SJF, Nehme NT, Limmer S, Liegeois S, Pospisilik JA, Schramek D, Leibbrandt A, de Matos Simoes R, Gruber S, Puc U, Ebersberger I, Zoranovic T, Neely GG, von Haeseler A, Ferrandon D, Penninger JM. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science, 2009, 325(5938): 340-343. DOI:10.1126/science.1173164 |
| [38] | Becker T, Loch G, Beyer M, Zinke I, Aschenbrenner AC, Carrera P, Inhester T, Schultze JL, Hoch M. FOXO-dependent regulation of innate immune homeostasis. Nature, 2010, 463(7279): 369-373. DOI:10.1038/nature08698 |
| [39] | Soonthornchai W, Rungrassamee W, Karoonuthaisiri N, Jarayabhand P, Klinbunga S, S derh ll K, Jiravanichpaisal P. Expression of immune-related genes in the digestive organ of shrimp, Penaeus monodon, after an oral infection by Vibrio harveyi. Developmental & Comparative Immunology, 2010, 34(1): 19-28. |
| [40] | Du XJ, Wang JX, Liu N, Zhao XF, Li FH, Xiang JH. Identification and molecular characterization of a peritrophin-like protein from fleshy prawn (Fenneropenaeus chinensis). Molecular Immunology, 2006, 43(10): 1633-1644. DOI:10.1016/j.molimm.2005.09.018 |
| [41] | Ren Q, Xu ZL, Wang XW, Zhao XF, Wang JX. Clip domain serine protease and its homolog respond to Vibrio challenge in Chinese white shrimp, Fenneropenaeus chinensis. Fish & Shellfish Immunology, 2009, 26(5): 787-798. |
| [42] | Xie SJ, Zhang XJ, Zhang JQ, Li FH, Xiang JH. Envelope proteins of white spot syndrome virus (WSSV) Interact with Litopenaeus vannamei peritrophin-like protein (LvPT). PLoS One, 2015, 10(12): e0144922. DOI:10.1371/journal.pone.0144922 |
| [43] | Yang HT, Yang MC, Sun JJ, Shi XZ, Zhao XF, Wang JX. Dual oxidases participate in the regulation of intestinal microbiotic homeostasis in the kuruma shrimp Marsupenaeus japonicus. Developmental & Comparative Immunology, 2016, 59: 153-163. |
| [44] | Yang HT, Yang MC, Sun JJ, Guo F, Lan JF, Wang XW, Zhao XF, Wang JX. Catalase eliminates reactive oxygen species and influences the intestinal microbiota of shrimp. Fish & Shellfish Immunology, 2015, 47(1): 63-73. |
| [45] | Reiber CL, McGaw IJ. A review of the "Open" and "Closed" circulatory systems:new terminology for complex invertebrate circulatory systems in light of current findings. International Journal of Zoology, 2009, 2009: 301284. |
| [46] | S derh ll I. Crustacean hematopoiesis. Developmental & Comparative Immunology, 2016, 58: 129-141. |
| [47] | McGaw IJ, Stillman JH. Cardiovascular system of the Majidae (Crustacea:Decapoda). Arthropod Structure & Development, 2010, 39(5): 340-349. |
| [48] | van de Braak CBT, Botterblom MHA, Liu W, Taverne N, van der Knaap WPW, Rombout JHWM. The role of the haematopoietic tissue in haemocyte production and maturation in the black tiger shrimp (Penaeus monodon). Fish & Shellfish Immunology, 2002, 12(3): 253-272. |
| [49] | S derh ll K, Smith VJ. Separation of the haemocyte populations of carcinus maenas and other marine decapods, and prophenoloxidase distribution. Developmental & Comparative Immunology, 1983, 7(2): 229-239. |
| [50] | Kobayashi M, Johansson MW, S derh ll K. The 76 kD cell-adhesion factor from crayfish haemocytes promotes encapsulation in vitro. Cell and Tissue Research, 1990, 260(1): 13-18. DOI:10.1007/BF00297485 |
| [51] | Th rnqvist PO, Johansson MW, S derh ll K. Opsonic activity of cell adhesion proteins and β-1, 3-glucan binding proteins from two crustaceans. Developmental & Comparative Immunology, 1994, 18(1): 3-12. |
| [52] | Gargioni R, Barracco MA. Hemocytes of the palaemonids Macrobrachium rosenbergii and M. acanthurus, and of the penaeid Penaeus paulensis. Journal of Morphology, 1998, 236(3): 209-221. DOI:10.1002/(ISSN)1097-4687 |
| [53] | Olafsen JA, Mikkelsen HV, Gi ver HM, Hansen GH. Indigenous bacteria in hemolymph and tissues of marine bivalves at low temperatures. Applied and Environmental Microbiology, 1993, 59(6): 1848-1854. |
| [54] | Tubiash HS, Sizemore RK, Colwell RR. Bacterial flora of the hemolymph of the blue crab, Callinectes sapidus:most probable numbers. Applied Microbiology, 1975, 29(3): 388-392. |
| [55] | Scott JR, Thune RL. Bacterial flora of hemolymph from red swamp crawfish, Procambarus clarkii (Girard), from commercial ponds. Aquaculture, 1986, 58(3/4): 161-165. |
| [56] | Wang XW, Xu JD, Zhao XF, Vasta GR, Wang JX. A shrimp C-type lectin inhibits proliferation of the hemolymph microbiota by maintaining the expression of antimicrobial peptides. Journal of Biological Chemistry, 2014, 289(17): 11779-11790. DOI:10.1074/jbc.M114.552307 |
| [57] | Ponprateep S, Tharntada S, Somboonwiwat K, Tassanakajon A. Gene silencing reveals a crucial role for anti-lipopolysaccharide factors from Penaeus monodon in the protection against microbial infections. Fish & Shellfish Immunology, 2012, 32(1): 26-34. |
| [58] | Gomez-Gil B, Tron-Mayén L, Roque A, Turnbull JF, Inglis V, Guerra-Flores AL. Species of Vibrio isolated from hepatopancreas, haemolymph and digestive tract of a population of healthy juvenile Penaeus vannamei. Aquaculture, 1998, 163(1/2): 1-9. |
| [59] | Fagutao FF, Koyama T, Kaizu A, Saito-Taki T, Kondo H, Aoki T, Hirono I. Increased bacterial load in shrimp hemolymph in the absence of prophenoloxidase. FEBS Journal, 2009, 276(18): 5298-5306. DOI:10.1111/j.1742-4658.2009.07225.x |
